心肌细胞凋亡增加和生存力降低是缺血(缺氧)/再灌注(复氧)诱导的心肌损伤、梗死后病理性心肌重塑、心力衰竭等疾病的重要发病机制[1,2,3]。研究表明整合素(integrin)的功能对心脏正常发育和心肌与细胞外基质黏附、生长及其生存能力的调节是必要的[4,5]。近年来的研究显示,整合素通路的β1亚基、整合素连接激酶 (ILK)和焦点黏附激酶 (FAK)等组分可抑制心肌细胞凋亡、促进其存活,阻滞缺血(缺氧)/再灌注(复氧)诱导的心肌损伤、梗死后病理性心肌重塑、心力衰竭等疾病的发生发展[6,7,8]。接头蛋白CrkL亦是整合素通路的组分之一[9],我们的前期研究发现CrkL蛋白在梗死灶周围非梗死区心肌细胞中存在表达[10],但CrkL蛋白是否具有抗心肌细胞凋亡、促心肌细胞生存等作用及其机制,目前仍不完全清楚。本研究通过慢病毒介导的RNA干扰技术下调CrkL蛋白的表达水平并进行缺氧/复氧(H/R)干预,探讨沉默CrkL对缺氧/复氧诱导的H9C2心肌细胞凋亡、生存力的影响,以及p-ERK1/2蛋白表达的影响,以期对缺血/再灌注诱导的心肌损伤、梗死后病理性心肌重塑、心力衰竭等疾病发病机制的阐明及其防治寻找新的思路。 1 材料和方法 1.1 实验材料
大鼠H9C2心肌细胞株(中国科学院上海生命科学研究院细胞资源中心,源自ATCC细胞库)。阴性慢病毒和CrkL RNAi慢病毒(沉默CrkL mRNA)均由上海吉凯公司合成,CrkL RNAi慢病毒作用有效的H9C2心肌细胞mRNA的靶序列为5′-GGTTTGATTCTTCAGACCGTT-3′。DMEM F-12培养基、胎牛血清均购自Gibco公司。RNA提取、反转录以及cDNA扩增试剂盒均购自TaKaRa公司,小鼠抗大鼠β-actin抗体 (sc-47778) 购自美国Santa Cruz公司,小鼠抗大鼠CrkL抗体 (3182)及兔抗大鼠p-ERK1/2抗体(4370)均购自Cell Signaling公司。四甲基氮唑盐 (MTT)为Sigma公司产品,流式细胞技术实验所使用的流式检测试剂盒(Annexin-PE、7-AAD)购自碧云天生物技术研究所。 1.2 H9C2心肌细胞培养、慢病毒感染及H/R干预
将5×105 H9C2心肌细胞分别接种于6个直径为10 cm培养皿中,用含10%胎牛血清的DMEM F-12培养基正常培养(条件为37℃,95% 空气,5% CO2),在细胞密度达到50%左右时更换新鲜的培养基,分别用空白试剂、阴性病毒、CrkL沉默病毒感染细胞,将细胞分为空白组、阴性病毒组、CrkL沉默组3组,每组备两份,12 h后更换为新鲜的培养基,再培养12 h(感染后24 h)。荧光显微镜下显示阴性病毒组和CrkL沉默组细胞的感染率均达90%以上。重新消化细胞,细胞计数,取相同数量细胞,分别接种于6个培养皿(RT-PCR和蛋白印迹检测时)或多孔板中(MTT检测时用96孔板;流式细胞计数时用6孔板)。从上述3组中随机各取一份细胞,将细胞培养基置换为新鲜的培养基,在正常条件下再培养48 h(感染后72 h);同时,另一份的3组细胞将培养基置换为生理盐水,置于缺氧孵箱 (条件为37℃,1% 空气,94% N2,5% CO2)缺氧3 h后,重新置换回新鲜的培养基,在正常条件下复氧继续培养45 h(感染后72h)。此时细胞分为空白组、阴性病毒组、CrkL沉默组、空白+H/R组、阴性病毒+H/R组、CrkL沉默+H/R组。然后,收集细胞进行RT-PCR、蛋白质印迹、MTT、流式细胞计数等实验[11]。 1.3 RT-PCR检测CrkL mRNA
提取各组的总RNA,分别逆转录为cDNA,进行PCR扩增。引物序列:大鼠 β-actin上游5′-AGATGACCCAGATCATGTTTGA-3′,下游5′-TTGGCATAGAGGTCTTTA-3′。大鼠 CrkL上游5′-CGCATATGCTCAACCTCAGA-3′,下游5′-ATATGAAAGTCGGCCACCAG-3′。 反转录反应条件为: 37℃ 15 min,85℃ 5 s,4℃ 5 min。PCR反应条件为: 94℃预变性3 min,94℃变性30 s,退火 (温度分别为大鼠β-actin 55℃、大鼠 CrkL 58℃) 30 s,72℃延伸30 s,共进行30个循环。分别等量取各组的上述不同基因PCR产物加入同一电泳通道,电泳成像后进行光密度(D)值定量分析。大鼠CrkL mRNA光密度值/大鼠β-actin光密度值表示大鼠CrkL mRNA的相对表达量[11]。 1.4 蛋白免疫印迹检测心肌细胞CrkL及p-ERK1/2蛋白表达
分别提取各组细胞总蛋白,用BCA法测定蛋白浓度,用10%SDS聚丙烯酰胺分离凝胶,上样50 μg蛋白,电泳分离后电转至PVDF膜上。5%牛奶封闭2 h后,孵一抗,过夜,洗膜,孵二抗,然后洗膜,再用ECL发光试剂盒显影成像,进行光密度值定量分析。以CrkL光密度值/β-actin光密度值表示心肌细胞CrkL蛋白的相对表达量,以p-ERK1的光密度值/β-actin光密度值表示p-ERK1蛋白的相对表达量,用p-ERK2的光密度值/β-actin光密度值表示p-ERK2蛋白的相对表达量[11]。 1.5 MTT法检测细胞增殖率
分别检测各组转染后24 h、72 h细胞的吸光度值,在上述时间点取细胞分别加MTT液20 μL (5 mg/mL),4 h后弃液体,加200 μL DMSO,37℃摇床培养30 min后,用酶标仪 (570 nm波长)测定光密度值。细胞增殖率 = (72 h光密度值-24 h光密度值)/24 h光密度值×100%[11]。 1.6 流式细胞术检测细胞凋亡率
分别检测各组转染后72 h的凋亡率。重新消化细胞,终止,离心,用1 mL PBS重悬后加入Annexin-PE、7-AAD,用流式细胞仪检测细胞凋亡。Annexin-PE 标记凋亡和坏死的细胞,7-AAD标记坏死的细胞,Annexin-PE染色阳性、7-AAD染色阴性的细胞为凋亡细胞。细胞凋亡率=凋亡细胞数/总细胞数×100%[11]。 1.7 统计学处理
应用SPSS17.0软件分析,计量数据以 x ±s 表示,多组间比较采用单因素方差分析 (One-way ANOVA),两组间比较采用Tukey检验,检验水准(α)为0.05。 2 结 果 2.1 心肌细胞CrkL mRNA的表达
RT-PCR结果显示(图 1),较空白组和阴性病毒组,CrkL沉默组的CrkL mRNA表达明显降低(P<0.01),而空白组和阴性病毒组之间CrkL mRNA的表达差异无统计学意义。经过H/R干预后,CrkL沉默+H/R组的CrkL mRNA 的表达明显较空白+H/R组和阴性病毒+H/R组低(P<0.01),而空白+H/R组和阴性病毒+H/R组之间差异无统计学意义。并且经H/R干预后,较未干预组(空白组、阴性病毒组、CrkL沉默组),各干预组(空白+H/R组、阴性病毒+H/R组、CrkL沉默+H/R组)的CrkL mRNA表达均明显降低(P<0.01)。
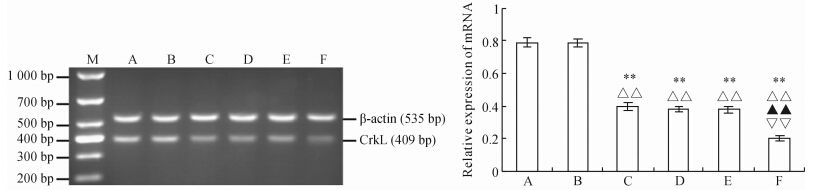 | 图 1 H9C2心肌细胞CrkL mRNA表达 M: 标记物; A:空白组;B:阴性病毒组;C:CrkL沉默组;D:空白+H/R组;E:阴性病毒+H/R组;F:CrkL沉默+H/R组;H/R: 缺氧/复氧. **P<0.01 与空白组比较; △△P<0.01与阴性病毒组比较; ▲▲P<0.01 与 CrkL沉默组比较;▽▽P<0.01 与空白+H/R组和阴性病毒+H/R组比较. n=7,x ±s |
图 2可见,与空白组及阴性病毒组比较,CrkL沉默组CrkL、p-ERK1、p-ERK2蛋白表达明显降低(P<0.01);与空白+H/R组及阴性病毒+H/R组比较,CrkL沉默+H/R组CrkL、p-ERK1/2蛋白表达均明显降低(P<0.01或P<0.05);较未干预组(空白组、阴性病毒组、沉默病毒组),各干预组(空白+H/R组、阴性病毒+H/R组、CrkL沉默+H/R组)的CrkL(P<0.01)、p-ERK1/2蛋白表达均降低(P<0.05或P<0.01)。
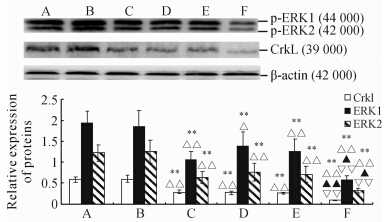 | 图 2 H9C2心肌细胞CrkL、p-ERK1/2蛋白表达 A:空白组;B:阴性病毒组;C:CrkL沉默组;D:空白+H/R组;E:阴性病毒+H/R组;F:CrkL沉默+H/R组;H/R: 缺氧/复氧. **P<0.01 与空白组比较; △△P<0.01 与阴性病毒组比较;△P<0.05与阴性病毒组比较;▲▲P<0.01 与 CrkL沉默组比较; ▲P<0.05 CrkL沉默组比较;▽▽P<0.01 与空白+H/R组和阴性病毒+H/R组比较. n=7,x ±s |
图 3可见,较空白组、阴性病毒组,CrkL沉默组的细胞增殖率明显降低(P<0.01);较空白+H/R组、阴性病毒+H/R组,CrkL沉默+H/R组的细胞增殖率明显降低(P<0.01)。较未干预组,各干预组(空白+H/R组、阴性病毒+H/R组、 CrkL沉默+H/R组)的细胞增殖率均明显降低(P<0.01)。
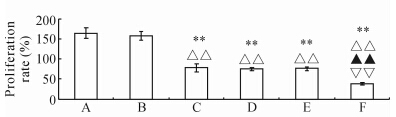 | 图 3 H9C2心肌细胞的增殖率 A:空白组;B:阴性病毒组;C:CrkL沉默组;D:空白+H/R组;E:阴性病毒+H/R组;F:CrkL沉默+H/R组;H/R: 缺氧/复氧. **P<0.01 与空白组比较; △△P<0.01 与阴性病毒组比较; ▲▲P<0.01 与CrkL沉默组比较;▽▽P<0.01 与空白+H/R组和阴性病毒+H/R组比较. n=12,x ±s |
图 4可见,较空白组、阴性病毒组,CrkL沉默组的细胞凋亡率明显增加(P<0.01);较空白+H/R组、阴性病毒+H/R组,CrkL沉默+H/R组的细胞凋亡率明显增加(P<0.01);较未干预组,各干预组(空白+H/R组、阴性病毒+H/R组、CrkL沉默+H/R组)的细胞凋亡率均明显增加(P<0.01)。
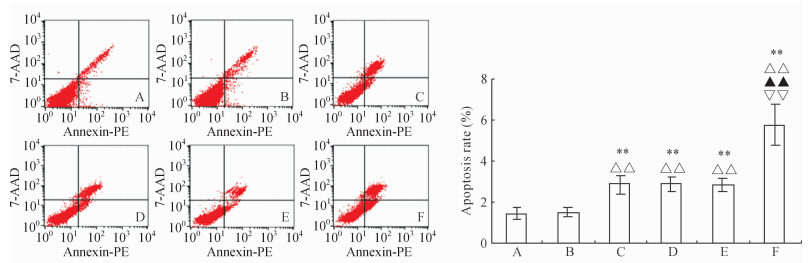 | 图 4 H9C2心肌细胞的凋亡率 A:空白组;B:阴性病毒组;C:CrkL沉默组;D:空白+H/R组;E:阴性病毒+H/R组;F:CrkL沉默+H/R组;H/R: 缺氧/复氧. **P<0.01 与空白组比较; △△P<0.01 与阴性病毒组比较; ▲▲P<0.01 与CrkL沉默组比较;▽▽P<0.01 与空白+H/R组和阴性病毒+H/R组比较. n=7,x ±s |
研究表明整合素信号通路组分,如整合素β1 、β3亚基及其下游的FAK、ILK具有抗心肌细胞凋亡和生存力降低的作用,可阻滞扩张性心肌病、梗死后缺血性心肌病和心力衰竭的进展[6,7,8,12]。 过表达ILK、鸟苷酸交换因子Dock180、C3G可抗心肌细胞凋亡和生存力降低[11,12,13],且可抑制H/R诱导的心肌细胞凋亡增加和生存力降低[11,13],从而可改善梗死后缺血性心肌病和心力衰竭[7]。且研究表明整合素信号通路抗心肌细胞凋亡和生存力降低的作用是通过其下游促生存信号分子如ERK[11,14,15,16]、PI3K/AKT/mTOR/p70S6K[13,15,16,17,18,19]而介导的。CrkL是整合素信号通路中的一种接头蛋白,其SH2结构域与上游的Cas等整合素组分交互作用,其SH3结构域与下游的Dock180、C3G、Sos等鸟苷酸交换因子交互作用[20,21]。由此可以推测,CrkL通过与上述整合素通路组分相互作用,从而也具有抑制心肌细胞凋亡、促进心肌细胞存活的作用。
本研究结果显示,沉默CrkL后H9C2心肌细胞生存力明显降低,细胞凋亡率明显增加,并且能够降低H/R诱导的H9C2心肌细胞增殖,增加细胞凋亡率。本研究还发现,沉默CrkL可使p-ERK1/2表达降低。本研究结果提示,沉默CrkL可促进心肌细胞凋亡,其机制可能与沉默CrkL导致的p-ERK1/2蛋白表达、心肌细胞增殖降低有关。CrkL有望成为治疗心血管疾病的潜在重要靶点。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Wang L,Li G,Wang Z,Liu X,Zhao W.Elevated expression of C3G protein in the peri-infarct myocardium of rats[J].Med Sci Monit Basic Res,2013,19:1-5. |
| [2] | Liu X L,Li G,Wang Z H,Zhao W J,Wang L P.Increased expression of Dock180 protein in the noninfarcted myocardium in rats[J].J Chin Med Assoc,2013,76:164-168. |
| [3] | 赵文菊,刘小兰,李 刚,王志华,王丽平.大鼠非梗死区心肌Sos1/2蛋白表达的改变[J].临床心血管病杂志, 2012, 28:865-867. |
| [4] | Shai S Y,Harpf A E,Ross R S.Integrins and the myocardium[J].Genet Eng (N Y), 2002,24:87-105. |
| [5] | Valencik M L,Keller R S,Loftus J C,McDonald J A.A lethal perinatal cardiac phenotype resulting from altered integrin function in cardiomyocytes[J].J Card Fail,2002,8:262-272. |
| [6] | Krishnamurthy P,Subramanian V,Singh M,Singh K.Deficiency of beta1 integrins results in increased myocardial dysfunction after myocardial infarction[J].Heart,2006,92:1309-1315. |
| [7] | Ding L,Dong L,Chen X,Zhang L,Xu X,Ferro A,et al.Increased expression of integrin-linked kinase attenuates left ventricular remodeling and improves cardiac function after myocardial infarction[J].Circulation,2009,120:764-773. |
| [8] | Hakim Z S,DiMichele L A,Rojas M,Meredith D,Mack C P,Taylor J M.FAK regulates cardiomyocyte survival following ischemia/reperfusion[J].J Mol Cell Cardiol,2009,46:241-248. |
| [9] | Sattler M,Salgia R,Shrikhande G,Verma S,Uemura N,Law S F,et al.Differential signaling after beta1 integrin ligation is mediated through binding of CRKL to p120(CBL) and p110(HEF1)[J].J Biol Chem,1997,272:14320-14326. |
| [10] | 朱雪锋,李 刚,张灿晶.CrkL在β受体过度激动促进心肌梗死后心室间质重塑中的作用[J].中国老年学杂志, 2010, 30:1083-1085. |
| [11] | 张 旭,李 刚.鸟苷酸交换因子C3G对心肌细胞生存力的影响及其可能机制[J].第二军医大学学报,2012,33:1172-1177. Zhang X,Li G.Effect of guanine nucleotide exchange factor C3G overexpression on survival of cardiomyocytes and its underlying mechanisms[J].Acad J Sec Mil Med Univ,2012,33:1083-1085. |
| [12] | Gu R,Bai J,Ling L,Ding L,Zhang N,Ye J X.Increased expression of integrin-linked kinase improves cardiac function and decreases mortality in dilated cardiomyopathy model of rats[J].PLoS One, 2012, 7:e31279. |
| [13] | Yan A,Li G,Zhang X,Zhu B B,Linghu H.Pro-survival effect of Dock180 overexpression on rat-derived H9C2 cardiomyocytes[J].Med Sci Monit Basic Res,2013,19:12-19. |
| [14] | Communal C,Singh M,Menon B,Xie Z,Colucci W S,Singh K .β1 integrins expression in adult rat ventricular myocytes and its role in the regulation of β-adrenergic receptor-stimulated apoptosis[J].J Cell Biochem,2003,89:381-388. |
| [15] | Li R,Wu Y,Manso A M,Gu Y S,Liao P,Lsraeli S,et al.β1 integrin gene excision in the adult murine cardiac myocyte causes defective mechanical and signaling responses[J].Am J Pathol,2012,180:952-962. |
| [16] | Lu H,Fedak P W,Dai X,Du C,Zhou Y Q,Henkelman M,et al.Integrin-linked kinase expression is elevated in human cardiac hypertrophy and induces hypertrophy in transgenic mice[J].Circulation,2006,114:2271-2279. |
| [17] | White D E, Coutu P,Shi Y F,Tardif J C,Nattel S,St Arnaud R,et al.Targeted ablation of ILK from the murine heart results in dilated cardiomyopathy and spontaneous heart failure[J].Genes Dev,2006, 20:2355-2360. |
| [18] | Harston R K,Kuppuswamy D.Integrins are the necessary links to hypertrophic growth in cardiomyocytes[J].J Signal Transduct,2011:521742. |
| [19] | Balasubramanian S,Kuppuswamy D.RGD-containing peptides activate S6K1 through β3 integrin in adult cardiac muscle cells[J].J Biol Chem,2003,278:42214-42224. |
| [20] | Feller S M.Crk family adaptors-signalling complex formation and biological roles[J].Oncogene,2001,20:6348-6371. |
| [21] | Birge R B,Kalodimos C,Inagaki F,Tanaka S.Crk and CrkL adaptor proteins:networks for physiological and pathological signaling[J].Cell Commun Signal,2009,7:13. |
 2014, Vol. 35
2014, Vol. 35


