2. 第二军医大学学员旅七队, 上海 200433
2. The 7th Student Brigade, Second Military Medical University, Shanghai 200433, China
自发性蛛网膜下隙出血(subarachnoid hemarrhage,SAH)是一种神经外科常见重症,迟发性脑血管痉挛(cerebral vasospasm,CVS)是SAH患者预后不良的重要因素[1, 2]。针对CVS目前尚没有理想的防治方法,是基础及临床研究的热点,而建立理想的动物模型是进行相关研究的基础。经典的枕大池二次注血模型能模拟脑动脉的痉挛状态,但由于实验动物的代偿血流充分,造成的缺血性脑损伤并不严重,无法达到理想的效果[1, 2, 3]。因此,本研究尝试在枕大池注血前进行单侧颈动脉结扎,以加强缺血敏感区的脑组织损伤,使模型更适合于CVS后脑损害的研究。
1 材料和方法 1.1 实验动物及分组雄性新西兰兔30只,由海军医学研究所实验动物中心提供[许可证号:SYXK(沪)2012-0033]。健康状况良好,体质量2.3~2.7 kg,在相同的条件及环境中(饲料和温度均相同)饲养3 d后进行实验。动物随机分为3组,分别为假手术组(Sham)、注血组(SAH)和结扎注血组(CAO+SAH),每组各10只动物。假手术组行颈部假手术及枕大池穿刺假手术;注血组行颈部假手术及枕大池二次注血;结扎注血组行右侧颈动脉结扎及枕大池二次注血。
1.2 手术操作 1.2.1 麻醉采用复合麻醉,使用速眠新Ⅱ(吉林省华牧动物保健品有限公司,批号:30106) 0.1 mg/kg肌注,待实验兔处于深度镇静状态时,再予戊巴比妥钠(上海伊卡生物技术有限公司,德国进口分装,批号:EK140430) 0.3 mg/kg 经耳缘静脉注射麻醉。麻醉成功后先行颈部手术,再行枕大池穿刺。
1.2.2 颈动脉结扎实验兔仰卧位置于固定架,备皮消毒后作颈部正中切口,暴露右侧颈动脉(图 1A)并以丝线结扎后切断,术区止血后缝合切口。假手术组暴露颈动脉后不作结扎,缝合切口。
1.2.3 枕大池二次注血枕颈部备皮消毒后沿枕大孔后缘穿刺蛛网膜下隙,遇突破感后可见澄清脑脊液自套管针内芯涌出,撤出内芯,缓慢释放脑脊液约1.5 mL。以无肝素的2 mL空针经耳中央动脉取自体动脉血1.5 mL,以1 mL/min的速度将自体动脉血注入枕大池。实验兔置于头低位(30°)30 min。
操作过程中保持气道通畅,待麻醉苏醒后送回兔笼观察,48 h后以相同方法再次注血。假手术组行枕大池穿刺见脑脊液后拔除穿刺针结束操作。
1.3 标本取材于首次操作后第5天处死实验兔。戊巴比妥钠过量麻醉后,用4%多聚甲醛心脏灌注,取脑组织后以多聚甲醛固定。石蜡包埋后以4 μm厚度切片,基底动脉(含脑干)切片行H-E染色;大脑冠状位切片,在双侧海马区域切片行H-E染色及TUNEL染色。基底动脉H-E染色切片在光镜下摄片,影像软件测量基底动脉内周长(换算成直径),取近端、中段及远段基底动脉分别测量后计平均值。海马TUNEL染色切片使用影像软件行凋亡细胞计数,取3个高倍镜视野计数后以平均值(取整)表示。
1.4 统计学处理采用SPSS 20.0软件,数据均以 x±s 表示,组间比较采用独立样本t检验,检验水准(α)为0.05。
2 结 果 2.1 手术成功率假手术组动物存活率100%(10/10),注血组存活率90%(9/10),结扎注血组存活率70%(7/10)。注血组1只实验兔于首次注血后持续精神差,进食少,无明显肢体功能障碍,于第4天死亡。结扎注血组1只实验兔于首次注血后持续精神差,进食少,后肢肌张力增高,二次注血后加重,于第3天死亡;2只实验兔分别于第3天出现精神差,进食少,无明显肢体功能障碍,于第4天死亡。假手术组动物取脑未见明显SAH,注血组和结扎注血组动物取脑可见基底池及基底动脉周围明显血凝块(图 1B)。
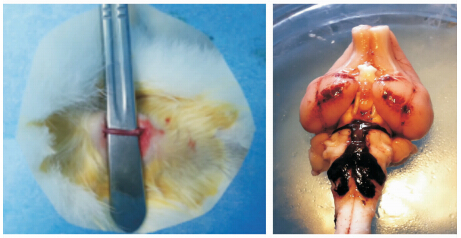
|
图 1 改良脑血管痉挛兔模型建模图 Fig 1 Pictures of modified vasospasm rabbit model A: Right carotid artery was exposed ready for occlusion; B: Sacrifice the rabbit on day 5,and blood blot at the basal cistern and around the basilar artery was shown |
结果(图 2A~2C)表明:与假手术组[(1 080.0±114.6) μm]相比,注血组[(712.4±98.9) μm]及结扎注血组[(761.7±100.0) μm]在建模第5天实验动物基底动脉直径均显著缩小(P<0.001)。结扎注血组与注血组间基底动脉直径差异无统计学意义(P=0.342),但结扎注血组基底动脉直径相比注血组增大约6.9%。
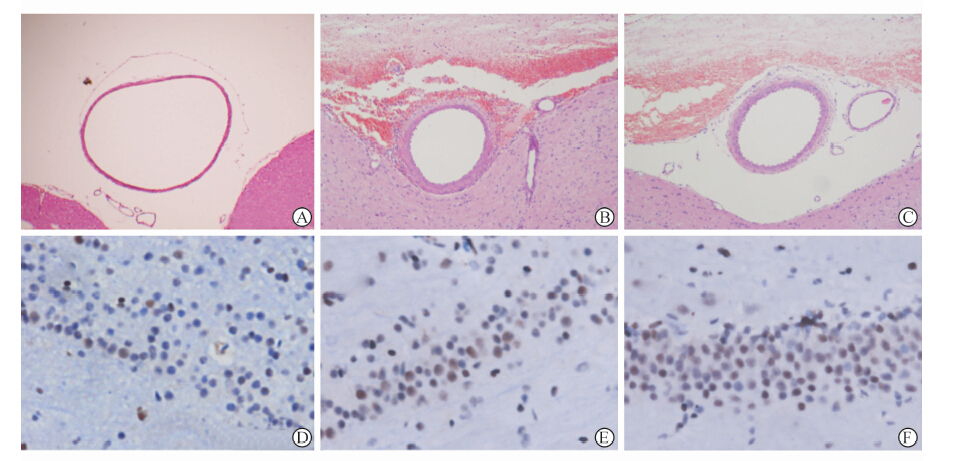
|
图 2 建模第5天各组模型基底动脉H-E染色(A-C)及海马TUNEL染色(D-F) Fig 2 H-E staining of basal artery(A-C) and TUNEL staining of hippocampus (D-F) on day 5 of modeling Vasospasm of basal artery and apoptosis at hippocampus are more serious in SAH group (B,E) and SAH+CAO group(C,F) than in sham group(A,D). The diameters of basal artery are not significantly different between SAH group (B) and SAH+CAO group (C),and there are more neuron apoptosis in SAH+CAO group (F) than in SAH group (E). SAH: Subarachnoid hemarrhage; CAO: Carotid artery occlusion |
结果(图 2D~2F)表明:与假手术组(45.6±16.0)相比,注血组(141.7±23.9)及结扎注血组(184.0±28.2)在建模第5天实验动物海马神经元凋亡计数升高,差异有统计学意义(P<0.001);且结扎注血组海马凋亡细胞计数较注血组升高,差异有统计学意义(P=0.005)。
2.4 结扎注血组双侧海马神经元凋亡计数的对比结扎注血组存活的7只兔右侧海马神经元凋亡计数为(184.0±28.2),左侧为(178.4±25.9),两侧比较差异无统计学意义(P=0.385)。
3 讨 论迟发性脑血管痉挛是动脉瘤性SAH后患者死亡和致残的重要因素[1, 2],但其发生发展机制目前仍未阐明。为了探索CVS的病理病生机制,学者们尝试建立了多种实验模型。尽管有体外模型被用于脑血管痉挛的研究,但是体内实验模型能更好地用于研究其发病机制、病理、诊断和治疗。考虑到可以进行血管造影评估血管痉挛程度,并将研究结果应用到人类的血管痉挛中去,使用猫、猪、狗,甚至灵长类动物模型可能是更理想的。但是这些大型动物的制作和饲养费用要比大鼠和兔子等小动物昂贵得多。
常用的SAH建模方法包括动脉内穿刺法、开颅手术蛛网膜下隙注血法和枕大池注血法。动脉内穿刺法导致的出血量不可控,动物死亡率较高,而且出血部位具有随机性,可能降低实验结果的可比性。开颅手术蛛网膜下隙注血法虽然能解决上述两个缺点,但是操作复杂,需要磨钻等专用设备,操作时间长、建模成本高。而枕大池注血法操作简便,成功率高,是目前使用最为广泛的建模方法,尤其是在通过二次注血后,脑血管痉挛的出现具有明显的双峰特征,能较好地模拟人类脑血管痉挛状态。
大量研究显示通过枕大池注血模型可以引起广泛的CVS[3, 4],但这种模型在发生血管痉挛的同时,造成的缺血性脑损伤常不严重。我们在临床上发现影像学确认的CVS不一定伴随严重的临床症状,但如果在此基础上发生低血压、低血容量等导致脑部低灌注的情况则极易造成缺血性脑损害[1]。 因此,本研究通过在注血前结扎一侧颈动脉造成低灌注状态,以建立一种合并严重缺血性脑损害的CVS模型。
在本组实验动物中,与假手术组相比,注血组基底动脉直径缩小了34.0%,结扎注血组缩小了29.5%,差异有统计学意义,与以往研究的结果相似[5, 6]。这提示与经典枕大池二次注血模型相比,结合颈动脉结扎的改良模型同样能引起实验动物脑动脉的明显痉挛。
结扎注血组的基底动脉直径平均值略大于注血组,约增加6.9%。这与结扎颈动脉诱导基底动脉顶端动脉瘤的研究中基底动脉发生扩张的现象[7]相似,考虑为后循环血流负荷加重引起的BA代偿性扩张。但与双侧颈动脉结扎引起的基底动脉增粗相比,单侧颈动脉结扎引起的后循环血流负荷增加程度较轻,而CVS的观察主要是建模后1周内,此时基底动脉直径改变尚不明显,对CVS的形成无明显影响。
脑血管痉挛后的缺血损害常通过海马凋亡神经元计数来评估,结扎注血组的海马凋亡神经元较注血组显著增加。而通过对比结扎注血组双侧海马的神经元凋亡情况,提示这种影响是双侧性的,与以往研究结果一致[8]。因此,神经元凋亡增加是低灌注状态下痉挛造成的缺血性脑损害加重,而不是颈动脉结扎引起的局限性脑缺血。
综上所述,与传统SAH模型相比,颈动脉结扎结合枕大池注血模型并不显著增加操作相关的动物死亡,而且在导致显著脑血管痉挛的同时,可以造成更严重的缺血性脑损害,有利于脑血管痉挛相关研究的开展。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Crowley R W,Medel R,Dumont A S,Ilodigwe D,Kassell N F,Mayer S A,et al.Angiographic vasospasm is strongly correlated with cerebral infarction after subarachnoid hemorrhage[J].Stroke,2011,42:919-923. |
| [2] | Frontera J A,Ahmed W,Zach V,Jovine M,Tanenbaum L,Sehba F,et al.Acute ischaemia after subarachnoid haemorrhage,relationship with early brain injury and impact on outcome: a prospective quantitative MRI study[J].J Neurol Neurosurg Psychiatry,2014,Apr 8.doi: 10.1136/jnnp-2013-307313. |
| [3] | Raslan F,Albert-Weissenberger C,Westermaier T,Saker S,Kleinschnitz C,Lee J Y.A modified double injection model of cisterna magna for the study of delayed cerebral vasospasm following subarachnoid hemorrhage in rats[J].Exp Transl Stroke Med,2012,4:23. |
| [4] | Zhou M L,Shi J X,Zhu J Q,Hang C H,Mao L,Chen K F,et al.Comparison between one- and two-hemorrhage models of cerebral vasospasm in rabbits[J].J Neurosci Methods,2007,159:318-324. |
| [5] | Guresir E,Raabe A,Jaiimsin A,Dias S,Raab P,Seifert V,et al.Histological evidence of delayed ischemic brain tissue damage in the rat double-hemorrhage model[J].J Neurol Sci,2010,293:18-22. |
| [6] | Lee J Y,Huang D L,Keep R,Sagher O.Characterization of an improved double hemorrhage rat model for the study of delayed cerebral vasospasm[J].J Neurosci Methods,2008,168:358-366. |
| [7] | 姚鹏飞,杨鹏飞,张照龙,黄清海,David F.Kallmes,刘建民.双侧颈总动脉结扎诱导兔基底动脉顶端动脉瘤模型的初步尝试[J].第二军医大学学报,2014,35:438-442. Yao P F,Yang P F,Zhang Z L,Huang Q H,Kallmes D F,Liu J M.Bilateral common carotid artery ligation for creating basilar terminus aneurysm model in rabbits:a preliminary study[J].Acad J Sec Mil Med Univ,2014,35:438-442. |
| [8] | De Ley G,Nshimyumuremyi J B,Leusen I.Hemispheric blood flow in the rat after unilateral common carotid occlusion: evolution with time[J].Stroke,1985,16:69-73. |
 2014, Vol. 35
2014, Vol. 35


