2. 第二军医大学长海医院骨科, 上海 200433
2. Department of Orthopaedics, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
结直肠癌(colorectal cancer,CRC)是消化道常见的恶性肿瘤,为全球高发的恶性肿瘤之一,发病率位居全球第三,在我国位居第四[1]。同时由于慢性失血、机体慢性消耗以及肿瘤放化疗后所致的外周血三系细胞减少等原因,CRC患者往往需要临床输血。Due等[2]报道CRC患者围手术期的输血率为10%~68%。目前临床上针对肿瘤患者的输血往往采取异体输血(allogeneic blood transfusion,ABT)。Opelz等[3]通过对肾移植患者的研究发现ABT可以提高移植肾的存活率,进一步的研究发现这种现象是由于输血造成受者的免疫抑制所致[4]。基于这一理论,Gantt[5]在1981年首次提出了ABT可能会对肿瘤患者产生不利影响的假说。尽管大量涉及ABT与肿瘤预后关系的文章相继发表,但关于这方面的研究结果至今仍存在争议。因此,本研究通过回顾ABT与CRC患者远期预后的相关文献,系统地分析与评价ABT对CRC患者总生存率(overall survival,OS)、无病生存率(disease free survival,DFS)、疾病特异性生存率(disease specific survival,DSS)、局部复发率(local recurrence)、远处转移率(distant metastasis)的影响,以期为临床安全输血提供科学指导。
1 资料和方法 1.1 文献检索采用PubMed、EMbase、The Cochrane Library以及中国生物医学文献数据库,检索2014年3月4日之前发表的文献。英文检索词为“(colon OR rectal OR colorectal) WITH (cancer OR tumor OR neoplasm) AND transfusion”。中文检索词为“(结肠癌OR直肠癌OR结直肠癌)AND输血”。此外还对纳入研究以及相关综述的参考文献进行了浏览,以减少漏检的情况。在语言方面没有特别限定。
1.2 文献纳入与排除标准研究类型:所有围手术期ABT患者与未输血患者远期预后相比较的观察性研究。研究对象:行根治术的CRC患者。暴露因素:输注异体血液。结局指标:OS、DFS、DSS、局部复发率以及远处转移率。排除标准:非论著文献(如综述等)、重复报告或信息不完整的文献。
1.3 数据提取两名研究者分别提取以下资料:第一作者、发表时间、样本量、随访时间、干预措施。提取的数据输入到Microsoft Excel 2007中,并由第3名研究者核对。任何存在分歧的问题均通过讨论解决。主要观察指标为OS,次要观察指标为DFS、DSS、局部复发率以及远处转移率。
1.4 质量评价采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)对纳入的文献进行质量评价[6]。
1.5 统计学处理为了定量地合并各远期预后结果,本研究提取风险比(hazard ratio,HR)及其95%可信区间(95% CI)作为各个纳入研究本身的效应量,并采用Inverse Variance方法合并各效应量。同时本研究采用χ2检验进行分析,通过计算P值以及I2值来判断各研究间异质性的大小。当I2值小于25%时,可以认为各研究间无异质性;当I2值介于25%~50%时,表示各研究间异质性低;当I2值介于50%~75%时,各研究间存在较大的异质性;当I2统计量大于75%时,各研究间存在很大的异质性[7]。对于异质性可以忽略的情况(P>0.1、I2≤50%),采用固定效应模型(fixed-effects model)进行分析;否则使用随机效应模型(random-effects model)进行分析,同时应用亚组分析来探讨异质性的来源。 所有统计分析与绘图均使用Stata 12.0软件(Stata Corp)。P值均为双侧检验结果,检验水准(α)为0.05。
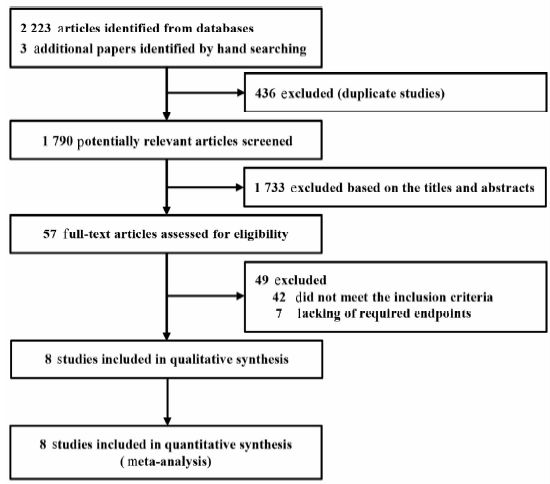
2 结 果 2.1 纳入研究的基本特征通过检索各数据库,共检出相关文献2 223篇,通过其他资源补充获得文献3篇,共2 226篇。2名研究者分别通过阅读标题、摘要和部分文献的全文,并结合研究目的,最终筛选出8篇文献[2, 8, 9, 10, 11, 12, 13, 14]纳入系统评价(图 1)。 纳入文献的基本特征如表 1所示。这些研究发表于2000—2014年,各研究的样本量为309~1 370不等(共计5 479例患者),随访时间至少为5年。采用NOS评价纳入研究的质量,如表 1所示,各研究的NOS得分为5~8,平均为7,其中高质量的研究(得分≥7)有7篇[2, 8, 9, 10, 12, 13, 14]。而扣分的主要原因为7篇文献[2, 8, 9, 10, 11, 12, 13]未充分描述失访情况,4篇文献[9, 11, 13, 14]未评价结局事件,3篇文献[2, 11, 14]未控制重要的混杂因素从而导致组间可比性不高,1篇文献[8]暴露队列代表性不强。
|
图 1 文献筛选流程图 Fig 1 Flow-chart for selecting studies |
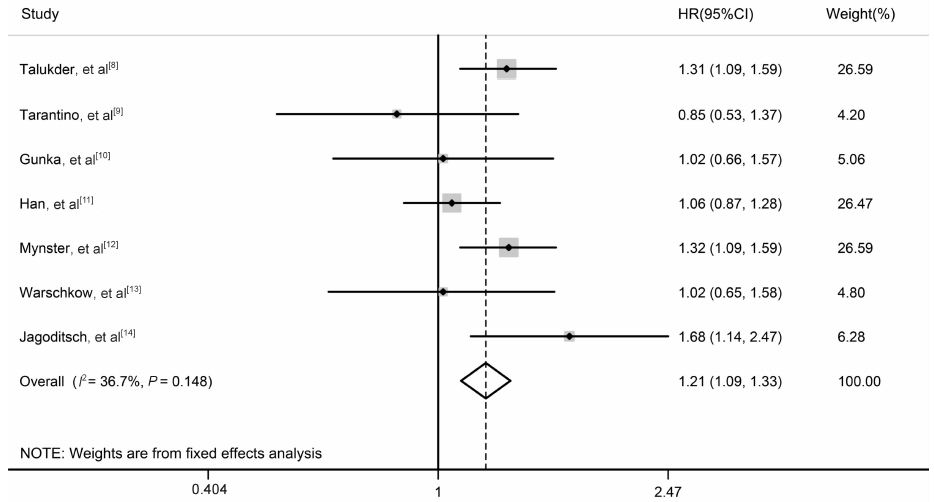
7篇文献[8, 9, 10, 11, 12, 13, 14]报道了输血组与未输血组相比较的总生存率HR,各研究间同质性较好(P=0.148,I2=36.7%),采用固定效应模型进行meta分析,结果(图 2)显示输血组的总生存风险比未输血组高21%(HR=1.21,95%CI: 1.09~1.33,P<0.001)。进一步分析表明,随机排除任意一个研究并未明显改变合并的HR值,其范围为1.17(95% CI: 1.04~1.31,P=0.007)到1.27(95% CI: 1.13~1.42,P<0.001)。
|
|
表 1 纳入研究的基本特征及质量评价 Tab 1 Characteristics and methodologic quality of studies included in the meta-analysis |
|
图 2 ABT与CRC患者术后总生存风险相关性的meta分析 Fig 2 Forest plot of HR for OS in CRC patients undergoing surgery after ABT ABT: Allogeneic blood transfusion; CRC: Colorectal cancer; HR: Hazard ratio; OS: Overall survival |
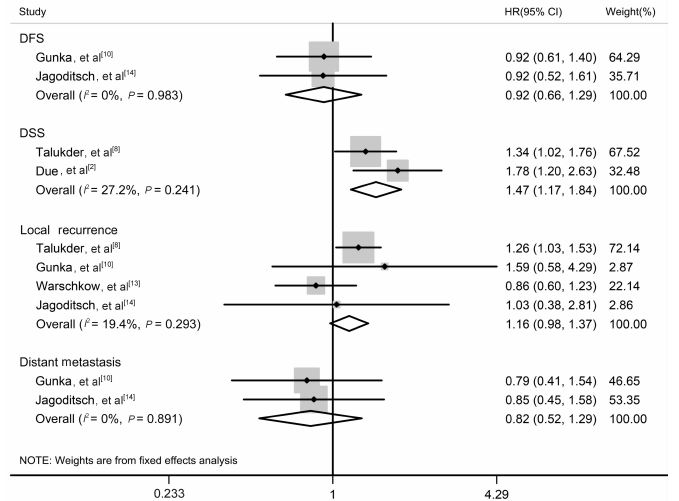
2篇文献[10, 14]报道了输血组与未输血组相比较的无病生存率HR,各研究间同质性较好(P=0.983,I2=0%),采用固定效应模型进行meta分析,结果(图 3)显示输血组的无病生存风险与未输血组的差异无统计学意义(HR=0.92,95% CI:0.66~1.29,P=0.633)。
|
图 3 ABT与CRC患者术后无病生存风险、疾病特异性生存风险、局部复发风险和远处转移风险相关性的meta分析 Fig 3 Forest plot of HR for DFS,DSS,local recurrence and distant metastasis in patients with CRC undergoing surgery after ABT ABT: Allogeneic blood transfusion; CRC: Colorectal cancer; HR: Hazard ratio; DFS: Disease free survival; DSS: Disease specific survival |
2篇文献[2, 8]报道了输血组与未输血组相比较的疾病特异性生存率HR,各研究间同质性较好(P=0.241,I2=27.2%),采用固定效应模型进行meta分析,结果(图 3)显示输血组的疾病特异性生存风险比未输血组高47%(HR=1.47,95% CI:1.17~1.84,P=0.001)。
2.2.4 局部复发率4篇文献[8, 10, 13, 14]报道了输血组与未输血组相比较的局部复发HR,各研究间同质性较好(P=0.293,I2=19.4%),采用固定效应模型进行meta分析,结果(图 3)显示输血组的局部复发风险与未输血组相比无明显差异(HR=1.16,95% CI:0.98~1.37,P=0.091)。
2.2.5 远处转移率2篇文献[10, 14]报道了输血组与未输血组远处转移的HR,各研究间同质性较好(P=0.891,I2=0%),采用固定效应模型进行meta分析,结果(图 3)显示输血组的远处转移风险与未输血组的差异无统计学意义(HR=0.82,95% CI:0.52~1.29,P=0.394)。
3 讨 论目前,研究人员在围手术期行ABT与肿瘤患者生存率、复发率以及远处转移率关系的问题上尚未达成共识。过去的几十年中,虽然有大量关于此类问题的研究,但是许多观点是相互矛盾的。本研究发现围手术期行ABT的CRC患者总生存风险和疾病特异性生存风险显著升高,而无病生存风险、局部复发风险和远处转移风险与未输血组相比无显著差异。之前亦有相关meta分析研究输血对CRC患者的影响,如Acheson等[15]研究发现异体输血增加CRC患者总死亡率、疾病特异死亡率以及术后并发症发生风险。Amato和Pescatori[16]的meta分析结果显示输血增加CRC患者复发率。然而我们的研究结果与这2篇meta分析结果部分存在分歧,具体原因可能如下:上述2篇meta分析对于终点事件的提取不够严谨,他们主要是采用总样本量×(1-某时间点的生存率)的方法来计算发生终点事件的数目,但是由于存在截尾数据或失访脱落等情况,该时间点的生存率已经不再是其占总样本量的比例,此外截取某个时间点的数据亦没有考虑时间因素对终点事件的影响;而本研究则是通过提取HR的方法以汇总整条生存曲线的信息,使结果更具说服力。
输血影响患者远期预后的机制尚不明确。有观点[17, 18]认为异源白细胞和血液储存过程中释放的炎症因子在输血介导免疫抑制过程中发挥重要作用。但是大量研究发现输注去白血液(去除白细胞的血液)对患者远期预后均无明显影响。一项多中心随机对照试验研究表明,输注去白血液并未改善胃肠癌患者5年OS、DFS和肿瘤复发率[19]。van de Watering[20]和Sknberg等[21]的研究结果也为上述观点提供了依据。此外上述试验均发现输血患者(无论输注何种类型的血液)的预后明显比未输血患者差。
血液储存时间也可能是影响肿瘤患者生存率和复发率的一个因素。有证据表明,血液在储存的过程中,细胞外生物活性物质如血管内皮生长因子(VEGF)会不断累积[22]。Patel等[23]发现输血可显著增加VEGF的水平,并且降低内皮抑素的水平,这种血管新生因子之间的失衡在离体情况下可增强血管的生成。且输血后可溶性VEGF的增高不仅促进肿瘤内部形成血管,而且有利于肿瘤细胞释放入血并转移到其他脏器。Mynster和Nielsen[24]发现输注储存时间大于21 d的去白红细胞是肿瘤复发的独立危险因素。但Edna和Bjerkeset[25]并未发现血液储存时间与CRC患者长期预后之间存在相关性。由于方法学上存在的显著差异,上述研究之间很难比较,其中主要分歧是在对需要多次输血患者血液储存时间的界定上。
尚有学者认为肿瘤患者自身基础疾病是影响其预后的主要因素,而非输血本身。Jagoditsh等[14]和Busch等[26]研究结果均发现,与输注去白红细胞相比,自体输血并未改善肿瘤患者远期预后。Benoist等[27]研究表明,围手术期输血的患者多为年龄>65岁、体质指数>27 kg/m2,术前血红蛋白≤125 g/L、ASA>Ⅱ级者,其共同特点是基础状况差。所以患者预后差可能为患者原本自身状况差所致,并不是输血造成的。
综上所述,当前证据表明围手术期ABT可以增加CRC患者的总生存风险与疾病特异性生存风险。但是,我们也注意到本研究存在一些缺陷。首先在文献纳入上,本篇meta分析纳入的文献主要为欧洲(瑞士、捷克、丹麦、奥地利),亚洲(中国)和大洋洲(澳大利亚)研究者发表的,而没有涉及非洲和美洲人群的研究。其次,纳入研究的样本量及方法学质量参差不齐,其中纳入的最大样本量(1 370例)是最小样本量(309例)的4.4倍,且无病生存率、疾病特异生存率、远处转移率等观察指标对应的研究数目过少。最后,由于各研究历时较长(有的研究长达20年),这段时间里输血已由输全血向成分输血转变,手术方法以及输血标准也在改变,因此采取亚组分析是十分必要的。但是由于大部分原始数据无法获取,亚组分析很难进行,这样得出的结果就可能存在偏倚。基于上述原因,今后尚需开展更多大样本、 多中心、高质量的研究,以指导临床输血的安全开展。
4 利益冲突所有作者声明本文不涉及任何利益冲突
| [1] | Soerjomataram I,Lortet-Tieulent J,Parkin D M,Ferlay J,Mathers C,Forman D,et al.Global burden of cancer in 2008:a systematic analysis of disability-adjusted life-years in 12 world regions[J].Lancet,2012,380:1840-1850. |
| [2] | Due S L,Wattchow D A,Sweeney J L,Milliken L,Luke C G.Colorectal cancer surgery 2000-2008: evaluation of a prospective database [J].ANZ J Surg,2012,82:412-419. |
| [3] | Opelz G,Sengar D P,Mickey M R,Terasaki P I.Effect of blood transfusions on subsequent kidney transplants [J].Transplant Proc,1973,5:253-259. |
| [4] | Opelz G,Terasaki P I.Prolongation effect of blood transfusions on kidney graft survival [J].Transplantation,1976,22:380-383. |
| [5] | Gantt C L.Red blood cells for cancer patients [J].Lancet,1981,2:363. |
| [6] | Wells G A,Shea B,O'Connell D,Peterson J,Welch V,Losos M,et al.The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses[S].http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. |
| [7] | Higgins J P,Thompson S G,Deeks J J,Altman D G.Measuring inconsistency in meta-analyses [J].BMJ,2003,327:557-560. |
| [8] | Talukder Y,Stillwell A P,Siu S K,Ho Y H.Comparing survival and recurrence in curative stage Ⅰ to Ⅲ colorectal cancer in transfused and nontransfused patients [J].Int Surg,2014,99:8-16. |
| [9] | Tarantino I,Ukegjini K,Warschkow R,Schmied B M,Steffen T,Ulrich A,et al.Blood transfusion does not adversely affect survival after elective colon cancer resection:a propensity score analysis[J].Langenbecks Arch Surg,2013,398:841-849. |
| [10] | Gunka I,Dostalik J,Martinek L,Gunkova P,Mazur M.Impact of blood transfusions on survival and recurrence in colorectal cancer surgery[J].Indian J Surg,2013,75:94-101. |
| [11] | Liang H,Wang X,Wang B,Pan Y,Liu N,Wang D,et al.Influence of perioperative blood transfusion on prognosis in patients with colon cancer[J].Chin German J Clin Oncol,2006,5:261-267. |
| [12] | Mynster T,Christensen I J,Moesgaard F,Nielsen H J.Effects of the combination of blood transfusion and postoperative infectious complications on prognosis after surgery for colorectal cancer [J].Br J Surg,2000,87: 1553-1562. |
| [13] | Warschkow R,Güller U,Köberle D,Müller S A,Steffen T,Thurnheer M,et al.Perioperative blood transfusions do not impact overall and disease-free survival after curative rectal cancer resection: a propensity score analysis[J].Ann Surg,2014,259:131-138. |
| [14] | Jagoditsch M,Pozgainer P,Klingler A,Tschmelitsch J.Impact of blood transfusions on recurrence and survival after rectal cancer surgery[J].Dis Colon Rectum,2006,49:1116-1130. |
| [15] | Acheson A G,Brookes M J,Spahn D R.Effects of allogeneic red blood cell transfusions on clinical outcomes in patients undergoing colorectal cancer surgery: a systematic review and meta-analysis[J].Ann Surg,2012,256:235-244. |
| [16] | Amato A,Pescatori M.Perioperative blood transfusions for the recurrence of colorectal cancer [J].Cochrane Database Syst Rev,2006(1):CD005033. |
| [17] | Dionigi G,Rovera F,Boni L,Carrafiello G,Recaldini C,Mangini M,et al.The impact of perioperative blood transfusion on clinical outcomes in colorectal surgery [J].Surg Oncol,2007,16(S1):177-182. |
| [18] | Vamvakas E C,Blajchman M A.Deleterious clinical effects of transfusion-associated immunomodulation: fact or fiction? [J].Blood,2001,97:1180-1195. |
| [19] | Lange M M,van Hilten J A,van de Watering L M,Bijnen B A,Roumen R M,Putter H,et al.Leucocyte depletion of perioperative blood transfusion does not affect long-term survival and recurrence in patients with gastrointestinal cancer [J].Br J Surg,2009,96:734-740. |
| [20] | van de Watering L M,Brand A,Houbiers J G,Klein Kranenbarg W M,Hermans J,van de Velde C,et al.Perioperative blood transfusions,with or without allogeneic leucocytes,relate to survival,not to cancer recurrence[J].Br J Surg,2001,88:267-272. |
| [21] | Skänberg J,Lundholm K,Haglind E.Effects of blood transfusion with leucocyte depletion on length of hospital stay,respiratory assistance and survival after curative surgery for colorectal cancer [J].Acta Oncol,2007,46:1123-1130. |
| [22] | Nielsen H J,Werther K,Mynster T,Brünner N.Soluble vascular endothelial growth factor in various blood transfusion components[J].Transfusion,1999,39:1078-1083. |
| [23] | Patel H B,Nasir F A,Nash G F,Scully M F,Kakkar A K.Enhanced angiogenesis following allogeneic blood transfusion [J].Clin Lab Haematol,2004,26:129-135. |
| [24] | Mynster T,Nielsen H J.Storage time of transfused blood and disease recurrence after colorectal cancer surgery [J].Dis Colon Rectum,2001,44:955-964. |
| [25] | Edna T H,Bjerkeset T.Perioperative blood transfusions reduce long-term survival following surgery for colorectal cancer [J].Dis Colon Rectum,1998,41:451-459. |
| [26] | Busch O R,Hop W C,Marquet R L,Jeekel J.Blood transfusions and local tumor recurrence in colorectal cancer:evidence of a noncausal relationship[J].Ann Surg,1994,220:791-797. |
| [27] | Benoist S,Panis Y,Pannegeon V,Alves A,Valleur P.Predictive factors for perioperative blood transfusions in rectal resection for cancer:a multivariate analysis of a group of 212 patients[J].Surgery,2001,129:433-439. |
 2014, Vol. 35
2014, Vol. 35


