2. 重庆医科大学附属第一医院神经内科, 重庆 400016;
3. 重庆医科大学附属第一医院中西医结合科, 重庆 400016
2. Department of Neurology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China;
3. Department of Integrative Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
脑血管病因其高发病率、高致残率及高死亡率,给社会和家庭带来了沉重的经济负担。缺血性脑卒中患者除在超早期进行静脉溶栓治疗外,尚缺乏有效的治疗手段。因此,积极寻求新的神经保护剂是目前研究的重点。米诺环素是一种第二代四环素类抗生素,具有抗炎、抗凋亡、抗氧化应激及血管保护活性,通过多途径、多靶点发挥保护作用[1]。有研究表明,腹腔注射大剂量米诺环素对大鼠缺血性脑损伤具有神经保护作用[2]。近期一项临床研究显示,静脉给予低剂量米诺环素对缺血性脑卒中患者是安全可行的[3]。大量基础和临床研究表明小胶质细胞激活介导的炎症反应及缺血灶周围高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)的聚集在缺血性脑损伤中起着重要作用[4, 5]。本研究旨在观察静脉给予低剂量米诺环素对大鼠缺血性脑损伤后脑梗死体积、血脑屏障通透性、小胶质细胞的活化、HMGB1的表达及神经功能的影响,从而阐明其可能的神经保护机制。
1 材料和方法 1.1 动物与试剂72只成年雄性SD大鼠,体质量250~280 g,购于重庆医科大学实验动物中心[SCXK(渝)20120001]。红四氯氮唑(TTC)及盐酸米诺环素(Sigma公司),山羊抗离子钙接头蛋白(Iba1)多克隆抗体(英国Abcam公司),兔抗HMGB1多克隆抗体(北京博奥森公司),全蛋白提取试剂盒(南京凯基公司),伊文思蓝(EB,碧云天生物公司)。
1.2 动物处理与分组72只SD大鼠按随机数字表分为假手术组(S组)、缺血再灌注组(I/R组)和米诺环素干预组(I/R+MC组),每组24只。从各组中各选6只分别进行蛋白质印迹、脑梗死体积、血脑屏障通透性及大鼠神经功能评分。I/R组大鼠参照本课题组前期的实验方法[6]制作大脑中动脉阻塞再灌注模型:大鼠麻醉后,将其仰卧位固定,颈正中切口,分离出颈总、颈内及颈外动脉,隔断颈外动脉及颈内外动脉之间的交通支,结扎颈总动脉和颈内动脉,从颈外动脉残端缓慢插入线栓,插入到微感阻力即停止,用丝线固定线栓并缝合伤口,缺血2 h后轻轻拔出线栓到动脉分叉处,实现再灌注。S组大鼠除不插入线栓外,其余步骤同I/R组。I/R+MC组在再灌注后,尾静脉注射3 mg/kg米诺环素,每日2次,持续14 d。
1.3 TTC染色法测定大鼠脑梗死体积大鼠脑缺血再灌注2 d后进行TTC染色。具体步骤如下:用3.5%水合氯醛麻醉大鼠后断头处死,将脑组织放入-20℃冰箱中冷冻30 min,取出后切成5片(每片厚2 mm);放入2% TTC溶液中,37℃避光孵育30 min;最后用数码相机采图,使用Image J软件测量不同层面的梗死面积,根据梯形法则计算梗死体积。
1.4 EB法测定血脑屏障通透性参照Belayev等[7]的方法,再灌注2 d后股静脉注射2% EB(5 mL/kg),6 h后处死大鼠,经左心室灌注生理盐水后取出大脑,称量双侧大脑半球,每克脑组织加入2 mL甲基酰胺,60℃水浴24 h取出,7 500×g离心20 min,取上清液,15 000×g离心10 min。取上清液200 μL加入酶标板中,酶标仪630 nm测定光密度值,计算脑组织EB含量,结果以μg/g脑组织表示。
1.5 蛋白质印迹法检测HMGB1、Iba1蛋白表达缺血再灌注2 d后,分别提取缺血侧脑组织蛋白。以30 μg蛋白/电泳道上样,10% SDS-PAGE电泳后将目的蛋白转移至0.45 μm的PDVF膜上,5%脱脂牛奶封闭后,4℃孵育特异性一抗过夜,辣根过氧化物酶标记的二抗孵育1 h后,用凝胶扫描成像仪拍照。采用Quantity One图像软件进行灰度定量分析,将目的蛋白与内参β-actin的光密度的比值作为目的蛋白的相对表达量。
1.6 大鼠神经功能缺损评分参照Chen等[8]提出的改良神经功能缺损评分(mNSS),对各组大鼠术后2、7、14 d的神经功能进行评价计分。0分是最低分,18分为最高分,得分越高神经功能损害越严重。
1.7 统计学处理采用SPSS 17.0统计软件对数据进行分析,数据以 x±s 表示,多组间比较运用AVONA分析,两两比较行LSD检验。检验水准(α)为0.05。
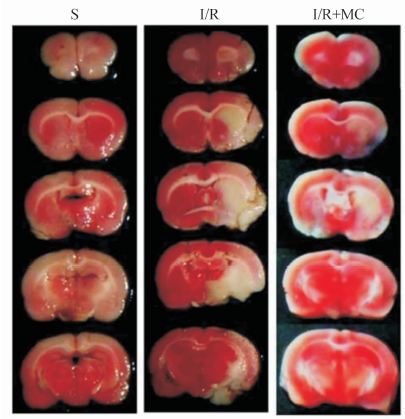
2 结 果 2.1 米诺环素对脑缺血再灌注后脑梗死体积的影响脑缺血再灌注后2 d,TTC染色结果显示,I/R组大鼠脑梗死体积约占S组正常脑组织体积的35.4%,米诺环素干预后大鼠的脑梗死体积约占S组的23.7%,低于I/R组梗死体积(图 1)。
|
图 1 米诺环素对大鼠脑缺血再灌注损伤后脑梗死体积的影响 Fig 1 Effects of minocycline on infarct volume of rats after cerebral ischemia/reperfusion S: Sham-operated group; I/R: Ischemia/reperfusion group;I/R+MC: Minocycline intervention group |
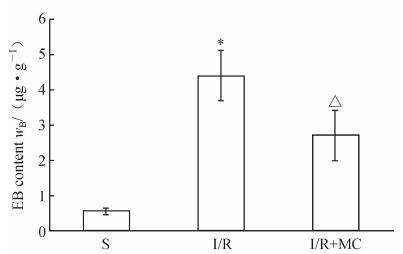
脑缺血再灌注后2 d ,I/R组大鼠右侧大脑半球皮质及皮质下有明显的EB渗出。定量分析结果表明,I/R组大鼠缺血侧脑组织EB含量多于S组(P<0.05),I/R+MC组大鼠缺血脑组织的EB含量低于I/R组,差异有统计学意义(P<0.05,图 2)。
|
图 2 米诺环素对大鼠脑缺血再灌注损伤后血脑屏障通透性的影响 Fig 2 Effects of minocycline on permeability of blood brain barrier of rats after cerebral ischemia/reperfusion S: Sham-operated group; I/R: Ischemia/reperfusion group;I/R+MC: Minocycline intervention group; EB: Evan’s blue. *P<0.05 vs S group;△P<0.05 vs I/R group. n=6,x±s |
S组缺血侧脑组织仅有少量Iba1和HMGB1蛋白表达。缺血再灌注后2 d,I/R组Iba1和HMGB1蛋白表达量高于S组(P<0.05);与I/R组比较,I/R+MC组Iba1和HMGB1蛋白表达量减少(P<0.05,图 3)。

|
图 3 米诺环素对大鼠脑缺血再灌注损伤后Iba1和HMGB1蛋白表达的影响 Fig 3 Effects of minocycline on Iba1 and HMGB1 expressions of rats after cerebral ischemia/reperfusion S: Sham-operated group; I/R: Ischemia/reperfusion group; I/R+MC: Minocycline intervention group. Iba1: Ionized calcium-binding adaptor molecule 1; HMGB1: High mobility group box-1 protein. *P<0.05 vs S group; △P<0.05 vs I/R group. n=6,x±s |
S组在各时间点无神经功能缺损症状。缺血再灌注后,I/R组和I/R+MC组大鼠均出现神经功能缺损症状。缺血再灌注2 d 后,I/R+MC组大鼠神经功能缺损评分与I/R组相比差异无统计学意义(P>0.05);缺血再灌注7、14 d后,I/R+MC组大鼠神经功能缺损评分均低于I/R组(P<0.05,表 1)。
|
|
表 1 各组间大鼠改良神经功能缺损评分比较 Tab 1 Comparison of modified neurological severity scores between rats of different groups |
米诺环素是一种高脂溶性且能通过血脑屏障的四环素类抗生素,在临床上被广泛用于治疗严重的关节炎及感染性疾病。最近的研究表明,米诺环素在中枢神经系统疾病中具有神经保护作用,是目前最具潜力的神经保护剂[2]。多项研究表明,长期给予米诺环素治疗可以通过抑制小胶质细胞/巨噬细胞的激活、清除氧自由基、调节半胱氨酸蛋白酶(caspases)依赖或非依赖性途径发挥抗炎、抗氧化应激、抗凋亡等作用,从而改善大鼠的神经功能[2, 9]。在脑缺血的动物模型中,常选择腹腔注射高剂量(10~90 mg/kg)米诺环素的方式给药[10],但腹腔注射会导致米诺环素的延迟吸收和腹膜激惹[11],而且不适合于临床的广泛应用。因此,寻找米诺环素最佳的给药途径及最佳剂量是将基础研究应用到临床的关键。静脉注射3 mg/kg的米诺环素可以达到口服200 mg米诺环素的血药浓度。Xu等[12]发现,脑缺血5 h内静脉注射3 mg/kg米诺环素能降低大鼠脑梗死体积,缓解神经功能的损害,与本研究的结果一致。血脑屏障在维持大脑功能中起到重要的作用,本实验表明低剂量米诺环素能降低伊文思蓝的渗出,减轻血脑屏障的损坏。
HMGB1是一种高度保守的非组蛋白DNA结合蛋白,在大脑皮质及海马等部位广泛表达。近年研究发现HMGB1是一种新的促炎性细胞因子,脑缺血再灌注后,HMGB1可通过活性小胶质细胞主动分泌和受损的神经细胞被动释放的方式从细胞核转移到细胞质,再释放到细胞外,激活体内多条信号通路,启动炎症反应,引起各种炎性介质的释放,从而导致缺血再灌注损伤[5]。Shin等[13]研究表明脑缺血后HMGB1的释放存在两个高峰,早期以受损细胞的释放增多为主,晚期以激活的炎性细胞合成增加为主。经鼻给予HMGB1七聚物肽治疗后,可以抑制HMGB1介导的神经元死亡,起到神经保护作用[14]。 本研究发现,静脉给予低剂量米诺环素2 d后,缺血脑组织内HMGB1的表达明显低于I/R组,表明米诺环素抑制了脑缺血早期HMGB1的释放。小胶质细胞是中枢神经系统的免疫细胞,Iba1是活性小胶质细胞的标记物,脑缺血后小胶质细胞过度激活,参与缺血再灌注损伤的病理过程。本研究发现,低剂量米诺环素可以抑制小胶质细胞的活化,减轻缺血再灌注损伤,与Hayakawa等[15]报道结果类似。
综上所述,尾静脉给予低剂量米诺环素可以改善局灶性脑缺血再灌注大鼠的神经功能,其机制可能包括减少脑梗死体积,降低血脑屏障的通透性,抑制小胶质细胞的活化及促炎因子HMGB1的释放。本研究结果提示,低剂量米诺环素对大鼠缺血性脑损伤具有神经保护作用,这为临床应用米诺环素治疗缺血性脑血管疾病提供了理论及实验基础。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Karachitos A,García Del Pozo J S,de Groot P W,Kmita H,Jordán J.Minocycline mediated mitochondrial cytoprotection: premises for therapy of cerebrovascular and neurodegenerative diseases[J].Curr Drug Targets,2013,14:47-55. |
| [2] | Plane J M,Shen Y,Pleasure D E,Deng W.Prospects for minocycline neuroprotection[J].Arch Neurol,2010,67:1442-1448. |
| [3] | Fagan S C,Waller J L,Nichols F T,Edwards D J,Pettigrew L C,Clark W M,et al.Minocycline to improve neurologic outcome in stroke (MINOS):a dose-finding study[J].Stroke,2010,41:2283-2287. |
| [4] | Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J].J Leukoc Biol,2010,87:779-789. |
| [5] | Wang Y C,Lin S,Yang Q W.Toll-like receptors in cerebral ischemic inflammatory injury[J].J Neuroinflammation,2011,8:134. |
| [6] | 陶 涛,秦新月,徐广会.养血清脑颗粒对大鼠脑缺血再灌注损伤后轴突再生及RGMa表达的影响[J].第三军医大学学报,2013,35:635-638. |
| [7] | Belayev L,Busto R,Zhao W,Ginsberg M D.Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats[J].Brain Res,1996,739(1-2):88-96. |
| [8] | Chen J,Sanberg P R,Li Y,Wang L,Lu M,Willing A E,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32:2682-2688. |
| [9] | Franco E C,Cardoso M M,Gouvêia A,Pereira A, Gomes-Leal W.Modulation of microglial activation enhances neuroprotection and functional recovery derived from bone marrow mononuclear cell transplantation after cortical ischemia[J].Neurosci Res,2012,73:122-132. |
| [10] | Matsukawa N,Yasuhara T,Hara K,Xu L,Maki M,Yu G,et al.Therapeutic targets and limits of minocycline neuroprotection in experimental ischemic stroke[J].BMC Neurosci,2009,10:126. |
| [11] | Fagan S C,Edwards D J,Borlongan C V,Xu L,Arora A,Feuerstein G,et al.Optimal delivery of minocycline to the brain:implication for human studies of acute neuroprotection[J].Exp Neurol,2004,186:248-251. |
| [12] | Xu L,Fagan S C,Waller J L,Edwards D,Borlongan C V,Zheng J,et al.Low dose intravenous minocycline is neuroprotective after middle cerebral artery occlusion-reperfusion in rats[J].BMC Neurol,2004,4:7. |
| [13] | Shin J H,Lee H K,Lee H B,Jin Y,Lee J K.Ethyl pyruvate inhibits HMGB1 phosphorylation and secretion in activated microglia and in the postischemic brain[J].Neurosci Lett,2014,558:159-163. |
| [14] | Kim I D,Shin J H,Lee H K,Jin Y C,Lee J K.Intranasal delivery of HMGB1-binding heptamer peptide confers a robust neuroprotection in the postischemic brain[J].Neurosci Lett,2012,525:179-183. |
| [15] | Hayakawa K,Mishima K,Nozako M,Hazekawa M, Mishima S,Fujioka M,et al.Delayed treatment with minocycline ameliorates neurologic impairment through activated microglia expressing a high-mobility group box1-inhibiting mechanism[J].Stroke,2008,39:951-958. |
 2014, Vol. 35
2014, Vol. 35


