2. 第四军医大学唐都医院心血管内科, 西安 710038;
3. 第四军医大学唐都医院胸外科, 西安 710038;
4. 济南军区联勤部卫生部保健办, 济南 250022
2. Department of Cardiovasology, Tangdu Hospital, Fourth Military Medical University, Xi'an 710038, Shaanxi, China;
3. Department of Thoracic Surgery, Tangdu Hospital, Fourth Military Medical University, Xi'an 710038, Shaanxi, China;
4. The Health Care Room, Health Sector, Joint Service Department of PLA Jinan Military Area Command, Jinan 250022, Shandong, China
心房颤动(房颤)是临床上最常见的心律失常之一,其发病机制目前尚不清楚,现在较为公认的有多重子波折返学说、肺静脉肌袖起源学说以及转子驱动学说(Roter)等。一些研究发现,心脏手术后房颤发病率明显增高,提示手术后炎症和氧化应激与房颤的发生密切相关[1]。大量临床和动物研究表明,膳食中的n-3多聚不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)对一般人群心血管事件具有显著的保护作用,其中包括减少总体死亡风险、冠心病死亡风险以及心肌梗死后猝死的风险,而且还可以降低卒中风险。GISSI-Prevenzione试验[2]纳入超过11 324例近期发生急性心肌梗死(AMI)的患者,研究显示每日摄入1 g n-3 PUFAs持续3.5年,总体病死率(包括冠心病及其他原因导致的病死率)将减少20%,心血管病死率减少30%,猝死发生率下降45%。 Schrepf等[3]和Mozaffarian等[4]研究发现PUFAs具有抗心律失常作用,对心室颤动(室颤)、猝死有很好疗效,但其对房颤有何影响目前并无定论。PUFAs具有很好的抗炎抗氧化作用,而这些作用是否能够对房颤的发生发展起到抑制作用,目前国内外尚未见报道。本研究采用犬无菌性心包炎模型来观察PUFAs对房颤及对心房内氧化应激的影响。
1 材料和方法 1.1 实验动物普通健康成年杂种犬22只,雌雄不限,雌性9只,雄性13只,体质量17~22 kg,购于第四军医大学实验动物管理中心,饲养温度20℃,湿度50%,12 h光照,充足食水。
1.2 仪器和试剂n-3 PUFAs(德国Omacor,Solvay Pharmaceuticals GmbH公司),64导联电生理记录仪(河南华南医电科技有限公司),Medtronic 5329 型程序刺激仪(美国美敦力公司),片状标测起搏电极(自制,河南华南医电科技有限公司协助),3-硝基酪氨酸抗体(美国Sigma公司),蛋白质印迹检测试剂盒(美国Pierce公司),GAPDH一抗和蛋白质印迹二抗(北京博奥森生物技术有限公司)。
1.3 实验分组采用随机数字法将犬分为:PUFAs组(n=11),在正常饮食中加入n-3 PUFAs 2 g/d;对照组(n=11),给予正常饮食,并严格控制以确保其饮食中不含任何不饱和脂肪酸。两组均饲养4周。
1.4 术前准备及手术操作实验犬经戊巴比妥钠(30 mg/kg)肌注麻醉后,气管插管,呼吸机机械通气。股动脉穿刺,抽血10 mL,离心取上清,-80℃保存。生理盐水500 mL缓慢静滴补液。64导联电生理记录仪连续记录体表心电图,股动脉插管监测动脉血压。右侧第4肋间切口,打开胸腔,暴露心包膜。沿房室沟向上剪开心包,暴露右心房、右心耳。分别于高右房(HRA)、低右房(LRA)、右房游离壁(ARA)、右心耳(RAA)处缝制自制双极刺激标测电极,行基线电生理学检查。
1.5 电生理学检查 1.5.1 心房有效不应期(AERP)和心房内传导时间(CT)的测定首先在HRA、LRA、ARA、RAA等4个位置以S1S1 400、300、200 ms周长起搏30 s,使之达到稳态,起搏电压2倍于舒张期阈值。分别以(1)S1S1 400 ms,S1S2 120 ms;(2)S1S1 300 ms,S1S2 100 ms;(3)S1S1 200 ms,S1S2 80 ms;S1∶S2=8∶1,3.5 V,10 ms步长于心外膜递增刺激HRA、LRA、ARA、RAA等部位,直至出现心房夺获,然后以夺获周长减去10 ms作为S2起搏,以2 ms步长递增刺激,直至心房再次夺获。AERP定义为心房再次夺获前的最长S1S2配对间期。RAA起搏时,RAA起搏信号和HRA、LRA、ARA起搏信号的时间差值定义为CT。
1.5.2 房颤诱发性和维持性的检测测量AERP和CT之后,分别在HRA、LRA、ARA和RAA处给予Burst刺激(10 V,频率10 Hz,脉冲宽度10 ms,10 s,重复10次)诱发房颤。将出现不规则的快速房性心律失常、A-A间期<150 ms、持续时间>1 min定义为房颤发作。房颤评价有如下2个指标:房颤易感性,以在AERP测量期间由单一额外刺激诱发房颤发作(至少1次)的犬百分比、Burst诱发出房颤发作的百分比表示。房颤维持性,以每条犬房颤持续时间以及房颤持续时间超过10 min(至少1次)的犬百分比表示。如果房颤发作时程>15 min,即给予双极除颤器除颤,5 min后再行刺激。
1.6 无菌性心包炎模型制作电刺激结束后,用含地塞米松和氨苄青霉素混合冲洗液进行胸腔冲洗,于心包内均匀播撒无菌滑石粉[5],关心包,逐层关胸,经皮下隧道将电极导线引至胸外。
1.7 手术后电生理学检查及标本采集于术后第2天再次麻醉,气管插管,呼吸机通气。股动脉穿刺抽血10 mL,离心取上清,-80℃保存。连续记录体表心电图、血压。开胸后再次行电生理学检查(同前)。行电生理检查后,处死犬,快速取左右心房组织,切成10 mm×5 mm大小,-80℃保存。
1.8 血浆脂肪酸浓度检测取血清500 μL于试管中,加入无水甲醇-苯-氢氧化钠(CH3OH-C6H6-NaOH),混匀后静置20 min,再加入0.5 mol/L甲醇-盐酸(CH3OH-HCl)1 mL,充分混匀,4 500×g离心15 min,取环己烷层,得到甲酯化的脂肪酸。应用日本岛津公司GC/MS-QP2010气相色谱仪对脂肪酸甲酯化产物进行分析,测定n-3 PUFAs含量。
1.9 蛋白质印迹检测3-硝基酪氨酸蛋白水平提取组织总蛋白,将组织块置于2 mL玻璃匀浆器中,加200 mL裂解液(含PMSF),重复匀浆。30 min后,将裂解液移至1.5 mL离心管中,4℃ 9 180×g离心5 min,取上清-20℃保存。Bradford法测定蛋白含量。SDS-PAGE电泳,转膜,TBS+8%牛奶封闭液室温封闭PVDF膜,4℃过夜。用TBS稀释兔抗3-硝基酪氨酸多克隆抗体(1∶2 000)或小鼠抗GAPDH单克隆抗体(1∶2 000),4℃孵育过夜。洗膜3次,用TBS稀释与一抗相应的抗兔/小鼠二抗,洗膜4次,ECL化学发光法显色,X线曝光显影,凝胶成像分析系统分析结果。阴性对照组来自3只心包炎假手术的犬心房组织。
1.10 统计学处理采用SPSS 11.5软件进行统计分析,正态分布数据以 x±s 表示,非正态分布资料以中位数(上、下四分位数)表示,计量资料组内比较采用配对t 检验,组间采用两样本t检验;计数资料采用χ2检验,非正态分布数据采用Mann-Whitney检验。检验水准(α)为0.05。
2 结 果 2.1 动物一般情况2只犬在术中、术后死亡,20只完成实验。术后第2天打开心包发现所有犬均出现不同程度的胸腔积液、心包粘连。
2.2 血液中n-3 PUFAs相对浓度的变化如表 1所示,在基线水平,PUFAs组和对照组血浆中n-3 PUFAs的相对浓度差异无统计学意义。经过4周n-3 PUFAs饲养后,PUFAs组血浆中n-3 PUFAs的相对浓度较基线水平显著增加,其中n-3 PUFAs相对浓度增加36.2%,EPA+DHA浓度增加81.2%,差异均有统计学意义(P<0.05)。
|
|
表 1 血浆中不同磷脂成分的变化 Tab 1 Changes of different phospholipid compositions in the plasma |
造模前两组在测量AERPs过程中,无犬诱发出房颤发作;但在造模术后第2天,对照组有70%的犬在测量AERPs过程中(单次额外刺激)诱发出房颤发作,PUFAs组仅有10%诱发房颤(P<0.05)。PUFAs组在术后第2天Burst诱发出房颤发作的百分比[(11.0±7.4)%] 较对照组同期[(28.0±10.3)%]降低(P<0.05)。两组造模后房颤持续时间均较造模前延长,但与对照组相比,PUFAs组心包炎造模前后房颤持续时间均缩短(均P<0.05)。在心包炎造模前,两组均不能诱发持续时间>10 min的房颤,但造模后两组均有持续时间>10 min的房颤发作,且PUFAs组此种房颤发作比率较对照组降低(20% vs 70%,P<0.05)。具体数据见表 2。
|
|
表 2 房颤易感性和房颤维持性变化 Tab 2 Inducibility and maintenance changes of atrial fibrillation (AF) |
造模术前两组AERP和CT差异均无统计学意义。术后第2天,两组AERP均较术前缩短(P<0.05,P<0.01),但PUFAs组缩短程度较对照组明显减轻(P<0.05,P<0.01);对照组中术后第2天CT较术前延长(P<0.05,P<0.01),而PUFAs组术前、术后无显著变化,术后PUFAs组CT较对照组缩短(P<0.05)。见表 3。
|
|
表 3 无菌性心包炎术前和术后的电生理学参数比较 Tab 3 Comparison of electrophysiological parameters before and after operation for sterile pericarditis |
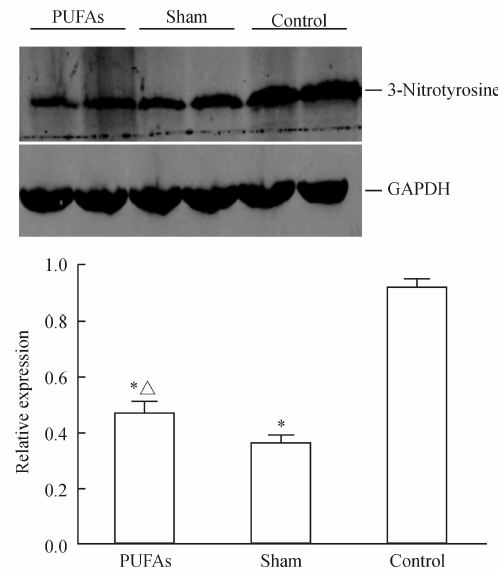
与假手术组相比,对照组和PUFAs组心房组织内3-硝基酪氨酸含量均增加(P<0.05),但PUFAs组心房组织内3-硝基酪氨酸表达低于对照组(P<0.05)。具体见图 1。
|
图 1 心房组织中3-硝基酪氨酸含量变化 Fig 1 Change of 3-nitrotyrosine levels in atrial tissue PUFAs: Polyunsaturated fatty acids. *P<0.05 vs control group; △P<0.05 vs sham group |
随着年龄的增长,心房系统性炎症增加,血浆抗氧化能力逐渐下降,炎症和氧化应激相互作用,患者发生房颤的危险随之增高。氧化应激是指机体内促氧化与抗氧化失衡时,过度氧化导致的细胞损伤。在体内发挥氧化应激损伤的最重要氧化剂是活性氧簇(reactive oxygen species,ROS)及其在级联反应中产生的过氧化亚硝基(ONOO-)。
Mihm等[6]对行迷宫术治疗的慢性房颤患者RAA进行活检,首次发现慢性房颤患者的心房肌存在着确实的氧化应激损伤,这种损伤被羟自由基(HO·)和过氧化亚硝基盐(ONOO-)介导,分别导致蛋白被羧化和产生硝基酪氨酸。此外,氧化应激会导致房颤患者发生一些结构和功能蛋白的改变,影响心房肌的能量代谢、电生理学特征和机械力学性能,从而影响心房重塑。Carnes等[7]利用快速心房起搏犬动物模型,发现快速起搏组心房组织中的维生素C(VitC)含量降低,而氧化应激导致的硝化蛋白含量增加以及伴随的AERP缩短,使犬动物模型出现心房电重构,给予具有抗氧化和催化ONOO-分解作用的VitC可减轻AERP的缩短,抑制心房早期的电重构。随后他们研究了VitC对冠状动脉旁路移植术(CABG)术后房颤的影响,43例患者给予VitC首剂负荷量2 g/d,随后每天500 mg直至术后第5天,结果显示接受VitC治疗的患者术后房颤发生率为16.3%,而对照组为34.9%。该研究结果进一步被Korantzopoulos等[8]所证实。他们将44例持续性房颤患者于心脏电复律后随机分为口服VitC组和对照组,随访7 d,口服VitC组的房颤复发率为4.5%,对照组为36.3%。
此外,由于心肌兴奋-收缩偶联过程中的关键性元件都对氧化应激比较敏感,有理由相信氧化应激在钙超载诱发的心房重构中发挥核心作用[9]。Kim等[10]对26例行迷宫术的永久性房颤患者RAA进行转录水平的研究,通过基因芯片对已知的1 152个基因进行分析,结果发现5个与活性氧(ROS)产生相关的基因表达上调和2个具有抗氧化作用的基因表达下调,提示促氧化和抗氧化基因的表达失衡可导致氧化应激的发生和ROS的增加,从而促进房颤的发生。
n-3 PUFAs分子中含有很多双键,因此其对氧化反应很敏感,具有一定的抗氧化能力。有研究发现,给予3.1~8.4 g/d EPA+DHA能够减少人类中性粒细胞30%~55%的ROS产生[11, 12],给予6 g/d EPA+DHA可以显著降低人类单核细胞过氧化氢产生[13]。Richard等[14]发现,在主动脉内皮细胞培养液中加入n-3 PUFAs能显著降低ROS产生,推测n-3 PUFAs具有独立的清除自由基的作用。还有一些研究发现n-3 PUFAs能够显著降低手术后房颤的发生。Calò等[15]将160例行CABG术患者随机分为2组,PUFAs组[n=71,女性11例,(66.2±8.0)岁)]和对照组[n=81,女性13例,(64.9±9.1)岁],PUFAs组在术前5 d给予PUFAs 2 g/d,结果显示:PUFAs组术后房颤率为15.2%,对照组为33.3%,与对照组相比PUFAs组术后房颤发生率下降了54.4%(P=0.013)。Mariscalco等[16]和Castillo等[17]在最近的实验中也证实了这一发现。
术后氧化应激会促进房颤的发作、维持,而n-3 PUFAs具有抗氧化应激特性,但是否可通过n-3 PUFAs的抗氧化应激特性来影响房颤发生,目前国内外尚无相关报道。我们的研究发现,给予犬n-3 PUFAs喂食4周,犬血液中n-3 PUFAs的相对浓度明显增加;术后第2天PUFAs组AERPs缩短程度较对照组减轻,CT也较对照组缩短;PUFAs组房颤可诱导性和维持性均较对照组降低。根据Moe等[18]的多重子波学说,PUFAs组心房波长较长,子波数量少,不利于房颤的发生和维持。
一氧化氮(nitric oxide,NO)和超氧阴离子(O-2·)反应产生ONOO-,其氧化作用于细胞磷脂、蛋白、DNA,导致细胞坏死或凋亡。ONOO-的一个独特的作用是使蛋白结合或游离的酪氨酸残基硝基化,从而形成3-硝基酪氨酸。因此3-硝基酪氨酸可作为一个稳定的体内ONOO-生物指示剂。通过测量3-硝基酪氨酸,可以了解活体内氧化应激水平。实验中我们发现心房组织3-硝基酪氨酸含量在对照组增加,反映出无菌性心包炎后心房组织内氧化应激水平较术前升高,而PUFAs组3-硝基酪氨酸含量增加不明显。提示n-3 PUFAs能够对抗无菌性心包炎导致的ONOO-升高,发挥其抗氧化应激作用。结合PUFAs组房颤可诱导性和维持性实验结果,我们推测n-3 PUFAs抗氧化应激作用可能也是其抗房颤效应的机制之一。
尽管我们发现n-3 PUFAs能够降低心房组织中氧化应激水平,但未对其具体机制进行探讨。既往研究表明,n-3 PUFAs抑制氧化应激水平的可能机制如下:(1)抑制脂蛋白的氧化,通过抑制低密度脂蛋白(LDL)被氧化成为ROS之一的氧化性LDL(ox-LDL),减少ROS产生。(2)抑制NF-κB激活减轻体内氧化应激损伤。ROS诱导的还原反应可以使胞质内NF-κB的抑制性亚单位IκB磷酸化,进而激活NF-κB。NF-κB结合于基因启动子区域,对控制细胞因子、趋化因子、生长因子、黏附因子及急性期反应蛋白的基因表达是必需的。n-3 PUFAs可以通过信号途径或直接作用于调控基因表达过程的核转录因子NF-κB。EPA和DHA作为n-3 PUFAs的主要成分,能对抗NF-κB抑制性亚单位IκB的磷酸化,进而抑制脂多糖(LPS)诱导的NF-κB活化和COX-2的表达[19]。(3)通过信号途径或直接作用于过氧化物酶体增殖活化受体(peroxisome proliferator activated receptors,PPAR)减少体内炎症反应和由炎症反应诱导的氧化应激。PPARs作为核因子受体对炎症相关基因表达调控起关键作用。PPARs不仅存在于肝脏和脂肪组织,还存在于炎性细胞,能作用于许多细胞反应,如细胞循环、增殖、炎症、凋亡。PPARs大多通过配体依赖的方式调节基因表达,PPARα能被PUFAs激活,AA来源的LTB4也可作为其配体,PPARγ能选择性地被PUFAs激活,调节脂质代谢及各种类型的细胞反应,从而发挥抗炎抗氧化应激作用[20, 21]。(4)抑制NAD(P)H活性,进而影响ROS生产。DHA能够抑制IL-1α诱导的ROS产生,其机制在于DHA的15-LOX-1产物能够抑制内皮细胞p47phox的膜转位,抑制NAD(P)H活性,进而影响ROS生产,并且这种作用独立于ERK1/2抑制机制[22]。
综上所述,在本实验中我们首次发现n-3 PUFAs 能够减轻心房组织中氧化应激反应。结合PUFAs组房颤可诱导性和维持性实验结果,可推测PUFAs通过抗氧化作用发挥其抗房颤效应。本研究为PUFAs在心脏手术后房颤并发症的预防和治疗中的意义和价值提供了有力的证据。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | 盛 力,李 悦,李为民.氧化应激与心房颤动时的心房结构重构[J].中国心脏起搏与心电生理杂志,2007,21:459-461. |
| [2] | Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico.[J]. Lancet,1999,354: 447-455. |
| [3] | Schrepf R,Limmert T,Claus Weber P,Theisen K, Sellmayer A. Immediate effects of n-3 fatty acid infusion on the induction of sustained ventricular tachycardia[J]. Lancet,2004,363: 1441-1442. |
| [4] | Mozaffarian D,Lemaitre R N,Kuller L H,Burke G L,Tracy R P,Siscovick D S; Cardiovascular Health Study.Cardiac benefits of fish consumption may depend on the type of fish meal consumed: the Cardiovascular Health Study[J]. Circulation,2003,107:1372-1377. |
| [5] | Pagé P L,Plumb V J,Okumura K,Waldo A L.A new animal model of atrial flutter[J]. J Am Coll Cardiol,1986,8:872-879. |
| [6] | Mihm M J,Yu F,Carnes C A,Reiser P J,McCarthy P M,van Wagoner D R,et al. Impaired myofibrillar energetics and oxidative injury during human atrial fibrillation[J]. Circulation,2001,104: 174-180. |
| [7] | Carnes C A,Chung M K,Nakayama T,Nakayama H,Baliga R S,Piao S,et al. Ascorbate attenuates atrial pacing-induced peroxynitrite formation and electrical remodeling and decreases the incidence of postoperative atrial fibrillation[J]. Circ Res,2001,89:E32-E38. |
| [8] | Korantzopoulos P,Kolettis T M,Kountouris E, Dimitroula V,Karanikis P,Pappa E,et al. Oral vitamin C administration reduces early recurrence rates after electrical cardioversion of persistent atrial fibrillation and attenuates associated inflammation[J]. Int J Cardiol,2005,102:321-326. |
| [9] | Dhalla N S,Temsah R M,Netticadan D. Role of oxidative stress in cardiovascular diseases[J]. J Hypertens,2000,18:655-673. |
| [10] | Kim Y H,Lim D S,Lee J H,Shim W J,Ro Y M,Park G H,et al. Gene expression profiling of oxidative stress on atrial fibrillation in humans[J]. Exp Mol Med,2003,35:336-349. |
| [11] | Varming K,Schmidt E B,Svaneborg N,Møller J M, Lervang H H,Grunnet N et al. The effect of n-3 fatty acids on neutrophil chemiluminescence[J]. Scand J Clin Lab Invest,1995,55:47-52. |
| [12] | Thompson P J,Misso N L,Passarelli M,Phillips M J.The effect of eicosapentaenoic acid consumption on human neutrophil chemiluminescence[J]. Lipids,1991,26:1223-1226. |
| [13] | Fisher M,Levine P H,Weiner B H,Johnson M H,Doyle E M,Ellis P A,et al. Dietary n-3 fatty acid supplementation reduces superoxide production and chemiluminescence in a monocyte-enriched preparation of leukocytes[J]. Am J Clin Nutr,1990,51: 804-808. |
| [14] | Richard D,Kefi K,Barbe U,Bausero P,Visioli F.Polyunsaturated fatty acids as antioxidants[J]. Pharmacol Res,2008,57: 451-455. |
| [15] | Calò L,Bianconi L,Colivicchi F,Lamberti F,Loricchio M L,de Ruvo E,et al.N-3 Fatty acids for the prevention of atrial fibrillation after coronary artery bypass surgery: a randomized,controlled trial[J]. J Am Coll Cardiol,2005,45:1723-1728. |
| [16] | Mariscalco G,Sarzi Braga S,Banach M,Borsani P, Bruno V D,Napoleone M,et al. Preoperative n-3 polyunsatured fatty acids are associated with a decrease in the incidence of early atrial fibrillation following cardiac surgery[J]. Angiology,2010,61: 643-650. |
| [17] | Castillo R,Rodrigo R,Perez F,Cereceda M,Asenjo R,Zamorano J,et al. Antioxidant therapy reduces oxidative and inflammatory tissue damage in patients subjected to cardiac surgery with extracorporeal circulation[J]. Basic Clin Pharmacol Toxicol,2011,108:256-262. |
| [18] | Moe G K,Rheinboldt W C,Abildskov J A. A computer model of atrial fibrillation[J]. Am Heart J,1964,67:200-220. |
| [19] | Lee J Y,Plakidas A,Lee W H,Heikkinen A,Chanmugam P,Bray G,et al. Differential modulation of Toll-like receptors by fatty acids: preferential inhibition by n-3 polyunsaturated fatty acids[J]. J Lipid Res,2003,44:479-486. |
| [20] | Khan S A,Vanden Heuvel J P. Role of nuclear receptors in the regulation of gene expression by dietary fatty acids (review) [J]. J Nutr Biochem,2003,14:554-567. |
| [21] | Jump D B.The biochemistry of n-3 polyunsaturated fatty acids[J]. J Biol Chem,2002,277:8755-8758. |
| [22] | Massaro M,Habib A,Lubrano L,Del Turco S,Lazzerini G,Bourcier T,et al.The omega-3 fatty acid docosahexaenoate attenuates endothelial cyclooxygenase-2 induction through both NADP(H) oxidase and PKC epsilon inhibition[J].Proc Natl Acad Sci ,2006,103:15184-15189. |
 2014, Vol. 35
2014, Vol. 35


