2. 徐州医学院附属医院内分泌科, 徐州 221002
2. Department of Endocrinology, The Affiliated Hospital of Xuzhou Medical College, Xuzhou 221002, Jiangsu, China
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的也是最为严重的微血管并发症,已成为世界性致盲的常见原因之一。高血糖、高血脂、氧化应激和炎性细胞因子的产生直接影响着DR的发生和发展[1, 2, 3]。番茄红素是类胡萝卜素的一种,具有抗氧化、清除氧自由基的功能,还能降低血糖,减轻和缓解糖尿病并发症[4, 5]。研究显示,提高糖尿病患者血清番茄红素的浓度可以抑制氧化应激反应,抑制DR的发生发展[6, 7],但其相关的机制尚未完全阐明。本实验通过研究番茄红素对大鼠DR模型的保护作用,初步探讨番茄红素保护DR的相关机制以及其在DR防治中的作用价值。
1 材料和方法 1.1 实验动物和试剂清洁级雄性SD大鼠,体质量160~180 g,8周龄,由徐州医学院实验动物中心[许可证号:SYXK(苏)2010-0011]提供;链脲佐菌素(STZ)购自Sigma公司;番茄红素购自郑州荔诺生物制剂公司;血糖仪(稳豪倍优)和血糖试纸购自强生生物制药有限公司;RIA试剂盒,免疫组化试剂盒和血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体购自中山金桥生物技术有限公司。
1.2 糖尿病视网膜病变大鼠模型制备、分组和标本采集 1.2.1 造模将40只大鼠腹腔一次性注射2% STZ 56 mg/kg(枸橼酸钠缓冲液配制,pH 4.5),72 h后尾静脉采血,血糖仪测定随机血糖>16.7 mmol/L为建造糖尿病模型成功,造模成功32只,成模率80%。12周后查糖尿病模型大鼠眼底,有明显出血、水肿及渗出者20只,成模率67%。
1.2.2 实验分组将糖尿视网膜病造模成功的20只大鼠随机分为糖尿病视网膜病变组(DR组)和番茄红素组(LP组),每组10只;另设10只正常大鼠为对照组(NC组)。LP组于糖尿病视网膜病变造模成功后每日给予番茄红素灌胃60 mg/kg,DR组和NC组每日给予等量生理盐水灌胃,均干预8周。实验过程中不给予胰岛素和其他降血糖药物,DR组和LP组大鼠分别死亡2只,NC组大鼠无死亡。
1.2.3 标本采集DR造模成功并治疗8周后,大鼠禁食12 h,10%水合氯醛麻醉后,心脏采血置于抗凝管中,4℃离心分离血浆后置于-20℃冰箱保存,待测内皮素(endothelin,ET)和降钙素基因相关蛋白(calcitonin gene related protein,CGRP);取大鼠左侧眼球于多聚甲醛中固定,行石蜡包埋,待免疫组化检测;右侧眼球分离视网膜于EP管中置于-80℃冰箱中保存,待测VEGF。
1.3 放射免疫测定法检测血浆ET和CGRP的水平按照试剂盒说明书操作,测定仪器为上海同济大学免疫研究所日环仪器厂SN-695B型智能放射免疫γ检测仪。
1.4 免疫组化法检测大鼠视网膜VEGF蛋白表达糖尿病大鼠视网膜组织的VEGF蛋白检测采用SP法,石蜡切片厚度4 μm,石蜡切片脱蜡至水。微波炉中(大火2 min,小火10 min)热抗原修复;3%过氧化氢37℃孵育5~10 min,以消除内源性过氧化物酶活性;PBS冲洗2 min×3次,按照VEGF免疫组化染色试剂盒的说明进行操作。
1.5 蛋白质印迹法测定大鼠视网膜VEGF蛋白表达将视网膜组织中加入裂解液,匀浆后,800×g、4 ℃离心15 min,取上清,15 000×g、4℃离心15 min,所得上清即为胞质蛋白提取液。胞质蛋白用4×蛋白处理液配制成等浓度的蛋白样品。 取等量蛋白样品行10% SDS-PAGE分离后,以湿转移法转至NC膜上,脱脂牛奶室温封闭2 h,加入抗体孵育后洗膜,显色后条带扫描、分析及打印。蛋白激活水平以免疫印迹中条带的灰度值与内参的比值来表示。
1.6 统计学处理应用SPSS13.0统计软件进行数据分析,数据以 x ±s 表示,两组间均数比较采用t检验,多组间均数比较采用完全随机设计的方差分析(ANOVA),检验水准(α)为0.05。
2 结 果 2.1 大鼠血浆ET和CGRP的含量由表 1可见,与NC组比较,DR组大鼠血浆ET含量升高,CGRP含量降低,差异均有统计学意义(P<0.05);与DR组比较,LP组大鼠血浆ET含量降低,CGRP含量增加,差异有统计学意义(P<0.05)。
|
|
表 1 各组大鼠血浆ET和CGRP的含量 |
由图 1可见,DR组大鼠视网膜细胞质中VEGF的表达高于NC组和LP组。

|
图 1 各组大鼠视网膜细胞中VEGF的表达(SP法) VEGF: 血管内皮生长因子. A: 正常对照(NC)组; B:糖尿病视网膜病变(DR)组; C:番茄红素(LP)组. Original magnification: ×400 |
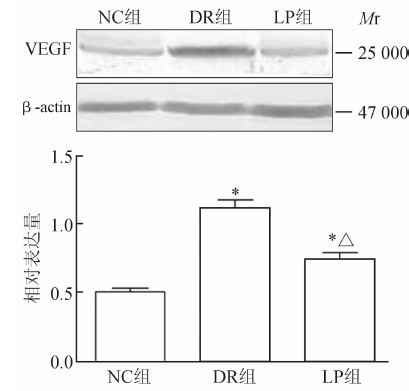
与NC组比较,DR组及LP组大鼠视网膜中VEGF蛋白表达量均升高(P<0.05);但LP组大鼠视网膜中VEGF蛋白的表达量低于DR组(P<0.05),见图 2。
|
图 2 各组大鼠视网膜VEGF蛋白的表达 NC: 正常对照; DR: 糖尿病视网膜病变; LP: 番茄红素; VEGF: 血管内皮生长因子. *P<0.05与NC组比较; △P<0.05与DR组比较. n=4,x ±s |
糖尿病视网膜病的发病机制迄今尚不完全明了,其基本病理过程表现为微循环障碍,病理特征为视网膜新生血管形成和血-视网膜屏障(blood-retinal barrier,BRB)破坏。糖尿病时由于血管及血液因素导致毛细血管闭塞,从而引起毛细血管扩张,微动脉瘤形成,最终导致视网膜缺血缺氧、生长因子释放增加,致使视网膜形成新生血管和纤维化。具有代表性的细胞因子有ET和VEGF,ET是迄今所知血管内皮细胞分泌的体内最强的缩血管物质,生理量的ET通过内皮细胞-周期细胞间相互作用调节视网膜血管的管径和局部血流量。糖尿病患者血管内皮损伤,引起血浆ET过量释放并强烈刺激视网膜周细胞收缩,导致视网膜局部循环调节功能紊乱,从而促进和加剧糖尿病视网膜病变的发生发展[8]。VEGF是目前所知最强的内皮细胞选择性促有丝分裂因子和血管生成因子,能特异性地刺激视网膜血管内皮细胞增殖,增加血管的通透性,促进新生血管的形成,一旦新生血管形成,则标志着视网膜发生增殖性病变[9]。有研究证明,在糖尿病视网膜病变早期,VEGF即发挥作用,促进和加重糖尿病视网膜病变的发生发展[10]。CGRP是体内已知的作用最强、持续时间最长的舒血管肽,与ET的缩血管作用相互拮抗。CGRP/ET分泌失衡在血管内皮细胞损伤的病理过程中起着重要的作用[11],若糖尿病病情长期控制不良,血管内皮细胞损伤加重、增殖减弱,从而引起ET和VEGF的大量释放[7]。由于CGRP的减少致血管收缩、微循环障碍加重、毛细血管通透性增加,导致视网膜微血管出血、渗出性改变,血管内皮细胞增殖、新生血管形成等,最终加重糖尿病视网膜病变。
番茄红素广泛存在于水果及蔬菜中,具有抗氧化、降血糖、抑制突变、减少心血管疾病及抗癌等生物学作用[6, 7, 12, 13]。人体内不能合成番茄红素,只能依靠食物补充。临床研究结果显示,提高糖尿病患者血清番茄红素水平,可以减轻糖尿病患者视网膜病变,降低糖化血红蛋白的值,患者血清番茄红素水平的降低与DR的诊断、严重程度和治疗密切相关[6]。本研究旨从细胞因子层面揭示番茄红素治疗糖尿病视网膜病变与细胞因子ET、VEGF和CGRP之间的联系。本研究结果显示,与DR组比较,LP组大鼠血浆ET和视网膜中VEGF的含量均降低(P<0.05),而血浆CGRP含量增加(P<0.05)。这一结果提示,番茄红素减轻大鼠糖尿病视网膜病是通过降低血浆中ET含量、提高血浆中CGRP含量和降低视网膜细胞因子VEGF的表达,抑制视网膜细胞异常增殖,阻止新生血管的生成,从而抑制视网膜增厚而实现的。本研究仅限于对实验动物现象的观察,有关番茄红素保护糖尿病视网膜病变的具体作用机制还需要更多临床研究予以揭示。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Matthews D R,Stratton I M,Aldington S J,Holman R R,Kohner E M;UK Prospective Diabetes Study Group.Risks of progression of retinopathy and vision loss related to tight blood pressure control in type 2 diabetes mellitus: UKPDS 69[J].Arch Ophthalmol,2004,122:1631-1640. |
| [2] | Noda K,Nokao S,Zandi S,Hares K C,Hafezi-Moqhadam A.Retinopathy in a novel model of metabolic syndrome and type 2 diabetes:new insight on the inflammatory paradigm[J].FASEB J,2014,28:2038-2046. |
| [3] | Tawfik A,Sanders T,Kahook K,Akeel S,Elmarakby A,Al-Shabrawey M.Suppression of retinal peroxisome proliferator-activated receptor gamma in experimental diabetes and oxygen-induced retinopathy:role of NADPH oxidase[J].Invest Ophthalmol Vis Sci,2009,50:878-884. |
| [4] | Bayramoglu A,Bayramoglu G,Senturk H.Lycopene partially reverses symptoms of diabetes in rats with streptozotocin-induced diabetes[J].J Med Food,2013,16:128-132. |
| [5] | Ali M M,Agha F G.Amelioration of streptozotocin-induced diabetes mellitus,oxidative stress and dyslipidemia in rats by tomato extract lycopene[J].Scand J Clin Lab Invest,2009,69:371-379. |
| [6] | Brazionis L,Rowley K,Itsiopoulos C,O'Dea K.Plasma carotenoids and diabetic retinopathy[J].Br J Nutr,2009,101:270-277. |
| [7] | Valero M A,Vidal A,Burgos R,Calvo F L,Martínez C ,Luengo L M,et al.Meta-analysis on the role of lycopene in type 2 diabetes mellitus [J].Nutr Hosp,2011,26:1236-1241. |
| [8] | Koleva-Georgieva D N,Sivkova N P,Terzieva D.Serum inflammatory cytokines IL-1beta,IL-6,TNF-alpha and VEGF have influence on the development of diabetic retinopathy[J].Folia Med (Plovdiv),2011,53:44-50. |
| [9] | Selim K M,Sahan D,Muhittin T,Osman C,Mustafa O.Increased levels of vascular endothelial growth factor in the aqueous humor of patients with diabetic retinopathy[J].Indian J Ophthalmol,2010,58:375-379. |
| [10] | Funatsu H,Yamashita H,Nakamura S,Mimura T,Eguchi S,Noma H,et al.Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor are related to diabetic macular edema[J].Ophthalmology,2006,113:294-301. |
| [11] | Yang J H,Meng X X,Xie L S,Guo Z.Acute myocardial ischemia up-regulates substance P in the retina of rats[J].Neurosci Lett,2008,443:218-222. |
| [12] | Chen J,O'Donoghue A,Deng Y F,Zhang B,Kent F,O'Hare T.The effect of lycopene on the PI3K/Akt signalling pathway in prostate cancer[J].Anticancer Agents Med Chem,2014,14:800-805. |
| [13] | Aman U,Vaibhav P,Balaraman R.Tomato lycopene attenuates myocardial infarction induced by isoproterenol:electrocardiographic,biochemical and anti-apoptotic study[J].Asian Pac J Trop Biomed,2012,2:345-351. |
 2014, Vol. 35
2014, Vol. 35


