据估计,全球约有15亿人群患有不同程度、不同类型的中枢神经系统疾病,至2020年,全球中枢神经疾病患者可能高达19亿[1]。脑肿瘤、癫疒 间 、神经退行性疾病等日益成为威胁人类健康的极为危险的疾病。然而,由于血脑屏障(blood-brain barrier,BBB)的存在,很大程度限制了药物的脑内递送,阻碍了药物对中枢神经系统疾病的治疗[2]。如何使药物高效透过血脑屏障、实现脑部传递是目前医学领域研究的重点。
Angiopep-2 (24 000)是由19 个氨基酸分子组成的新型多肽,它可通过血脑屏障上表达的低密度脂蛋白受体相关蛋白(LRP)受体介导内吞进入脑组织。研究表明angiopep-2 修饰的纳米递药系统通过LRP介导显著增加脑部的蓄积[3]。转铁蛋白受体在脑内皮细胞表面有大量表达[4],有学者将转铁蛋白连接到纳米粒表面增强了脂质体的脑部靶向性[4, 5]。这些结果表明angiopep-2和转铁蛋白单独修饰的纳米给药系统均能够增强脑部蓄积能力。本研究将angiopep-2和转铁蛋白共同修饰到脂质体的表面,探讨经过angiopep-2和转铁蛋白共同修饰后对脂质体的脑部蓄积的增强效果。
1 材料和方法 1.1 材料及细胞
Zetasizer Nano ZS90型激光粒度仪及Zeta电位分析仪(英国Malvern公司)。Angiopep-2(上海吉尔生物科技公司);转铁蛋白(美国Sigma公司);大豆磷脂(SPC,美国Sigma公司);DSPE-PEG2000(美国Avanti polar lipids公司);FITC-PE(美国Sigma公司);DSPE-PEG2000-MAL (美国Avanti Polar Lipids公司);其余试剂为分析纯。鼠脑内皮细胞(bEnd.3细胞)购自ATCC。
1.2 方法 1.2.1 Angiopep-2修饰脂质体(ANG-LPs)的制备参照文献[6]方法合成ANG-PEG2000-DSPE。精密称取大豆磷脂15.20 mg,胆固醇1.26 mg,白藜芦醇3.85 mg,DSPE-PEG2000 1.45 mg,将以上材料和药物溶于氯仿中,在茄形瓶中减压蒸馏成膜,除去有机溶剂,置于真空干燥器中过夜,使其充分干燥,加入2 mL磷酸盐缓冲液(PBS)水化得到angiopep-2修饰白藜芦醇脂质体。
1.2.2 转铁蛋白修饰脂质体(TF-LPs)及Angiopep-2和转铁蛋白共同修饰脂质体(ANG/TF-LPs)的制备采用后插入法[5]制备ANG/TF-LPs。首先将转铁蛋白巯基化,再与商品化的DSPE-PEG2000-MAL孵育得到转铁蛋白胶束,将胶束后插入普通脂质体或已经制备的ANG-LPs得到TF-LPs和ANG/TF-LPs。用FITC标记的磷脂取代适量的大豆磷脂,制备得到FITC标记的脂质体。
1.2.3 脂质体的粒径、Zeta电位、包封率和血清稳定性测定取脂质体适量用Zetasizer Nano ZS90型激光粒度仪测定其粒径以及Zeta电位。取制备得到的白藜芦醇脂质体 0.1 mL,过G50葡萄糖凝胶柱,PBS (pH 7.4)洗脱,将脂质体用甲醇破乳,用十八烷基键合硅胶柱在306 nm、乙腈∶0.02%磷酸水溶液(27∶73体积比)为流动相,检测白藜芦醇的含量。按照W包/W投×100%计算包封率(EE),W包:脂质体中包载的药物量,W投:制备脂质体的投药量。
取各组脂质体500 μL,分别与等体积的PBS、含有50%胎牛血清(fetal bovine serum,FBS)的PBS混合,于37℃下孵育1、4、8、24 h,分别测定其在750 nm的透光率。以脂质体在PBS中的透光率值为空白,以脂质体在含有50%FBS的PBS中的透光率与其在PBS中的透光率的比值来评价纳米粒在血清中的稳定性。
1.2.4 体外细胞摄取实验将对数生长期的bEnd.3细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后,每孔加入适量不同脂质体使孔中脂质体浓度为0.2 mg/mL,37℃孵育2 h和4 h后除去含脂质体培养液,冷PBS清洗2次,0.25%胰酶消化后离心,PBS清洗3次,流式细胞仪测定细胞荧光值。为了定性观察细胞对脂质体的摄取情况,将脂质体与细胞共同孵育4 h后,将细胞用PBS漂洗3次,加入2 μg/mL DAPI溶液,室温孵育15 min,加冰PBS漂洗3次,加4%多聚甲醛固定15 min,弃去多聚甲醛,用冰PBS保存。置激光共聚焦显微镜下观察细胞摄取情况。
为了模拟内源性的转铁蛋白对ANG/TF-LPs的入胞能力的影响,本研究在细胞摄取实验中加入游离转铁蛋白,研究其对ANG/TF-LPs的竞争性抑制作用。在加入各脂质体前30 min预先加入游离的转铁蛋白(4 mg/mL),于37℃下共同孵育30 min。30 min后弃去旧培养液,加入新鲜培养液,再分别对应加入ANG/TF-LPs、TF-LPs、ANG-LPs 3种脂质体,用不含FBS的基础培养液调整各脂质体的脂质浓度,使其脂质体终浓度为0.2 mg/mL。于37℃孵育4 h除去含脂质体培养液,冷PBS清洗2次,0.25%胰酶消化后离心,PBS清洗3次,流式细胞仪测定细胞荧光值。
1.2.5 脂质体的跨膜转运实验将bEnd.3细胞以2×105 个/cm2接种于Transwell聚碳酸酯膜上,培养3周后,用WPI细胞跨膜电阻仪测定跨膜电阻值(TEER),当TEER 值大于250 Ω·cm2时,可用作跨膜转运实验。跨膜转运实验时,上腔A面加入脂质体溶液,下腔B面均为PBS。定时(0.5、1、2、3、4、5、6 h)取出下腔B面溶液,用荧光分光光度法测定其荧光值。 1.3 统计学处理
应用SPSS 21.0统计软件进行数据分析,计量数据以 ±s 表示,两组间比较采用t检验,多组间比较用方差分析。检验水准(α)为0.05。
2 结 果 2.1 脂质体的表征取适量脂质体用激光粒度仪测定粒径以及Zeta电位,结果如表 1所示,ANG/TF-LPs的粒径为(93.2±13.5) nm,Zeta电位为(7.55±1.85) mV。白藜芦醇的包封率为92.6%。
|
|
表 1 不同脂质体的表征 Tab 1 Characteristics of different liposomes |
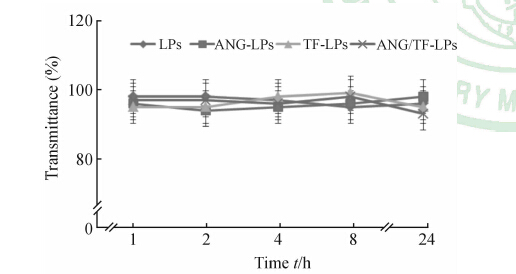
脂质体的血清稳定性测定结果如图 1所示:不同脂质体在50%FBS中的透光率与其在PBS中的透光率的比值均大于90%,表明4种脂质体24 h在FBS中均具有较好的稳定性。
|
图 1 不同脂质体在50%FBS中的透光率变化 Fig 1 Transmittance variation of different liposomes in 50% FBS LPs: Liposomes; ANG-LPs: Angiopep-2 modified liposomes; TF-LPs: Transferrin modified liposomes; ANG/TF-LPs: Angiopep-2 and transferrin co-modified liposomes; FBS: Fetal bovine serum. n=3,x ±s |
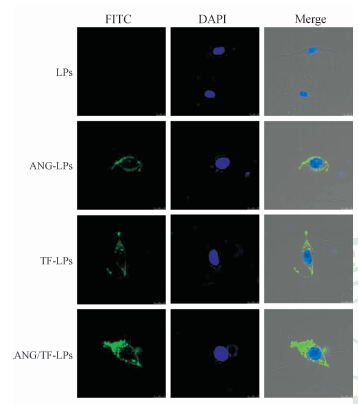
体外细胞定量摄取实验(图 2)表明,ANG/TF-LPs在4 h摄取效率是2 h的1.85倍,差异具有统计学意义(P<0.05),说明bEnd.3细胞对脂质体的摄取是一个时间依赖的过程。在4 h,bEnd.3细胞对ANG/TF-LPs的摄取效率分别是TF-LPs、ANG-LPs和LPs的2.4倍、2.9倍和4.8倍,差异具有统计学意义(P<0.01)。定性的激光共聚焦显微镜观察结果如图 3所示,脂质体与bEnd.3细胞共同孵育4 h后,ANG/TF-LPs组荧光强度显著强于其他3组,与定量的实验结果一致。

|
图 2 bEnd.3细胞对不同脂质体的摄取效率 Fig 2 Uptake of different liposomes by bEnd.3 cells Ps: Liposomes; ANG-LPs: Angiopep-2 modified liposomes; TF-LPs: Transferrin modified liposomes; ANG/TF-LPs:Angiopep-2 and transferrin co-modified liposomes. *P<0.05 vs ANG/TF-LPs at 2 h; △△P<0.01 vs other three groups at the same time. n=3,x±s |
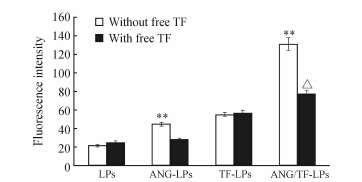
加入游离转铁蛋白后,bEnd.3细胞对TF-LPs和ANG/TF-LPs的摄取受到抑制,差异具体统计学意义(P<0.01);对LPs和ANG-LPs的摄取未发生显著变化(P>0.05)。ANG/TF-LPs组加入游离转铁蛋白后,bEnd.3细胞对ANG/TF-LPs的摄取效率高于TF-LPs加入游离转铁蛋白,差异具有统计学意义(P<0.05)。详见图 4。这说明angiopep-2的修饰对内源性转铁蛋白的干扰有保护作用。
|
图 3 激光共聚焦显微镜观察bEnd.3细胞对FITC标记脂质体的摄取 Fig 3 Uptake of FITC labelled liposomes by bEnd.3 cells under confocal laser scanning microscopy LPs:Liposomes; ANG-LPs: Angiopep-2 modified liposomes; TF-LPs: Transferrin modified liposomes; ANG/TF-LPs: Angiopep-2 and transferrin co-modified liposomes. Original magnification: ×1 000 |
|
图 4 游离转铁蛋白对不同脂质体被bEnd.3细胞摄取的影响 Fig 4 Influence of free TF on uptake of different liposomes by bEnd.3 cells LPs:Liposomes; ANG-LPs: Angiopep-2 modified liposomes; TF-LPs: Transferrin modified liposomes; ANG/TF-LPs: Angiopep-2 and transferrin co-modified liposomes; TF:Transferrin. **P<0.01 vs the same liposomes with free TF; △P<0.05 vs TF-LPs with free TF. n=3,x±s |
通过检测不同时间段下腔B面均为PBS的荧光强度,可以观察到脂质体的跨膜量随着时间的增加而增大,6 h后,ANG/TF-LPs的跨血脑屏障效率分别是TF-LPs、ANG-LPs和LPs的2.9倍、3.1倍和5.4倍,差异具有统计学意义(P<0.01,图 5)。说明angiopep-2和转铁蛋白共修饰后能增强脂质体跨血脑屏障能力。

|
图 5 Fig 5 Fluorescence intensity of FITC labeled liposomes crossing blood-brain barrier LPs:Liposomes; ANG-LPs: Angiopep-2 modified liposomes; TF-LPs: Transferrin modified liposomes; ANG/TF-LPs: Angiopep-2 and transferrin co-modified liposomes. **P<0.01 vs other three groups at 6 h; △P<0.05 vs LPs at 6 h; n=3, x |
血脑屏障是由脑毛细血管内皮细胞组成的一个多样复杂的动态系统。其中,毛细血管内皮细胞及其紧密连接是血脑屏障的主要形态学基础。血脑屏障维护中枢神经组织内环境的稳定,同时也限制了药物进入中枢神经系统[7, 8]。为了使药物高效地透过血脑屏障,目前常用的手段包括脑内植入、脑室注射、鞘内注射等介入性脑内递药技术,采用高渗溶液、血管活性物质等干扰血脑屏障[9],使血脑屏障暂时性打开或经嗅黏膜、内耳等途径实现脑部给药,然而这些手段可能使血脑屏障受到不可逆的破坏以及存在给药量有限、对黏膜有损伤等问题。本研究将血脑屏障上高度表达的低密度脂蛋白受体和转铁蛋白受体结合物——angiopep-2和转铁蛋白共同修饰到脂质体的表面,实现了脂质体对脑内皮细胞的高效亲和力以及脂质体的高效跨膜能力。
本研究结果显示,脑内皮细胞对angiopep-2和转铁蛋白共修饰脂质体的摄取效率远高于转铁蛋白脂质体或angiopep-2修饰脂质体。这是由于在血脑屏障虽然具有转铁蛋白受体和低密度脂蛋白受体的高度表达,然而受体依赖的纳米载体转运过程会受到“受体饱和效应”以及体内相关物质的竞争,因此单独的angiopep-2修饰脂质体或转铁蛋白修饰脂质体被脑内皮细胞摄取和跨血脑屏障的能力有限。本研究将angiopep-2和转铁蛋白共同修饰到脂质体的表面,使得angiopep-2和转铁蛋白能够起到协同作用,促进脂质体被脑内皮细胞摄取。脑内皮bEnd.3细胞是形成血脑屏障能力的主要功能性细胞,因此本研究首先选取bEnd.3细胞进行体外摄取实验。定量和定性的细胞摄取实验结果证实,经过转铁蛋白和angiopep-2共同修饰后,bEnd.3细胞对脂质体的摄取能力显著增强。但是由于细胞摄取实验中的bEnd.3细胞为贴壁生长,仅一侧与溶液发生物质交换,因此其结果反映为细胞对脂质体的摄取能力。为了考察脂质体被bEnd.3细胞摄取后进一步入脑的能力,本研究引入了体外培养的血脑屏障模型,该模型可以模拟血脑屏障的生理特征,包括紧密连接、转运蛋白等,同时可以观察脂质体的胞吞转运的作用[10]。结果表明,转铁蛋白和angiopep-2共修饰脂质体的跨膜能力最强。纳米载体类药物的体内稳定性对其靶向性和药效具有直接的影响,本研究通过血清稳定性模拟脂质体在体内的稳定性,结果显示制备的脂质体在50%FBS中都具有很好的稳定性,可以推测本研究制备的脂质体在体内也会具有较好的稳定性。
综上所述,本研究构建了angiopep-2和转铁蛋白共修饰的脂质体,考察了脂质体的粒径以及Zeta电位,通过体外细胞摄取实验和血脑屏障跨膜实验证实了所构建的共修饰脂质体具有良好的跨血脑屏障能力,是一种潜在的脑靶向给药系统。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Brasnjevic I,Steinbusch H W,Schmitz C,Martinez- Martinez P;European NanoBioPharmaceutics Research Initiative.Delivery of peptide and protein drugs over the blood-brain barrier[J].Prog Neurobiol,2009,87:212-251. |
| [2] | Takasato Y,Rapoport S I,Smith Q R.An in situ brain perfusion technique to study cerebrovascular transport in the rat[J].Am J Physiol,1984,247(3 Pt 2):H484-H493. |
| [3] | Huile G,Shuaiqi P,Zhi Y,Shijie C,Chen C,Xinguo J,et al.A cascade targeting strategy for brain neuroglial cells employing nanoparticles modified with angiopep-2 peptide and EGFP-EGF1 protein[J].Biomaterials,2011,32:8669-8675. |
| [4] | van Rooy I,Mastrobattista E,Storm G,Hennink W E,Schiffelers R M.Comparison of five different targeting ligands to enhance accumulation of liposomes into the brain[J].J Control Release,2011,150:30-36. |
| [5] | Qin Y,Chen H,Yuan W,Kuai R,Zhang Q,Xie F.Liposome formulated with TAT-modified cholesterol for enhancing the brain delivery[J].Int J Pharm,2011,419(1-2):85-95. |
| [6] | Gan C W,Feng S S.Transferrin-conjugated nanoparticles of poly(lactide)-D-alpha-tocopheryl polyethylene glycol succinate diblock copolymer for targeted drug delivery across the blood-brain barrier[J].Biomaterials,2010,31:7748-7757. |
| [7] | Jiang X,Xin H,Gu J,Xu X,Xia W,Chen S,et al.Solid tumor penetration by integrin-mediated pegylatedoly(trimethylene-carbonate) nanoparticles loaded with paclitaxel[J].Biomaterials,2013,34:1739-1746. |
| [8] | Ying X,Wen H,Lu W L,Du J,Guo J,Tian W,et al.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].J Control Release,2010,141:183-192. |
| [9] | 曹 卫,邓医宇,黄林强,祝森志,朱高峰,江稳强,等.高渗盐水对脑缺血再灌注大鼠血脑屏障通透性的影响[J].实用医学杂志,2013,29:1412-1415. |
| [10] | Qin Y,Chen H,Zhang Q,Wang X,Yuan W,Kuai R,et al.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeuticefficacy on brain glioma in animals[J].Int J Pharm,2011,420:304-312. |
 2014, Vol. 35
2014, Vol. 35


