抗原提呈细胞(antigen presenting cells,APCs)是连接抗原和淋巴细胞的桥梁,而树突状细胞(dendritic cells,DCs)作为专职抗原提呈细胞,具有强大的捕获、加工和提呈抗原功能,并能够刺激初始T细胞增殖和T细胞依赖性抗体的形成,在感染、肿瘤、自身免疫及移植等免疫相关性疾病的发生、发展中发挥关键的作用[1]。DCs在介导免疫应答过程中,一方面通过提供黏附辅佐分子、细胞因子启动抗原刺激信号对T细胞的活化,因此阻断这些分子可以抑制细胞的活化;另一方面,DCs也可通过抑制性的分子或受体如细胞毒T淋巴细胞相关抗原4、B7-H1(PD-L1)、B7-H4等负相调控或抑制T细胞免疫反应[2, 3];适当调节或干预这些协同刺激信号,在移植免疫排斥以及自身免疫性疾病的治疗及改善疾病症状方面取得了一定的效果[4]。因此研究DCs在分化成熟过程中相关分子的改变,进而寻找发生排斥反应时在DCs中起主导作用的关键分子,对延长移植物的存活时间、诱导免疫耐受的形成以及防止排斥反应的发生具有重要意义。
MicroRNA(miRNA)是细胞内一类表达丰富、非编码的高度保守的RNA片段,长度一般为18~25 nt,可以通过结合靶基因的mRNA的3′非翻译区(3′-untranslated region,3′UTR)抑制基因的表达。而miRNA对免疫细胞的调控机制研究更是近年来免疫学研究的热点[5, 6, 7, 8],一系列的miRNA参与免疫反应的调控,包括T/B细胞的发育分化、抗体类型的转换、单核/中性粒细胞的增殖、炎症因子的释放被广泛报道。尽管如此,miRNA对DCs功能的调控作用研究较少,仅仅局限于个别“明星”miRNA的作用研究,例如miRNA(miR)-155被鉴定出在DCs成熟中发挥重要作用[9],miR-30b被发现可以通过靶向Notch1 调控DCs分化[10]。我们通过分析本实验室前期DCs成熟前后差异性表达的miRNA的芯片数据,筛选出多个表达下调的miRNA,其中miR-144下调显著,提示miR-144分子在DCs成熟过程中可能是重要的负调控因子(MIAME:E-MEXP-2110)[11]。基于此,本研究旨在进一步探讨miR-144对DCs分泌细胞因子的影响及机制。
1 材料和方法 1.1 材料及仪器清洁级 C57BL/6雄性小鼠购自第二军医大学免疫学研究所[许可证号:SYXK(沪)2010-0101],均为6~8周龄,体质量为15~20 g,按标准饮食、分笼饲养于第二军医大学基础部免疫学教研室动物实验室。FAST200 RNA抽提试剂盒购自上海飞捷生物技术有限公司,一步法反转录试剂盒、SYBR RT-PCR试剂盒、KOD plus酶、T4连接酶、Hind Ⅲ与Kpn Ⅰ内切酶购自日本TaKaRa公司,Luciferase双荧光素酶报告检测试剂盒购自美国Promega公司,NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL) ELISA检测试剂盒购自上海凯博生化试剂有限公司,BCA法蛋白浓度检测试剂盒购自美国Thermo公司,TRIzol试剂购自美国Invitrogen公司,G418与脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司,蛋白质印迹分析所用抗体购自美国Santa Cruz公司,RNA转染试剂INTERFERin-HTS、DNA转染试剂jetPRIME购自Polyplus公司,ABI Step-one实时定量PCR仪购自美国ABI公司,全自动数码凝胶图像分析系统购自上海天能科技有限公司。DC2.4细胞系购自江阴康众康民生物医药技术有限公司,HEK-293细胞系为本室保存株。
1.2 细胞培养、转染与刺激颈椎脱位法处死小鼠,无菌状态下分离股骨和胫骨,冲出骨髓并离心收集。用Tris-NH4Cl破除红细胞,RPMI 1640培养液洗涤3次后离心收集细胞。调整细胞密度为2.5×109/L,置于6 孔板内并加入rmGM-CSF(10 ng/mL)和IL-4(10 ng/mL)。37℃、5% CO2 孵箱中培养48 h吸除培养液及悬浮细胞,保留贴壁细胞;继续培养至第5天换半液,第7天吹打收集细胞,即可获得纯度大于95%的小鼠原代DCs。
RNA的转染使用INTERFERin-HTS,按产品说明书推荐步骤操作。miR-144拟似物与抑制物由上海吉玛制药技术有限公司合成,RANKL的干扰RNA(siRANKL)由上海吉玛制药技术有限公司设计合成。DCs在转染48 h后用LPS刺激使细胞成熟,LPS工作浓度为1 000 ng/mL。
1.3 细胞因子表达检测细胞因子TNF-α、IL-1β、IL-6、IL-23以及分泌蛋白RANKL的RNA表达水平使用实时定量PCR(qRT-PCR)检测,所用引物均来源于哈佛大学PrimerBank数据库(http://pga.mgh.harvard.edu/primerbank/)。用TRIzol法抽提细胞总RNA,Fast200试剂盒抽提总mNRA。qRT-PCR使用SYBR RT-PCR试剂盒并在ABI Step-one实时定量PCR仪上完成。相对定量采用2-ΔΔCt法计算,mRNA的检测用GAPDH作为内参照,miRNA的检测用U6作为内参照。RANKL蛋白表达水平使用ELISA定量。
1.4 蛋白印迹分析检测信号通路活化通过蛋白印迹分析检测NF-κB(p65)与MAPK(ERK、JNK、p38)信号通路活化情况。2×106个DCs分别用LPS(1 000 ng/mL)刺激1、2 h后加入300 μL M-PER蛋白抽提试剂裂解,4℃、5 000×g离心15 min,将上清转移至干净EP管内,按照BCA法蛋白浓度检测试剂盒说明书进行蛋白定量,调整各组样品蛋白浓度达到一致,加入等量上样缓冲液,100℃水浴煮沸5 min,冷却后上样;用12%SDS聚丙烯酰胺凝胶电泳分离蛋白质;用转膜系统将蛋白转移至硝酸纤维素膜上;常温下用含5%脱脂奶粉的TBST封闭2 h;TBST洗脱2次;加入1∶1 000稀释的第一抗体,4℃孵育过夜;TBST洗脱3次;加入辣根过氧化物酶偶联的第二抗体孵育1 h;TBST洗脱3次;将发光检测试剂中的A液和B液等体积混匀,于凝胶成像分析仪上进行检测。
1.5 miRNA靶点预测与3′UTR报告基因分析miR-144的靶基因预测使用在线软件Targetscan 6.2(http://www.targetscan.org)。预测miR-144的所有潜在靶点后,导入KEGG pathway数据库中与TLR4/NF-κB通路涉及的所有基因进行比对,筛选出潜在靶基因。使用PCR扩增RANKL mRNA的3′UTR序列并连接到p-MIR质粒(购自Invitrogen公司),得到RANKL 3′UTR的Firefly荧光素酶报告基因;进一步在1 058~1 065与679~685位点两端设计引物,使用KOD酶一步法扩增出位点删除质粒。 HEK293细胞共转80 ng RANKL 3′UTR荧光素酶报告基因质粒,40 ng pRL-TK-Renilla荧光素酶内参质粒(购自Invitrogen公司),以及miRNA或对照(终浓度为20 nmol/L)。转染24 h后,用双荧光素酶报告基因检测系统检测荧光活性。最终数据为Firefly荧光值与内参Renilla荧光值的比值。
1.6 稳定过表达RANKL的DC2.4细胞系构建在RANKL编码序列(conding sequence,CDS)两端设计引物,引入酶切位点Hind Ⅲ与Kpn Ⅰ,连接至pcDNA3.1质粒上,挑单克隆测序成功后,获得RNAKL的表达质粒。使用DNA转染试剂jetPRIME将表达质粒转染DC2.4细胞系,48 h后使用500 ng/mL的10%FBS RPMI 1640培养液筛选阳性克隆,4周后用克隆环随机挑取20个克隆,接种于96孔板中培养,24 h后ELISA检测培养上清,选取RANKL分泌量最高的细胞株。
1.7 统计学处理采用SPSS 16.0 软件对数据进行统计学分析,结果用 x±s 表示,各组间比较采用One-way ANOVA,多组之间两两比较采 用最小显著差数法 (LSD法)。检验水准(α)为0.05。
2 结 果 2.1 DCs成熟前后miR-144表达的变化通过检测DCs成熟前后miR-144的表达变化,发现miR-144在成熟DCs中发生了下调(成熟前:1.022±0.010,成熟后:0.243±0.002;P<0.01)。
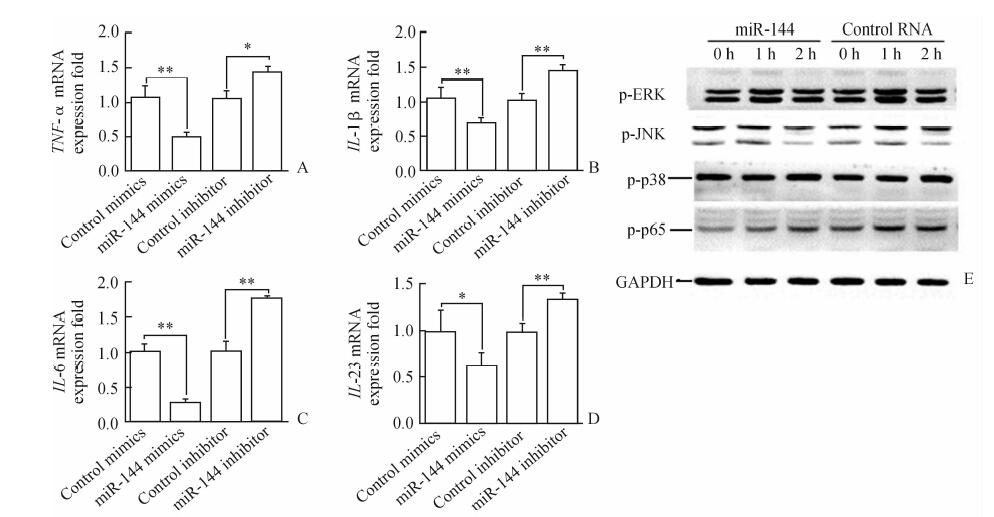
2.2 miR-144对DCs细胞因子产生的影响在小鼠DCs中转染miR-144拟似物及其抑制物后使用LPS刺激,检测细胞因子的mRNA水平,结果显示在转染miR-144拟似物后,TNF-α、IL-1β、IL-6以及IL-23 mRNA均下调(P<0.05,P<0.01),而对应的miR-144抑制物则可以上调这些细胞因子的表达(P<0.05,P<0.01,图 1A~1D)。KEGG pathway数据库显示这些细胞因子的表达都位于转录因子NF-κB或MAPK通路下游,进一步检测 LPS刺激后DCs中ERK、JNK、p38、p65的磷酸化情况,结果显示miR-144高表达后抑制了NF-κB通 路中p65的磷酸化,而对MAPK通路无影响(图 1E)。
|
图 1 miR-144对树突状细胞(DCs)细胞因子产生的影响 Fig 1 Effect of miR-144 on cytokine production in dendritic cells (DCs) A-D: TNF-α,IL-1β,IL-6 and IL-23 mRNA expression levels in DCs after transfection with miR-144 mimics or inhibitor; E: Phosphorylation levels of MAPK and NF-κB in DCs after transfection with miR-144 mimics. *P<0.05,**P<0.01. n=3,x±s |
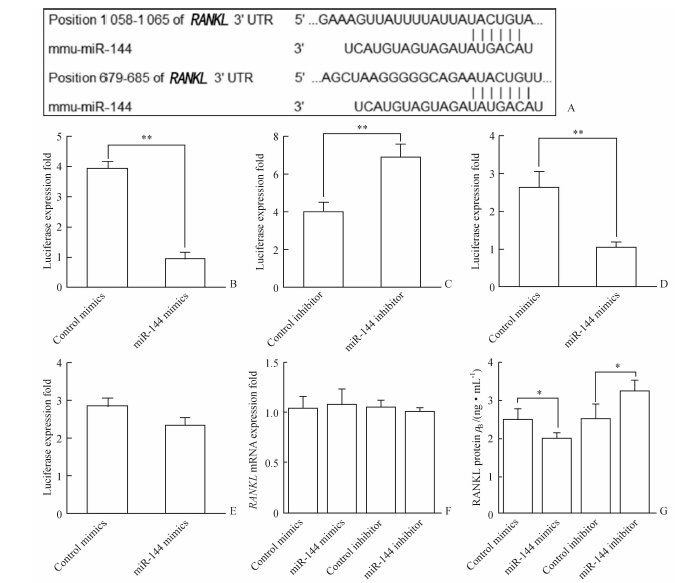
上述结果表明miR-144可能对TLR4/NF-κB途径中的活化因子起到了负调控作用。通过TargetScan预测miR-144靶点,发现miR-144在TLR4/NF-κB途径中只有1个靶向基因RANKL,并且miR-144在RANKL 3′UTR区域有两个潜在作用位点(图 2A)。将RANKL 3′UTR区域克隆至pMIR荧光素报告质粒,之后进行双荧光报告系统检测,结果显示miR-144拟似物可以下调荧光素酶(P<0.01,图 2B),而miR-144抑制物可以上调荧光素酶(P<0.01,图 2C),提示miR-144可以靶向RANKL。为了探究miR-144究竟是作用于RANKL的哪个位点发挥负调控作用,分别删除RANKL 3′UTR-pMIR质粒中的1 058 ~1 065与679 ~ 685位点,发现去除1 058 ~1 065的结合位点后,miR-144对于RANKL 3′UTR仍有作用 (P<0.01,图 2D),而去 除679 ~685的结合位点后,miR-144无法发挥对RANKL的负调控作用(图 2E)。因此,我们认为miR-144通过靶向RANKL 3′UTR区域的679~685结合位点发挥负向调控作用。
|
图 2 miR-144可以靶向RANKL在树突状细胞(DCs)中发挥作用 Fig 2 miR-144 targets RANKL in dendritic cells (DCs) A: RANKL might be the molecular target of miR-144. Shown is a sequence alignment of miR-144 and its target sites in 3′-UTR of RANKL,which was downloaded from TargetScan; B: miR-144 mimics downregulated luciferase activity compared with control group; C: miR-144 inhibitor upregulated luciferase activity compared with control group; D: 1 058-1 065 of RANKL 3′UTR deletion did not cause luciferase activity change compared with in B; E: 679-685 of RANKL 3′UTR deletion caused miR-144 no longer impact RANKL expression; F: miR-144 mimics or inhibitor cannot trigger RANKL degradation; G: miR-144 mimics or inhibitor impacted RANKL protein synthesis. RANKL: Receptor activator of NF-κB ligand. *P<0.05,**P<0.01. n=3,x±s |
miRNA主要通过和靶基因mRNA碱基配对引导沉默复合体(RISC)降解mRNA,或者形成发卡结构阻碍mRNA进入翻译复合体从而阻碍其翻译两条途径发挥作用。为了探究miR-144对RANKL的负向调控作用是何种方式,我们将miR-144拟似物或抑制物及相应阴性对照RNA转染DCs后使用LPS刺激其成熟,qRT-PCR检测细胞中RANKL mRNA水平,同时ELISA检测培养上清中的RANKL蛋白水平。结果显示,miR-144不降解RANKL mRNA(图 2F),而通过抑制RANKL mRNA的翻译来实现负调控作用(P<0.05,图 2G)。
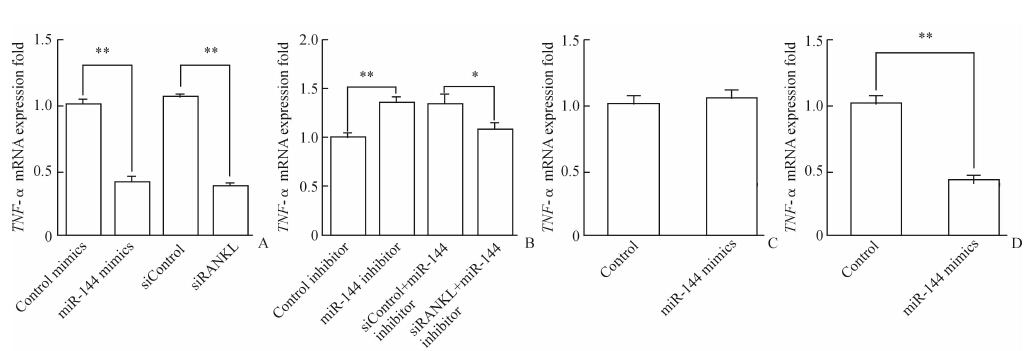
2.4 miR-144靶向RANKL影响 DCs细胞因子分泌为了验证miR-144通过靶向RANKL影响DCs的细胞因子分泌,将miR-144拟似物与siRANKL分别转染小鼠DCs,结果显示siRANKL与miR-144效果类似,可以抑制LPS刺激后TNF-α mRNA的表达量(P<0.01,图 3A)。miR-144抑制物转染DCs后会介导TNF-α mRNA的上调(P<0.01),而siRANKL与miR-144抑制物共转后会阻止这种趋势(P<0.05,图 3B)。在稳定过表达RANKL的DC2.4细胞系中转染miR-144拟似物后用LPS刺激细胞,结果显示TNF-α mRNA的表达量不受影响(图 3C)。与此对照瞬时转染空载体的DC2.4细胞系在转染miR-144拟似物后,TNF-α mRNA表达下调(P<0.01,图 3D)。
|
图 3 miR-144通过靶向RANKL影响 DCs细胞因子分泌 Fig 3 miR-144 impacted cytokine production by targeting RANKL A: siRNA of RANKL (siRANKL) functioned similarly with miR-144; B: siRANKL can recuse the upregulation of TNF-α mRNA caused by miR-144 inhibitor; C: miR-144 mimics cannot trigger TNF-α mRNA downregulation in DC2.4 cell lines with stable RNAKL overexpression; D: As control for C,miR-144 can still downregulate TNF-α mRNA in DC2.4 cell lines after transient transfection with empty vector. RANKL: Receptor activator of NF-κB ligand. *P<0.05,**P<0.01. n=3,x±s |
miRNA作为一种机体的精细调节方式,已经被多次报道在移植排斥中发挥重要作用[8, 12]。2009年,Anglicheau等[13]报道了人肾脏移植后miRNA表达谱的变化与急性排斥的关系,通过对33例肾脏移植(12例急性排斥)肾脏活检标本进行 miRNA表达谱检测,发现miRNA可 作为急性排斥的生物学标记物;2001年Scian等[14]应用 microRNA 芯片检测肾脏移植慢性失功患者的纤维化间质和肾小管活检组织miRNA变化,发现56个miRNAs中的5个 (miR-142-3p、miR-204、miR-107、miR-211、miR-32)有非常明显的改变(P<0.001),且与尿液中的miRNAs改变相符,认为这些miRNAs的变化可作为尿液无创伤的预判慢性排斥的生物标记物。2012年Asaoka等[15]发现小肠移植后的活检组织病理切片miRNA可以作为判断排斥以及 抗排斥治疗的标记物。这些结果表明miRNA很可能参与了移植排斥反应过程,但确切机制尤其miRNA对排斥反应中抗原提呈细胞的影响值得进一步研究。
移植免疫学的研究表明,DCs在移植排斥过程以及移植物损伤中发挥着重要的作用[16]。因此本研究中通过挖掘实验室已有的miRNA芯片数据结果,分析了DCs成熟过程中miRNA的变化,发现miR-144在DCs活化后发生显著下调。在移植术后,一方面缺血造成的细胞坏死会导致大量危险信号的释放[17],另一方面,补体与异源的细胞表面糖链触发级联反应,所产生的裂解片段和复合物将作用于抗原提呈细胞。这些信号将通过模式识别受体使抗原提呈细胞发生活化,开始摄取和提呈抗原,同时释放大量的细胞因子,加强获得性免疫应答,促进B细胞活化加重体液排斥[18]并参与T细胞增殖分化[19]。 而DCs作为一类功能最强的抗原提呈细胞,在识别和提呈抗原、启动免疫应答、诱导移植排斥反应中起着重要的作用。一方面,DCs分泌TNF-α促进自身成熟与抗原提呈,另一方面产生的细胞因子IL-23、IL6、IL-1β直接调控着T细胞的分化与发育[20, 21]。
本研究发现,miR-144可以靶向DCs中RANKL的mRNA,从而下调分泌性RANKL的表达。RANKL可以与RANK结合,促进NF-κB的活化,引起下游众多细胞因子的表达。在DCs成熟的过程中,RANKL会被释放到周围的微环境中帮助DCs活化。之前有研究报道,miR-144在心脏发生缺血再灌注损伤后也会发生下调,miR-144下调后抑制了Akt、GSK3β 与 MAPK途径,同时促进了mTOR途径的活化,加重了心脏损伤[22]。本研究则发现miR-144在DCs成熟中也发生显著下调,因此我们推测,在器官发生缺血再灌注后,发生损伤的器官在早期会释放趋化因子募集大量的固有免疫细胞参与损伤和炎症的发生,在这一过程中未成熟DCs接受抗原或炎性介质刺激后可分化为成熟DCs,这时候miR-144的下调除了加重组织损伤之外,同时有助于DCs释放更多的RANKL帮助自身活化。而RANKL的上调也促进了固有免疫细胞分泌包括TNF-α、IL-1β、IL-6、IL-23在内的多种细胞因子,这些细胞因子一方面促进了DCs的成熟与抗原提呈能力,另一方面促进了T细胞的成熟与分化,导致缺血再灌注损伤的加重。
综上所述,我们通过分析实验室已有的miRNA芯片数据,筛选到了靶向RANKL的miR-144,该miRNA可以抑制DCs细胞因子的分泌。本研究揭示了miRNA在异源性移植物与受体免疫系统作用后如何发挥精确调控作用的分子机制,也为miRNA作为防治移植排斥反应的潜在治疗靶点提供了首要数据。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Gutcher I,Becher B.APC-derived cytokines and T cell polarization in autoimmune inflammation[J].J Clin Invest,2007,117:1119-1127. |
| [2] | Pruitt S K,Boczkowski D,de Rosa N,Haley N R, Morse M A,Tyler D S,et al.Enhancement of anti-tumor immunity through local modulation of CTLA-4 and GITR by dendritic cells[J].Eur J Immunol,2011:41:3553-3563. |
| [3] | Guo G,Shang Y,Zhu G,Bao X,Xu S,Chen Y.The expression and distribution of immunomodulatory proteins B7-H1,B7-DC,B7-H3,and B7-H4 in rheumatoid synovium[J].Clin Rheumatol,2012,31:271-281. |
| [4] | Athanasiadis Y,de Wit D,Kumar V,Moore J E, Sharma A.Reply to:Costa DC et al.The use of subconjunctival triamcinolone acetonide (SCTA) in the management of corneal endothelial graft rejection[J].Eye (Lond),2009,23:744-745. |
| [5] | Taganov K D,Boldin M P,Chang K J,Baltimore D.NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103:12481-12486. |
| [6] | Perry M M,Moschos S A,Williams A E,Shepherd N J,Larner-Svensson H M,Lindsay M A.Rapid changes in microRNA-146a expression negatively regulate the IL-1beta-induced inflammatory response in human lung alveolar epithelial cells[J].J Immunol,2008,180:5689-5698. |
| [7] | Ma F,Xu S,Liu X,Zhang Q,Xu X,Liu M,et al.The microRNA miR-29 controls innate and adaptive immune responses to intracellular bacterial infection by targeting interferon-γ[J].Nat Immunol,2011,12:861-869. |
| [8] | Cullen B R.MicroRNAs as mediators of viral evasion of the immune system[J].Nat Immunol,2013,14:205-210. |
| [9] | Dueck A,Eichner A,Sixt M,Meister G.A miR-155-dependent microRNA hierarchy in dendritic cell maturation and macrophage activation[J].FEBS Lett,2014,588:632-640. |
| [10] | Su X,Qian C,Zhang Q,Hou J,Gu Y,Han Y,et al.miRNomes of haematopoietic stem cells and dendritic cells identify miR-30b as a regulator of Notch1[J].Nat Commun,2013,4:2903. |
| [11] | Hou J,Wang P,Lin L,Liu X,Ma F,An H,et al.MicroRNA-146a feedback inhibits RIG-I-dependent Type Ⅰ IFN production in macrophages by targeting TRAF6,IRAK1,and IRAK2[J].J Immunol,2009,183:2150-2158. |
| [12] | Baumjohann D,Ansel K M.MicroRNA-mediated regulation of T helper cell differentiation and plasticity[J].Nat Rev Immunol,2013,13:666-678. |
| [13] | Anglicheau D,Sharma V K,Ding R,Hummel A, Snopkowski C,Dadhania D,et al.MicroRNA expression profiles predictive of human renalallograft status[J].Proc Natl Acad Sci USA,2009,106:5330-5335. |
| [14] | Scian M J,Maluf D G,David K G,Archer K J,Suh J L,Wolen A R,et al.MicroRNA profiles in allograft tissues and paired urines associate with chronic allograft dysfunction with IF/TA[J].Am J Transplant,2011,11:2110-2122. |
| [15] | Asaoka T,Sotolongo B,Island E R,Tryphonopoulos P,Selvaggi G,Moon J,et al.MicroRNA signature of intestinal acute cellular rejection in formalin-fixed paraffin-embedded mucosal biopsies[J].Am J Transplant,2012,12:458-468. |
| [16] | Ge F,Yuan S,Su L,Shen Z,He A,Huang T,et al.Alteration of innate immunity by donor IL-6 deficiency in a presensitized heart transplant model[J].PLoS One,2013,8:e77559. |
| [17] | Bagul A.Ischaemic/reperfusion injury:role of infliximab[J].World J Transplant,2012,2:35-40. |
| [18] | Jiang S Y,Zou Y Y,Wang J T.p38 mitogen-activated protein kinase-induced nuclear factor kappa-light-chain-enhancer of activated B cell activity is required for neuroprotection in retinal ischemia/reperfusion injury[J].Mol Vis,2012,18:2096-2106. |
| [19] | Devey L R,Richards J A,O'Connor R A,Borthwick G,Clay S,Howie A F,et al.Ischemic preconditioning in the liver is independent of regulatory T cell activity[J].PLoS One,2012,7:e49647. |
| [20] | Shan M,Cheng H F,Song L Z,Roberts L,Green L,Hacken-Bitar J,et al.Lung myeloid dendritic cells coordinately induce TH1 and TH17 responses in human emphysema[J].Sci Transl Med,2009,1:4ra10. |
| [21] | Takahashi S,Fukuda M,Mitani A,Fujimura T, Iwamura Y,Sato S,et al.Follicular dendritic cell-secreted protein is decreased in experimental periodontitis concurrently with the increase of interleukin-17 expression and the RANKL/Opg mRNA ratio[J].J Periodontal Res,2014,49:390-397. |
| [22] | Li J,Rohailla S,Gelber N,Rutka J,Sabah N, Gladstone R A,et al.MicroRNA-144 is a circulating effector of remote ischemic preconditioning[J].Basic Res Cardiol,2014,109:423. |
 2014, Vol. 35
2014, Vol. 35


