结肠癌是现今对人类健康危害最大的恶性肿瘤之一,目前依然没有特效的治疗手段,其中结肠癌细胞对临床化疗药物普遍不敏感是重要障碍。细胞凋亡是细胞死亡形式之一,与肿瘤的发生发展密切相关,并且与肿瘤的治疗效果直接关联。大部分化疗药物可通过诱导细胞凋亡杀死肿瘤细胞,从而达到治疗效果[1, 2]。5-氟尿嘧啶(5-FU)作为应用于临床的一线化疗药物,已被证实能抑制多种体外培养肿瘤细胞的增殖,诱导肿瘤细胞衰老和凋亡[3],但迄今尚不清楚其确切作用机制。我们前期研究发现,鞘氨醇激酶2(sphingosine kinase 2,SphK2) 在丁酸钠诱导的结肠癌细胞凋亡中发挥重要的作用[4],那么SphK2是否也参与5-FU诱导的结肠癌细胞的凋亡呢?本研究旨在探讨SphK2在5-FU诱导的结肠癌细胞凋亡中的作用,以期为临床治疗结肠癌提供一个新的分子靶点。
1 材料和方法 1.1 试剂5-FU购于Sigma公司,Annexin Ⅴ试剂盒购于BD公司,胎牛血清、DMEM高糖培养基购于Gibco公司,SphK2抗体购于Abcam公司,磷酸化SphK2抗体购于Assay Biotechnology公司,PARP抗体购于CST公司;GAPDH抗体购于Santa Cruz公司;脂质体lipofectamine 2000购于Invitrogen公司,SphK2的干扰片段(正义链:5′-GCU GGG CUG UCC UUC AAC CU-3′;反义链:5′-AGG UUG AAG GAC AGC CCA GC-3′)由上海吉玛公司合成,SphK2的表达质粒由日本神户大学Nakamura教授赠送,其他试剂均为国产分析纯。
1.2 细胞培养人结肠癌细胞株HCT116(购自中国科学院上海生命科学院)置于含10%胎牛血清的DMEM高糖培养液中(内含青霉素、链霉素),在37℃、5%CO2、饱和湿度的细胞培养箱中培养。
1.3 细胞转染取对数生长期的HCT116细胞,细胞贴壁后加入SphK2干扰片段或表达质粒与脂质体形成的复合物,培养24 h后加入5-FU。具 体步骤参照脂质体lipofectamine 2000试剂盒说明书。
1.4 流式细胞术检测HCT116细胞凋亡取对数生长期HCT116细胞,细胞贴壁后分别加入5-FU(5-FU处理组)或不加入5-FU(对照组),作用48 h后收集细胞,调整细胞密度为5×106/mL,用Annexin Ⅴ/PI双染色法处理细胞;FACSCalibur流式细胞仪(美国BD公司)检测5-FU对HCT116细胞的诱导凋亡情况。具体步骤参照试剂盒说明书。检测干扰SphK2和过表达SphK2对细胞凋亡的影响时,取对数生长期的HCT116细胞,细胞贴壁后分别加入阴性干扰片段(空质粒)、SphK2干扰片段(SphK2的表达质粒),继续培养24 h(48 h)后,分别加入或不加入300 mg/L 5-FU,培养48 h后收集细胞,后续过程如上述。
1.5 蛋白质印迹法检测蛋白活性取对数生长期细胞接种于6孔板,贴壁后加入5-FU,作用终浓度为300 mg/L。分别处理2、4、6 h后,收集细胞,BCA法定量蛋白,制备SDS-PAGE凝胶,常规电泳、转膜、封闭,分别加入相对应的磷酸化SphK2抗体、SphK2抗体后4℃孵育过夜,二抗室温孵育,ECL化学发光法显色。检测SphK2干扰和过表达效率时,取对数生长期细胞,贴壁后分别加入阴性干扰片段(空质粒)、SphK2干扰片段(SphK2的表达质粒),继续培养24 h(48 h)后收集细胞,后续蛋白质印迹过程如上述;检测干扰SphK2和过表达SphK2对凋亡标记蛋白PARP表达的影响时,取对数生长期细胞,细胞贴壁后分别加入阴性干扰片段(空质粒)、SphK2干扰片段(SphK2的表达质粒),继续培养24 h(48 h)后,分别加入或者不加入5-FU,48 h后收集细胞,后续蛋白质印迹过程如上述。
1.6 Hoechst33342染色法检测细胞凋亡的形态学变化取对数生长期细胞接种于6孔板中,贴壁后加入5-FU(5-FU处理组)或者不加入5-FU(对照组)培养48 h后,弃培养液,PBS缓冲液清洗2次,加入细胞固定液,4℃固定5 min,蒸馏水冲洗后,加Hoechst33342染色液作用10 min,蒸馏水冲洗后,用滤纸吸去多余液体,荧光显微镜下观察。
1.7 统计学处理数据用 x±s 表示,实验均至少重复3次,采用SPSS13.0软件进行统计分析。两组间比较采用独立样本t检验,多组间比较采用方差分析。检验水准(α)为0.05。
2 结 果 2.1 5-FU对HCT116细胞的诱导凋亡作用 2.1.1 5-FU诱导HCT116细胞凋亡率的变化如图 1所示,HCT116细胞经300 mg/L浓度的5-FU处理48 h后,细胞凋亡率为(22.49±1.38)%,高于对照组的(3.42±1.02)%,差异有统计学意义(P<0.01)。因晚期凋亡细胞所占百分比高于早期凋亡细胞,推测5-FU对HCT116的诱导凋亡作用主要表现为诱导细胞发生晚期凋亡。

|
图 1 5-氟尿嘧啶(5-FU)诱导HCT116细胞凋亡 Fig 1 5-Fluorouracil (5-FU) induced apoptosis in HCT116 cells | A:Control group; B: Cells treated with 300 mg/L 5-FU for 48 h
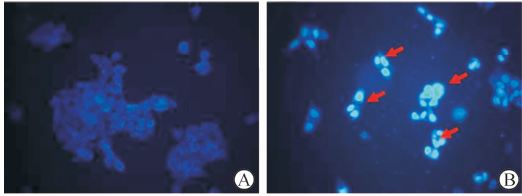
Hoechst33342染色显示,对照组细胞基本存活,细胞核膜完整,呈淡蓝色均匀染色,未见凋亡细胞(图 2A);而5-FU处理组部分细胞出现核固缩、染色质凝集等典型的细胞凋亡特征(图 2B)。
|
图 2 5-氟尿嘧啶(5-FU)诱导HCT116细胞凋亡的形态学变化 Fig 2 Morphological changes of 5-fluorouracil (5-FU)-induced HCT116 cell apoptosis under fluorescence microscopy A:Control group; B:Cells treated by 300 mg/L 5-FU for 48 h. Arrows showed the apoptotic cells. Original magnification: ×400 |
蛋白质印迹分析结果显示,5-FU处理组PARP蛋白降解剪切部分较对照组细胞明显增强(图 3)。

|
图 3 5-氟尿嘧啶(5-FU)诱导HCT116细胞凋亡的凋亡标记蛋白变化 Fig 3 Western blotting analysis of apoptotic marker protein in 5-fluorouracil (5-FU)-induced HCT116 cell apoptosis 1:Control group; 2: Cells treated with 300 mg/L 5-FU for 48 h |
经蛋白质印迹分析检测,干扰SphK2组中SphK2的相对表达量为阴性干扰对照组的13%~15%,干扰效率达80%以上,见图 4。

|
图 4 蛋白质印迹检测干扰鞘氨醇激酶2的效率 Fig 4 Interference efficiency of sphingosine kinase 2 (SphK2) by Western blotting analysis 1:Negative siRNA control group;2:Cells treated with SphK2 siRNA |
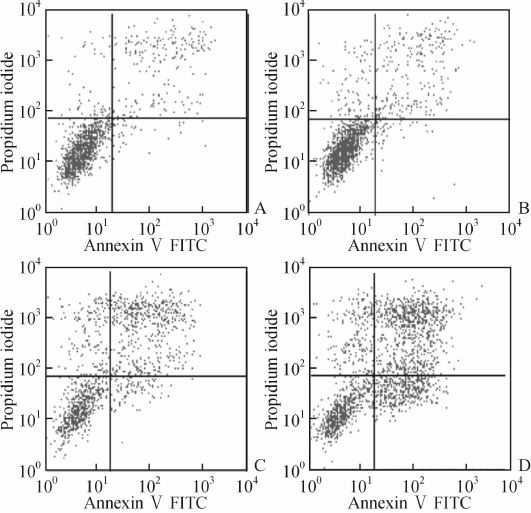
经阴性干扰和SphK2干扰的HCT116细胞在5-FU处理48 h后,细胞凋亡率分别为(23.62±0.65)%和(42.30±0.81)%,分别高于其未暴露于5-FU的对照组[(3.33±0.79)%、(4.23±0.59)%,P均<0.01,图 5]。与阴性干扰的细胞比较,干扰SphK2增强了5-FU诱导的细胞凋亡(P<0.01)。
|
图 5 干扰鞘氨醇激酶2对5-氟尿嘧啶(5-FU)诱导的HCT116细胞凋亡的影响 Fig 5 Effect of sphingosine kinase 2 (SphK2) down-regulation on 5-fluorouracil (5-FU)-induced HCT116 cell apoptosis A:Negative siRNA control group; B: Cells transfected with SphK2 siRNA; C: Cells transfected with negative siRNA plus 300 mg/L 5-FU for 48 h; D: Cells transfected with SphK2 siRNA plus 300 mg/L 5-FU for 48 h |
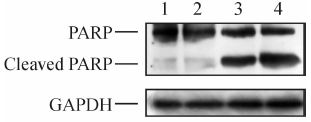
蛋白质印迹分析结果显示,在5-FU处理48 h后,与阴性干扰的细胞比较,干扰SphK2增强了PARP蛋白降解剪切部分(图 6)。
|
图 6 干扰鞘氨醇激酶2对凋亡标记蛋白的影响 Fig 6 Effect of sphingosine kinase 2 (SphK2) down-regulation on apoptotic marker protein by Western blotting analysis 1:Negative siRNA control group; 2: Cells transfected with SphK2 siRNA; 3: Cells transfected with negative siRNA plus 300 mg/L 5-fluorouracil (5-FU) for 48 h; 4: Cells transfected with SphK2 siRNA plus 300 mg/L 5-FU for 48 h |
蛋白质印迹法检测显示,过表达SphK2组中SphK2的相对表达量为空质粒对照组的1.5~2.1倍(图 7)。

|
图 7 蛋白质印迹检测鞘氨醇激酶2的过表达效率 Fig 7 Efficiency of sphingosine kinase 2 (SphK2) over-expression by Western blotting analysis 1:Empty vector group; 2: Cells transfected with wild-type SphK2 plasmid |
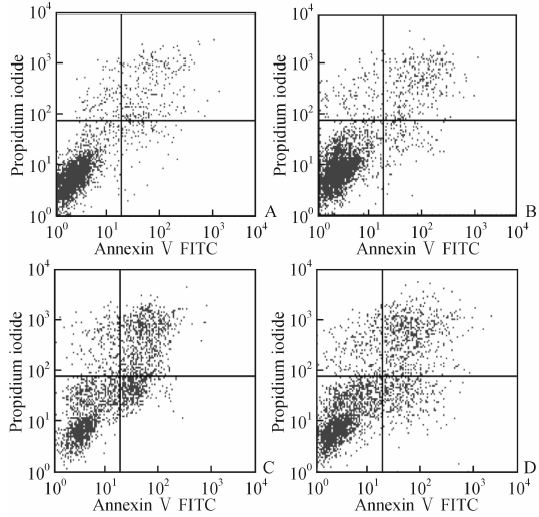
空质粒或过表达SphK2处理的HCT116细胞暴露于5-FU 48 h后,细胞凋亡率分别为(23.67±1.09)%和(11.03±1.31)%,均高于相应的对照(5-FU未暴露)组[(4.38±0.89)%、(3.52±0.84)%,P均<0.01,图 8)]。相较于空质粒处理细胞,过表达SphK2的细胞经5-FU诱导后细胞凋亡率明显下降(P<0.01)。
|
图 8 过表达鞘氨醇激酶2对5-氟尿嘧啶(5-FU)诱导的HCT116细胞凋亡的影响 Fig 8 Effect of sphingosine kinase 2 (SphK2) over-expression on 5-fluorouracil (5-FU)-induced HCT116 cell apoptosis A:Empty vector group; B: Cells transfected with wild-type SphK2 plasmid; C: Cells transfected with empty vector plus 300 mg/L 5-FU for 48 h; D: Cells transfected with wild-type SphK2 plus 300 mg/L 5-FU for 48 h |
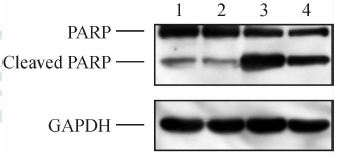
如图 9所示,蛋白质印迹结果显示,经空质粒或过表达SphK2处理的HCT116细胞暴露于5-FU 48 h后,与空质粒处理组细胞比较,过表达SphK2组PARP蛋白降解剪切部分减弱(图 9)。
|
图 9 过表达鞘氨醇激酶2对凋亡标记蛋白的影响 Fig 9 Effect of sphingosine kinase 2 (SphK2) over-expression on apoptotic marker protein by Western blotting analysis 1:Empty vector group; 2:Cells transfected with wild-type SphK2 plasmid; 3: Cells transfected with empty vector plus 300 mg/L 5-fluorouracil (5-FU) for 48 h; 4: Cells transfected with wild-type SphK2 and 300 mg/L 5-FU for 48 h |
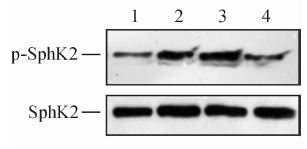
5-FU(300 mg/L)处理HCT116细胞2 h,磷酸化SphK2表达水平升高,处理4 h时达最高峰,6 h时下降(图 10)。
|
图 10 5-氟尿嘧啶(5-FU)对HCT116细胞鞘氨醇激酶2活性的影响 Fig 10 Effect of 5-fluorouracil (5-FU) on activity of sphingosine kinase 2 (SphK2) in HCT116 cells 1: Control group; 2-4: Cells treated by 5-FU for 2,4,and 6 h,respectively |
结肠癌的治疗多采用手术与化疗相结合的综合治疗手段,其中化疗占据着重要地位。近年来虽然在用药流程、药物开发等方面做了大量工作,但仍有超过半数的患者发生耐药。因此,寻求新的治疗靶点已成为结肠癌治疗迫切需要解决的问题。
在结肠癌等肿瘤的发生、发展过程中,鞘磷脂的代谢产物——神经酰胺、神经鞘氨醇、1-磷酸鞘氨醇发挥着重要的作用,三者构成一个代谢平衡,此动态平衡与细胞的生存、死亡密切相关。SphK2是维系代谢平衡的关键酶之一[6],在多种实体肿瘤(如结肠癌[7]、前列腺癌[8]等)中均有不同丰度的表达,其通过SphK2/1-磷酸鞘氨醇信号途径对肿瘤的生长发展起促进作用,从而使肿瘤细胞对放化疗产生耐受。SphK2与肿瘤的耐药性相关近几年才被证实,Antoon等[9, 10]报道,SphK2的特异性抑制剂ABC294640能显著抑制雌激素受体阳性的乳腺癌细胞的生长,以及雌激素介导的雌激素受体调控的SDF1及前雌激素受体的基因转录;ABC294640还能够抑制抵抗内分泌治疗的MDA-MB-231及化疗的MCF-7TN-R乳腺癌细胞的增殖。Schnitzer等[11]也报道,SphK2在A549肺癌细胞耐受依托泊苷诱导的死亡中发挥了重要的作用。我们前期研究也报道过,SphK2通过蛋白激酶D引起的自身核输出导致的自身磷酸化抵抗丁酸钠诱导的结肠癌细胞凋亡[4]。近几十年来,5-FU始终作为一线抗肿瘤药物用于临床食管癌、胃癌、结肠癌、肺癌和乳腺癌等多种肿瘤的治疗。5-FU治疗肿瘤的机制主要有特异性作用于细胞周期,抑制细胞由G0/G1向S期转化,阻滞细胞周期;在体内转变为5-氟-2-脱氧尿嘧啶核苷酸,抑制胸腺嘧啶核苷酸合成酶,阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸而抑制 DNA的生物合成。本研究观察到5-FU对HCT116细胞具有诱导凋亡的作用。这一结果与5-FU作用于其他肿瘤细胞的发现相符[12]。我们前期研究提示丁酸钠诱导结肠癌细胞凋亡的作用与SphK2密切相关[4],在此基础上本研究证实了内源性的SphK2在5-FU诱导HCT116细胞凋亡这一过程中起负调控作用。SphK2被干扰时,5-FU诱导的HCT116细胞的凋亡率明显增高;而过表达SphK2则导致5-FU诱导的HCT116细胞凋亡显著降低。我们的结果与一些早期的研究不一致,即SphK2能够在血清饥饿的情况下抑制HEK293(人胚胎肾)细胞的增殖,并且促进其凋亡[13];但与另外一些报道结论相似,即SphK2能够保护A549肺癌细胞、U87恶性胶质瘤细胞免于凋亡[11, 14]。提示SphK2在某些细胞类型(如U87恶性胶质瘤细胞、A549肺癌细胞、HCT116结肠癌细胞等)中被诱导可能与细胞自身获得性耐药机制高度相关。此外,本研究还观察到5-FU暴露数小时即可诱导SphK2活性形式的表达,这与后者调节5-FU所致细胞凋亡的发现相吻合。
本研究观察到的SphK2参与5-FU诱导HCT116结肠癌细胞凋亡调控的作用与我们前期发现的该蛋白对丁酸钠诱导的结肠癌HCT116细胞的凋亡作用[4]相似。SphK2是否普遍参与肿瘤细胞诱导凋亡的调控尚待更多的研究来证实,并且有必要以体内动物实验进行验证;另一方面,探寻安全有效的SphK2抑制物可能具有一定的临床应用前景,SphK2可能成为结肠癌有效治疗的新靶点。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Wlodkowic D,Telford W,Skommer J,Darzynkiewicz Z.Apoptosis and beyond: cytometry in studies of programmed cell death.[J].Methods Cell Biol,2011,103:55-98. |
| [2] | Favaloro B,Allocati N,Graziano V,Di Ilio C,De Laurenzi V.Role of apoptosis in disease[J].Aging (Albany NY),2012,4:330-349. |
| [3] | Ye Y W,Hu S,Shi Y Q,Zhang X F,Zhou Y,Zhao C L,et al.Combination of the FGFR4 inhibitor PD173074 and 5-fluorouracil reduces proliferation and promotes apoptosis in gastric cancer[J].Oncol Rep,2013,30:2777-2784. |
| [4] | Xiao M,Liu Y,Zou F.Sensitization of human colon cancer cells to sodium butyrate-induced apoptosis by modulation of sphingosine kinase 2 and protein kinase D[J].Exp Cell Res,2012,318:43-52. |
| [5] | Konishi T,Sasaki S,Watanabe T,Kitayama J,Nagawa H.Overexpression of hRFI inhibits 5-fluorouracil-induced apoptosis in colorectal cancer cells via activation of NF-kappaB and upregulation of bcl-2 and bcl-XL[J].Oncogene,2006,25: 3160-3169. |
| [6] | Spiegel S,Milstien S.Sphingosine-1-phosphate: an enigmatic signalling lipid[J].Nat Rev Mol Cell Biol,2003,4:397-407. |
| [7] | Rawuszko A A,Sawek S,Gollogly A,Szkudelska K,Jagodziński P P.Effect of butyrate on aromatase cytochrome P450 levels in HT29 and LoVo colon cancer cells [J].Biomed Pharmacother,2012,66:77-82. |
| [8] | Paskova L,Smesny Trtkova K,Fialova B,Benedikova A,Langova K,Kolar Z.Different effect of sodium butyrate on cancer and normal prostate cells[J].Toxicol In Vitro,2013,27:1489-1495. |
| [9] | Antoon J W,White M D,Meacham W D,Slaughter E M,Muir S E,Elliott S,et al.Antiestrogenic effects of the novel sphingosine kinase-2 inhibitor ABC294640[J].Endocrinology,2010,151:5124-5135. |
| [10] | Antoon J W,White M D,Slaughter E M,Driver J L,Khalili H S,Elliott S,et al.Targeting NF-κB mediated breast cancer chemoresistance through selective inhibition of sphingosine kinase-2[J].Cancer Biol Ther,2011,11:678-689. |
| [11] | Schnitzer S E,Weigert A,Zhou J,Brüne B.Hypoxia enhances sphingosine kinase 2 activity and provokes sphingosine-1-phosphate-mediated chemoresistance in A549 lung cancer cells[J].Mol Cancer Res,2009,7:393-401. |
| [12] | Li Y,Yu J,Du D,Fu S,Chen Y,Yu F,et al.Involvement of post-transcriptional regulation of FOXO1 by HuR in 5-FU-induced apoptosis in breast cancer cells [J].Onco Lett,2013,6:156-160. |
| [13] | Okada T,Ding G,Sonoda H,Kajimoto T,Haga Y,Khosrowbeygi A,et al.Involvement of N-terminal-extended form of sphingosine kinase2 in serum-dependent regulation of cell proliferation and apoptosis [J].J Biol Chem,2005,280: 36318-36325. |
| [14] | Van Brocklyn J R,Jackson C A,Pearl D K,Kotur M S,Snyder P J,Prior T W.Sphingosine kinase-1 expression correlates withpoor survival of patients with glioblastoma multiforme: roles of sphingosine kinase isoforms in growth of glioblastoma cell lines [J].J Neuropathol Exp Neurol,2005,64:695-705. |
 2014, Vol. 35
2014, Vol. 35


