2. 解放军92330部队医院, 青岛 266102;
3. 解放军522医院药材科, 洛阳 471003
2. Hospital of No. 92330 Troop of PLA , Qingdao 266102, Shandong, China;
3. Department of Pharmacy, No. 522 Hospital of PLA, Luoyang 471003, Henan, China
基因治疗是一种非常有前景的治疗方式,其研究已经深入到遗传性疾病、肿瘤、心血管疾病、神经系统疾病等各个疾病领域[1]。基因治疗主要是通过基因载体将基因片段导入到特定细胞中而实现的,基因载体可分为病毒类基因载体和非病毒类基因载体两大类,前者由于带有病毒的一些特性,容易引起一些不良反应,限制了其临床应用,因此近年来研究者主要将重点集中在非病毒基因载体的研究上[2]。在众多的非病毒基因载体材料中,虽然部分材料获得了较高的基因转染效率,但是这些材料并不能完全解决免疫原性、生物相容性及体内降解性等难题[3]。为了彻底解决非病毒基因载体的上述问题,最好能采用人体自身含有的成分,使材料能够接近人体的组成,从这一思路出发,氨基酸均聚与共聚材料可以是潜在的理想基因载体。精氨酸是人体半必需氨基酸,天然存在的精氨酸均为L型,有一个胍基和氨基,在生理条件下带正电荷,大量存在于细胞膜穿透肽 (MPPs) 中,并且被证实是细胞膜穿透肽中发挥穿膜作用的一种氨基酸[4]。蛋白转导区域 (PTDs) 和人类免疫缺陷病毒(HIV)的Tat蛋白中也富含精氨酸,前者是能够进入细胞的阳离子肽,后者是协助HIV病毒进入人体细胞的一种蛋白[5, 6]。聚精氨酸(PLR)由多个精氨酸上的氨基和羧基脱水聚合形成,在中性水溶液中带正电荷,能够与带负电的基因片段以静电力结合,形成的纳米级复合物能够被细胞摄取,因此聚精氨酸是一种能够跨膜转运基因片段的多肽。PLR容易制备,有很好的生物相容性,基因转染效率较高,易于降解,降解产物为精氨酸,可以被人体利用,但PLR具有比较大的细胞毒性,限制了其作为基因载体的广泛应用。
目前国内非病毒基因载体的研究多集中于不可生物降解的合成或天然材料,可生物降解的基因载体研究和应用处于起步阶段,而利用PLR作为可生物降解的基因载体用于肿瘤干细胞的基因治疗研究尚属空白。聚乙二醇(PEG)是一种无毒性、无刺激性的聚合物,具有良好的亲水性,与阳离子聚合物连接后,可以增加后者在血浆中的稳定性,降低其毒性和免疫原性,还可以减少阳离子聚合物被网状内皮系统(RES)清除,延长后者在血液循环中的滞留时间[7]。本实验通过在PLR上修饰PEG的方式降低了前者的细胞毒性,选择前列腺癌干细胞模型细胞系(RC-92a/hTERT)作为实验对象,探讨了PEG修饰对PLR介导的RNA干扰效率的影响,为广泛应用PEG修饰的PLR作为基因载体进行研究奠定了基础,也为下一步针对前列腺癌干细胞的基因治疗研究提供了依据。
1 材料和方法 1.1 主要仪器和试剂Mercury Plus 600 MHz超导核磁共振波谱仪(Varian公司,美国);Zeta sizer ZS90电位粒径分析仪(Malvern公司,英国);全自动酶标仪(Thermo公司,美国);FACSCalibur流式细胞仪(BD 公司,美国);直线型聚精氨酸(PLR,相对分子质量7 500,Sigma-Aldrich,美国);琥珀酰亚胺(NHS)功能化聚乙二醇(NHS-PEG,相对分子质量2 000,嘉兴博美生物技术有限公司,中国);胎牛血清(FBS,Gibco公司,美国);DMEM培养基(Gibco公司,美国);FAM-siRNA oligo(上海吉玛制药技术有限公司,中国);CCK-8试剂盒(南京凯基生物科技发展有限公司,中国);RC-92a/hTERT细胞系(上海抚生生物科技有限公司,中国)。
1.2 细胞培养RC-92a/hTERT是Miki等将人端粒酶反转录酶(hTERT)片段的真核表达质粒通过反转录病毒载体(LXSN)导入到原代培养的前列腺癌RC-92a细胞中而构建的具有前列腺癌干细胞特性的细胞系,RC-92a/hTERT细胞在体外增殖侵袭、小鼠致瘤能力以及细胞内基因和蛋白的表达上都与前列腺癌干细胞接近[8],因此作为模型细胞来研究前列腺癌干细胞具有很强的说服力[9]。细胞培养方法参照文献[10]进行,具体如下:将RC-92a/hTERT细胞株置于含10% FBS的DMEM培养液中,37℃、5%CO2条件下培养,每2 d换液1次,每4 d消化传代1次,当细胞生长达到50%~80%融合状态时,可用于实验。
1.3 聚精氨酸-聚乙二醇(PLR-PEG)的合成精密称取一定量PLR,溶解于50 mmol/L四硼酸钠缓冲液(pH 8.5)中,用0.22 μm的微孔滤膜过滤至无菌容器中,然后一边搅拌一边缓慢加入一定量NHS-PEG(相对分子质量2 000),使NHS-PEG与PLR反应的摩尔比为1∶1,室温避光反应24 h,利用透析袋(截留相对分子质量为3 500)在蒸馏水中透析48 h,间隔24 h换液1次,透析后的溶液利用冻干机冻干(-50℃,20 Pa,48 h),最终得到1∶1修饰的PLR-PEG,产物用1HNMR鉴定。不同PEG修饰度(1∶3、1∶5)的PLR-PEG合成过程同上。
1.4 PLR-PEG的结构鉴定将1.3项下合成的产物各称量5 mg,溶于0.5 mL 重水,转移至核磁管中进行600 MHz核磁共振波谱分析。
1.5 PLR-PEG/siRNA复合物的制备及粒径和Zeta电位测定取siRNA 3 μg,分别与不同PEG修饰度的PLR-PEG溶液按照氮磷比(N/P)为5、10、20、40漩涡混合30 s,室温孵育1 h,即制得PLR-PEG/siRNA复合物,复合物稀释成1 mL,通过电位粒径分析仪对复合物的粒径和Zeta电位进行测定,测定条件为室温、固定角90°,每组复合物各重复测定3次。
1.6 PLR-PEG的细胞毒性考察将RC-92a/hTERT细胞按照4 000/孔接种于96孔板,37℃、5%CO2继续培养24 h,吸去细胞培养液,加入含不同浓度PLR-PEG(0,5,10,20,30,40,50,60,80,100 μg/mL)的培养液,继续培养24 h后每孔加入10 μL CCK-8试剂,37℃、5%CO2孵育3 h显色,用酶标仪测定各细胞孔在450 nm处的光密度(D)。以无细胞生长的培养孔为空白对照,未加入PLR-PEG的细胞孔为阴性对照,计算细胞存活率: 细胞存活率(%)=(D样品-D空白)/(D阴性-D空白)×100%。
1.7 PLR-PEG对siRNA的包裹能力测定取siRNA 1 μg,分别与不同PEG修饰度的PLR-PEG溶液30 μL,按照N/P为0.5、1、2、3、5、10、20混合,室温孵育1 h,1.0%琼脂糖凝胶电泳30 min(100 V,50 A),溴化乙啶染色后利用紫外透射仪观察并拍照。
1.8 PLR-PEG/siRNA复合物的细胞摄取效率考察将前列腺癌细胞RC-92a/hTERT按照每孔2×105个的密度接种于6孔培养板中,37℃、5%CO2条件下培养24 h,给药前更换为无血清培养液,每孔含2 mL培养液。取带荧光标记的FAM-siRNA 2 μg,分别与不同PEG修饰度的PLR-PEG溶液按照N/P为5、10、20混合均匀,用PBS稀释至50 μL,室温避光孵育1 h,配制成PLR-PEG/siRNA复合物溶液,将上述溶液分别加入到6孔培养板中,避光培养4 h,胰酶消化收集细胞,利用流式细胞仪定量检测成功摄取FAM-siRNA的细胞比例。
1.9 PLR-PEG/siBcl-2复合物的体外干扰效率测定将前列腺癌细胞RC-92a/hTERT按照每孔1×105个的密度接种于6孔培养板中,37℃、5%CO2条件下培养24 h,给药前更换为每孔2 mL无血清培养液。取对Bcl-2基因表达有干扰作用的siBcl-2小干扰RNA 4 μg,分别与不同PEG修饰度的PLR-PEG溶液按照N/P为10混合均匀,用PBS稀释至50 μL,室温孵育1 h,之后加入到6孔培养板的各孔中,孵育4 h后,每孔更换为2 mL完全培养液,于37℃、5%CO2条件下继续培养24 h,以GAPDH蛋白为内参照,采用蛋白质印迹法测定Bcl-2蛋白的表达。
2 结 果 2.1 PLR-PEG的结构鉴定由于NHS-PEG上的NHS基团可以与PLR表面的氨基连接,并且该反应完全,接近100%,因此根据反应投料的比例不同,可以得到不同PEG修饰度的PLR。通过1HNMR分析鉴定,NHS-PEG与PLR完全反应,成功合成了PLR-PEG。化学位移为4.7左右的峰为D2O溶剂峰,峰1、2、3、4是PLR的骨架峰(图 1A、1B);化学位移为3.6左右的峰5为PEG的亚甲基特征吸收峰(图 1B),从峰面积比可以得出,PEG的修饰度与反应的投料比一致,分别合成了PEG修饰比例为1、3、5的PLR-PEG (PLR-PEG1,3,5)。

|
图 1 PLR(A)和PLR-PEG1(B)的1HNMR谱图 Fig 1 1HNMR spectrograms of PLR(A)and PLR-PEG1(B) The signal 1-4 are attributed to protons of PLR; the signal 5 are due to protons of PEG. PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG1: PEG modified PLR with PLR∶PEG=1∶1 |
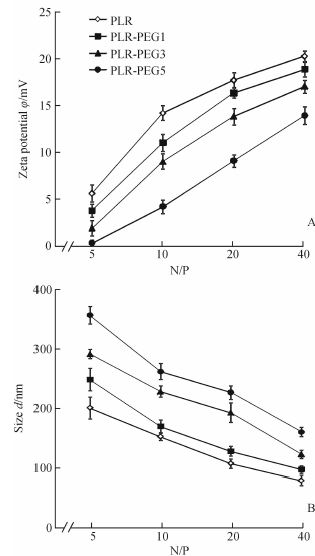
PLR-PEG/siRNA复合物的粒径在80~400 nm之间,并且随着N/P的增大而降低(图 2B);Zeta电位随着N/P比增大而增加(图 2A),说明随着N/P的增大,载体所带电荷增加,使得PLR-PEG/siRNA复合物颗粒包裹得更加紧密;同时随着PEG修饰度的增加,PLR-PEG/siRNA的粒径增加,Zeta电位降低,说明PEG屏蔽了PLR表面的部分正电荷,而PLR的包裹能力与其表面的正电荷有关,PEG也降低了PLR对siRNA的包裹能力。
|
图 2 PLR-PEG/siRNA复合物的Zeta电位和粒径测定结果 Fig 2 Zeta potential and particle size of PLR-PEG/siRNA complex A: Zeta potential of various PLR-PEG/siRNA complexes at different N/P ratios; B: Particle size of various PLR-PEG/siRNA complexes at different N/P ratios. PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG 1,3,5: PEG modified PLR with PLR∶PEG=1∶1,1∶3 and 1∶5,respectively. n=3,x±s |
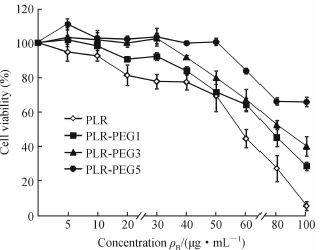
阳离子聚合物基因载体的细胞毒性与载体表面的正电荷有关,降低表面的正电荷可以降低载体的细胞毒性。从图 3可以看出,随着PEG修饰度的增加,PLR-PEG对RC-92a/hTERT细胞的毒性下降,未经PEG修饰的PLR的IC50为60 μg/mL,在100 μg/mL时只有不到10%的细胞能够存活,说明PLR的细胞毒性较大,不适合直接作为基因载体应用。 而经PEG修饰后,PEG屏蔽了PLR表面的部分正电荷,增加了PLR的亲水性能,因此明显降低了其细胞毒性,每分子5个PEG修饰的PLR-PEG5的IC50值>100 μg/mL,在100 μg/mL时仍有70%的细胞存活,与相同浓度PLR只有5.5%的细胞存活率相比,有了极大的改善。PLR-PEG5达到了基因载体在细胞毒性方面的要求。
|
图 3 不同修饰度的PLR-PEG对RC-92a/hTERT细胞的毒性 Fig 3 Cytotoxicity of PLR-PEG of different modification degrees on RC-92a/hTERT cells PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG 1,3,5: PEG modified PLR with PLR∶PEG=1∶1,1∶3 and 1∶5,respectively. n=3,x±s |
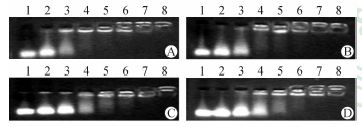
由于PLR-PEG表面带正电,siRNA表面带负电,两者在溶液中通过静电作用缩合成团状的纳米结构,从而滞留在凝胶上的点样孔内,而未完全压缩的siRNA仍能随着电场的作用,由负极向正极在凝胶上移动,在紫外光照射下会显现出明亮的siRNA条带。PLR/siRNA复合物的凝胶电泳结果见图 4,最左侧条带为裸siRNA在琼脂糖凝胶上出现典型的siRNA条带,泳道从左向右,随着N/P的增加,PLR-PEG包裹住的siRNA越多,siRNA在泳道中出现的越少,滞留在点样孔的越多。可以发现,随着PEG修饰度的增加,PLR-PEG对siRNA的包裹能力也在下降。PLR在N/P为2时可以完全包裹住siRNA(图 4A),而PLR-PEG5完全包裹住siRNA的N/P则增加到了5(图 4D)。
|
图 4 琼脂糖凝胶电泳检测不同PEG修饰度的PLR对siRNA的包裹能力 Fig 4 siRNA condensation ability of PLR-PEG of different modificaiton degrees A: PLR; B: PLR-PEG1; C: PLR-PEG3; D: PLR-PEG5. 1: Naked siRNA; 2-8: N/P ratio is 0.5,1,2,3,5,10,20,respectively. PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG 1,3,5: PEG modified PLR with PLR∶PEG=1∶1,1∶3 and 1∶5,respectively |
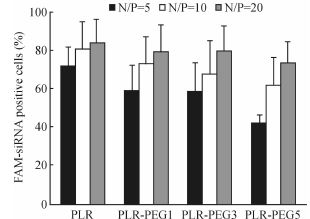
从图 5可以看出,随着N/P的增加,RC-92a/hTERT细胞对PLR-PEG/FAM-siRNA复合物的摄取效率也随之增加,流式细胞仪检测带有荧光的细胞比例增加,这是由于N/P增加后,PLR-PEG/FAM-siRNA复合物结合的更加紧密,复合物表面的阳离子增多,而细胞膜带负电荷,PLR-PEG/siRNA复合物更容易与细胞膜表面结合。 还可以看出,随着PEG修饰度的增加,PLR-PEG/FAM-siRNA复合物的细胞摄取效率呈下降趋势,在N/P为5时,PEG修饰后细胞摄取效率下降很明显,在N/P为10和20时,PEG修饰对复合物的细胞摄取效率影响不大。未经修饰的PLR的基因递送入胞效率最高,在N/P为20时,细胞荧光阳性率最高可以达到97.87%,PEG修饰度为5的PLR-PEG5基因递送入胞效率最低,在N/P为5时,由于无法完全包裹住siRNA,PLR-PEG5/siRNA复合物的细胞摄取效率最低只有35.86%。
|
图 5 PLR-PEG/siRNA复合物的细胞摄取效率 Fig 5 Cellular uptake efficiency of PLR-PEG/siRNA complex in different groups PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG 1,3,5: PEG modified PLR with PLR∶PEG=1∶1,1∶3 and 1∶5,respectively. n=3,x±s |
不同修饰度的PLR-PEG/siBcl-2纳米复合物分别与前列腺癌细胞RC-92a/hTERT作用24 h后,对Bcl-2蛋白的表达均产生了干扰作用(图 6),可以看出随着PEG修饰度的增加,PLR-PEG/siBcl-2纳米复合物对蛋白合成的干扰作用呈减弱趋势,PLR-PEG1和PLR-PEG3与siRNA形成的纳米复合物对Bcl-2表达的干扰作用与未经修饰的PLR相差不大,而PLR-PEG5/siBcl-2纳米复合物的干扰作用与PLR相比差距较大,与阴性对照组(PLR/NC-siRNA复合物)相比差距已经不明显。

|
图 6 PLR-PEG/siBcl-2复合物对Bcl-2表达的干扰作用 Fig 6 Interference of Bcl-2 by PLR-PEG/siBcl-2 complex 1: Untreated; 2: PLR/NC-siRNA; 3: PLR-PEG5/siBcl-2; 4: PLR-PEG3/siBcl-2; 5: PLR-PEG1/siBcl-2; 6: PLR/siBcl-2. PLR: Polyargine; PEG: Polyethylene glycol; PLR-PEG 1,3,5: PEG modified PLR with PLR∶PEG=1∶1,1∶3 and 1∶5,respectively |
前列腺癌的发病率不断上升,目前已成为危害男性健康的主要肿瘤之一。前列腺癌干细胞是前列腺癌组织中少数具有无限增殖潜能的细胞,驱动肿瘤的形成和生长,目前已在研究中得到证实[11]。虽然前列腺癌干细胞在癌细胞中只占极少数,但它极有可能是前列腺癌出现耐药、复发及转移等现象的根源[12]。因此,针对前列腺癌干细胞的治疗研究有着重要的临床意义,是治疗前列腺癌的新思路和新策略[13]。本研究利用PEG对可降解载体PLR进行改造,在具有前列腺癌干细胞特性的RC-92a/hTERT细胞上,对改造后的PLR-PEG载体进行了一系列评价。PLR-PEG/siRNA复合物的粒径根据N/P的不同在80~400 nm之间变化,PEG修饰增大了PLR与siRNA所形成复合物的粒径,其粒径范围仍符合载体/基因复合物在体内应用的要求;PLR-PEG/siRNA复合物在溶液中的Zeta电位为正值,因此可以有效地被细胞摄取,PEG的修饰降低了复合物的Zeta电位。在PLR分子上引入PEG基团可以明显降低PLR的细胞毒性,使其达到作为基因载体材料的要求,原因可能是PEG可以屏蔽PLR的部分正电荷,减少PLR与细胞膜表面的相互作用。由于PLR与siRNA之间主要通过静电力结合,PEG修饰在降低PLR毒性的同时也降低了PLR对siRNA的包裹能力,PLR-PEG/siRNA复合物表面正电荷的减弱也使得细胞摄取效率有所降低,但在高N/P时依然能保持较高的细胞摄取率。在基因干扰效率方面,随着PEG修饰度的增加,PLR-PEG/siBcl-2复合物对Bcl-2基因表达的干扰效率呈下降趋势,产生这种趋势的原因一方面是随着PEG修饰度的增加,细胞对PLR-PEG/siRNA复合物的摄取效率下降,导致进入细胞内的siBcl-2有所减少,另一方面由于PEG的亲水作用,致使PLR-PEG/siBcl-2复合物的内涵体逃逸能力有所减弱,进入细胞质内的siBcl-2也有所减少,而siBcl-2需要随载体从内涵体逃逸出来进入细胞质后才能发挥干扰作用。当修饰每分子PLR的PEG数目不超过3个时,对PLR-PEG/siRNA复合物的基因干扰效率影响比较小。综合上述实验结果,PEG修饰PLR可以降低后者的细胞毒性,同时保持PLR/siRNA复合物在前列腺癌干细胞模型细胞中较高的基因干扰效率,我们认为PEG修饰度为3的PLR-PEG3是本研究中最合适的基因载体。
在细胞凋亡过程中,Bcl-2基因的表达起着至关重要的作用[14],Bcl-2的过表达还与肿瘤耐药有关[15],目前已有一些针对前列腺癌细胞Bcl-2基因的治疗研究[16]。本研究中的PLR-PEG/siBcl-2复合物明显减少了RC-92a/hTERT细胞中Bcl-2蛋白的表达,显示出了PLR-PEG载体在前列腺癌干细胞基因治疗中的潜力。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Kaufmann K B,Büning H,Galy A,Schambach A,Grez M. Gene therapy on the move[J]. EMBO Mol Med,2013,5:1642-1661. |
| [2] | Rogers M L,Rush R A. Non-viral gene therapy for neurological diseases,with an emphasis on targeted gene delivery[J]. J Contr Rel,2012,157:183-189. |
| [3] | Panyam J,Labhasetwar V. Biodegradable nanoparticles for drug and gene delivery to cells and tissue[J]. Adv Drug Deliv Rev,2003,55:329-347. |
| [4] | He C X,Tabata Y,Gao J Q. Non-viral gene delivery carrier and its three-dimensional transfection system[J]. Int J Pharm,2010,386(1-2):232-242. |
| [5] | Lundberg M,Wikström S,Johansson M. Cell surface adherence and endocytosis of protein transduction domains[J]. Mol Ther,2003,8:143-150. |
| [6] | Torchilin V P. Tat peptide-mediated intracellular delivery of pharmaceutical nanocarriers[J]. Adv Drug Deliv Rev,2008,60(4-5):548-558. |
| [7] | Sato A,Choi S W,Hirai M,Yamayoshi A,Moriyama R,Yamano T,et al. Polymer brush-stabilized polyplex for a siRNA carrier with long circulatory half-life[J].J Contr Rel,2007,122:209-216. |
| [8] | Gu Y,Li H,Miki J,Kim K H,Furusato B,Sesterhenn I A,et al. Phenotypic characterization of telomerase-immortalized primary non-malignant and malignant tumor-derived human prostate epithelial cell lines[J]. Exp Cell Res,2006,312:831-843. |
| [9] | Miki J,Rhim J S. Prostate cell cultures as in vitro models for the study of normal stem cells and cancer stem cells[J]. Prostate Cancer Prostatic Dis,2008,11:32-39. |
| [10] | Miki J,Furusato B,Li H,Gu Y,Takahashi H,Egawa S,et al. Identification of putative stem cell markers,CD133 and CXCR4,in hTERT-immortalized primary nonmalignant and malignant tumor-derived human prostate epithelial cell lines and in prostate cancer specimens[J]. Cancer Res,2007,67:3153-3161. |
| [11] | Tu S M,Lin S H. Prostate cancer stem cells[J]. Clin Ggenitourin Cancer,2012,10:69-76. |
| [12] | Sun Y,Gao W Q. Human prostate cancer stem cells:new features unveiled[J]. Asian J Androl,2011,13:355-356. |
| [13] | Zhou Y,Yang J,Kopeček J. Selective inhibitory effect of HPMA copolymer-cyclopamine conjugate on prostate cancer stem cells[J]. Biomaterials,2012,33:1863-1872. |
| [14] | Raffo A J,Perlman H,Chen M W,Day M L,Streitman J S,Buttyan R. Overexpression of bcl-2 protects prostate cancer cells from apoptosis in vitro and confers resistance to androgen depletion in vivo [J]. Cancer Res,1995,55:4438-4445. |
| [15] | Calastretti A,Gatti G,Quaresmini C,Bevilacqua A. Down-modulation of bcl-2 sensitizes PTEN-mutated prostate cancer cells to starvation and taxanes [J]. Prostate,2014,74:1411-1422. |
| [16] | Karnak D,Xu L. Chemosensitization of prostate cancer by modulating bcl-2 family proteins [J]. Curr Drug Targets,2010,11:699-707. |
 2014, Vol. 35
2014, Vol. 35


