缺血性脑卒中是常见的脑血管病,发病率呈持续增高趋势,颅内动脉粥样硬化性狭窄与脑卒中密切相关,但确切机制尚不清楚[1, 2]。颅内动脉粥样硬化常发生于基底动脉(basilar artery,BA)及大脑中动脉(middle cerebral artery,MCA),以MCA为主,具体机制仍不明确,可能与颅内小血管血流动力学有关[3, 4, 5, 6, 7, 8]。Saam等[9]采用 1.5 T高分辨率磁共振成像(high-resolution magnetic resonance imaging,HR MRI)技术对颈内动脉粥样硬化狭窄进行管壁成像研究,成功显示了硬化斑块,取得了初步成效,但对颅内血管评估效果有限。因此,本研究尝试采用3.0 T HR MRI评估大脑中动脉M1段粥样硬化性狭窄,探讨粥样硬化性大脑中动脉狭窄的斑块分布特性及血管重构特点,并初步了解HR MRI评估颅内动脉狭窄的可能价值。
1 材料和方法 1.1 研究对象2012年2月至2013年1月在第二军医大学长海医院完成3.0 T HR MRI检查的患者,排除单纯狭窄或动脉炎及图像质量较差的患者后,选择64例确诊为大脑中动脉M1段动脉粥样硬化的患者为研究对象,其中男性44例,女性20例,年龄28~76岁,平均(60.11±11.70)岁,16例为双侧大脑中动脉M1段均有动脉粥样硬化斑块。
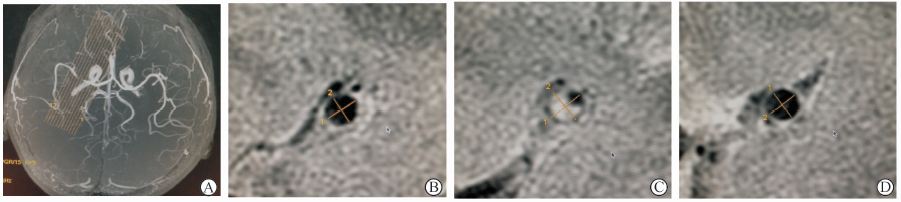
1.2 检查方法3.0 T HR MRI管壁成像使用3.0 T GE HDxt MR仪,头颅正交鸟笼式线圈,扫描范围包括颅底到胼胝体层面。三维时间飞跃法(three dimensional-time of flight,3D-TOF)采用4个薄块重叠采集,3D-TOF参数:重复时间(repetition time,TR) 29 ms,回波时间(echo time,TE) 3.4 ms,层厚 1.2 mm,层间距0.6 mm,无间距扫描,视野(field of view,FOV) 22 cm,扫描时间 287 s,扫描原始图像104层。HR MRI管壁成像以3D-TOF MRA二维图像为定位引导对大脑中动脉M1段行垂直断面扫描(图 1A)。T2快速自旋回波(T2 weighted fast spin echo,T2-FSE)序列参数:TR 2 800 ms,TE 51 ms,层厚2 mm,层间距0.5 mm,FOV 10 cm;短时间反转恢复(short time inversion recovery,STIR)序列参数:TR 3 700 ms,TE 51 ms,层厚2 mm,层间距0.5 mm,FOV 10 cm;T1快速自旋回波(T1 weighted fast spin echo,T1-FSE)序列参数:TR 580 ms,TE 20 ms,层厚2 mm,层间距0.5 mm,FOV 10 cm。
1.3 测量分析方法 1.3.1 图像分析图像质量评估标准: (1)优,管腔内外壁显示清晰; (2)良,大多数层面管腔内外壁显示清晰,极小部分层面显示不清晰; (3)中,有伪影,大部分管壁显示欠清晰; (4)差,伪影较多,管壁无法观察。前两者患者入选,后两者被排除。斑块存在与否分析:(1)正常管壁为管壁很薄、均匀或不显示;(2)斑块为偏心性、局限性管壁增厚;(3)管壁环形增厚为管壁厚度可见,>1 mm,环形。管壁环形增厚者可能为环形斑块或动脉炎,需鉴别,环形斑块管壁增厚欠均匀,连续出现在图像上的层面较少;动脉炎患者可根据病史或管壁环形均匀增厚、连续出现在图像上的层面较多进行鉴别。
1.3.2 影像评价分析(1)统计64例患者斑块所在位置及厚度。(2)拟定斑块面积比(plaque area rate)=斑块面积/斑块所在层面管腔的截面积;重构率=斑块所在层面血管的截面积/近远端正常血管面积的平均值,数值>1为正性重构,数值<1为负性重构;残腔率(residual cavity rate)=剩余管腔面积/近远端正常管腔面积的平均值(图 1B~1D)。斑块面积、 剩余管腔面积、截面积及近远端正常血管面积均测量3次取平均值。将血管近似认为是椭圆形,测量其最长径及与其垂直的短径,面积=π×长径×短径/4。所有测量均由两名具有多年工作经历且经验丰富的放射科医生在取得一致意见后共同完成。
1.4 统计学处理采用SPSS 20.0统计软件,斑块面积比与残腔率及重构率与残腔率相关性分析采用Pearson相关性检验。检验水准(α)为0.05。
|
图 1 典型病例3.0 T 高分辨率磁共振成像(HR MRI)检查(46岁,女性) A:管壁成像定位像;B:斑块近端正常血管截面积长短径的测量;C:斑块所在部位血管截面长短径的测量;D:分斑块远端正常血管截面长短径的测量 |
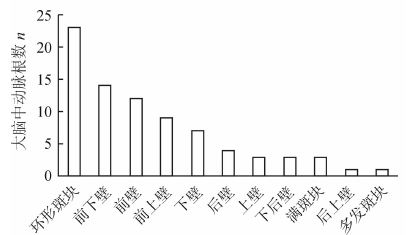
64例患者中共80根MCA发现斑块(图 2),其中环形斑块23根(28.75%),前下壁斑块14根(17.50%),前壁斑块12根(15.00%),前上壁斑块9根(11.25%),下壁斑块7根(8.75%),另有4根后壁、3根上壁、3根下后壁、1根后上壁、3根满斑块,1根MCA发现多发斑块。
|
图 2 大脑中动脉粥样硬化性狭窄斑块位置分布 |
斑块厚度分布于0.4~3.4 mm,平均(1.3±0.6) mm。大部分斑块厚度为0.5~2 mm(不包括0.5 mm),0.5~1 mm(不包括0.5 mm)者35处(43.75%),1~1.5 mm(不包括1 mm)者23处(28.75%),1.5~2 mm(不包括1.5 mm)者12处(15.00%)。详见图 3。

|
图 3 大脑中动脉粥样硬化性狭窄斑块厚度分布 |
所有患者病变血管的重构率平均为1.42±0.14;斑块面积比与残腔率负相关(r=-0.943,P=0.001),且在轻、中、重度狭窄时斑块面积比与残腔率均呈负相关;重构率与残腔率无明显相关性。详见表 1。
|
|
表 1 斑块面积比与残腔率及重构率与残腔率的Pearson相关性分析 |
亚洲人群大脑中动脉粥样硬化较白种人更易导致缺血性卒中[1, 10]。症状性大脑中动脉狭窄患者每年卒中风险为12.5%[11]。传统血管检查方法均无法观察到管壁内部结构。既往已有学者利用1.5 T HR MRI显示颈内动脉粥样硬化斑块并进行测量[9]。本研究采用3.0 T HR MRI评估颅内动脉粥样硬化斑块,能够达到更高的分辨率,取得更可靠的结果。
本组64例单侧或双侧大脑中动脉M1段的80根动脉粥样硬化斑块统计结果表明:环形斑块及前下壁斑块最多见,分别约占28.75%和17.50%。环形斑块形成的原因可能为:血管中心血流速度快,周围血流速度慢,在无分支血管的情况下,管壁任何位置的剪切力均相等,当血液中有炎性反应的时候,脂质将分散沉着在管壁的各个面上。大脑中动脉M1段血液流速相对慢,且M1段弯曲、转角大等原因造成脂质易于沉积。粥样硬化狭窄动脉斑块易于发生在与血管分叉方向相反的部位[12, 13, 14]。大脑中动脉M1段的小分支多为背侧且向上的分支,故而斑块易发生在腹侧下壁即前下壁,与本研究结果相符。
从64例患者的80个大脑中动脉M1段粥样硬化斑块厚度测量结果可以看出斑块厚度介于0.5~1 mm(不包括0.5 mm)的患者人数最多,其次为厚度1~1.5 mm(不包括1 mm)。究其原因可能为:一旦动脉内膜破裂或炎症反应形成斑块,血液中的脂质将更易沉积于斑块处,使斑块不断增大,而斑块增大到一定程度,由于其自身张力、外部血流压力尤其是斑块肩部的血流压力较大及斑块表面的剪切力使斑块容易破裂[15]。
对于动脉粥样硬化患者,管腔重构是延迟血管性事件的重要机制。随着粥样斑块的不断形成累积,病变处管腔外径逐渐扩张,以通过此机制减少血管性事件的发生。由于斑块处管腔重构,残余管腔可以与正常管径无差异[16]。这一现象在颈动脉及冠状动脉中均已被证实[17, 18]。Kiechl等[17]研究发现颈总动脉正性重构、颈内动脉负性重构,以至颈总动脉内3~4 mm斑块形成时管腔仍无明显狭窄。Glagov等[16]研究发现冠状动脉斑块面积大于40%时才会导致管腔狭窄。本研究结果表明斑块面积比与残腔率负相关,即残腔率越小时斑块面积比越大,也就是说管腔越窄时实际斑块越大,与临床实际相符。本研究测得的重构率为1.42±0.14,说明大脑中动脉粥样硬化斑块可能以正性重构为主。重构率与残腔率无明显相关,即管腔狭窄程度可能与管腔重构无明显关联,此结论仍需大样本进一步验证。
综上所述,大脑中动脉粥样硬化斑块面积比率越大,管腔越狭窄;管腔狭窄程度可能与管腔重构无关,但相关结论仍有待进一步的研究证实。3.0 T HR MRI有利于评估大脑中动脉段粥样硬化性狭窄斑块分布及管壁重构模式,值得进一步深入研究。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Suh D C,Lee S H,Kim K R,Park S T,Lim S M,Kim S J,et al. Pattern of atherosclerotic carotid stenosis in Korean patients with stroke:different involvement of intracranial versus extracranial vessels[J].AJNR Am J Neuroradiol,2003,24:239-244. |
| [2] | Suh D C,Kim J K,Choi J W,Choi B S,Pyun H W,Choi Y J,et al. Intracranial stenting of severe symptomatic intracranial stenosis:results of 100 consecutive patients[J].AJNR Am J Neuroradiol,2008,29:781-785. |
| [3] | Groen H C,Gijsen F J,van der Lugt A,Ferguson M S,Hatsukami T S,van der Steen A F,et al. Plaque rupture in the carotid artery is localized at the high shear stress region:a case report[J].Stroke,2007,38:2379-2381. |
| [4] | Groen H C,Gijsen F J,van der Lugt A,Ferguson M S,Hatsukami T S,Yuan C,et al. High shear stress influences plaque vulnerability Part of the data presented in this paper were published in Stroke 2007;38:2379-81[J].Neth Heart J,2008,16(7-8):280-283. |
| [5] | Malek A M,Alper S L,Izumo S. Hemodynamic shear stress and its role in atherosclerosis[J].JAMA,1999,282:2035-2042. |
| [6] | Suh D C,Sung K B,Cho Y S,Choi C G,Lee H K,Lee J H,et al. Transluminal angioplasty for middle cerebral artery stenosis in patients with acute ischemic stroke[J].AJNR Am J Neuroradiol,1999,20:553-558. |
| [7] | Choi J W,Kim J K,Choi B S,Kim J H,Hwang H J,Kim J S,et al. Adjuvant revascularization of intracranial artery occlusion with angioplasty and/or stenting[J].Neuroradiology,2009,51:33-43. |
| [8] | Choi J W,Kim J K,Choi B S,Lim H K,Kim S J,Kim J S,et al. Angiographic pattern of symptomatic severe M1 stenosis:comparison with presenting symptoms,infarct patterns,perfusion status,and outcome after recanalization[J].Cerebrovasc Dis,2010,29:297-303. |
| [9] | Saam T,Schoenberg S O,Hatsukami T S,Reiser M, Yuan C,Nikolaou K. High-resolution magnetic resonance imaging of carotid atherosclerotic plaque[J].Rofo,2008,180:100-111. |
| [10] | Wong K S,Huang Y N,Gao S,Lam W W,Chan Y L,Kay R. Intracranial stenosis in Chinese patients with acute stroke[J]. Neurology,1998,50:812-813. |
| [11] | Kern R,Steinke W,Daffertshofer M,Prager R,Hennerici M. Stroke recurrences in patients with symptomatic vs asymptomatic middle cerebral artery disease[J].Neurology,2005,65:859-864. |
| [12] | Klein I F,Lavallée P C,Touboul P J,Schouman-Claeys E,Amarenco P.In vivo middle cerebral artery plaque imaging by high-resolution MRI[J].Neurology,2006,67:327-329. |
| [13] | Xu W H,Li M L,Gao S,Ni J,Zhou L X,Yao M,et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J].Stroke,2011,42:2957-2959. |
| [14] | 李 珊,杨庭树,盖鲁粤,王 禹,刘宏斌. 冠状动脉分叉病变斑块分布的CT研究[J].医学影像学杂志,2010,20:1609-1613. |
| [15] | 程训民,何国祥,仝识非,冉擘力,刘建平,姚 青,等.中度狭窄病变中斑块分布对冠状动脉生物力学特性的影响[J].中国循环杂志,2004,10:335-337. |
| [16] | Glagov S,Weisenberg E,Zarins C K,Stankunavicius R,Kolettis G J. Compensatory enlargement of human atherosclerotic coronary arteries[J].N Engl J Med,1987,316:1371-1375. |
| [17] | Kiechl S,Willeit J. The natural course of atherosclerosis. Part Ⅱ:vascular remodeling.Bruneck Study Group[J].Arterioscler Thromb Vasc Biol,1999,19:1491-1498. |
| [18] | Clarkson T B,Prichard R W,Morgan T M,Petrick G S,Klein K P.Remodeling of coronary arteries in human and nonhuman primates[J].JAMA,1994,271:289-294. |
 2014, Vol. 35
2014, Vol. 35


