睡眠K复合波(K-complex,KC)是睡眠特有的脑波。早在1939年,Loomis等首次报告:在睡眠中,外部刺激能诱发一个很大波幅的脑波,在脑电图(electroencephalography,EEG)上能明显观察到,他们将其命名为KC。长久以来,尽管KC是生理学和睡眠医学的一个重要研究课题,但关于其功能与作用一直存有争议,主要有两种观点:一种观点认为KC是非快速眼动(non-rapid eye movement,NREM)睡眠中脑对内部或外部刺激的觉醒反应,另一种观点认为KC是保护性反应[ 1 ]。自KC首次报道以来,70多年来仍存在诸多未解问题。如,若KC是觉醒反应,为何又与δ波规律类似?若是保护反应,为何出现自主神经及肌肉活动,以及对外部刺激敏感?既然对外部刺激敏感,为何头皮分布与清醒时感官刺激的头皮分布又截然不同?作为睡眠微观结构,KC的深入研究对睡眠的生理机制、睡眠障碍、认知活动等探索有着重要意义。
1 KC的性质KC是人脑EEG上的最大成分,可用肉眼清楚地观察和分辨,出现在NREM中的第Ⅱ、Ⅲ、Ⅳ期。其一般由2个波组成:一个很大的负波和一个小的正波,持续时间大于0.5 s,平均约0.63 s,最小的峰值不低于100 μV,最大不超过400 μV,其出现频率一般为0.7~3.2个/min,且随着年龄的增加波幅降低、出现率降低[ 2,3 ]。KC既可以自发出现,也可以因外部刺激而出现,外部刺激可以是听觉、触觉、痛觉等。至于自发KC,目前倾向于认为是躯体内部刺激引起的,如短暂呼吸阻塞、血压波动、心率变异等。外部刺激可以诱发KC,但不是所有的外部刺激均可诱发KC,这与刺激的强度、出现的频率等有关,也与刺激出现的时间间隔有关。KC与睡眠另一种特有脑波——梭形波(spindle)有着密切联系[ 4,5 ]。通过对自发或诱发的KC进行叠加和平均后,相应的事件相关电位(event related potentials,ERP)成分为N550,峰值约在刺激呈现后500~600 ms。在EEG上,无论是自发的还是诱发的KC均在额叶部位波幅最大。研究表明,不管是听觉刺激、呼吸刺激抑或其他刺激,均是如此,无模式特异性[ 6 ]。至于ERP成分N550,在ERP和 脑磁图(magnetoencephalography,MEG)的研究中表明, 其主要分布在额叶及额中央区,且两侧对称[ 7 ]。诸多研究表明,KC起源于广泛的皮质网络,对应的是非特异性丘脑-皮质系统[ 8 ]。Caporro等[ 9 ]运用EEG与磁共振(magnetic resonance imaging,MRI)同时记录,发现KC对应于初级感觉皮质的广泛激活。Colrain等[ 3 ]同样运用EEG和MRI发现,相对于皮质下结构,皮质结构对KC的产生具有更为重要的作用。Wennberg等[ 10 ]在癫 患者身上运用颅内EEG,发现KC最大幅度对应的颅内区域是前额中线区域,在扣带回上部和颞下回侧部则出现翻转,翻转始于额叶皮质白质。这种翻转表明KC的发生源位于额叶皮质前端浅表部位。新近Wennberg等[ 11 ]运用脑电图源成像(EEG source imaging,ESI)和磁源成像(magnetic source imaging,MSI),没有发现单个和平均KC的有生理意义的发生源,也没有发现与颅内电极记录一致的发生源。
2 KC的功能
KC自其首次发现就被认为很难解释其产生根源和作用[ 6 ],关于KC功能的争论自20世纪50年代末期开始,迄今尚未停止。有两种观点,一种是保护和维持睡眠,另一种是唤醒睡眠脑以应对外部刺激。下面分别阐述。 2.1 保护功能
持睡眠保护功能观点的研究者认为,KC是睡眠的自我保护性反应,当外部刺激作用于皮质和皮质下结构时,睡眠本身试图将这种干扰最小化以保护睡眠的连续性。持睡眠保护和维持功能观点的证据主要来自两方面:一是KC活动规律与δ波相似。δ波是睡眠重要的微观成分,与睡眠质量有直接联系,因此KC是保护和维持睡眠;另一方面的证据是KC出现与不出现时脑波频率不同,当KC出现时慢波增加、快波减少,而当KC不出现时快波增加。
2.1.1 KC类似δ波的规律KC类似δ波的规律较多。δ波反映EEG的同步化,由丘脑-皮质神经元点射(burst-firing)后超极化(hyperpolarization)产生,或由皮质神经元独立于丘脑的点射产生,而KC也是一种同步化脑波,属于δ波频段。年龄、皮质灰质、睡眠质量、乙醇中毒、催眠药物、镇静药物及睡眠障碍等对δ波均具有一定的影响,导致慢波睡眠(slow wave sleep,SWS)变化,KC也出现相应的变化。Nicholas等[ 12 ]实验发现,经过两晚的片段睡眠后,在第三晚的恢复性睡眠中,SWS增加,睡眠效率提高,刺激相关的α活动减少,相对于基线夜晚诱发KC和自发KC数量显著增加;还发现N550幅度显著增大、潜伏期显著缩短。Peszka等[ 13 ]进行的睡眠剥夺实验表明,经过整晚的睡眠剥夺,在随后的恢复性睡眠中N350、N550、P900均增大,P220无变化,顶尖波(vertex sharp wave,VSW)和KC数量均增加。Nicholas等[ 14 ]的另一项研究发现,与正常被试相比,老年人和酗酒者的睡眠中,自发的和诱发的KC出现数量均减少,幅度降低,与δ波的降低规律相同。Colrain等[ 2 ]的研究表明,随着年龄的增加,N550幅度降低,诱发KC的数量减少。随后,他们运用EEG和MRI研究灰质、年龄、性别和酒精中毒对诱发KC的影响,发现随年龄的增加,N550幅度呈线性递减,约每10年递减14.5 μV;灰质、性别和酒精中毒都对N550幅度有显著影响[ 3 ]。他们认为皮质体积对KC波幅具有重要作用,诱发KC是反映脑龄的一个敏感指标[ 2 ]。Wauquier等[ 15 ]比较了正常人与癫 、抑郁、嗜睡和睡眠呼吸暂停患者的自发KC,他们抽取NREMⅡ前5 min和后5 min的KC进行统计分析,发现这些遭受睡眠问题困扰的患者的KC数量较正常人明显减少。Czisch等[ 16 ]研究在NREM呈现刺激时,KC和δ波与血氧水平依赖(blood oxygenation level dependence,BOLD)的关系,发现KC和δ波出现时,BOLD信号降低。他们也认为这是NREM睡眠的一种保护性机制,当外部刺激作用于大脑时,大脑皮质自动去活化,从而保护睡眠[ 16 ]。有研究报道缬草(valerian,具有镇静作用)对睡眠质量差者在提高SWS的同时提高了KC的密度;佐匹克隆(zopiclone,一种安眠药)在降低SWS的同时也降低了KC出现的频率[ 6 ]。
上述KC类似δ波规律的实验结果基本一致,即KC的密度、波幅等增减现象以及频段与δ波相同。但这仅仅是表象,若KC与δ波同质,即它们拥有同样的产生机制,方能真正证实其睡眠保护与维持功能。至于KC与δ波是否同质,尚需进一步研究。
2.1.2 KC与其他脑波的关系KC出现与不出现时脑波频率不同, 由此说明,KC具有睡眠保护功能,其原理如下: 不同节律的脑波对应不同的清醒状态,如清醒时出现β波,思睡时出现α波,困顿时出现θ波,深睡时出现δ波。因此,分析KC出现前后的EEG频率成分,若快波增加(θ波、α波、β波),则KC与觉醒相关,若慢波(δ波)增加,则KC与睡眠保护有关。按美国睡眠医学科学院(American Academy of Sleep Medicine,AASM)的定义,EEG由慢波转变为去同步化快波即可判定为皮质觉醒。Bastien等运用听觉刺激诱发KC,将能诱发出KC和不能诱发出KC的前后脑电(各8 s)进行分类分析,发现诱发KC前后脑电没有改变,而没有诱发KC的脑电出现α波、β波的功率谱增加。他们认为听觉刺激没能诱发KC时引起了SWS的微觉醒,但诱发出KC时则这种微觉醒不会出现[ 17 ]。 Forget等研究了自发与诱发KC前后1 s脑电。诱发KC分析听觉刺激呈现前1 s以及KC出现后1 s的EEG,自发KC分析按负相位峰值潜伏期对齐后进行分析,发现无论是自发还是诱发KC,在紧随的EEG的功率谱中均出现δ波增加,θ波、α波、β波减少;而刺激呈现但没有诱发出KC时,则这种随后EEG功率谱的改变不会出现。他们认为这反映了KC的睡眠保护功能[ 18 ]。
上述两个实验结果有点区别,第一个表明KC不出现时快波增加,而出现时不变;第二个表明KC不出现时不变,而出现时慢波增加。这也许与数据分析方法有关,前者取的是KC前后8 s,后者是1 s。不过,此睡眠保护证据也需进一步研究,因为实验结果如此不一致,如Halasz与Ujsziszi发现KC出现后10 s的各频段功率均升高,10 s后又下降回到原始水平[ 19 ]。
2.2 唤醒功能持唤醒功能的研究者认为,KC是睡眠过程中睡眠脑对内部或外部刺激的一种反应,此反应主要作用为唤醒睡眠脑,促使个体醒来应对刺激。KC为唤醒功能的证据也主要来自两方面:一是KC与自主神经活动及肌肉活动有着紧密联系。一般认为,上述活动意味着觉醒,所以KC是觉醒性反应。二是睡眠脑可进行信息加工,诸多睡眠的ERP实验结果可表明睡眠中人脑对外部信息进行了一定程度的处理和加工。 2.2.1 KC与自主神经系统和肌肉活动
觉醒反应一个强有力的证据是KC与自主神经活动、肌肉活动甚至肢体运动有着紧密联系。研究表明,KC伴随着心率的增加、血压的增加及皮肤交感神经活动的增加、皮肤电反应增强等[ 6 ]。此外,KC与心脏活动有密切联系,有研究发现KC出现在心电P波250~650 ms之后,与R波关系相当密切[ 20 ]。Okada等[ 21 ]检测睡眠中胫骨交感神经肌肉活动(muscle-nerve activity,MSA),发现自发KC出现在MSA之后,而诱发KC出现在轻轻拍打胫骨之后[ 21 ]。Hornyak等研究了睡眠中的MSA,发现在NREMⅡ期,KC伴随着MSA短时持续增长,且与大脑皮质激活同时出现。他们认为KC相关的MSA增加是一种觉醒信号,引起EEG的变化和大脑交感神经中枢的激活[ 22 ]。Montplaisir等比较了正常人与不宁腿综合征患者在接受左旋多巴治疗前后的KC、K-α事件。在治疗前,不宁腿综合征的患者在KC数量上与正常人一样,但K-α比正常人显著增多 (37.2±4.3 vs 11.3±0.7),K-α事件中有47.8%的出现在腿动前后2 s,其中有三分之二出现在腿动之后。在经过左旋多巴治疗之后,不宁腿综合征患者的KC、K-α事件减少了,与正常人无异[ 23 ]。
KC与外周交感神经激活(MSA增加)、心率增加、血压升高乃至肢体运动等相联系是毋庸置疑的。也许MSA增加、心率增加、血压升高等变化仅仅是一种刺激,而正是因为这些刺激,引发了KC。到底是KC的出现导致觉醒,还是所谓的“觉醒”导致了KC的产生,抑或KC仅仅是对这些刺激的一种皮质反应,而这种反应(大量皮质神经元的同步爆发)保护皮质免于真正地觉醒。
2.2.2 KC与睡眠信息加工觉醒反应的另一方面的证据是睡眠过程中的信息加工。人能因叫唤而从睡眠中醒来,表明人脑在睡眠中对外部环境的感知和分析是必须的。尽管睡眠中信息处理能力降低,但还是能够与外界保持联系、处理外部信息的。诸多ERP研究表明,在睡眠中ERP常规成分N1、MMN、P300、N400等均可诱发,表明睡眠中人脑对外部刺激保持觉察,也说明睡眠中人脑对外部信息进行了一定程度的处理和加工[ 24 ]。至于N350和N550,均为睡眠特有ERP成分,其机制和作用目前尚未完全弄清,但既然它们也是由外部刺激所诱发,应是睡眠中人脑觉察和处理外部信息的标志。
N350的波幅主要受刺激的内在含义影响,尽管刺激的强度、新异性和刺激的概率对其也有影响。Perrin 等[ 25 ]发现,当被试自己的名字和等概率的其他名字呈现时,N350出现更大的波幅,提出N350是睡眠过程中人脑参与外部信息处理的表现。此外,N350的出现伴随着VSW,因此许多研究者认为N350与VSW关系密切。N350与N550同为睡眠特有ERP成分,它们之间有何关系呢?相当多的研究表明N550未出现时N350也可诱发。Bastien等[ 17 ]发现,当N350后面紧跟着N550时其波幅更大。不由得令人假设N350是N550的前奏。但Gora等[ 26 ]的研究表明,N350的波幅是独立于N550的出现的。N350的出现伴随着VSW,而N550的出现伴随着KC。总之,这些研究表明N350和N550反映了睡眠中信息处理的不同加工过程。Colrain等用3种不同频率的纯音诱发KC,其中1 000 Hz为标准刺激(占60%),2 000 Hz为目标刺激(占20%),500 Hz为标准刺激(占20%),发现在NREM Ⅱ期,目标刺激和偏差刺激诱发的N550幅度明显大于标准刺激[ 27 ]。至于N550波幅是否反映有意义刺激,目前尚无一致意见。如Franzen等研究了战争创伤后 应激综合征患者(post-traumatic stress disorder,PTSD)的诱发KC情况,PTSD患者在诱发KC的数量上明显低于正常组,但枪炮声诱发的N550幅度未见与正常人有明显差异[ 28 ]。
3 KC理论模型 3.1 模型描述KC到底是睡眠的保护性反应还是觉醒性反应,现结合文献整合出KC功能模型。如图 1所示,内部或外部刺激经感觉通道进入大脑后先进行初级加工(ERP成分N1、MMN等),然后再进行深度加工(ERP成分P300、N400、N350、N550等),也就是对刺激的意义及重要性进行评估。由前述睡眠的信息加工研究可得知,睡眠中存在一个睡眠信息评估中枢机制。依据刺激的意义和对个体的重要性,评估后的结果基本分为以下三类:很重要(导致直接觉醒,从睡眠中醒来)、重要(出现唤醒征兆,即出现自主神经活动、肌肉活动甚至肢体运动)、不重要(无唤醒征兆)。睡眠脑对刺激进行信息加工,至于能否产生KC,则依赖于当时的大脑状态。脑状态由3种节律决定,即睡眠周期、中枢振荡、皮质振荡(图 1中用正弦波表示,实际上非正弦,仅仅示意周期)。其中睡眠周期与KC的密度和幅度有关,中枢振荡决定KC是否出现,皮质振荡决定KC密度。在这3种节律的不同组合下,大脑就会出现有皮质反应(有KC)或无皮质反应(无KC)两种情况。无KC现象直接被大脑忽略,而有KC又结合睡眠信息评估系统所得出重要程度的不同,出现前述2种不同的反应。
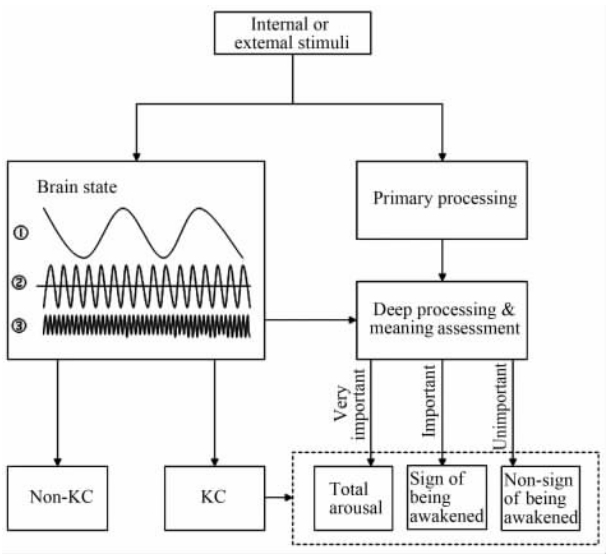 | 图 1 睡眠K复合波功能模型Fig 1 The functional model of K-complex during sleep1: Sleep cyclic; 2: Central oscillation; 3: Cortical oscillation; KC: K-complex |
睡眠周期与KC的密度和幅度有关。人的睡眠自NREMⅠ期由浅入深至Ⅳ期,直到快速眼动(rapid eyes movement,REM)睡眠,再由REM睡眠至NREMⅠ或Ⅱ期,如此循环,一晚上约5~6个循环。KC与这种周期性的循环有何关系呢?研究发现,KC密度随着循环的递进,从夜间到早晨逐渐减少。Kurella等将NREMⅡ期分成以下3种类型:即从NREMⅠ到NREMⅡ、从NREMⅡ到NREMⅢ、从REM到NREMⅡ。他们发现,诱发KC出现的概率在第2种类型时最高,在第3种类型时最低,随着睡眠的第一个周期到最后一个周期逐渐降低,并且睡眠循环周期的下降沿(睡眠加深)所出现的KC幅度大于上升沿(睡眠变浅)出现的幅度[ 29 ]。Geunaro等的研究也发现,NREMⅡ到NREMⅢ,KC密度增加,而REM到NREMⅡ,KC密度不变。在整晚的睡眠周期中,KC密度逐渐降低,KC的间隔逐渐延长,据此,他们认为KC在丘脑-皮质同步化导致δ波睡眠的过程中具有重要作用,是δ波的前奏[ 30 ]。
3.2.2 中枢振荡模型中提及的中枢振荡指的是脑中存在一个中枢自主网络,包括皮质、下丘脑、低级脑干,这个网络负责调节内脏运动、神经内分泌以及对外部环境的反应等[ 31 ],产生一种固有振荡。如Lagaresi等[ 32 ] 描述了NREM睡眠中的血压(blood pressure,BP)振荡,他们称之为迈耶波(Mayer waves,MW),MW的周期约15~30 s。此外,心率、周期性肢动、脑电觉醒等都存在一种节律。这种节律是否产生于上述网络,尚需进一步研究。Kohsaka等研究发现,在KC出现之前脑干腹侧出现激活,且这种激活领先于KC约1 s。在这段时间内,脑干腹侧的激活通过上行网状激活系统(ascending reticular activating system,ARAS)传递到大脑皮质,导致皮质的激活。这说明KC与上述网络关系密切[ 33 ]。Monstad和Guilleminault发现,BP下降沿与KC的出现具有密切联系。无论是自发还是诱发KC,均出现在BP的下降沿,从不出现在上升沿。据此,他们认为BP的下降沿给KC的出现提供了一个“窗口”[ 34 ]。这也许能解释为何不是所有的外部刺激都能诱发KC。KC出现后,BP立即上升,这种上升具有一定规律的延迟,且KC在不同的下降沿位置出现引起的BP上升幅度不同,下降沿位置越深则BP上升越高。 有许多关于KC的研究发现,KC伴随着心率、呼吸、血压等的改变,这也许与KC出现在中枢振荡的不同下降沿位置有关[ 6, 7, 29 ]。
3.2.3 皮质振荡有研究认为KC与一个极低频率(0.6~0.9 Hz)的皮质神经元振荡有关,在麻醉患者及睡眠EEG和肌电图(electromyography,EMG)上可观察到这种极低频率的振荡[ 35 ]。这种振荡通过影响皮质兴奋性的变化,从而产生KC电位。对大脑皮质、丘脑皮质、丘脑网状结构同时进行颅内记录发现,这种振荡表现为神经元膜电位在两种电压水平间周期性的波动:去极化(depolarization)和超极化。这两种相位对应于双相位KC的2个成分,去极化对应KC的正成分,超极化对应KC的负成分。Cash等[ 36 ]认为在慢波睡眠中,皮质神经元呈现2种稳定的状态:激活态——膜电位去极化引起的高频动作电位以及静息态——膜电位超极化引起静息电位,而KC对应于这种静息态 。KC与皮质振荡的关系,也许如同α波、β波节律,KC属于一种大脑固有节律,只不过在中枢振荡的调控下,出现比较零散。随着睡眠的加深,由于神经元膜电位的固有特性,这种低频振荡逐渐规则化也更快(接近1 Hz),以致在NREMⅢ、Ⅳ期,大部分KC都由δ波组成[ 35 ]。这可以解释为何睡眠循环周期的下降沿(睡眠加深)所出现的KC密度大于上升沿(睡眠变浅)出现的密度。
3.3 KC是脑状态的反映从模型来看,无论自发KC还是诱发KC,既不是睡眠的保护性反应,也不是觉醒性反应,而是在刺激作用下的一种脑状态的反映。从进化学的观点来看,人的睡眠必须时刻对外部环境的变化保持警觉,不然无法在人类早期进化的恶劣环境中生存下来。刺激是唤醒人脑还是继续保护睡眠,这与刺激的性质和睡眠脑的状态有关。人脑在睡眠中对外部环境仍能感知和分析,进行信息处理,与外界保持联系。研究也已表明,在睡眠过程中人脑对外部信息进行一定程度的处理和加工是完全可能并确实存在的[ 24 ]。 人在睡眠中又不能时刻被外部刺激所唤醒,否则人的睡眠得不到保障,也无法生存。所以,人脑也需要一种对刺激的缓冲机制,无关的、意义不重大的刺激均被缓冲机制所吸纳,KC也许是这样一个睡眠过程中对刺激进行缓冲的人脑产物。从诸多实验结果来看,KC既像保护睡眠又像唤醒睡眠,但实际上,这只是一种表象。前述模型及其机制的探讨表明,KC只是睡眠脑对外部或内部刺激引起的一种脑状态的反映。
4 小 结KC作为EEG上最大的脑波,是睡眠脑电的重要组成部分,也是睡眠分期的重要依据。自其发现伊始,就受到生理学、心理学和睡眠医学的高度关注,其脑定位、产生机制、功能与各种睡眠障碍的关系等,仍然存在诸多争论[ 37 ]。KC可以反映刺激的出现、脑龄的变化、睡眠质量[ 38 ],也可以反映睡眠障碍[ 39,40 ],甚至可以反映认知功能的好坏[ 41,42 ],但归根结底,KC是刺激引起的一种脑状态的反映。随着神经科学的发展和睡眠研究的深入,KC不仅仅是反映脑状态的窗口,因其独特属性,更可能是反映脑高级功能的窗口。
5 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Kokkinos V,Koupparis A M,Kostopoulos G K.An intra-K-complex oscillation with independent and labile frequency and topography in NREM sleep[J].Front Hum Neurosci,2013,7:163. |
| [2] | Colrain I M,Crowley K E,Nicholas C L,Afifi L,Baker F C,Padilla M,et al.Sleep evoked delta frequency responses show a linear decline in amplitude across the adult lifespan[J].Neurobiol Aging,2010,31:874-883. |
| [3] | Colrain I M,Sullivan E V,Rohlfing T,Baker F C,Nicholas C L,Padilla M L,et al.Independent contributions of cortical gray matter,aging,sex and alcoholism to K-complex amplitude evoked during sleep[J].Sleep,2011,34:787-795. |
| [4] | Kokkinos V,Kostopoulos G K.Human non-rapid eye movement stage Ⅱ sleep spindles are blocked upon spontaneous K-complex coincidence and resume as higher frequency spindles afterwards[J].J Sleep Res,2011,20(1 Pt 1):57-72. |
| [5] | Koupparis A M,Kokkinos V,Kostopoulos G K.Spindle power is not affected after spontaneous K-complexes during human NREM sleep[J].PLoS One,2013,8:e54343. |
| [6] | Colrain I M,Campbell K B.The use of evoked potentials in sleep research[J].Sleep Med Rev,2007,11:277-293. |
| [7] | Colrain I M.The K-complex: a 7-decade history[J].Sleep,2005,28:255-273. |
| [8] | Jahnke K,von Wegner F,Morzelewski A,Borisov S,Maischein M,Steinmetz H,et al.To wake or not to wake? The two-sided nature of the human K-complex[J].Neuroimage,2012,59:1631-1638. |
| [9] | Caporro M,Haneef Z,Yeh H J,Lenartowicz A,Buttinelli C,Parvizi J,et al.Functional MRI of sleep spindles and K-complexes[J].Clin Neurophysiol,2012,123:303-309. |
| [10] | Wennberg R.Intracranial cortical localization of the human K-complex[J].Clin Neurophysiol,2010,121:1176-1186. |
| [11] | Wennberg R,Cheyne D.On noninvasive source imaging of the human K-complex[J].Clin Neurophysiol,2013,124:941-955. |
| [12] | Nicholas C L,Trinder J,Colrain I M.Increased production of evoked and spontaneous K-complexes following a night of fragmented sleep[J].Sleep,2002,25:882-887. |
| [13] | Peszka J,Harsh J.Effect of sleep deprivation on NREM sleep ERPs and related activity at sleep onset[J].Int J Psychophysiol,2002,46:275-286. |
| [14] | Nicholas C L,Sullivan E V,Pfefferbaum A,Trinder J,Colrain I M.The effects of alcoholism on auditory evoked potentials during sleep[J].J Sleep Res,2002,11:247-253. |
| [15] | Wauquier A.Aging and changes in phasic events during sleep[J].Physiol Behav,1993,54:803-806. |
| [16] | Czisch M,Wehrle R,Kaufmann C,Wetter T C,Holsboer F,Pollmächer T,et al.Functional MRI during sleep: BOLD signal decreases and their electrophysiological correlates[J].Eur J Neurosci,2004,20:566-574. |
| [17] | Bastien C H,Ladouceur C,Campbell K B.EEG characteristics prior to and following the evoked K-Complex[J].Can J Exp Psychol,2000,54:255-265. |
| [18] | Forget D,Morin C M,Bastien C H.The role of the spontaneous and evoked k-complex in good-sleeper controls and in individuals with insomnia[J].Sleep,2011,34:1251-1260. |
| [19] | Halasz P,Ujsziszi J.Spectral features of evoked micro-arousals[M]// Terzano M G,Halasz P,Declerck A C.eds.Phasic events and dynamic organization of sleep.New York: Raven Press,1991: 85-100. |
| [20] | Fruhistorfer H,Partanen J,Lumio J.Vertex sharp waves and heart action during the onset of sleep[J].Electroencephalogr Clin Neurophysiol,1971,31:614-617. |
| [21] | Okada H,Iwase S,Mano T,Sugiyama Y,Watanabe T.Changes in muscle sympathetic nerve activity during sleep in humans[J].Neurology,1991,41:1961-1966. |
| [22] | Hornyak M,Cejnar M,Elam M,Matousek M,Wallin B G.Sympathetic muscle nerve activity during sleep in man[J].Brain,1991,114 (Pt 3):1281-1295. |
| [23] | Montplaisir J,Boucher S,Gosselin A,Poirier G,Lavigne G.Persistence of repetitive EEG arousals (K-alpha complexes) in RLS patients treated with L-DOPA [J].Sleep,1996,19:196-199. |
| [24] | 彭小虎,彭聃龄,王国锋.睡眠过程中自动信息加工的ERP研究进展[J].心理科学,2006,29: 130-132. |
| [25] | Perrin F,García-Larrea L,Mauguière F,Bastuji H.A differential brain response to the subject’s own name persists during sleep[J].Clin Neurophysiol,1999,110:2153-2164. |
| [26] | Gora J,Colrain I M,Trinder J.The investigation of K-complex and vertex sharp wave activity in response to mid-inspiratory occlusions and complete obstructions to breathing during NREM sleep[J].Sleep,2001,24:81-89. |
| [27] | Colrain I M,Di Parsia P,Gora J.The impact of prestimulus EEG frequency on auditory evoked potentials during sleep onset[J].Can J Exp Psychol,2000,54:243-254. |
| [28] | Franzen P L,Woodward S H,Bootzin R R,Germain A,Colrain I M.K-complexes are not preferentially evoked to combat sounds in combat-exposed Vietnam veterans with and without post-traumatic stress disorder[J].Int J Psychophysiol,2012,83:393-398. |
| [29] | Kurella B.The probability of eliciting K-complexes during sleep.Is there a possibility to use this parameter for sleep estimation? [J].Jour Sleep Res,1992,1(S1):1. |
| [30] | De Gennaro L,Ferrara M,Bertini M.The spontaneous K-complex during stage 2 sleep: is it the 'forerunner’ of delta waves?[J].Neurosci Lett,2000,291:41-43. |
| [31] | Benarroch E E.The central autonomic network: functional organization,dysfunction,and perspective[J].Mayo Clin Proc,1993,68:988-1001. |
| [32] | Lugaresi E,Coccagna G,Mantovani M,Lebrun R.Some periodic phenomena arising during drowsiness and sleep in man[J].Electroencephalogr Clin Neurophysiol,1972,32:701-705. |
| [33] | Kohsaka S,Sakai T,Kohsaka M,Fukuda N,Ariga T.Activation of the brainstem precedes and outlasts the K-complex in humans[J].Neuroscience,2012,202:243-251. |
| [34] | Monstad P,Guilleminault C.Cardiovascular changes associated with spontaneous and evoked K-complexes[J].Neurosci Lett,1999,263(2-3):211-213. |
| [35] | Buzsáki G,Draguhn A.Neuronal oscillations in cortical networks[J].Science,2004,304:1926-1929. |
| [36] | Cash S S,Halgren E,Dehghani N,Rossetti A O,Thesen T,Wang C,et al.The human K-complex represents an isolated cortical down-state[J].Science,2009,324:1084-1087. |
| [37] | Bastien C H,St-Jean G,Turcotte I,Morin C M,Lavallée M,Carrier J,et al.Spontaneous K-complexes in chronic psychophysiological insomnia[J].J Psychosom Res,2009,67:117-125. |
| [38] | Moser D,Kloesch G,Fischmeister F P,Bauer H,Zeitlhofer J.Cyclic alternating pattern and sleep quality in healthy subjects--is there a first-night effect on different approaches of sleep quality?[J].Biol Psychol,2010,83:20-26. |
| [39] | El Helou J,Navarro V,Depienne C,Fedirko E,LeGuern E,Baulac M,et al.K-complex-induced seizures in autosomal dominant nocturnal frontal lobe epilepsy[J].Clin Neurophysiol,2008,119:2201-2204. |
| [40] | Si Y,Liu L,Li Q,Mu J,Tian L Y,Chen J N,et al.Features of the K-complex waves in refractory nocturnal frontal lobe epilepsy[J].Epilepsy Res,2010,92(2-3):219-25. |
| [41] | Parrino L,Ferri R,Bruni O,Terzano M G.Cyclic alternating pattern (CAP): the marker of sleep instability[J].Sleep Med Rev,2012,16:27-45. |
| [42] | Ramakrishnan M,Sartory G,van Beekum A,Lohrmann T,Pietrowsky R.Sleep-related cognitive function and the K-complex in schizophrenia[J].Behav Brain Res,2012,234:161-166. |
 2014, Vol. 35
2014, Vol. 35


