2. 北京军区联勤部药品仪器检验所中药室, 北京 100071
2. Division of Traditional Chinese Medicine Testing, Institute for Drug and Instrument Control, The Joint Logistics Department, PLA Beijing Military Area Command, Beijing 100071, China
易卒中的自发性高血压大鼠(stroke-prone spontaneously hypertensive rats,SHRSPs)是从自发性高血压大鼠(spontaneously hypertensive rats,SHRs)中通过选择性交配,再经继代近亲繁殖培育而成[ 1 ]。该品系的大鼠脑卒中的发生率在90%以上,因此SHRSPs被广泛用于高血压诱导脑卒中的发生发展机制研究。目前,已有很多传统药物被证实具有心血管保护作用,可在一定程度上减轻脑血管病变的严重程度[ 2,3 ]。
牛樟芝(Antrodia cinnamomea)又名牛樟菇,属于非褶菌目、多孔科、多年生蕈菌类,主要含有多糖体、三萜类化合物、腺苷等多种生理活性成分。已有研究证实牛樟芝具有免疫调节、抗肿瘤、抗血栓等多种生物学活性[ 4,5,6 ]。牛樟芝体内含有的三萜类化合物能有效抑制血管紧张素的活性,发挥降血压作用。此外,有学者发现牛樟芝抗炎、抗血小板聚集、抗氧化活性与其体内含有的多糖类物质有关[ 7 ]。因此,牛樟芝可能对易发脑卒中的高血压患者具有潜在的防治效应,而目前并无相关报道。 本研究旨在明确长期服用牛樟芝对 SHRSPs是否具有保护作用,能否延长SHRSPs的生存时间,并进一步运用蛋白质组学方法对其机制进行探讨。
1 材料和方法1.1 药物、动物及试剂药物牛樟芝于2012年8月购自宏潮生物健康科技推广中心,并经解放军302医院药学部临床药理研究室黄正明教授鉴定。SHRSPs购自上海斯莱克实验动物有限公司,动物许可证号: SCXK(沪)2009-0015。Wistar Kyoto(WKY) 大鼠(雄性,180~220 g)购自军事医学科学院动物中心,动物许可证号: SCXK-(军)-2007-004。 固相pH梯度干胶条(IPG strip pH 3~10,17 cm,Bio-Rad 公司),尿素(Sigma公司),硫脲(Sigma公司),3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS,Amresco公司),两性电解质(Bio-Lyte,Bio-Rad公司),矿物油(Bio-Rad公司),二硫苏糖醇(dithiothreitol,DTT;Merk公司),Tris-HCl(上海增健生物科技有限公司),十二烷基苯磺酸钠(sodium dodecyl sulfonate,SDS;Bio-Rad公司),碘乙酰胺(Bio-Rad公司),过硫酸铵(ammonium persulfate,AP; Bio-Rad公司),40%丙烯酰胺甲叉双丙烯酰胺配胶液为291(上海增健生物科技有限公司),四甲基二乙胺(N,N,N′,N′-tetramethylethylenediamine,TEMED; Sigma公司)。谷胱甘肽巯基转移酶(glutathione S-transferase,GST)抗体和超氧化物歧化酶(superoxide dismutase,SOD)抗体均购自Santa Cruz公司。 总抗氧化能力(T-AOC)检测试剂盒、GST活性检测试剂盒、SOD活性检测试剂盒以及丙二醛 (malondialdehyde,MDA)检测试剂盒均购自南京建成生物工程研究所。
1.2 仪器设备Eppendorf冷冻离心机、等电聚焦电泳仪、垂直电泳仪、凝胶成像扫描仪购自Bio-Rad公司,Odyssey 红外激光成像系统购自LI-COR公司。
1.3 动物分组80只SHRSPs(5月龄,雄性)随机分为对照组和牛樟芝给药组,每组40只。牛樟芝给药组采用灌胃治疗,剂量为150 mg/kg,连续给药,每天1次,观察并记录大鼠的死亡时间。
另外再取6只SHRSPs(5月龄,雄性)随机分为对照组和牛樟芝给药组,每组3只。牛樟芝给药组采用灌胃治疗,剂量为150 mg/kg,连续给药,每天1次,连续90 d。用3只WKY大鼠作为正常对照。 实验结束后取脑组织进行二维电泳。
1.4 蛋白质抽提及蛋白浓度测定处死大鼠,取全脑,置于冰冷的PBS中洗净血液,然后放入预冷的匀浆管中加入5 mL蛋白提取液(裂解液),冰上匀浆至无肉眼可见的组织块。冰上孵育40 min。4℃ 10 000×g 离心20 min,取上清。运用2-D Quant试剂盒进行浓度测定。具体步骤见参考文献[ 8 ]。
1.5 电泳第一向等电聚焦电泳(IEF)程序:30 V 6 h,60 V 6 h,100 V 1 h,200 V 1 h,500 V 1 h,1 000 V 1 h,1 000~8 000 V 30 min,8 000 V 7.5 h。
在等电聚焦电泳结束时,将胶条在平衡液Ⅰ和Ⅱ中分别平衡14 min,再进行垂直电泳。第二向电泳程序: 80 V 30 min,280 V 4 h。电泳结束后进行银染,所有步骤均在摇床上进行。凝胶图像分析用Molecular Image Fx 激光图像扫描仪扫描,两组间的差异点比较采用PDQuest 6.0软件完成。
1.6 差异蛋白点的鉴定将有显著差异的蛋白点进行质谱鉴定,采用MALTI-TOF-TOF(二级串联质谱)技术,质谱流程见参考文献[ 9 ]。 用蛋白质印迹法对有差异的蛋白点进行重复验证。按文献 [ 9 ]介绍的步骤,依次进行上样、电泳(80 V 30 min,120 V 2~3 h)、转膜(100 V 60 min)、封闭(5%脱脂奶粉,37℃ 1 h)、一抗孵育(室温,3 h)、二抗孵育(室温,1 h),然后扫描(参数设置:激发光波长为700 nm,800 nm;分辨率84 μm)。
1.7 氧化应激指标检测GST活性、SOD活性、MDA水平以及T-AOC检测采用南京建成生物工程研究所的相关试剂盒检测。在岛津UV-265双光道紫外分光光度计上测定光密度,并根据说明书上的公式计算相应指标。
1.8 统计学处理实验数据应用SPSS 11.0统计软件进行分析,计量资料以x±s表示,组间比较采用t检验。生存分析时,生存时间以中位生存时间表示,生存率的非参数估计法采用Kaplan-Meier法,生存曲线的比较采用Log-rank检验。检验水准(α)为0.05。
2 结 果2.1 长期服用牛樟芝对SHRSPs生存曲线的影响
从图 1可以看出,与未服药的SHRSPs大鼠相比,在长期服用牛樟芝后SHRSPs因发生脑卒中导致死亡的时间延后(P<0.05)。表明牛樟芝对SHRSPs具有保护作用,长期服用牛樟芝可以延长SHRSPs的寿命。
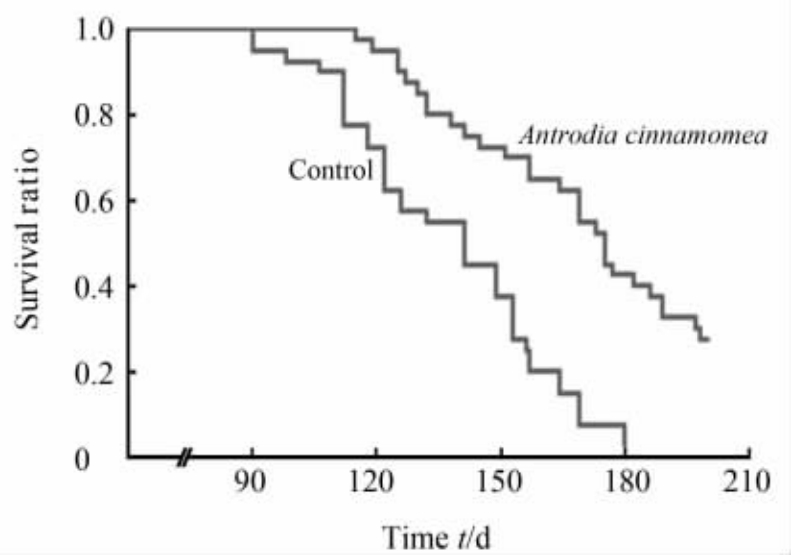 | 图 1 两组SHRSPs生存曲线Fig 1 Survival curves in stroke-prone spontaneously hypertensive rats in two groups |
如图 2A~2C所示,服用牛樟芝后SHRSPs脑组织中有2个蛋白点的表达量增加,经过质谱鉴定,发现是与氧化应激有关的蛋白GST pi2亚基和SOD。进一步经蛋白质印迹法验证,证实服用牛樟芝后SHRSPs脑组织中GST和SOD的表达增加(图 2D、2E)。
从图 2E可见,与正常对照WKY大鼠相比,未服牛樟芝的SHRSPs脑组织SOD和GST的活性均出现下调(P均<0.05)。服用牛樟芝后,SHRSPs脑组织GST和SOD的活性均上调(P均<0.05)。
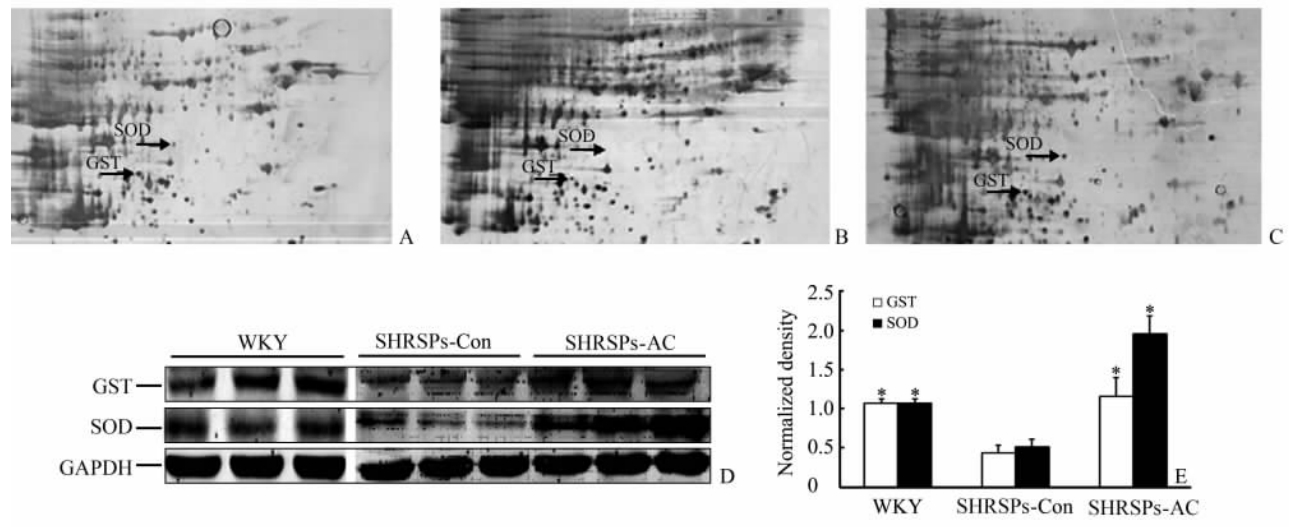 | 图 2牛樟芝给药后SHRSPs脑组织的蛋白质组学分析和蛋白质印迹分析验证Fig 2 Proteomic analysis for differentially expressed proteins of the brain from SHRSPs treated with Antrodia cinnamomea and confirmation by Western blotting analysisA,B,C: Images of the brains in WKY rats,stroke-prone spontaneously hypertensive rats (SHRSPs-Con), and SHRSPs treated with Antrodia cinnamomea (SHRSPs-AC),respectively; D: Western blotting analysis of glutathione S-transferase (GST) and superoxide dismutase (SOD) in brains of WKY rats, SHRSPs-Con and SHRSPs-AC; E: Normalized density of GST and SOD by Western blotting analysis. *P<0.05 vs SHRSPs-Con group. n=3,x±s |
结果如表 1所示,与未服牛樟芝的SHRSPs相比,服用牛樟芝后,SHRSPs脑组织T-AOC增强(P<0.05),表现为服药后脑组织GST和SOD 的活性增加(P<0.05),而氧化应激代谢产物MDA的含量下降(P<0.05)。与正常对照WKY大鼠相比较,未服用牛樟芝的SHRSPs脑组织GST和SOD活性下调(P<0.05),这与蛋白质印迹分析法所得结果一致,而反映机体整体氧化程度的MDA水平上调(P<0.05),T-AOC相应降低(P<0.05)。
| 表 1 牛樟芝对SHRSPs脑氧化应激相关指标的影响Tab 1 Effects of Antrodia cinnamomea on oxidative stress parameters in the brains of stroke-prone spontaneously hypertensive rats (SHRSPs) n=3,x±s |
目前,以脑卒中为主要表现的脑血管病已成为世界上成年人的第3位致死和第1位致残原因[ 10 ]。 流行病学研究表明,我国每年有150~200万新发卒中的病例[ 11 ]。脑卒中存活的患者绝大部分丧失了 不同程度的生活自理能力,给家庭和社会带来沉重的负担。目前,对于脑卒中的预防尚没有十分理想的方法,主要是针对其各种危险因素进行干预,从而延缓卒中高危患者发生卒中的时间[ 12,13 ]。SHRSPs是一种以高血压为主要表现的大鼠,并且该类雄性大鼠自发脑卒中的时间为10个月龄左右,发生率在90%以上,是一种非常理想的研究脑卒中的病理模型。
在本研究中,我们发现长期给予SHRSPs牛樟芝灌胃治疗可以延长其生存时间,表明牛樟芝对于高血压诱发的脑卒中有防治作用。牛樟芝是产于台湾的一种较为珍贵的中药材 ,目前对于它的研究报道相对较少,而且主要集中在抗肿瘤和免疫调节方面。有学者发现从牛樟芝中提取的三萜类化合物具有广谱的抗肿瘤活性,体外实验证明三萜类化合物能通过caspase和Bax介导的凋亡通路诱导肿瘤细胞程序性死亡[ 14 ]。而腹腔注射半萜内酯化合物antrocin则可以抑制非小细胞肺癌的生长,其抗肿瘤活性与antrocin抑制了JAK2/STAT3通路有关[ 4 ]。另外,从牛樟芝中提取的多糖分子还能减轻多重细菌败血症小鼠体内的炎症反应,表明牛樟芝是一种具有多重生物学活性的中药材[ 7 ]。本研究首次发现牛樟芝能延长SHRSPs的生存时间,表明牛樟芝能对高血压诱发的脑卒中具有潜在的保护效应。我们随后测定了长期服用牛樟芝后SHRSPs的血压值,尽管用药后SHRSPs的血压出现下降趋势,但差异无统计学意义(数据未展示),提示牛樟芝的这种保护效应可能与血压调节无关。
Marc Wilkins 在1995年提出了蛋白质组学这一理念,其本质上指的是在大规模水平上研究蛋白质的特征。蛋白质组的研究不仅能为生命活动规律提供物质基础,也能为众多疾病机制的阐明提供理论根据和解决途径。在本研究中,我们运用蛋白质组学的手段比较了服用牛樟芝前后SHRSPs脑组织蛋白质的表达差异,发现有2个蛋白点的表达量增加,经过质谱鉴定为机体参与抗氧化的蛋白酶GST pi2亚基和SOD。这2种蛋白酶构成了机体抗氧化系统的重要组成部分,并被广泛报道能对抗机体的氧化应激造成的各种损伤。运用遗传学的手段造成GST表达缺陷的小鼠往往更容易受到氧化应激的伤害[ 15 ],而过度表达GST则能增加生物体抗击应激的能力[ 16 ]。条件敲除小鼠骨骼肌的SOD会加重氧化应激对肌肉的损害[ 17 ]。而在生理情况下,大脑中的抗氧化酶类的含量均较低,加之其又富含脂质,因此是最容易受到氧化应激损伤的器官。氧化应激参与了多种脑部疾病的发生及发展过程,通过抗氧化干预能有效地缓解病情的恶化[ 18 ]。有学者指出,长期给予SHRSPs以抗氧化剂维生素C和维生素E可以减少大鼠急性大脑中动脉栓塞后的脑梗死面积,同时也能在一定程度上缓解其血压的增高,这可能是其发挥保护作用的关键机制[ 19 ]。此外,日常抗氧化饮品绿茶也被证明能通过减轻SHRSPs的血管壁的氧化应激水平发挥预防脑血管疾病的保护功能[ 20 ]。大规模人群的流行病学调查研究也证实了长期服用绿茶可以降低卒中的发生率[ 21 ]。 因此抗氧化可以作为防治脑卒中的一种治疗策略。在本研究中我们发现牛樟芝服用后可以上调SHRSPs脑组织中GST和SOD的活性,可以增强机体的抗氧化能力,减少氧化应激的产物产生,并最终延长了SHRSPs的生存时间,意味着牛樟芝可能成为延缓卒中发作的一个新型药物。
但是本研究并没有明确是牛樟芝中的何种成分发挥了抗氧化效应,并且在有高血压基础的SHRSPs上联合应用降压药和牛樟芝是否能产生协同效应,以及对卒中的发作能否产生更大的保护作用还不清楚,这都将是我们进一步研究和努力的方向。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Okamoto K,Yamori Y,Nagaoka A.Establishment of stroke-prone spontaneously hypertensive rats (SHR)[J].Circ Res,1974,34:I-143-I-145. |
| [2] | Chen C,Venketasubramanian N,Gan R N,Lambert C,Picard D,Chan B L,et al.Danqi Piantang Jiaonang (DJ),a traditional Chinese medicine,in poststroke recovery[J].Stroke,2009,40:859-863. |
| [3] | Wu B,Liu M.How to improve the quality of a clinical trial on traditional Chinese medicine for stroke[J].Stroke,2009,40:e641-e642. |
| [4] | Lee Y P,Chitsai W,Jan C,Rao Y K,Yang C R,Chen D R,et al.Anticancer effects of eleven triterpenoids derived from Antrodia camphorata[J].Anticancer Res,2012,32:2727-2734. |
| [5] | Chen Y Y,Sheu M J.Crude extracts of Antrodia cinnamomea inhibit invasion and migration of human hepatocellular carcinoma cells[J].FASEB J,2013,27:1105.9. |
| [6] | Tsou H T,Yang H L,Hseu Y C.The anti-tumor activity of Antrodia camphorata in melanoma cells:modulation of Wnt/β-catenin signaling[J].FASEB J,2011,25:979.19. |
| [7] | Meng L M,Pai M H,Yeh S L.Polysaccharides from extracts of Antrodia camphorata mycelia and fruiting bodies modulate inflammatory mediator expression in mice with polymicrobial sepsis[J].Nutrition,2012,28:942-949. |
| [8] | Ando A,Mitsuma Y,Katano T,Ito S,Nishimura T,Takahashi K.Proteomics analysis of cultured human retinal vascular endothelial cells[J].Invest Ophthalmol Vis Sci,2010,51:1883. |
| [9] | Zhang X H,Lei H,Liu A J,Zou Y X,Shen F M,Su D F.Increased oxidative stress is responsible for severer cerebral infarction in stroke-prone spontaneously hypertensive rats[J].CNS Neurosci Ther,2011,17:590-598. |
| [10] | Doyle K P,Simon R P,Stenzel-Poore M P.Mechanism of ischemic brain damage[J].Neuropharmacology,2008,55:310-318. |
| [11] | Ferri C P,Schoenborn C,Kalra L,Acosta D,Guerra M,Huang Y,et al.Prevalence of stroke and related burden among older people living in Latin America,India and China[J].J Neurol Neurosurg Psychiatry,2011,82:1074-1082. |
| [12] | Fang X H,Kronmal R A,Li S C,Longstreth W T,Cheng X M,Wang W Z,et al.Prevention of stroke in urban China:a community-based intervention trial[J].Stroke,1999,30:495-501. |
| [13] | Chiuve S E,Rexrode K M,Spiegelman D,Logroscino G,Manson J E,Rimm E B.Primary prevention of stroke by healthy lifestyle[J].Circulation,2008,118:947-954. |
| [14] | Yeh C T,Huang W C,Rao Y K,Ye M,Lee W H,Wang L S,et al.A sesquiterpene lactone antrocin from Antrodia camphorata negatively modulates JAK2/STAT3 signaling via microRNA let-7c and induces apoptosis in lung cancer cells[J].Carcinogenesis,2013,34:2918-2928. |
| [15] | Blackburn A C,Matthaei K I,Lim C,Taylor M C,Cappello J Y,Hayes J D,et al.Deficiency of glutathione transferase zeta causes oxidative stress and activation of antioxidant response pathways[J].Mol Pharmacol,2006,69:650-657. |
| [16] | Burmeister C,Lüersen K,Heinick A.Oxidative stress in Caenorhabditis elegans:protective effects of the Omega class glutathione transferase (GSTO-1)[J].FASEB J,2008,22:343-354. |
| [17] | Lustgarten M S,Jang Y C,Liu Y,Muller F L,Qi W,Steinhelper M,et al.Conditional knockout of Mn-SOD targeted to type ⅡB skeletal muscle fibers increases oxidative stress and is sufficient to alter aerobic exercise capacity[J].Am J Physiol Cell Physiol,2009,297:C1520-C1532. |
| [18] | Hamel E,Nicolakakis N,Aboulkassim T,Ongali B,Tong X K.Oxidative stress and cerebrovascular dysfunction in mouse models of Alzheimer’s disease[J].Exp Physiol,2008,93:116-120. |
| [19] | Chen X,Touyz R M,Park J B,Schiffrin E L.Antioxidant effects of vitamins C and E are associated with altered activation of vascular NADPH oxidase and superoxide dismutase in stroke-prone SHR[J].Hypertension,2001,38:606-611. |
| [20] | Negishi H,Xu J W,Ikeda K,Njelekela M,Nara Y,Yamori Y.Black and green tea polyphenols attenuate blood pressure increases in stroke-prone spontaneously hypertensive rats[J].J Nutr,2004,134:38-42. |
| [21] | Kokubo Y,Iso H,Saito I,Yamagishi K,Yatsuya H,Ishihara J,et al.The impact of green tea and coffee consumption on the reduced risk of stroke incidence in Japanese population:The Japan Public Health Center-Based Study Cohort[J].Stroke,2013,44:1369-1374. |
 2014, Vol. 35
2014, Vol. 35


