2. 第二军医大学药学院药物分析学教研室, 上海市药物(中药)代谢产物研究重点实验室, 上海 200433;
3. 沈阳药科大学药学院药物分析学教研室, 沈阳 110016;
4. 第二军医大学基础部组织学与胚胎学教研室, 上海 200433
2. Department of Pharmaceutical Analysis, School of Pharmacy, Second Military Medical University & Key Laboratory of Shanghai Drug (Chinese Materia Medica) Metabolism Research, Shanghai 200433, China;
3. Department of Pharmaceutical Analysis, School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, Liaoning, China;
4. Department of Histology and Embryology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
西地那非(sildenafil)又译昔多芬,化学名为1-[4-乙氧基-3-[5-(6,7-二氢-1-甲基-7-氧代-3-丙基-1H-吡唑并[4,3d]嘧啶)]苯磺酰]-4-甲基哌嗪,为一种环磷酸鸟苷(cGMP)特异的Ⅴ型磷酸二酯酶(PDE5)选择性抑制剂[ 1 ],临床上主要用于治疗男性性功能障碍(ED)[ 2,3,4,5,6 ]。近年的一系列研究结果亦证实,西地那非在原发性高血压、肺动脉高压、缺血再灌注损伤、内皮功能不全、心肌梗死、心力衰竭等方面均有良好的治疗效果[ 7,8,9,10,11,12,13,14,15 ]。另外,有研究表明其在妇女不孕症[ 16 ]、睾丸扭转大鼠的保护作用[ 17 ]中也发挥一定药理作用。
在体内发挥主要药理作用的是原型药物西地那非,进一步研究表明N-去甲西地那非等代谢产物与西地那非具有相似的PDE5选择性,作用强度约为后者的50%,因此西地那非的药理作用约20%来自代谢产物[ 18,19 ]。药物的活性代谢物如达到一定的体内药物浓度,必将影响原型药物的药理、药效作用。
西地那非的临床给药途径为口服,口服药物首先经过胃肠道,通过肠壁吸收,再通过肝脏最终进入全身血液循环。以往的研究中仅考察小肠在药物吸收环节中的作用而忽略其对药物的代谢能力,目前研究表明,除了肝脏被认为是药物在体内代谢的主要器官外,小肠黏膜上皮细胞含有一系列与肝脏相同的细胞色素P450(CYP450)代谢酶。已在人小肠组织样本中检测到CYP1A1、CYP2C9、CYP2C19、CYP2J2、CYP2D6、CYP3A、CYP2E1等多种CYP450酶[ 20,21 ]。
西地那非代谢部位及途径未见相关研究,其经肠道代谢及吸收特性尚未见报道,本研究以国内研制开发的新药硫酸氢钠西地那非为研究对象,首先采用电喷雾(ESI)质谱技术对西地那非及其代谢产物N-去甲西地那非进行质谱结构解析和裂解规律研究,基于质谱裂解规律,建立血浆样品液相色谱(LC)-ESI(+)MS/MS分析方法, 同时结合在体肠襻给药模型,考察雄性SD大鼠肠襻给予硫酸氢钠西地那非后,该药物在肠内吸收与代谢特性。
1 材料和方法 1.1 仪器美国Varian公司1200L三重四级杆串联质谱仪,配备大气压ESI源以及6.8版本的瓦里安质谱数据处理系统;高效液相色谱(HPLC)系统,包括ProStar 410 自动进样器、2台ProStar210输液泵;梅特勒-托利多XS205DU电子天平(梅特勒-托利多仪器上海有限公司);ThermoFisher CR3i 台式高速冷冻离心机和ThermoFisher SPD121减压离心浓缩仪(美国ThermoFisher 公司);Vortex Mixer 230V EU涡旋混合器(美国Labnet公司);SK 5200 LH 超声仪(上海科导超声仪器有限公司)。
1.2 药品及试剂枸橼酸西地那非对照品(纯度>98%,德国Dr. Ehrenstorfer GmbH公司,批号81107);去甲西地那非对照品(纯度>98%,加拿大TRC公司,批号4-ROK-142-1);硫酸氢钠西地那非原料药(杭州奥默医药技术有限公司);甲醇(德国Merck公司,色谱纯);甲酸(中国医药集团上海化学试剂公司,色谱纯);乙酸铵、氢氧化钠、乙酸乙酯(中国医药集团上海化学试剂公司,分析纯);去离子水为Mili-Q系统(美国Millipore公司)自制超纯水。
1.3 测定条件 1.3.1 色谱条件
采用YMC-Pack ODS-A(150 mm×4.6 mm,5 μm)分析柱;甲醇(A)-含0.01%甲酸的10 mmol/L乙酸铵(B),梯度洗脱: 0~1 min,35%A; 1′1″~5 min,85%A; 5′1″~6 min,35%A。 流速0.8 mL/min, 3 2分流入质谱的流速约为0.32 mL/min; 进样量20 μL;柱温25℃。
1.3.2 质谱条件毛细管电压75 V;干燥气(氮气)温度300℃,0.14 MPa;鞘气(氮气)温度50℃,压力0.36 MPa;碰撞气(氩气)压力0.24 Pa;检测器电压1 620 V;正离子扫描。
1.4 实验动物及给药方案清洁级成年健康雄性SD大鼠25只,体质量 (200±20) g,6~8周龄 [上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2007-0001]。 随机分成5组,每组5只。禁食(14 h)过夜后,经25%乌拉坦麻醉(腹腔注射,1.2 g/kg)后,用结扎法[ 22,23,24 ]分离约30 cm的十二指肠至回肠肠襻,用生理盐水洗去肠内容物,将硫酸氢钠西地那非原料药(以西地那非计10 mg/kg)导入肠腔,给药前及给药后0.25、0.5、1、4 h时各取一组SD大鼠,从肝门静脉处取血约0.5 mL,分离血浆,于-80℃冰箱保存待测。
1.5 血浆样品前处理血浆样品于37℃水浴下解冻后,取血浆100 μL置于1.5 mL塑料离心管中,加入20 μL(1 mol/L)氢氧化钠涡旋碱化30 s,再加入1 mL乙酸乙酯进行液液萃取,涡旋振荡3 min,2 700×g 离心10 min,分取上清液800 μL置于另一塑料离心管中,于减压离心浓缩仪中35℃挥干,残渣用50 μL 80%甲醇复溶,24 200×g离心10 min后进样分析。
1.6 半定量分析的标准曲线分别精密称取枸橼酸西地那非、N-去甲西地那非对照品适量,甲醇-水(50 50,体积比)溶解配制含枸橼酸西地那非、 N-去甲西地那非一定浓度的系列标准混合溶液。取空白SD大鼠血浆适量,加入上述系列标准混合溶液配制成相当于含西地那非浓度为5.01、10.02、20.04、50.1、200.4、501、1 002和2 004 ng/mL,N-去甲西地那非浓度为5.02、10.04、20.08、50.2、200.8、502、1 004和2 008 ng/mL的SD大鼠标准血浆样品,按1.5项下进行前处理操作,然后按1.3项下条件分析,进样20 μL记录色谱图和质谱图。
2 结 果 2.1 原型药物西地那非的质谱裂解规律根据西地那非的相对分子质量474.6,选择m/z为100~500的范围进行正负离子的一级全扫,结果显示其在正负离子模式下均有响应,但正离子模式下的响应强度远远高于负离子模式,最终采用正离子模式。由图 1A西地那非一级质谱可知,西地那非准分子离子峰m/z 475.3 [M+H]+。由m/z 475.3 [M+H]+进一步作二级质谱扫描,结果出现m/z 100.4、243.5、283.4、311.5等碎片峰(图 1B)。其中m/z 311.5、283.4丰度较高。推测由于西地那非的甲砜基团有2个O原子,具有很强的吸电子作用,造成C-S键不稳定易发生断裂,形成碎片m/z 311 (M+H-C5H12O2N2S),而且乙氧基的O-C键不稳定发生断裂,易脱去C2H4产生m/z 283 碎片离子。
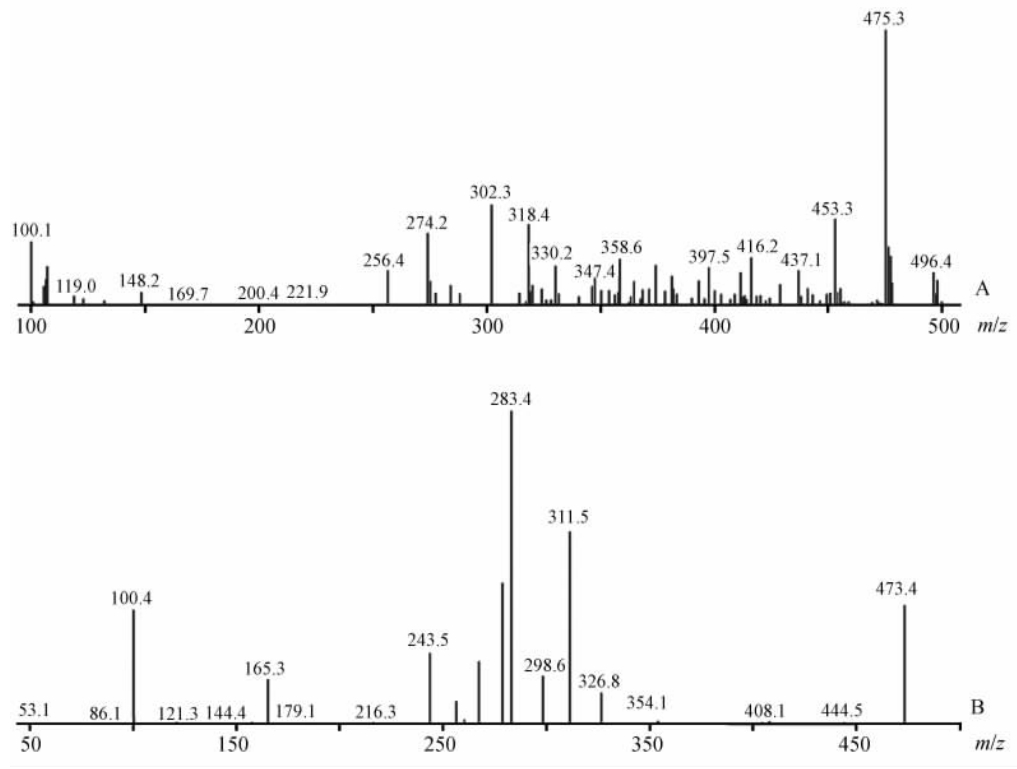 | 图 1 西地那非的一级(A)、二级(B)质谱图Fig 1 Mass spectra (A: ESI-MS; B: ESI-MS2) of sildenafil |
同法根据N-去甲西地那非的相对分子质量460.55,选择m/z为200~500的范围进行正离子一级全扫描。由图 2A N-去甲西地那非一级质谱可见,N-去甲西地那非准分子离子峰m/z 461.4 [M+H]+。由m/z 461.4 [M+H]+进一步作二级质谱扫描,结果出现m/z 164.2、283.4、311.0等碎片峰(图 2B)。其中m/z 283.4、311.0碎片峰丰度较高。
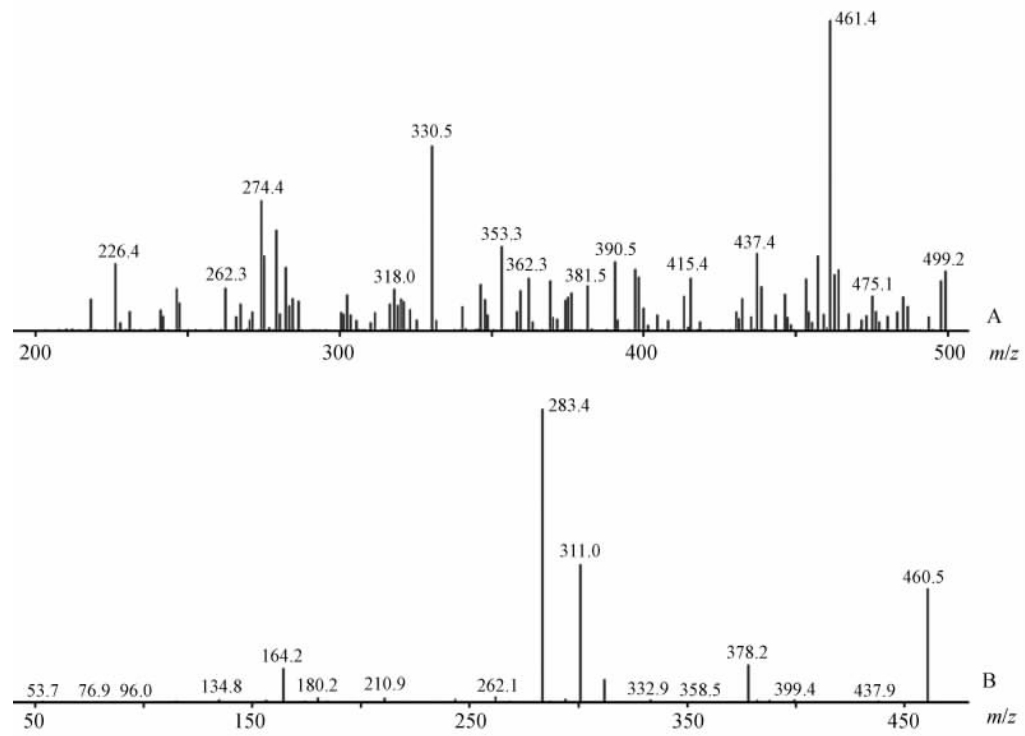 | 图 2 N-去甲西地那非的一级(A)、二级(B)质谱图Fig 2 Mass spectra (A: ESI-MS; B: ESI-MS2) of N-desmethylsildenafil |
西地那非和N-去甲西地那非裂解途径见图 3。
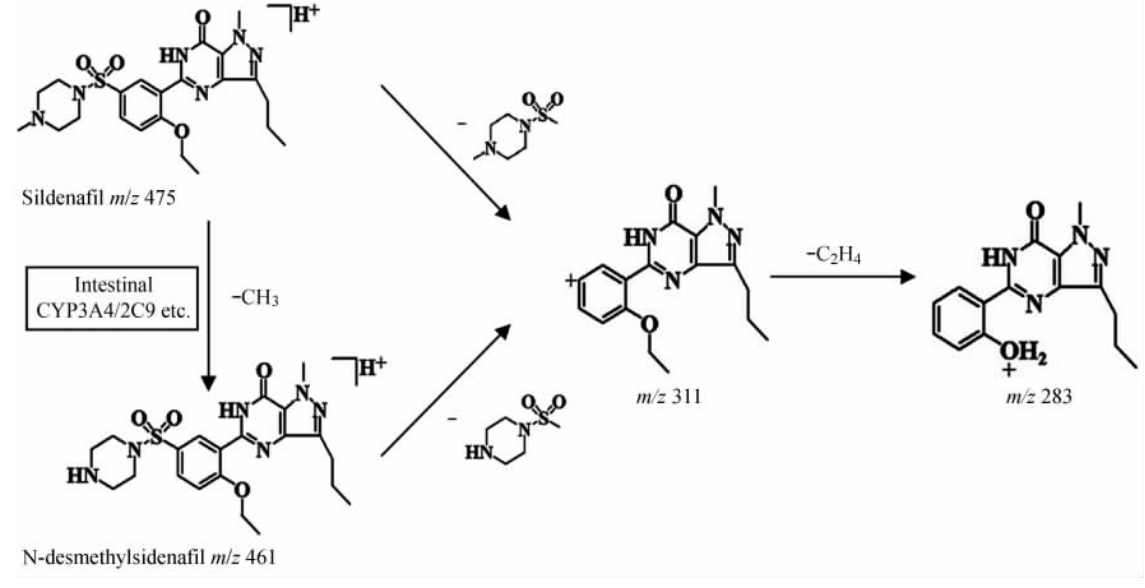 | 图 3 西地那非及N-去甲西地那非的质谱裂解规律Fig 3 Fragmentation pathways of sildenafil and N-desmethylsildenafil |
血浆样品按1.4项下步骤操作后进行一级/二级扫描,由肝门静脉血浆的提取离子流色谱图(XIC)可知,肝门静脉处同时检测到西地那非及其活性代谢产物N-去甲西地那非(图 4)。由此可推断,西地那非在肠道吸收的同时,部分药物发生氮去甲基代谢作用生成了活性代谢产物N-去甲基西地那非。
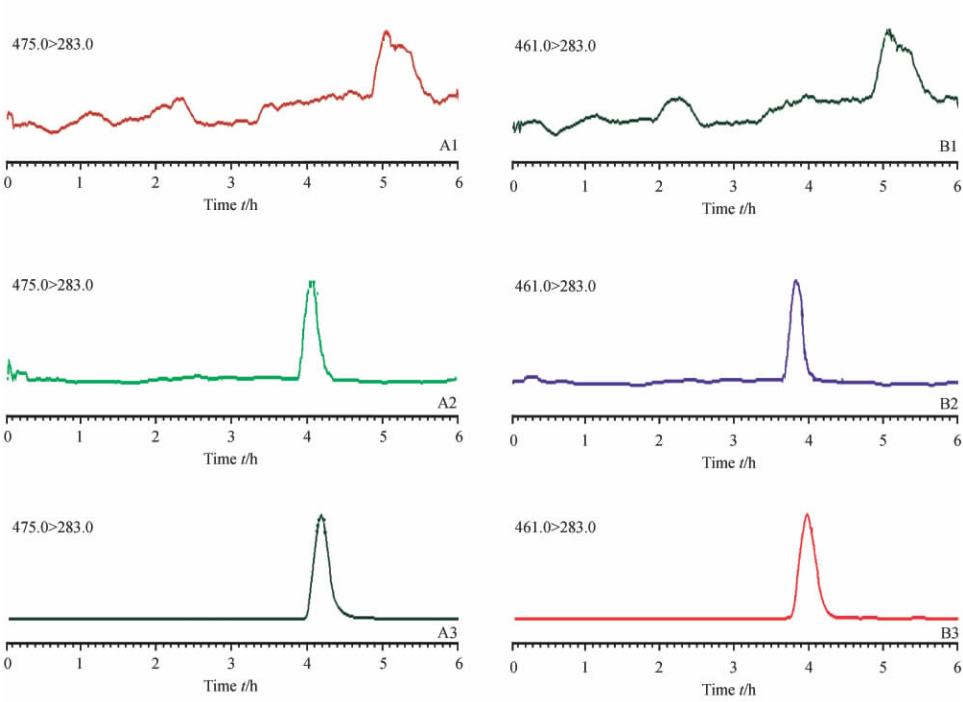 | 图 4 肝门静脉血浆中西地那非(A)和N-去甲西地那非(B)的提取离子流色谱图Fig 4 Extracted ion chromatogram of sildenafil (A) and N-desmethylsildenafil (B) in hepatic portal vein plasmaA1,B1: Blank plasma; A2,B2: Blank plasma spiked with sildenafil and N-desmethylsildenafil at concentration of 5 ng/mL; A3,B3: Plasma sample obtained at 1.5 h after single administration of 10 mg/kg of sildenafil sodium bisulfate |
基于上述西地那非、N-去甲西地那非的多级质谱裂解规律,选择m/z 475→m/z 283(西地那非)和m/z 461→m/z 283(N-去甲西地那非)为离子反应监测通道,建立LC-ESI(+)MS/MS的半定量分析方法。25只雄性SD大鼠肠襻给予硫酸氢钠西地那非10 mg/kg不同时间点肝门静脉血浆样品与标准曲线样品同批处理,分别以待测物的浓度为横坐标、待测物与内标峰面积的比值为纵坐标,加权(W=1/x)最小二乘法进行线性回归运算,得西地那非血浆标准曲线方程y=0.003 9x+0.004 1,r=0.999 2 (n=8);N-去甲西地那非血浆标准曲线方程y=0.009 5x+0.018 2,r=0.999 1 (n=8)。大鼠肝门静脉处血浆西地那非及N-去甲西地那非的半定量测定比较结果见图 5。结果表明,约有1/5的原型药物在SD大鼠肠道吸收时发生代谢反应,生成活性代谢产物进入肝门静脉。
 | 图 5 经肠给药后大鼠肝门静脉处血浆西地那非、N-去甲西地那非浓度测定比较图Fig 5 Comparison of plasma concentrations of sildenafil and N-desmethylsildenafil in hepatic portal vein after an intestinal administration n=5,x±s |
口服药物的吸收路径提示,药物经口服到达胃肠道,经小肠黏膜吸收后,首先随毛细血管流经汇合至肝门静脉进入肝脏,然后进入全身的血液循环。 小肠黏膜上皮细胞是口服药物的第一个吸收点。同时,大量研究发现,肠组织中富含参与药物代谢的大量CYP450酶,因此肠道实质上也是口服药物的第一个代谢点[ 26 ]。以往的研究过分强调小肠在药物吸收环节的作用而忽略了其对药物的代谢能力。在体肠襻给药模型可以将自药物进入肠道黏膜至药物经血入肝前发生的吸收剂代谢过程作为一个独立的体系进行研究,肠襻给药后,研究药物经肠黏膜吸收后经毛细血管到达肝门静脉汇合,于入肝前在此处取血测定,有效排除非肠源性代谢的干扰。本实验结果提示约有1/5的西地那非原型药物在此过程中被代谢,并生成了活性代谢产物。由此可以推断,西地那非经口服,首先在肠道中经被动扩散或主动转运进入肠细胞,再经跨膜转运至肠系膜,药物在跨膜转运过程中与药物代谢CYP450酶接触并被其代谢,成为西地那非体内代谢的环节之一。有研究表明西地那非在体内通过CYP450 3A4(主要途径)和CYP450 2C9(次要途径)代谢,发生氮去甲基作用而生成N-去甲西地那非[ 18,19 ]。
肠道对药物的代谢作用除可将原型药物代谢成活性代谢产物,相应的也参与药物首过清除。有报道表明肠道CYP酶参与环孢素A[ 26 ]、咪达唑仑[ 27 ]、维拉帕米[ 28 ]等药物的首关效用甚至与肝脏相当。因此可以判断肠道在药物代谢过程中有非常重要的作用。
目前研究药物肠道吸收的实验方法大致可分为体外实验法、在体实验法和体内实验法等。其中离体实验破坏了胃肠道的真实生存环境,可导致与实际吸收产生较大差异;而在体实验较接近正常生理条件,现已发展有多种方法,如肠段结扎、肠道插管、肠血管灌流等[ 29 ]。对于不同特性的药物应选用不同的考察模型。
本研究运用ESI-MS技术对西地那非、N-去甲西地那非的质谱裂解规律进行研究,结果表明2种药物的二级质谱中均出现强度较大的m/z 311和m/z 283碎片离子,推测甲砜基中具有强吸电子作用的2个O原子造成C-S键不稳定而发生断裂,脱去C5H12O2N2S形成碎片离子m/z 311;另外,乙氧基中C-O键不稳定而发生断裂,在脱去C5H12O2N2S同时脱去C2H4,最终形成稳定的m/z 283碎片离子。以上裂解推断符合质谱常规裂解规律,并与相关文献 [ 30, 31, 32, 33 ] 报道一致。对西地那非及其代谢产物N-去甲西地那非的质谱结构解析和裂解规律研究,为选择最佳离子反应监测通道及药物在生物体内转化及代谢可能途径提供了依据。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Sussman D O.Pharmacokinetics,pharmacodynamics,and efficacy of phosphodiesterase type 5 inhibitors[J].J Am Osteopath Assoc,2004,104:S11-S15. |
| [2] | 严 肃,张志超,李宏军,张新宇,李汉忠.西地那非治疗原发性勃起功能障碍的效果分析[J].中华泌尿外科杂志,2012,33:925-928. |
| [3] | 商学军,黄宇烽.西地那非在中国男科临床应用十年回顾[J].中华男科学杂志,2012,18:742-746. |
| [4] | 郭宏波.勃起功能障碍的治疗现状和研究进展[J].临床和实验医学杂志,2013,12:222-224. |
| [5] | Ghanem H,Zaazaa A,Kamel I,Anis T,Salem A,El Guindi A.Short-term use of sildenafil in the treatment of unconsumated marriages[J].Int J Impot Res,2006,18:52-54. |
| [6] | Das A,Xi L,Kukreja R C.Phosphodiesterase-5 inhibitor sildenafil preconditions adult cardiac myocytes against necrosis and apoptosis.Essential role of nitric oxide signaling[J].J Biol Chem,2005,280:12944-12955. |
| [7] | Maggiorini I M.Prevention and treatment of high-altitude pulmonary edema [J].Prog Cardiovasc Dis,2010,52:500-506. |
| [8] | Olfert I M,Loeckinger A,Treml B,Faulhaber M,Flatz M,Burtscher M,et al.Sildenafil and bosentan improve arterial oxygenation during acute hypoxic exercise:a controlled laboratory trial [J].Wilderness Environ Med,2011,22:211-221. |
| [9] | Wong R C,Koh G M,Choong P H,Yip W L.Oral sildenafil therapy improves health-related quality of life and functional status in pulmonary arterial hypertension[J].Int J Cardiol,2007,119:400-402. |
| [10] | Xu X Q,Jing Z C,Zhang J H,Wu Y,Wang Y,Jiang X,et al.The efficacy and safety of sildenafil in Chinese patients with pulmonary arterial hypertension[J].Hypertens Res,2009,32:911-915. |
| [11] | 吴文汇,荆志成.西地那非治疗肺动脉高压的研究[J].临床药物治疗杂志,2011,9:5-11. |
| [12] | 皇甫卫忠,付秀华.西地那非治疗慢性阻塞性肺疾病肺动脉高压的疗效研究[J].内蒙古医学院学报,2011,33:60-62. |
| [13] | 郭 玮,张焕改,谷惠芳,王敬群,杨 柳.枸橼酸西地那非治疗新生儿肺动脉高压50例[J].医药导报,2013,32:616-618. |
| [14] | Ayala J E,Bracy D P,Julien B M,Rottman J N,Fueger P T,Wasserman D H.Chronic treatment with sildenafil improves energy balance and insulin action in high fat-fed conscious mice[J].Diabetes,2007,56:1025-1033. |
| [15] | 王延玲,王 荣,谢 华,李文斌,武晓玉,张娟红,等.西地那非对急进高原大鼠心肌保护作用研究[J].解放军医药杂志,2013,25:10-13. |
| [16] | 丘 彦,桂文武,曾品鸿,徐红兵,廖 慧,周永芳,等.枸橼酸西地那非片对不孕妇女子宫和卵巢动脉血流的影响[J].重庆医科大学学报,2003,28:29-31. |
| [17] | 刘 勇.西地那非对睾丸扭转大鼠的保护作用[J].中华男科学杂志,2008,26:572. |
| [18] | 王逸民.细胞色素P4503A4和3A5对磷酸二酯酶5抑制剂(PDE5Is)-西地那非,优地那非,伐地那非3种药物代谢的影响[J].中国男科学杂志,2008,22:49. |
| [19] | 陈 聪,向 平,沈保华,卓先义.体液中西地那非的测定及其代谢物的确认[J].分析化学,2011,39:1093-1099. |
| [20] | 谢珊珊,景欣悦,刘晓东.小肠CYP450酶在药物代谢中的作用[J].中国药科大学学报,2010,41:186-192. |
| [21] | 李晓宇,刘皋林.CYP450酶特性及其应用研究进展[J].中国临床药理学与治疗学,2008,13:942-946. |
| [22] | Curran P F,Solomon A K.Ion and water fluxes in the ileum of rats[J].J Gen Physiol,1957,41:143-168. |
| [23] | 杜 秋,狄留庆,单进军,刘陶世,张新庄.在体单向肠灌流模型研究瑞香素的大鼠肠吸收特性[J].药学学报,2009,44:922-926. |
| [24] | Punyashthiti K,Finkelstein R A.Enteropathogencity of Escherichia coli.Ⅰ.Evaluation of mouse intestinal loops [J].Infect Immun,1971,4:473-478. |
| [25] | Paine M F,Hart H L,Ludington S S,Haining R L,Rettie A E,Zeldin D C.The human intestinal cytochrome P450 “pie”[J].Drug Metab Dispos,2006,34:880-886. |
| [26] | Kolars J C,Awni W M,Merion R M,Watkins P B.First-pass metabolism of cyclosporin by the gut[J].Lancet,1991,338:1488-1490. |
| [27] | Paine M F,Shen D D,Kunze K L,Perkins J D,Marsh C L,McVicar J P,et al.First-pass metabolism of midazolam by the human intestine[J].Clin Pharmacol Ther,1996,60:14-24. |
| [28] | von Richter O,Greiner B,Fromm M F,Fraser R,Omari T,Barclay M L,et al.Determination of in vivo absorption,metabolism and transport of dogs by the human intestinal wall and liver with a novel perfusion technique[J].Clin Pharmacol Ther,2001,70:217-227. |
| [29] | 祝诚诚,何 新.药物肠道吸收研究方法[J].药物评价研究,2010,33:222-227. |
| [30] | Weinmann W,Bohnert M,Wiedemann A,Renz M,Lehmann N,Pollak S.Post-mortem detection and identification of sildenafil (Viagra) and its metabolites by LC/MS and LC/MS/MS[J].Int J Legal Med,2001,114:252-258. |
| [31] | Wang Y,Wang J,Cui Y,Fawcett J P,Gu J.Liquid chromatographic-tandem mass spectrometric method for the quantitation of sildenafil in human plasma[J].J Chromatogr B Analyt Technol Biomed Life Sci,2005,828:118-121. |
| [32] | Lewis R J,Johnson R D,Blank C L.Quantitative determination of sildenafil (Viagra) and its metabolite (UK-103,320) in fluid and tissue specimens obtained from six aviation fatalities[J].J Anal Toxicol,2006,30:14-20. |
| [33] | Kim J,Ji H,Kim S J,Lee H W,Lee S S,Kim D S,et al.Simultaneous determination of sildenafil and its active metabolite UK-103,320 in human plasma using liquid chromatography-tandem mass spectrometry[J].J Pham Biomed Anal,2003,32:317-322. |
 2014, Vol. 35
2014, Vol. 35


