2. 第二军医大学基础部人体解剖与组织胚胎学教研室, 上海 200433;
3. 泰安市妇幼保健院儿童保健科, 泰安 271000
2. Department of Human Anatomy, Histology and Embryology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China;
3. Department of Child Health Care, Maternity and Child Health Hospital, Taian 271000, Shandong, China
内皮细胞(endothelial cells,ECs)和平滑肌细胞(smooth muscle cells,SMCs)是构建组织工程化静脉瓣重要的种子细胞。种子细胞的性能决定着组织化静脉瓣的功能,如何在短期内获取大量高性能的种子细胞是构建组织工程化静脉瓣面临的问题。早期组织工程化静脉瓣研究采用的种子细胞来源于血管组织[ 1 ],但细胞增殖能力低,很难在短期内获得大量纯度较高的种子细胞。内皮祖细胞(endothelial progenitor cells,EPCs)是ECs的前体细胞,存在于骨髓和外周血等组织内,可在体内外分化为ECs[ 2 ]。温昱等[ 3 ]利用犬骨髓来源的多能成体祖细胞(multipotent adult progenitor cells,MAPCs)和 EPCs作为种子细胞构建组织工程化静脉瓣,并完成了在体效用性的观察,发现从骨髓获得的种子细胞活性好、增殖能力强、表型稳定。但由于EPCs和MAPCs的获用采取的是全骨髓培养免疫磁珠分选术,操作过程复杂、分选难度大、易污染、费用高,而且分别培养两类种子细胞, 耗费时间久,在时间上不能很好地满足构建组织工程化静脉瓣需求。本研究从兔骨髓中分离出单个核细胞,同步诱导培养出EPCs和平滑肌祖细胞(smooth muscle progenitor cells,SPCs),并鉴定EPCs和SPCs的生物学特性,探索一种操作简便、经济、高效地获取组织工程化静脉瓣种子细胞的方法,并为其他心血管组织工程构建提供借鉴。
1 材料和方法 1.1 实验材料清洁级新西兰大白兔10只,雌雄不限,体质量2.3~2.5 kg,购自第二军医大学实验动物中心,合格证号: SCXK(沪)2011-0011。 EGM-2和EBM-2培养基购自美国Lonza公司; 兔淋巴细胞分离液购自美国Parmacia公司; 胰酶消化液购自美国 Gibco公司; 胎牛血清(FBS)购自美国HyClone公司; 重组人血小板源性生长因子BB(PDGF-BB)购自美国 Pepro Tech 公司; 兔抗人CD133单克隆抗体和小鼠抗人α-平滑肌肌动蛋白(α-SMA)抗体购自武汉博士德生物工程有限公司; 兔抗人CD34单克隆抗体购自美国Sigma公司; 兔源血管性血友病因子(vWF)多克隆抗体和兔抗人血管内皮生长因子受 体2(VEGFR-2)抗体购自美国Santa Cruz公司。基质胶(matrigel)购自美国BectonDickinson公司。 EPCs诱导培养液为EGM-2完全培养液,含5%FBS及1 ng/mL 血管内皮生长因子(VEGF)、5 ng/mL碱性成纤维细胞生长因子(bFGF)及 1 ng/mL胰岛素样生长因子1(IGF-1)等细胞生长因子; SPCs诱导培养液为含5% FBS、20 ng/mL PDGF-BB,不含VEGF的EBM-2培养液。
1.2 兔骨髓单个核细胞获取及诱导培养用3%戊巴比妥钠按30 mg/kg经兔耳缘静脉麻醉动物。电动剃毛器剪去兔单侧髂部毛发,用碘酊消毒术区皮肤,乙醇脱碘,铺盖无菌孔巾,骨髓穿刺针在髂嵴前0.5 cm处缓缓进针,抽取骨髓血2 mL于400 U肝素润壁的10 mL注射器中,用PBS以12的比例稀释。将密度为1.077的兔淋巴细胞分离液加入 50 mL无菌离心管中,缓慢注入稀释的骨髓液,使骨髓液浮于兔淋巴细胞分离液面之上,二者体积之比为53,2 000 r/min离心20 min。 离心后管内液体分4层, 最上层是血浆,含部分血小板; 第2层为薄薄的白膜层,主要含单个核细胞; 第3层为淋巴细胞分离液; 第4层为红细胞及细胞沉淀。 吸取紧贴在血浆下的白膜层细胞,即为单个核细胞(示意图见图 1)。 将吸取的单个核细胞用10 mL PBS吹打漂洗,1 500 r/min 离心5 min,弃上清后将细胞沉淀再次用10 mL PBS漂洗,各取一半PBS细胞悬液, 1 500 r/min离心5 min,将细胞沉淀分别用EPCs诱导培养液和SPCs诱导培养液2 mL重悬,吸入25 cm2 培养瓶中,再加上对应的诱导培养液3 mL。将细胞培养瓶置于37℃、5% CO2、95%湿度的细胞培养箱中进行培养,第48小时后换培养液,此后每日更换培养液,倒置显微镜下观察细胞形态变化并摄片。
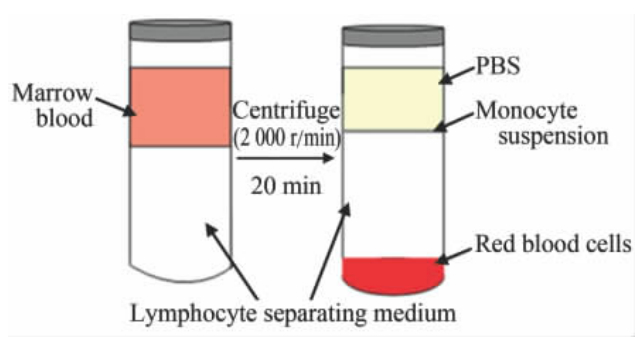 | 图 1 梯度密度离心前后骨髓血的液体分层Fig 1 Marrow blood layers before and after gradient density centrifugation |
(1)细胞免疫荧光检测vWF和α-SMA表达:EPCs/SPCs培养第10天,制备爬片细胞,PBS洗涤后用2%山羊血清封闭40 min;分别加入抗体稀释液稀释的1100的兔抗人vWF多克隆抗体、小鼠抗人α-SMA抗体50 μL(阴性对照以抗体稀释液代替一抗),放入湿盒,4℃过夜。取出湿盒,室温下复温30 min,PBS漂洗,5 min×3次;滴加对应的荧光二抗IgG,
室温下放置30 min;PBS洗5 min×3次;封片,荧光显微镜下观察vWF/α-SMA的表达情况。(2)免疫细胞化学染色DAB显色检测CD34、CD133、 VEGFR-2、α-SMA的表达: PBS清洗细胞爬片3次,每次3 min;3%H2O2阻断内源性过氧化物酶10 min;PBS清洗3次,每次3 min;分别加兔抗人CD34、CD133、 VEGFR-2抗体及鼠抗人α-SMA 抗体(滴度均为1100) 100 μL,37℃孵育60 min;PBS清洗3次,每次5 min;分别加入HRP标记的羊抗鼠、羊抗兔二抗100 μL,37℃孵育30 min;PBS清洗后DAB显色10 min,苏木精衬染1.5 min,甘油明胶封片;显微镜下观察拍照。
1.4 透射电镜检测细胞超微结构将培养第10天的EPCs和SPCs经0.25%胰蛋白酶+0.01%EDTA消化后,1 000 r/min离心6 min,弃上清,PBS漂洗细胞沉淀2次, 1 000 r/min离心6 min。收集沉淀到Eppendorf管中,2.5%戊二醛固定(4℃)2 h,1%锇酸后固定2 h(pH 7.3);再用缓冲液漂洗20 min,梯度乙醇脱水,环氧树脂包埋,超薄切片(70 nm),染色后 拍照。
1.5 细胞在基质胶上成血管实验基质胶4℃解冻备用,24孔板置于冰上预冷,将呈液态状的基质胶铺在24孔板上,每孔200 μL;将铺好的24孔板置于37℃培养箱过夜。将培养1周的EPCs和SPCs 分别消化、离心,细胞沉淀分别用EPCs培养液和SPCs培养液重悬,每孔加1 mL细胞悬液,细胞数约6×105/孔,置于CO2培养箱内培养。当细胞融合度达80%~90%,在倒置显微镜下摄片。
2 结 果 2.1 EPCs、SPCs细胞形态的变化分离的单个核细胞用诱导培养液重悬后,镜下观察细胞悬浮于培养液中,大小不一,细胞透光度高(图 2A)。48 h后首次换液培养,换液前观察到部分细胞已贴壁,细胞大小不一,呈圆形,饱满,有突起(图 3A),此时从形态上看两类细胞无明显区别。EPCs原代培养4 d后有克隆形成,细胞克隆中间为细胞团,细胞团向周围“发出”短梭形、三角形、多角型细胞,呈放射冠样(图 2B);传代后,EPCs体积增大呈椭圆形,胞质丰富(图 2C);培养10 d左右,EPCs排列致密,单层融合呈“铺路石”状(图 2D)。SPCs原代培养6 d后,以细胞克隆团为中心向外呈放射性生长,周围细胞形态呈长梭形 (图 3B)。传代后SPCs呈长梭状,细胞增殖迅速,需2 d传代1次(图 3C)。培养14 d左右,SPCs生长融合时呈“峰-谷”状(图 3D),多层细胞交叉重叠生长而形成“峰”,两“峰”之间细胞呈单层或层数少为“谷”。
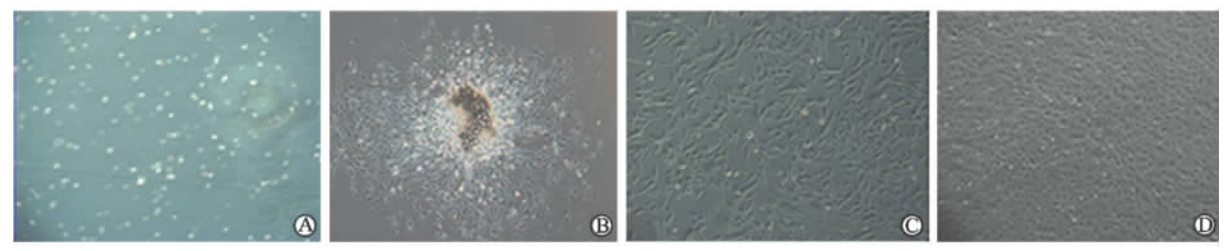 | 图 2 EPCs显微镜下形态Fig 2 Microscopic morphology of endothelial progenitor cells (EPCs) A: Newly isolated mononuclear cells; B: Colony-like growth of EPCs 4 d after culture; C: The EPCs was round and grew much bigger after subculture; D: The EPCs showed the so called stepping-stone appearance. Original magnification: ×10 (A,B,D); ×20 (C) |
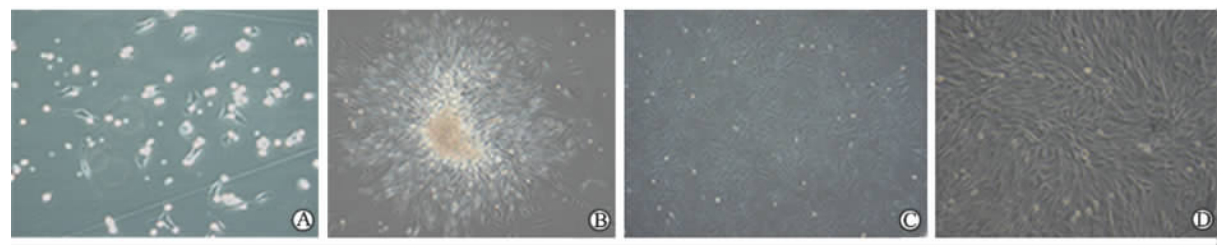 | 图 3 SPCs显微镜下形态Fig 3 Microscopic morphology of smooth muscle progenitor cells (SPCs)A: Mononuclear cells 48 h after culture; B: Colony-like growth of SPCs 6 d after culture; C: The SPCs were spindle-shaped; D: The SPCs showed the “peak-valley” appearance. Original magnification: ×10 (B,C); ×20 (D); ×40 (A) |
EPCs表达vWF(图 4A)、VEGFR-2(图 4B)、CD133(图 4C),不表达α-SMA(图 4D); SPCs表达α-SMA(图 5A、5B)、CD34(图 5C),不表达vWF(图 5D)和VEGFR-2。
 | 图 4 EPCs免疫荧光(A)和免疫细胞化学染色(B-D)鉴定Fig 4 Immunofluorescence (A) and immunocytochemistry (B-D) identification of endothelial progenitor cells (EPCs)EPCs were illustrated positive for von Willebrand factor (vWF) (A), vascular endothelial growth factor receptor-2 (VEGFR-2) (B),and CD133 (C); negative for α-smooth muscle actin (α-SMA) (D). Original magnification: ×40 |
 | 图 5 SPCs免疫荧光(A)和免疫细胞化学染色(B-D)鉴定Fig 5 Immunofluorescence (A) and immunocytochemistry (B-D) identification of smooth muscle progenitor cells (SPCs) SPCs was illustrated positive for α-smooth muscle actin (α-SMA) (A,B) and CD34 (C),negative for von Willebrand factor (vWF) (D). Original magnification: ×40 |
透射电镜下,EPCs呈不规则的扁平形,细胞核呈卵圆形,细胞核周围胞质丰富,胞质内可见大量吞噬小泡(图 6A),有ECs特征性的Weibel-Palade小体(W-P小体,图 6B);SPCs内含有与细胞纵轴平行排列的肌丝,分布在细胞核的周围,数量不等(图 6C、6D)。
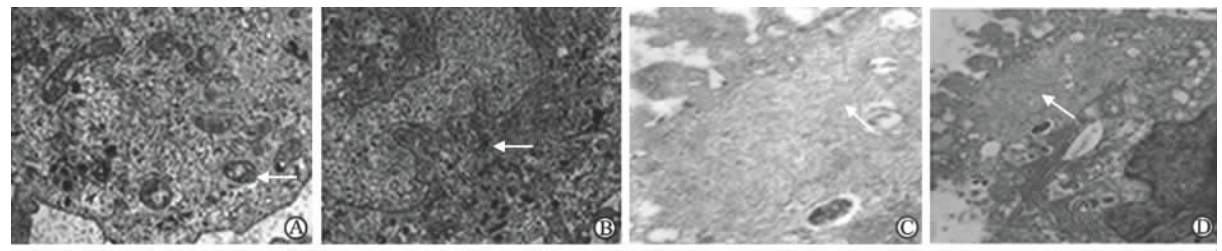 | 图 6 透射电镜下EPCs(A,B)和SPCs(C,D)的超微结构Fig 6 Ultrastructure of EPCs (A,B) and SPCs (C,D) by transmission electron microscopyEPCs: Endothelial progenitor cells; SPCs: Smooth muscle progenitor cells. A: The arrow indicates phagocytic vesicles in cytoplasm of EPCs; B: The arrow indicates Weibel-Palade bodies of EPCs; C,D: The arrows indicate myofilaments paralleling with the cell longitudinal axis in SPCs. Original magnification: ×10 000 (A,D); ×20 000 (B,C) |
将EPCs和SPCs分别接种在基质胶上培养24 h,EPCs在基质胶上生长时呈血管网状(图 7A),SPCs在基质胶上生长比较均匀,呈现不规则形态(图 7B)。
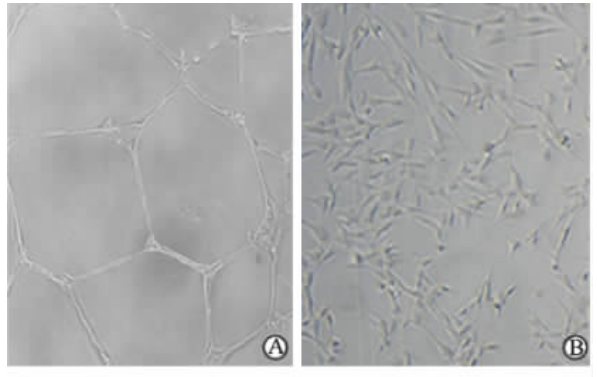 | 图 7 EPCs (A)和SPCs (B)在基质胶上的生长状态Fig 7 Growth state of EPCs (A) and SPCs (B) on matrigelEPCs: Endothelial progenitor cells; SPCs: Smooth muscle progenitor cells. A: EPCs grew on the matrigel in blood vessel-like form; B: SPCs grew on the matrigel in an irregular growth state. Original magnification: ×20 |
ECs和SMCs是组织工程化静脉瓣重要的种子细胞,以往构建组织工程化静脉瓣时获取种子细胞采用组织块贴壁培养法和酶消化法。贴壁法获取的是成熟的种子细胞,细胞活性低,增殖能力有限,而酶消化法会改变细胞表面分子的特性。EPCs是一类具有高增殖潜能的前体细胞,它不同于多向分化潜能的干细胞,介于干细胞和成熟细胞之间,在一定条件下可分化为成熟的ECs,具有生成血管的能力[4]。在脐带血、外周血、骨髓中均有EPCs存在,但前两者中的EPCs被证实均来源于骨髓[ 5 ]。SPCs是SMCs前体细胞,在体内外能直接分化为血管平滑肌细胞,在成体骨髓、外周血、动脉外膜、心脏及骨骼肌等外周组织中均存在[ 6, 7, 8, 9 ],但SPCs的起源尚未完全清楚[ 10 ]。
目前,诱导培养EPCs/SPCs种子细胞的方法主要为离体扩增培养法。在离体扩增培养法中细胞生长因子是诱导细胞分化的主要因素。诱导单个核细胞向EPCs分化的细胞因子主要是 VEGF,VEGF与EPCs表面的VEGFR-2结合,诱导EPCs增殖,并分化为ECs。诱导SPCs分化的细胞因子不一,转化生长因子β(TGF-β)、雌激素、PDGF-BB都可诱导干细胞分化成SMCs[ 11,12,13 ]。其中 PDGF-BB是一种强烈的细胞丝裂原,可通过激活多条信号通路而调节功能蛋白的磷酸化状态和相互作用,最终抑制或激活靶基因的表达。将人外周血单个核细胞接种到含PDGF-BB的EBM-2培养液中,培养出的细胞呈梭型,这类细胞表达成熟SMCs特异性标记如α-SMA、肌球蛋白重链等,还表达祖细胞的标记CD34,提示SPCs可能起源于这类CD34阳性的细胞[ 14 ]。另有研究发现EPCs可诱导为SPCs[ 15 ],说明ECs的前体细胞可能也是SMCs的前体细胞,因后天的微环境不同而分化为不同组织。已有报道人外周血EPCs在PDGF-BB作用下能分化为SMCs[ 16 ],以上研究提示ECs/SMCs可能来源于同一祖细胞,启发我们在诱导培养兔骨髓来源的EPCs时,同时向SPCs方向诱导分化,以便同步获取两类种子细胞。
本研究采用梯度密度离心分离了兔骨髓血单个核细胞,用含VEGF的EGM-2诱导培养后细胞扁平,呈现“铺路石”状排列,而经含PDGF-BB的EBM-2 诱导培养,细胞呈梭形外观。尽管这些细胞在形态上存在差异,但仅通过形态并不能将 EPCs与SPCs区分开来,我们采用了综合鉴定的方法,最大可能地对ECs和SMCs进行鉴定。实验分别选用了EPCs和SPCs的表面标记物CD133、vWF、CD34、VEGFR-2、α-SMA进行细胞鉴定,同时表达抗原CD133、CD34、vWF的细胞可以鉴定为EPCs[ 17 ]。同时透射电镜下观察2种细胞的超微结构特征,并做了在基质胶上形成毛细血管管道的成血管实验。从实验的结果看,EPCs体外培养早期细胞呈三角形、短梭形、多角形等多种形态,培养至10 d左右,呈现典型的“铺路石”样;SPCs在培养至14 d左右细胞呈现 “峰-谷”样SMCs生长状态。 细胞超微结构观察发现,EPCs胞质可见特征性W-P小体,SPCs胞质周边可见散在的肌丝状结构。细胞表面标记物鉴定显示EPCs表达CD133、VEGFR-2和vWF,不表达α-SMA;SPCs表达CD34、α-SMA,不表达vWF和VEGFR-2。成血管实验显示,EPCs在基质胶上生长时呈血管网状,而SPCs呈现不规则形态。
综上所述,本研究建立了从兔骨髓血分离的单个核细胞同步诱导培养EPCs和SPCs的方法,所培养的EPCs和SPCs具有成熟 ECs和SMCs的特征,又具有祖细胞的特征。 所诱导的种子细胞可以快速增殖分化,短时间培养的种子细胞的性能和数量可以满足构建组织工程化静脉瓣的需要。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Teebken O E,Puschmann C,Aper T,Haverich A,Mertsching H.Tissue-engineered bioprosthetic venous valve:a long-term study in sheep[J]. Eur J Vasc Endovasc Surg,2003,25:305-312. |
| [2] | Asahara T,Murohara T,Sullivan A,Silver M,van der Zee R,Li T,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275:964-967. |
| [3] | 温 昱,李 彬,党瑞山,张传森,张 喜,刘艳春.犬骨髓内皮祖细胞生物学特性及诱导分化[J].解剖学杂志,2008,31:317-321. |
| [4] | Arany P R,Mooney D J.At the edge of translation-materials to program cells for directed differentiation[J].Oral Dis,2011,17:241-251. |
| [5] | Shintani S,Murohara T,Ikeda H,Ueno T,Sasaki K,Duan J,et al.Augmentation of postnatal neovascularization with autologous bone marrow transplantation[J].Circulation,2001,103:897-903. |
| [6] | Sone M,Itoh H,Yamahara K,Yamashita J K,Yurugi-Kobayashi J,Nonoguchi A,et al.Pathway for differentiation of human embryonic stem cells to vascular cell components and their potential for vascular regeneration[J].Arterioscler Thromb Vasc Biol,2007,27:2127-2134. |
| [7] | Huang H,Zhao X,Chen L,Xu C,Yao X,Lu Y,et al.Differentiation of human embryonic stem cells into smooth muscle cells in adherent monolayer culture[J].Biochem Biophys Res Commun,2006,351:321-327. |
| [8] | Cesselli D,Beltrami A P,Rigo S,Bergamin N,D’Aurizio F,Verardo R,et al.Multipotent progenitor cells are present in human peripheral blood[J].Circ Res,2009,104:1225-1234. |
| [9] | Daniel J M,Bielenberg W,Stieger P,Weinert S,Tillmanns H,Sedding D G.Time-course analysis on the differentiation of bone marrow-derived progenitor cells into smooth muscle cells during neointima formation[J].Arterioscler Thromb Vasc Biol,2010,30:1890-1896. |
| [10] | Ferreira L S,Gerecht S,Shieh H F,Watson N,Rupnick M A,Dallabrida S M,et al.Vascular progenitor cells isolated from human embryonic stem cells give rise to endothelial and smooth muscle like cells and form vascular networks in vivo[J].Circ Res,2007,101:286-294. |
| [11] | Simper D,Stalboerger P G,Panetta C J,Wang S,Caplice N M.Smooth muscle progenitor cells in human blood[J].Circulation,2002,106:1199-1204. |
| [12] | Frid M G,Kale V A,Stenmark K R.Mature vascular endothelium can give rise to smooth muscle cells via endothelial-mesenchymal transdifferentiation[J].Circ Res,2002,90:1189-1196. |
| [13] | Hong J H,Song C,Shin Y,Kim H,Cho S P,Kim W J,et al.Estrogen induction of smooth muscle differentiation of human prostatic stromal cells is mediated by transforming growth factor-beta[J].J Urol,2004,171:1965-1969. |
| [14] | Kurpinski K,Park J,Thakar R G,Li S.Regulation of vascular smooth muscle cells and mesenchymal stem cells by mechanical strain[J].Mol Cell Biomech,2006,3:21-34. |
| [15] | Gong Z,Niklason L E.Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs)[J].FASEB J,2008,22:1635-1648. |
| [16] | Tanzi M C,Farè S.Adipose tissue engineering: state of the art,recent advances and innovative approaches[J].Expert Rev Med Devices,2009,6:533-551. |
| [17] | Wu Y,Zhang J,Gu Y,Li J,Chen B,Guo L,et al.Expansion of canine bone marrow-derived endothelial progenitor cells and dynamic observation[J].Ann Vasc Surg,2006,20:387-394. |
 2014, Vol. 35
2014, Vol. 35


