2. 解放军454医院药剂科, 南京 210002
2. Department of Pharmacy, No.454 Hospital of PLA, Nanjing 210002, Jiangsu, China
S100A6基因定位于人染色体的1q21区域,作为钙结合蛋白S100家族中重要的一员,主要通过与钙离子结合而参与细胞生长分化、基因调控和功能调节等全部活动[ 1 ]。 研究表明,S100A6在多种肿瘤细胞及组织中高表达,转移性淋巴结标本中S100A6阳性率为100%[ 2 ]。也有研究人员应用cDNA基因芯片检测食管腺癌与癌旁正常黏膜组织的差异表达基因,发现癌组织中S100A6基因表达水平显著高于正常组织[ 3,4,5 ]。而S100A6与食管癌的关系目前国内外尚未见报道。
食管癌是发生在食管上皮组织的恶性肿瘤,其发病率和死亡率在各国差异很大。我国是世界上食管癌高发地区之一,也是高死亡率的国家之一,每年平均死亡约15万人[ 6,7 ]。随着现代快节奏的生活方式及食品安全、环境污染问题的日益严重,食管癌在我国的发病率有逐年上升的趋势。在食管癌患者中,约20%~30%的患者病灶限于局部,目前常用的治疗方法为外科手术治疗,体积较大但仍属局部的肿瘤可以先施以化疗或放疗, 把肿瘤缩小到适宜手术的范围治疗[ 8 ]。但由于食管癌部位的特殊性,无论化疗、放疗还是手术疗法,都会对患者的日常生活造成巨大的影响。因此,寻找食管癌相关的癌基因,明确其作用机制,进而寻找以其为靶点的化学、基因治疗药物,显得尤为重要。 本研究通过shRNA干扰技术沉默S100A6基因表达,观察S100A6基因沉默对人食管癌细胞Eca109增殖活性及迁移能力的影响。
1 材料和方法 1.1 材料人食管癌细胞株Eca109购于中国科学院上海细胞生物学研究所; 细胞培养板、无菌枪头、一次性移液管均购于 美国Corning公司; DMEM培养基,胎牛血清(FBS),0.25%胰蛋白酶,Lipofectamine 2000转染试剂,四甲基偶氮唑盐(MTT)及二甲亚砜(DMSO)、TRIzol及反转录试剂盒均为美国Sigma公司产品; pshRNA-H1载体购于美国System Biosciences公司; 限制性内切酶 BamHⅠ和EcoRⅠ、DH5α感受态细胞、DNA 分子量标准及荧光定量试剂盒购于日本TaKaRa公司; 无内毒素质粒提取试剂盒为德国Qiagen公司产品; S100A6、GAPDH一抗及二抗均为美国Santa Cruz公司产品;蛋白提取试剂盒、BCA蛋白定量试剂盒及ECL发光试剂盒均购于美国Pierce公司。 细胞培养箱为美国Nuaire公司产品,移液器、离心机为德国Eppendorf公司产品,定量PCR仪为日本TaKaRa公司产品,电泳仪及垂直电泳设备为Bio-Rad公司产品,酶标仪及紫外分光光度检测仪为Thermo公司产品。 引物合成及测序在上海英骏生物技术有限公司完成。
1.2 shRNA重组表达载体构建登陆NCBI数据库查找人S100A6基因信息(NM_014624.3),根据美国Invitrogen公司的siRNA设计软件设计针对S100A6基因编码区的siRNA序列(表 1),同时选择通用的错配序列(NC)。根据siRNA序列,设计两条互补的DNA模板单链,模板链包括shRNA的正义链(sense)和反义链(antisense),中间以12个脱氧核苷酸的loop结构(5′-CTTCCTGTCAGA-3′)相连,后面接有RNA PolyⅢ聚合酶转录中止位点(TTTTT),同时模板链两端分别添加BamHⅠ(GGATCC)和EcoRⅠ(GAATTC)酶切位点,合成相应的DNA单链(PAGE级别)。用无菌水稀释合成好的单链DNA至20 pmol/L,然后进行DNA单链退火,形成互补的双链DNA。退火产物与线性化载体连接、 转化感受态细菌DH5α,涂布于平板,37℃过夜培养。在每组序列对应的平板上,使用无菌牙签挑取2个菌落,95℃处理10 min进行菌体裂解,然后加入PCR扩增体系,引物为载体多克隆位点两端的引物,上游引物: 5′-ATA TTT GCA TGT CGC TAT GTG-3′,下游引物: 5′-CAG GCT AGA TCT GGT CTA ACC A-3′,取PCR产物5 μL 进行2%琼脂糖凝胶电泳,筛选阳性菌落。对于筛选到的阳性菌落,提取质粒DNA后进行序列分析。对于测序正确的重组表达载体,扩增其对应的转化菌株,进行无内毒素质粒DNA提取,提取方法和步骤严格按照试剂盒说明书进行。
| 表 1 siRNA序列及其对应的双链DNA序列Tab 1 siRNA sequences and corresponding double-stranded DNA sequences |
取对数生长期Eca109细胞,用胰酶消化法制备细胞悬液,使用完全培养液(DMEM+10%FBS)调整细胞密度为1×105个/mL。将细胞接种到6孔板,每孔添加2 mL细胞悬液,37℃、5%CO2条件下培养24 h, 按照Lipofectamine2000转染试剂说明书进行质粒转染。实验分为错义序列组(Eca109+NC组)和基因沉默组(Eca109+siRNA1/siRNA2/siRNA3组),以未转染Eca109细胞作为空白对照组。转染后48 h,收集细胞,TRIzol裂解法提取总RNA,取1 μg RNA反转录制备cDNA,使用反转录引物Oligo(dT),然后取1 μL反转录产物进行PCR检测, 实验使用GAPDH(NM_002046.4)作为内参。 引物序列: GAPDH上游引物5′-ATC CCA TCA CCA TCT TCC AGG-3′, 下游引物5′-TGC TGA TGA TCT TGA GGC TGT-3′; S100A6上游引物5′- TTG GCC TCC TCG TGG CCA TC-3′, 下游引物5′-AGG AAG GTG ACA TAC TCC TG-3′。PCR反应总体系为20 μL:TaKaRa SYBR ○ R Premix Ex TaqTM 10 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA 2 μL,dH2O补足反应体系至20 μL。反应条件:95℃ 10 min,58℃ 20 min,72℃ 20 min,共35个循环。 应用2-ΔΔCt法分析基因相对表达量。
1.4 蛋白质印迹法检测转染后细胞中S100A6蛋白表达量收集转染后48 h的Eca109细胞,加入细胞裂解液 提取细胞总蛋白,95℃ 10 min处理蛋白变性,BCA法检测总蛋白浓度。每组样本取10 μL进行SDS-PAGE垂直电泳,其中分离胶浓度为12%,400 mA恒流45 min进行蛋白转膜,丽春红染色观察目的条带,后5%脱脂牛奶常温封闭2 h,加入TBST稀释的一抗(1800),4℃过夜孵育; TBST洗膜3次,加入小鼠二抗,室温孵育2 h,再洗膜3次,添加ECL发光液反应底物,进行X光曝片,扫描曝光底片,用相关图像分析软件进行目的条带光密度扫描分析。S100A6蛋白相对表达量=目的条带光密度值/参照蛋白条带光密度值。
1.5 MTT法检测S100A6基因沉默对肿瘤细胞增殖活性影响取转染后48 h的Eca109细胞,胰酶消化法制备细胞悬液,使用完全培养液调整细胞密度至1×105个/mL,接种细胞到96孔板,每孔100 μL,接种后正常条件培养,转染后24、48和72 h分别检测细胞活性。每孔加入10 μL 5 mg/mL的MTT溶液,继续培养4 h后吸去上清,每孔加入150 μL DMSO溶液,37℃下振荡15 min,用酶标仪于570 nm处检测光密度值,绘制细胞生长曲线。
1.6 细胞划线法检测S100A6基因沉默对肿瘤细胞迁移能力的影响取转染后48 h的Eca109细胞,胰酶消化法制备细胞悬液,锥虫蓝染色后进行细胞计数,使用完全培养液调整细胞密度至1×105个/mL,接种细胞到6孔板,每孔2 mL,接种后正常条件培养; 细胞培养24 h,使用无菌200 μL枪头划痕,再使用无血清培养液冲洗2次,加入含1%血清的培养液2 mL,正常条件培养; 划线后24、48和72 h分别用显微镜拍照,观察细胞迁移情况。
1.7 统计学处理应用SPSS 13.0 统计软件进行分析,数据结果以x±s表示,采用析因分析进行组间差异及组内差异的比较。检验水准(α)为0.05。
2 结 果 2.1 shRNA重组表达载体的构建我们针对S100A6基因编码区成功设计了siRNA序列并构建了3组shRNA重组表达载体,经测序分析发现,插入序列与设计序列完全一致(图 1)。
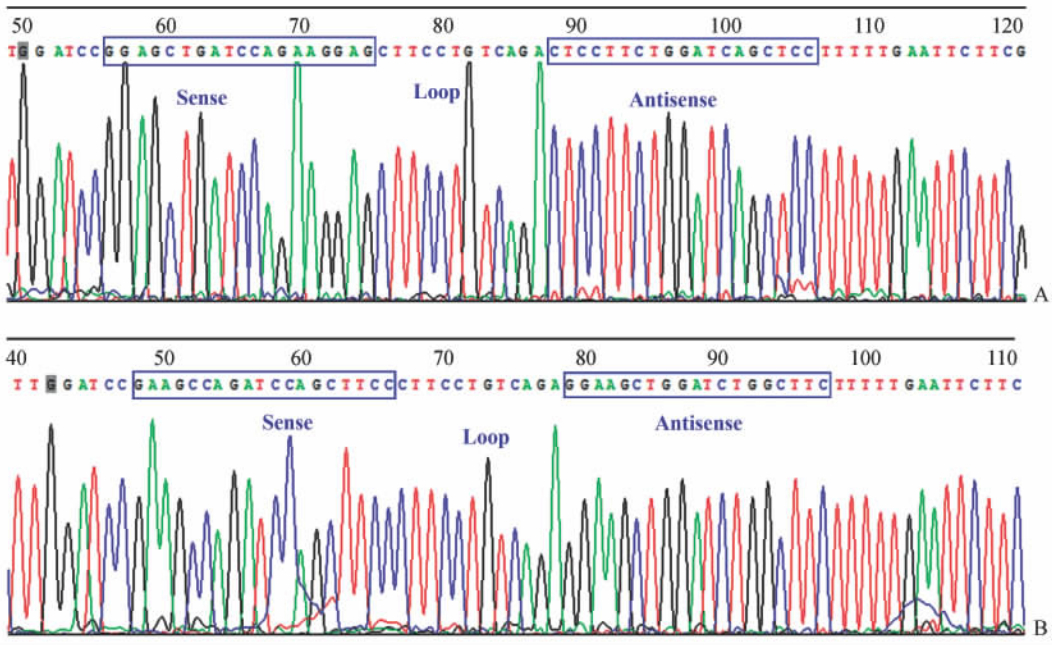 | 图 1 重组载体测序结果Fig 1 Sequence analysis of recombinant vectorA: shRNA2-S100A6; B: shRNA-NC-S100A6 |
2.2 Real-time PCR检测转染后细胞中S100A6 mRNA表达
结果如图 2所示,基因沉默组Eca109细胞中S100A6 mRNA表达量低于未转染组,差异有统计学意义(P<0.05,P<0.01);错义序列组与未转染组相比较,差异无统计学意义,说明shRNA结构或者转染试剂对细胞内目的基因表达量无明显影响。
 | 图 2 Real-time PCR检测Eca109细胞中S100A6 mRNA表达Fig 2 Real-time PCR detection of S100A6 mRNA expression in Eca109 cells*P<0.05,**P<0.01 vs blank control group. n=3,x±s |
2.3 蛋白质印迹法检测转染后细胞中S100A6蛋白表达
结果如图 3所示,基因沉默组Eca109细胞中S100A6蛋白相对表达量低于未转染组,差异有统计学意义 (P<0.05,P<0.01),其中2号序列的沉默效果最好。
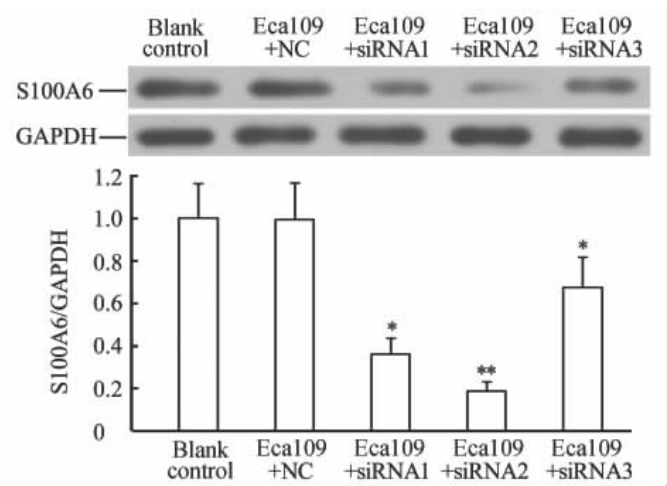 | 图 3 蛋白质印迹分析法检测Eca109细胞中S100A6蛋白表达Fig 3 Western blotting analysis of S100A6 protein expression in Eca109 cells*P<0.05,**P<0.01 vs blank control group. n=3,x±s |
2.4 S100A6基因沉默对肿瘤细胞增殖活性影响
检测结果(图 4)显示,未转染组Eca109细胞的增殖活性高于基因沉默组,48 h及72 h时差异有统计学意义(P<0.01);错义序列组与未转染组细胞相比较差异无统计学意义。
 | 图 4 MTT法检测Eca109细胞增殖活性Fig 4 MTT assay of proliferative activity of Eca109 cells**P<0.01 vs the same point in blank control group. n=3,x±s |
通过观察不同时间点细胞沿划线向内延伸生长速度,发现在细胞对数生长期,基因沉默组Eca109细胞的迁移能力低于错义序列组及未转染组,结果如图 5所示。
 | 图 5 细胞划线法检测Eca109细胞迁移能力Fig 5 Wound healing assay of migration of Eca109 cells Original magnification: ×120 |
3 讨 论
食管癌是消化道常见肿瘤,恶性化程度较高。我国是食管癌的高发国家,又是食管癌病死率最高的国家,全世界每年食管癌新发病例31.04万,我国约16.72万。我国食管癌病死率通常男性高于女性,男女之比约为21; 患病年龄多在50~69岁(约占60%)[ 9,10 ]。
S100 蛋白相对分子质量大约为9 000~13 000,目前共发现23 个S100蛋白家族成员,是蛋白超家族中最大的多基因家族。S100A6为S100 蛋白家族成员之一,在细胞内分布广泛,最初在腹水瘤中被检出,在细胞周期活动、细胞分化、肿瘤生长以及细胞外基质分泌活动等过程中发挥诸多功能。研究表明S100A6在多种肿瘤中表达异常,并与肿瘤的增殖、浸润转移和凋亡密切相关[ 11 ]。S100A6可以作为胰腺癌、胃癌和结肠癌等的肿瘤标记物[ 12 ],其对于肿瘤的影响首先与钙离子相关[ 13 ],其次与肿瘤常见的调控通路相关,如Wnt/β-catenin信号通路等。
基因沉默是一种转录后调控机制,首先在转基因植物中被发现,大量研究表明环境因子、发育因子、DNA修饰、组蛋白乙酰化程度、基因拷贝数、位置效应、生物的保护性限制修饰以及基因的过度转录等都与基因沉默有关[ 14 ]。作为基因沉默的一项新技术,RNA干扰(RNA interference,RNAi)的应用有望成为一种防治疾病的新方法。RNAi 具有特异、 高效的特点,因此可用于一些肿瘤的治疗。Zhou 等[ 15 ]在人类卵巢癌CaoV3 细胞系中特异性沉默血管内皮生长因子(VEGF)基因,结果显示肿瘤细胞增殖及侵袭能力明显下降,VEGF基因沉默可引起caspase-3 活性增强,MMP-9 和MMP-2 表达显著下降。Nalla等[ 16 ]将针对MMP-9及uPAR和cathepsinB设计的siRNA序列导入前列腺癌细胞株PC3和Du145细胞,结果显示目的基因表达量明显下调,细胞侵袭能力明显减弱,细胞凋亡明显增加。Patutina等[ 17 ]在体内肿瘤模型上针对MDR1基因进行RNAi实验,结果表明通过RNAi途径也可实现细胞耐药性逆转,同时对体内肿瘤模型抑制作用亦十分明显。
本实验通过在线siRNA软件设计了针对人S100A6基因的siRNA序列并成功构建了3组shRNA表达载体及对照质粒。转染后细胞中mRNA及蛋白相对表达量分析表明,3条siRNA序列均对目的基因有一定的沉默效果,其中2号siRNA序列沉默效果最好。MTT法检测结果显示,细胞在进入对数生长期后,相对于对照组,S100A6基因沉默组细胞增殖活性明显降低(P<0.01)。以上结果提示我们,S100A6在食管癌的发病及发展中有着重要而且关键的作用,可能成为潜在的食管癌基因治疗的靶点。Eca109是来源于人食管癌、具有代表性的食管鳞癌细胞株,属于高分化肿瘤细胞株,在食管癌的体外研究及裸鼠成瘤实验中多被用到。后续研究中,我们将对从Eca109细胞中取得的实验数据在多种食管来源的肿瘤细胞株中进行验证,以确定其是否具有普遍性。
目前食管癌的治疗主要包括化疗和手术疗法,化疗对患者产生巨大的不良反应,而手术疗法会对患者日常生活造成巨大影响。基因治疗作为一种靶向无创疗法, 一直是近年肿瘤治疗研究的热点,下一步我们将通过基因沉默结合靶向启动子,对食管癌进行靶向治疗研究,以为食管癌的基因治疗提供新的理论依据,也为以后的临床应用提供可行的思路。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Donato R.S100:a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J].Int J Biochem Cell Bio1,2001,33:637-668. |
| [2] | 张连海,王晓红,季加孚.胃癌防治研究:S100A6作为胃癌肿瘤标志物[C].第十三届中国科协年会第18分会场癌症流行病趋势和防控策略研讨会论文集,2011. |
| [3] | Zhang Q,Ye Z,Yang Q,He X,Wang H,Zhao Z.Upregulated expression of annexin Ⅱ is a prognostic marker for patients with gastric cancer[J].World J Surg Oncol,2012,10:103. |
| [4] | Hua Z,Chen J,Sun B,Zhao G,Zhang Y,Fong Y,et al.Specific expression of osteopontin and S100A6 in hepatocellular carcinoma[J].Surgery,2011,149:783-791. |
| [5] | Yang Y Q,Zhang L J,Dong H,Jiang C L,Zhu Z G,Wu J X,et al.Upregulated expression of S100A6 in human gastric cancer[J].J Dig Dis,2007,8:186-193. |
| [6] | 侯秋雨,韩 戟,单清华.食管胃胸腔内吻合口瘘的临床诊治研究[J].医学综述,2013,19:565-566. |
| [7] | 邹小农.食管癌流行病学[J].中华肿瘤防治杂志,2006,13:I0001-I0004. |
| [8] | 徐文鑫,徐广全.微创外科技术在食管癌治疗中的应用及临床意义[J].中华消化外科杂志,2013,12:74-77. |
| [9] | Wheeler J B,Reed C E.Epidemiology of esophageal cancer[J].Surg Clin North Am,2012,92:1077-1087. |
| [10] | 张思维,张 敏,李光琳,魏文强,孟凡书,刘志才,等.2003-2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012,21:241-247. |
| [11] | 李 晖,关宏伟.钙结合蛋白S100A6与肿瘤和细胞信号转导的相关研究进展[J].大连医科大学学报,2012,34:194-199. |
| [12] | 焦丽燕,应万涛,蔡 耘,钱小红.肿瘤研究中的蛋白质组学研究策略[J].肿瘤防治研究,2005,32:245-247. |
| [13] | Leśniak W,Slomnicki L P,Filipek A.S100A6-new facts and features[J].Biochem Biophys Res Commun,2009,390:1087-1092. |
| [14] | Grant S R.Dissecting the mechnaisms of posttranscriptional gene silencing:divide and conquer[J].Cell,1999,96:303-306. |
| [15] | Zhou J,Gan N,Zhang W,Lu W,Xie X.Proliferation suppression and apoptosis of ovarian carcinoma cells induced by small interfering RNA against vascular endothelial growth factor[J].J Obstet Gynaecol Res,2010,36:232-238. |
| [16] | Nalla A K,Estes N,Patel J,Rao J S.N-cadherin mediates angiogenesis by regulating monocyte chemoattractant protein-1 expression via PI3K/Akt signaling in prostate cancer cells[J].Exp Cell Res,2011,317:2512-2521. |
| [17] | Patutina O A,Mironova N L,Popova N A,Kaledin V I,Nikolin V P,Vlassov V V,et al.The siRNA targeted to mdr1b and mdr1a mRNAs in vivo sensitizes murine lymphosarcoma to chemotherapy[J].BMC Cancer,2010,10:204. |
 2014, Vol. 35
2014, Vol. 35


