2. 上海体育学院中国乒乓球学院, 上海 200438
2. The China Table Tennis College, Shanghai University of Sport, Shanghai 200438, China
基因组DNA的提取物作为分子生物学研究必需的一项技术手段,已被广泛应用于生物学及医学领域[ 1 ]。根据研究的目的不同,研究者对基因组DNA的完整性、纯度和得率也有不同要求[ 2 ],也需进行多种常用方法的比较分析[ 3,4,5 ]。K-ras突变通常被认为是胰腺癌发生的早期事件,对胰腺癌的诊断具有重要意义[ 6,7,8,9 ]。本实验室在胰腺癌的早期诊断研究中,拟对胰腺癌高危人群的外周血中的K-ras基因突变进行检测,研发胰腺癌筛查诊断试剂盒,这需要多中心、大样本的DNA抽提,必须事先对冻存血和新鲜血及不同抽提方法进行评估,以保证后期大规模实验的成功和成本核算。本研究比较了进口试剂盒、国产试剂盒和改良苯酚抽提法3种血细胞DNA提取方法对新鲜血细胞及冻血细胞DNA的提取效率,以寻找一种高效率、低成本的基因组DNA抽提方法。
1 材料和方法 1.1 标本来源、试剂及仪器外周血样本来源于长海医院消化内科及胰腺外科的胰腺癌患者,共20例,每例晨间抽取5 mL外周静脉血,EDTA-Na2抗凝。进口外周血DNA抽提试剂盒为Qiagen公司的QIAamp DNA Blood Mini Kit(Cat. No. 51104),国产外周血DNA抽提试剂盒为天根生化科技(北京)有限公司生产的血液基因组DNA抽取系统(货号:DP319-01),饱和酚购自上海生工生物工程技术服务有限公司,红细胞裂解液和DNA裂解液由本实验室配制。ND-1000核酸测定仪为Nano-Drop公司产品,电泳仪为Bio-Rad公司产品,低速离心机为上海飞鸽仪器厂产品,高速台式离心机为Hettich公司产品,水浴锅为上海精宏仪器厂产品,凝胶电泳成像系统为上海复日科技公司产品。
1.2 标本分组及处理抗凝全血950×g低速离心10 min,分离血浆和血细胞,用枪头小心吸除上层血浆至淡黄色层(此为密度不均一的白细胞宽带),将剩下的血细胞吹散、颠倒混匀后,吸取血细胞(200 μL或300 μL)用1.5 mL的EP离心管进行分组分装(表 1)。拟进行新鲜血细胞抽提的样品不经冻存,12 h内进行DNA抽提;拟进行血液冻存后抽提的样品,-40℃冻存72 h后,室温解冻,进行DNA抽提。
| 表 1 标本分组方案Tab 1 Specimen grouping |
采用吸附柱抽提方法,取200 μL血细胞,应用QIAamp DNA Blood Mini Kit试剂盒(同一货号不同批次随机选用),按说明书上的步骤进行操作。
1.3.2 国产试剂盒抽提采用吸附柱抽提方法,取300 μL血细胞,应用天根生化科技(北京)有限公司的血液基因组DNA抽取试剂盒(同一货号不同批次随机选用),按说明书上的步骤进行操作。
1.3.3 改良苯酚抽提法对源自于《分子克隆实验指南》的“新鲜抽取或冻存血细胞的裂解”[ 10 ]方法进行改良。主要对DNA裂解液成分进行了添加,配方如下:67 mmol/L Tris-HCl (pH 8.8), 16.6 mmol/L硫酸铵,5 mmol/L β-巯基乙醇,6.7 mmol/L MgCl2,6.7 μmol/L EDTA(pH 8.0),1.7 μmol/L SDS,50 μg/mL 蛋白酶K。硫酸铵可以降低裂解液中的蛋白含量及去除RNA,提高DNA的得率。β-巯基乙醇是一种还原剂,可以防止DNA提取过程中细胞内物质发生褐变,以免对实验结果产生影响。MgCl2是为了增加ETDA的螯合作用。操作过程如下:取300 μL血细胞,加1 mL红细胞裂解液(10 mmol/L Tris-HCl(pH 7.6),1% Triton X-100), 振荡混匀,950×g离心10 min,弃上清。如此重复2次,裂解红细胞。然后,向沉淀中加300 μL DNA裂解液,振荡混匀,55℃水浴1 h,再放入85℃水浴10 min。而后,加入等体积饱和酚、氯仿各抽提1次,取上清,加1/10体积的3 mol/L 乙酸钠,再加入等体积的异丙醇,上下颠倒混匀;室温放置5 min后, 15 290×g,离心5 min,弃上清。再加1 mL 70%乙醇, 15 290×g,离心5 min,弃上清,用滤纸尽量吸干废液,放超净台吹风,晾干。用30 μL无核酸纯净水溶解沉淀。
1.4 DNA质量检测 1.4.1 琼脂糖凝胶电泳检测取5 μL DNA样品,用含溴化乙啶的1%琼脂糖凝胶进行电泳,凝胶成像系统分析电泳结果并成像。
1.4.2 核酸蛋白测定仪检测取1 μL DNA样品,使用ND-1000核酸测定仪进行吸光谱带扫描,检测D260/D280的值及DNA浓度。根据溶解体积和抽提血量,计算3种方法抽提DNA的得率(ng/mL);按一次抽提所用的血细胞量,计算3种方法对新鲜和冻存血细胞样本抽提获得的血DNA总量;按各自方法最后推荐的溶解体积,计算3种抽提方法对新鲜和冻存血细胞样本抽提获得血DNA的浓度。
1.5 统计学处理使用SPSS 13.0软件分析数据,各组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结 果 2.1 三种方法所提取的DNA的完整性比较对随机挑取的新鲜及冻存血细胞4例血样用3种DNA抽提方法抽提获得的DNA进行琼脂糖凝胶电泳,以检测DNA质量。如图 1所示,3种方法抽提的DNA主条带基本一致,但进口和国产试剂盒抽提的DNA均表现出一定程度的小片段模糊影,而改良苯酚法抽提的DNA无此模糊影。
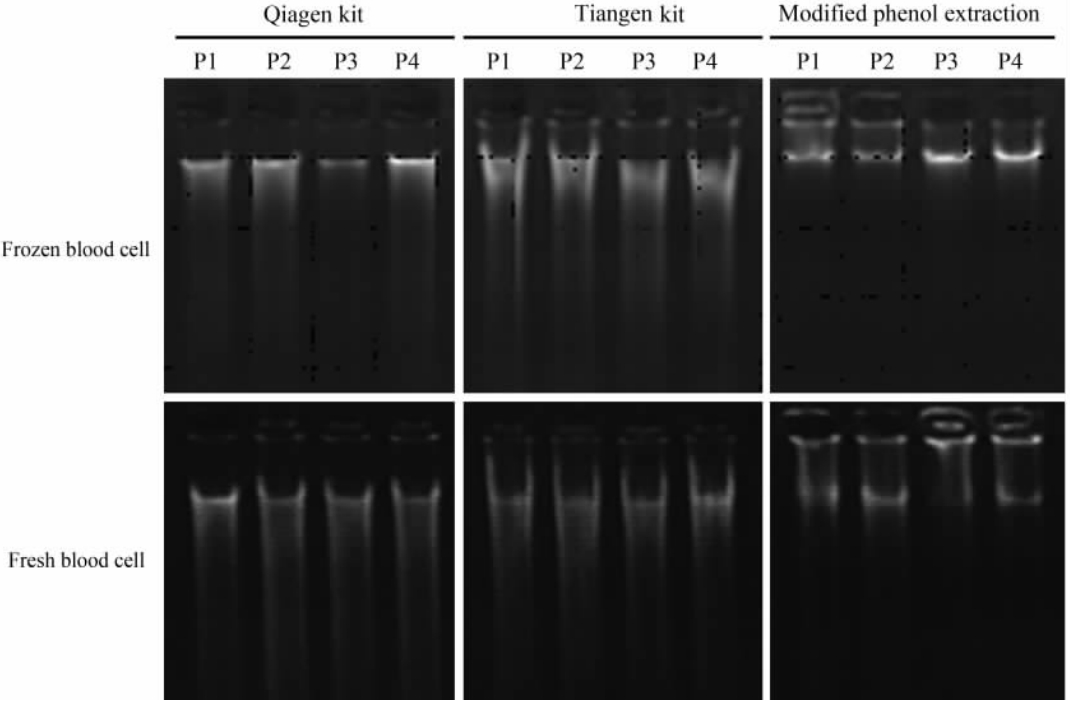 | 图 1 琼脂糖凝胶电泳检测3种DNA抽提方法获得的DNA完整性Fig 1 Detection of DNA obtained with different DNA extraction methods by agarose gel electrophoresis P1-P4: Four randomly selected blood samples |
用核酸蛋白测定仪对抽提的所有样品进行吸光谱带扫描,发现吸光谱带扫描的主吸收峰均在260 nm处,但部分冻存血细胞在230 nm处显示出杂峰。图 2所示为上述随机挑取的4例血样的3种DNA抽提方法获得的DNA的检测结果。采用3种DNA抽提方法对新鲜血细胞及冻存血细胞抽提获得的DNA的D260/D280比值的均数及标准差、中位数及最小数和最大数结果见表 2,各组之间进行单因素方差分析,差异无统计学意义。
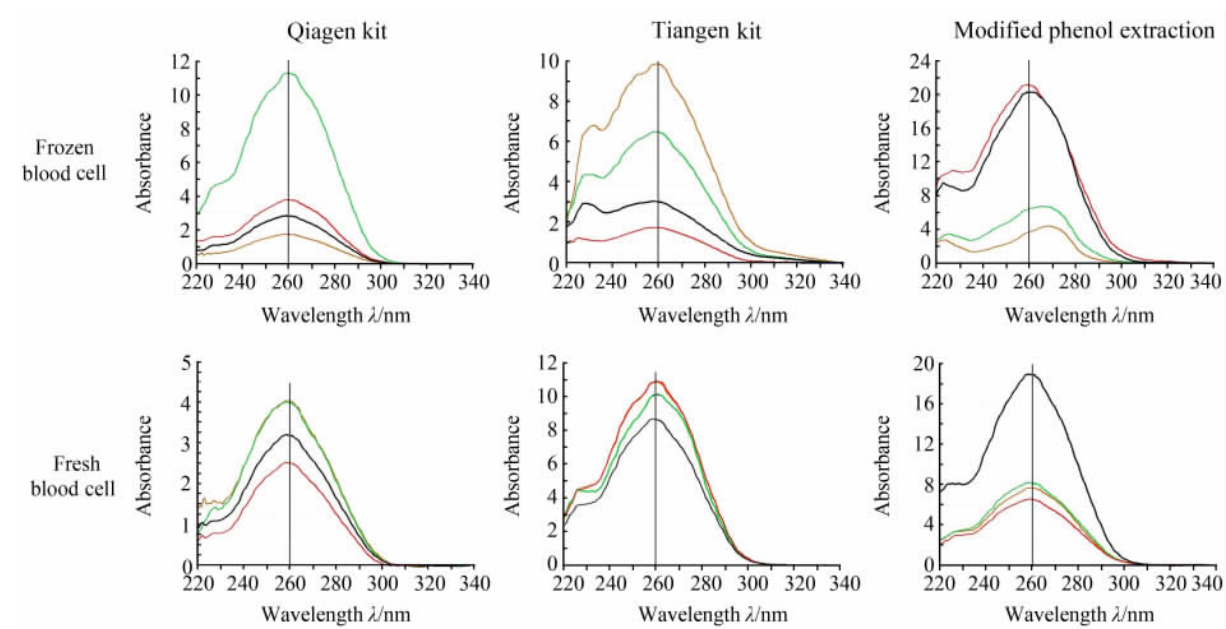 | 图 2 核酸蛋白检测仪检测3种抽提方法获得的DNA吸光谱带Fig 2 Detection of DNA obtained with different DNA extraction methods by protein nucleic acid detector The different curves indicate the four randomly selected blood samples in Fig 1 |
| 表 2 核酸蛋白检测仪检测3种DNA抽提方法获得的DNA的D260/D280比值Tab 2 D260/D280 ratios of DNA obtained by 3 different extraction methods by protein nucleic acid detector n=20 |
ND-100核酸测定仪测得3种方法抽提获得的DNA浓度均在330 ng/μL左右,各组之间差异无统计学意义。3种方法抽提DNA的得率如图 3所示,无论新鲜和冻存血细胞,均是进口试剂盒得率最高,分别为(82.6±8.1) ng/mL和(81.4±10.3) ng/mL;其次为国产试剂盒;苯酚抽提冻存血细胞的DNA得率与国产试剂盒相当,得率最低的是苯酚抽提新鲜血细胞DNA,为(32.9±4.0) ng/mL。3种抽提方法对新鲜和冻存血细胞样本抽提获得血DNA总量的中位数(最小值,最大值)为15.7(8.0,20.0) μg,DNA浓度的中位数(最小值,最大值)为319.5(239.1,400.5) ng/μL。这些结果表明,本实验中3种抽提方法获得血DNA质量均可满足一般分子生物学检测需要。
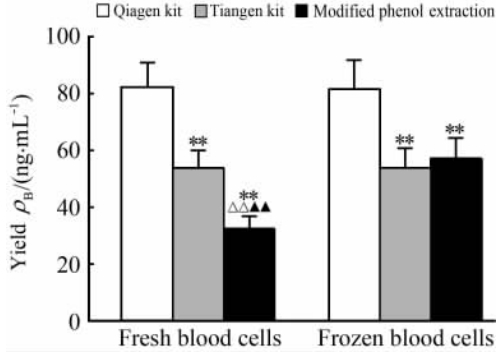 | 图 3 不同DNA抽提方法获得的DNA得率比较Fig 3 Comparison of DNA yield obtained by different extraction methods**P<0.01 vs the same blood samples extracted with Qiagen kit; △△P<0.01 vs the same blood samples extracted with Tiangen kit; ▲▲P<0.01 vs the frozen blood samples extracted with the same modified manual extraction method. n=20,x±s |
两种试剂盒抽提血细胞DNA一般需要耗时1 h,改良苯酚法抽提耗时1.5 h。国产天根生化科技(北京)有限公司试剂盒一次价格约为10元,进口Qiagen试剂盒价格约为20元,改良苯酚抽提约需3~4元。 3 讨 论
本研究对采用3种不同的抽提方法抽提血细胞DNA的效率进行了全面的比较研究,同时比对了新鲜血细胞和冻存血细胞用同一方法抽提的效率差异。结果表明,改良苯酚抽提法可获得较进口Qiagen和国产天根生化科技(北京)有限公司试剂盒片段更长、更完整的基因组DNA,虽然在得率和耗时方面稍逊色,但其成本较低,可推荐用于大规模、分批次、低成本冻存血细胞的基因组DNA抽提。
在抽取新鲜血细胞和冻存血细胞DNA的差异分析中,我们发现,两者在DNA得率之间没有显著差异,仅仅发现在改良苯酚抽提时,冻存血细胞具有更高的得率,原因可能在于苯酚抽提法的裂解液在短时间内作用不够充分,而冻存可能使血细胞裂解得更为彻底,从而获得更高的得率。另一方面,也表明试剂盒的裂解能力是充分的[ 11 ]。其次,在获得DNA完整性和纯度方面,虽然各组的D260/D280比值之间差异无统计学意义,但是,从吸光谱带扫描检测中可以发现,冻存血可导致部分样品 在230 nm处出现杂质峰,其性质有待进一步分析。
分析3种抽提方法的实验操作,我们发现进口Qiagen试剂盒抽提时需要的血量少,耗时短,操作简便,但成本较高。国产天根生化科技(北京)有限公司试剂盒使用时操作也很简便,耗时短,需要的血量比进口试剂盒多出100 μL,其成本也相对低于进口试剂盒。改良苯酚抽提方法需要的标本量和国产试剂盒相同,操作时间略多于试剂盒所需的时间,但操作也相对简便,其成本最低。
本研究在方法学上获得了一些差异结果,考虑导致这些差异的原因可能为多方面的:首先是抽提原理的不同,吸附柱抽提主要靠材料的吸附能力大小,国产和进口的吸附材料的品质不同可能是造成这两种试剂盒差异的主要原因;改良苯酚法主要靠乙醇沉淀。其次是裂解液的不同,冻存血和新鲜血的差异可能主要在于细胞裂解程度的差异。在进行3种抽提方法之间的差异分析时,由于本实验室长期进行DNA标本的抽提,所以有多批次的进口和国产抽提试剂盒,在实验中我们对所用的试剂盒进行随机化处理,在同一货号不同批次随机选用,具有一定的普遍意义。但不能据此数据,随意扩大推论到所用进口和国产试剂盒的比较。
综上所述,3种抽提方法均具有其特点,本研究从多个层次上评估了实验室常用3种外周血DNA抽提方式的实用性,为今后的实验合理选用DNA抽提方法提供了可靠的依据。为进行小样本、完整性好和纯度高的血细胞基因组DNA抽提,推荐采用新鲜血细胞改良苯酚抽提方法;为进行大规模、分批次、低成本抽提血细胞基因组DNA,推荐采用冻存血细胞改良苯酚抽提方法;为进行快速血细胞DNA抽提,推荐采用进口和国产试剂盒。本试验室前期进行胰腺癌早期筛查与早期诊断研究中,血细胞样品收集具有多中心、大样本和冻存时间长等特点[ 12 ],因此采用改良苯酚抽提获得的DNA样品可有效用于靶基因的PCR检测。本研究为今后开展类似工作提供了技术支持。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Sharma R,Virdi A S,Singh P.A novel method for whole blood PCR without pretreatment[J].Gene,2012,501:85-88. |
| [2] | Regan J F,Furtado M R,Brevnov M G,Jordan J A.A sample extraction method for faster,more sensitive PCR-based detection of pathogens in blood culture[J].J Mol Diagn,2012,14:120-129. |
| [3] | 齐 麟,郜 杨,向志明,张 彤.血液痕迹中DNA抽提方法的比较与优化[J].河南大学学报:自然科学版,2011,41:505-510. |
| [4] | 刘孟黎,韦小谦.两种DNA抽提方法的操作过程及影响因素分析[J].现代检验医学杂志,2006,21:60-61. |
| [5] | 刘丽荣,张小蕾.不同DNA抽提方法在乳腺癌血清循环DNA提取中的效果比较[J].吉林医学,2010,31:2368-2369. |
| [6] | Huang H,Daniluk J,Liu Y,Chu J,Li Z,Ji B,et al.Oncogenic K-Ras requires activation for enhanced activity[J].Oncogene,2013 Jan 21.doi:10.1038/onc.2012.619. |
| [7] | Wang W,Liao Z,Li G,Li Z S,Chen J,Zhan X B,et al.Incidence of pancreatic cancer in Chinese patients with chronic pancreatitis[J].Pancreatology,2011,11:16-23. |
| [8] | 朱艳平,李泉江,高 军,顾俊骏,黄浩杰,李兆申.胰腺癌及相关胰腺疾病组织中K-ras12、13密码子突变的检测及其临床诊断价值[J].中华胰腺病杂志,2012,12:246-249. |
| [9] | 顾俊骏,高 军,路 华,李兆申.K-ras基因突变的定量检测在胰腺疾病诊断中的应用[J].世界华人消化杂志,2011,19:94-97. |
| [10] | 萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].3版.黄培堂,等译.北京:科学出版社,2002:467. |
| [11] | Laus S,Kingsley L A,Green M,Wadowsky R M.Comparison of QIAsymphony automated and QIAamp manual DNA extraction systems for measuring Epstein-Barr virus DNA load in whole blood using real-time PCR[J].J Mol Diagn,2011,13:695-700. |
| [12] | Ben Q,Wang K,Yuan Y,Li Z.Pancreatic cancer incidence and outcome in relation to ABO blood groups among Han Chinese patients:a case-control study[J].Int J Cancer,2011,128:1179-1186. |
 2014, Vol. 35
2014, Vol. 35


