扩展功能
文章信息
- 魏铭聪, 许天福, 贝科奇, 金光荣, 刘肖, 曹玉清, 刘娜
- WEI MingCong, XU TianFu, BEI KeQi, JIN GuangRong, LIU Xiao, CAO YuQing, LIU Na
- 富含微生物体系内温压条件对自生碳酸盐岩和铁硫化物形成的影响
- Eeffect of the Temperature and Pressure Conditions on the Formation of Authigene Carbonate Minerals and Iron Sulfide in a Microorganisms System
- 沉积学报, 2018, 36(4): 664-673
- ACTA SEDIMENTOLOGICA SINCA, 2018, 36(4): 664-673
- 10.14027/j.issn.1000-0550.2018.053
-
文章历史
- 收稿日期:2017-06-30
- 收修改稿日期: 2017-09-08
2. 吉林大学地球科学学院, 长春 130021
2. College of Earth Sciences, Jilin University, Changchun 130021, China
自生矿物主要包括碳酸盐类、硫化物类、硫酸盐类和自然铝[1-4]。其中,碳酸盐和铁硫化物是海洋沉积层中重要的矿物,可指示特殊的沉积环境,是天然气水合物存在的重要标志。海洋中碳酸盐的形成和沉积使得地球表面80%的碳被固定[5],因此,碳酸盐也是地球上重要的储碳物质。
海底沉积层中自生碳酸盐和铁硫化物的形成与微生物活动密切相关[6]。研究发现,甲烷渗漏区自生碳酸盐和铁硫化物的形成与甲烷氧化古菌(Anaerobic methanotrophic archaea, ANME)和硫酸盐还原菌(Sulfate reducing bacteria, SRB)有关[7-9]。在适宜条件下,甲烷和硫酸盐分别被微生物氧化和还原产生HS-和HCO3-,为铁硫化物和碳酸盐岩形成提供阴离子[8]。微生物代谢产生的HS-和HCO3-是自生矿物产生的重要物源,物源浓度和自生矿物的形成均受温度控制[10-11]。学者对于海洋自生碳酸盐和硫化物形成的研究,多停留在野外调查和室内分析阶段,暂未进入实验模拟阶段。
碳酸盐和铁硫化物的形成是复杂的反应动力学和热力学过程[11]。研究发现,压力影响动力学过程,压力升高,海水中硫化氢和二氧化碳气体分压(pH2S、pCO2)增大[12-13],pH降低,pS2-(S2-的对数值)升高,当达到临界值时,自生碳酸盐和铁硫化物分别产生溶解和沉淀。同时,温度在自生碳酸盐和铁硫化物形成过程中起着至关重要的作用。Rickard et al.[14]在25 ℃~125 ℃条件下研究铁硫化物与H2S反应形成黄铁矿的反应机理时,发现反应的阿仑尼乌斯能与温度相关,温度直接控制着反应电子能和FeS的活性。Morse et al.[11]通过实验发现,温度会影响文石和方解石的沉淀比例,温度较高时,文石沉淀多;相反,方解石沉淀较多。前人对于碳酸盐和黄铁矿的研究,取得较多成果。然而,模拟海底条件,还原自生矿物早期形成过程的实验研究暂未开展。
自生碳酸盐和铁硫化物的形成是复杂的微生物地球化学过程,在实验室开展相关研究难度较大。以往研究碳酸盐和铁硫化物形成实验时,多无微生物的参与[11-12, 14],亦无模拟海底的温压条件。本文报道由自主研发的反应系统,模拟海底低温高压条件,用于研究微生物作用下自生矿物形成的温压条件。利用此系统,在低温高压、饱和甲烷条件下,模拟海底水化学环境及微生物条件,探讨温压对水化学环境及自生碳酸盐和铁硫化物形成的影响。以期还原自生矿物的早期形成过程,明确自生矿物的形成机理。
1 材料与方法 1.1 菌种富集与母菌制备从某石油污染场地取含油黑色淤泥样品(取样点位于潜水位下部的厌氧沉积层)。将样品装入充满氮气的三层PEI铝袋中,在4 ℃下保存。将保存的样品在厌氧操作台中,注入到去氧灭菌水中并震荡静置;取上清液转接入液体培养基[10, 15]。微生物的培养操作据文献[15]。
重复上述步骤两次,获得的浓度较高和菌种组分稳定的母菌(经鉴定硫酸盐还原菌和甲烷氧化菌超过总菌量的30%),用于反应釜实验。
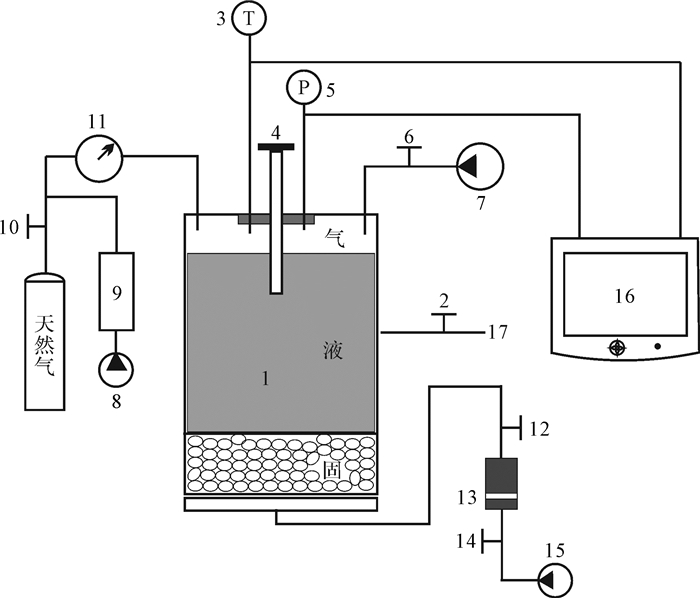
1.2 低温高压反应装置海底甲烷渗漏区存在一个厚度小于60 m、温度低于15 ℃的缺氧沉积带—硫酸盐还原—甲烷厌氧氧化带(Sulfate-Methane Transition Zone, SMTZ)[13, 16-17],自生碳酸盐和铁硫化物在此带分布广泛且含量较高[18-21]。
SMTZ所处水深一般为几百至几千米,压力在几十至几百个大气压之间,温度处于0 ℃~15 ℃之间[2, 4, 22-23]。在进行实验装置设计时,应使实验温压与SMTZ接近。同时,应保证设计的实验装置在上述低温和高压条件下能正常运行。为实现研究目标,自主设计了符合上述条件的实验装置。实验装置及其主要技术指标如图 1和表 1。
| 项目 | 技术指标 |
| 内胆组成 | 哈氏合金 |
| 有效容积 | 1 L,高度与直径比为2:1 |
| 最大工作压力 | 20 MPa,设计安全压力为:25 MPa |
| 工作温度 | -15 ℃~90 ℃,测量精度:0.1%FS |
反应溶液组分及其入釜前处理据文献[15]。实验步骤主要包括菌液注入、温压调节、取样测试和矿物分析四个步骤,具体如下:
(1) 将母菌注入已灭菌的微生物容器中,保持控制阀14(图 1)处于拧紧状态,随后拧紧阀12;将灭菌后的石英砂200 g和花岗岩磨片(Granite abrasive disc, GAD,由石英、钠长石和钾长石组成)两片装入反应釜中;继续往反应釜中注入灭菌后的反应溶液670 mL,将保存于微生物容器内的母菌注入反应釜内。
(2) 当反应釜内达设计实验温度并稳定后,往反应釜内注入甲烷气体直至压力达到实验所需。待温度和压力都保持稳定后,开始第一次取样,此时实验时间记为0。
(3) 实验开始后,每隔一段时间用真空取样器取水样,测试水样中的光密度pH,ORP,HCO3-和S2-的浓度。
(4) 实验结束后,从釜中取出花岗岩磨片,用酒精洗表面,烘干后编号,在密封干燥条件下送至矿物分析鉴定中心,进行测试。
1.4 分析方法利用哈希HQ40d对pH和ORP进行测定,前者精度为±0.01,后者分辨率为0.1 mV。哈希DR2800分光光度计在波长为665 nm下测定S2-浓度(亚甲基蓝法),其测量范围5~800 μg/L。HCO3-离子浓度采用酸碱中和滴定法测定,单位为mg/L。
通过吉林大学古生物中心实验室配置的JSM-6700F型扫描电镜(Scanning electron microscope, SEM)和INCAX-SIGHT型能谱仪(energy-dispersive X-ray spectrometer, EDS, Oxford, UK),分别对自生矿物的形态和组分进行观察及鉴定。
1.5 反应条件实验过程中,反应釜内压力由甲烷气体提供。低温条件下,当压力过高时,容易破坏甲烷在系统内的三相平衡,形成甲烷水合物[25-27]。其形成会使反应釜内液相体积减小,影响测试结果。为防止次生甲烷水合物生成,并结合甲烷渗漏区沉积层的温度和压力条件,选定了实验温度和压力(表 2)。实验组1,2和3,探讨不同温度对自生矿物形成的影响。实验组4,5和6研究在10 ℃时,不同压力对自生矿物形成种类及形态的影响。
| 实验编号 | 温度/℃ | 压力/MPa |
| 1 | 5.0 | 5.0 |
| 2 | 8.0 | 5.0 |
| 3 | 10.0 | 5.0 |
| 4 | 10.0 | 2.5 |
| 5 | 10.0 | 5.0 |
| 6 | 10.0 | 7.5 |
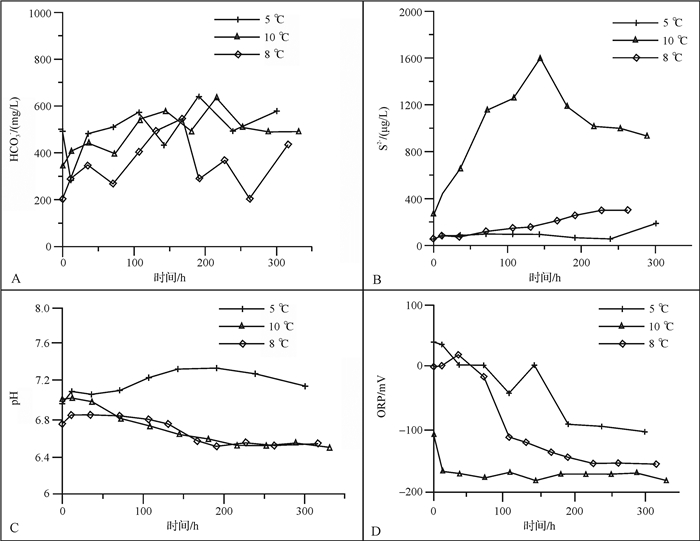
实验过程中,微生物的代谢和相关地球化学作用对系统内的水化学组分和性质产生影响[13, 28-29]。不同温度实验的水化学组分和性质变化曲线如图 2所示。由曲线可知,5 ℃,8 ℃和10 ℃实验中,HCO3-浓度随时间呈先上升后下降趋势(图 2A),HCO3-浓度变化范围分别为283.07~639.93 mg/L,202.55~549.78 mg/L和347.23~636.59 mg/L。这表明温度升高,HCO3-浓度变化范围变小。图 2B显示,5 ℃和8 ℃中S2-浓度都呈上升趋势;10 ℃曲线在144 h前一直上升,后开始下降,表明伴随着温度升高,S2-浓度也增大。HCO3-和HS-(或S2-)是微生物代谢的直接产物[8, 30],当它们从微生物细胞内部排放至外部时,引起周围环境的HCO3-和HS-浓度变化,实验结果表明微生物的代谢能力较好。在适应条件下,HCO3-和HS-可与阳离子反应形成沉淀[31]。
|
| 图 2 5 ℃,8 ℃和10 ℃中离子组分和水化学性质随时间的变化 Figure 2 Changes of ion componets and water chemical properties over time in experiments process at 5 ℃, 8 ℃and 10 ℃ |
不同温度下pH在6.5~7.4之间变化(图 2C),表明温度的改变,对pH的影响不大。在不同温度的甲烷渗漏区沉积层的孔隙水中,pH一般保持在5.2~7.9之间[16, 32]。因此,可以断定,在甲烷渗漏区沉积层物质变化过程中,pH保持在一个相对稳定的区域内。ORP随时间先下降后逐渐达到稳定,最终维持在负值(还原环境);温度升高,ORP(负值)越大(图 2D)。从图 2B和2D可以看出,S2-浓度与ORP之间存在较好的相关性,这与前人的研究相同[33]。
2.1.2 自生矿物方解石、白云石、文石、镁方解石和黄铁矿是海底甲烷渗漏区沉积层中分布较为广泛的自生矿物[1-2, 5, 34-35]。图 3,图 4和图 5显示,本次实验中形成的自生矿物种类(白云石和镁方解石未列出)与实际甲烷渗漏区相似,且自生矿物在SEM下呈亮白色和灰色。

|
| 图 3 不同温度下碳酸盐形态对比(方框圈出部分)(左至右分别放大2 000,1 500和2 000倍) Figure 3 SEM images of calcite minerals morphology at different temperatures(minerals were surrounded by square) (they are respectively amplified 2 000, 1 500 and 2 000 times from left to right) |

|
| 图 4 不同温度下菱铁矿形态对比(方框圈出)(左至右分别放大2 000,1 000和1 500倍) Figure 4 SEM images of siderite minerals morphology at different temperatures(minerals were surrounded by square and pointed out by arrow) (they are amplified 2 000, 1, 000 and 1 500 times from left to right, respectively) |

|
| 图 5 不同温度下铁硫化物形态对比(黄色方框圈出和箭头指出)(左至右分别放大1 100,1 500和1 000倍) Figure 5 SEM images of iron sulfide minerals morphology at different temperatures (minerals were surrounded by square or pointed out by arrow) (they are amplified 1 100, 1 500 and 1 000 times from left to right, respectively) |
图 3是5 ℃,8 ℃和10 ℃条件下形成的碳酸钙在SEM下的形态。图 3a中碳酸钙矿物呈三棱柱和不定型块状,图 3b和3c中分别呈棱块状和砾状。结果表明,不同温度下碳酸钙形成分布较少。
图 4显示不同温度下形成的菱铁矿的形态:5 ℃形成的菱铁矿呈长方体状(图 4a),10 ℃中呈花簇状(图 4c),8 ℃中分布较散却无固定的形态。统计不同温度下菱铁矿分布时发现,温度升高,分布增多。
图 5a中铁硫化物呈块状,分布较少;图 5b中铁硫化物呈圆球状和棒状,分布范围较广;图 5c中铁硫化物未形成较好的形态,但分布面积较大。对比实验结果发现:铁硫化物分布范围从小到大分别为5 ℃,8 ℃和10 ℃。结合图 2B推断,温度升高,S2-浓度越高,利于铁硫化物形成。
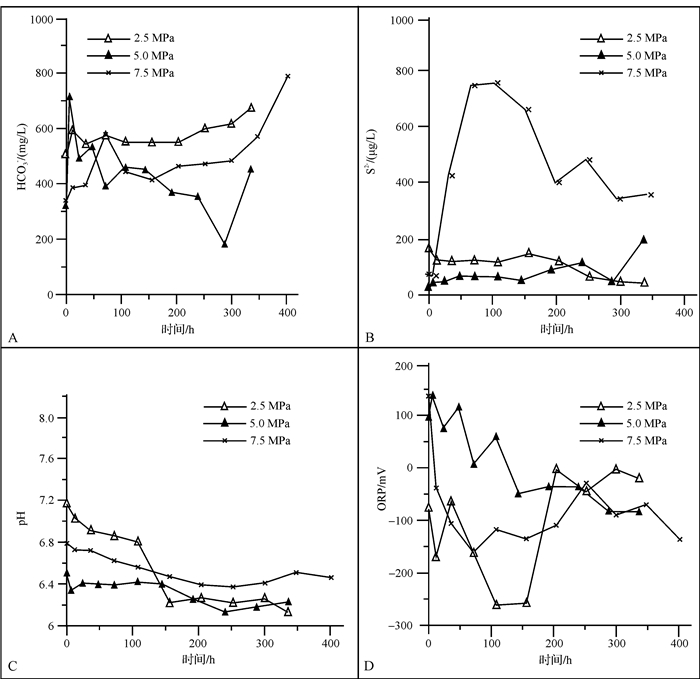
2.2 不同压力 2.2.1 水化学性质和组分图 6分别是2.5 MPa,5.0 MPa和7.5 MPa实验(分别为实验4,5和6)中HCO3-及S2-浓度,pH及ORP随时间变化的曲线。图 6A可看出,HCO3-浓度在低压和高压中随时间呈上升趋势,在5.0 MPa中随时间呈先快速上升后缓慢下降的趋势。HCO3-浓度变化范围338.55~789.95 mg/L(实验6),其次为324.08~572.90 mg/L(实验5),最小为506.37~674.20 mg/L(实验4)。这表明,压力增加,微生物代谢生成的HCO3-量增加。
|
| 图 6 2.5 MPa,5.0 MPa和7.5 MPa实验过程离子组分和水化学性质随时间的变化曲线 Figure 6 Changes of ion componets and water chemical properties over time in experiments process at 5 MPa, 8 MPa and 10 MPa |
从图 6B可知,S2-浓度在几十至几百微克之间变化。实验6中S2-浓度变化范围为75~760 μg/L,与实验3变化趋势相似(图 2B);实验4和实验5分别呈下降和上升趋势。因此,压力升高,S2-浓度变化范围变大。图 6C显示,pH曲线整体呈下降趋势,其值保持在6.1~7.2之间。结合图 6A和6B发现,HCO3-和S2-浓度变化大时,pH变化范围小。
图 6D是不同压力下ORP随时间变化的曲线。实验4前期先上升后下降再上升,最后保持稳定,变化范围为-262.0~-2.5 mV;实验5中,ORP整体呈下降趋势,变化范围为-83.6~137.0 mV;实验6表现为先下降后上升,最后下降,ORP变化范围为-162.0~136.6 mV。三组实验中,ORP最终维持在-180.0~-50.0 mV之间,可以推测此区间利于微生物生长代谢。结合图 6C和6D可知,S2-浓度变化范围越大,ORP变化范围也越大,即S2-浓度和ORP变化范围呈正相关关系。因此,HS-是引起系统内ORP变化的重要离子[29]。
2.2.2 自生矿物图 7、图 8和图 9是不同压力条件下形成的自生矿物在SEM下的型态,经EDS分析发现,主要有碳酸钙、菱铁矿和铁硫化物。图 7a显示,莓状碳酸钙呈灰色;图 7b中碳酸钙呈块状和长方体状,多处有分布;图 7c中碳酸钙为砾状,较少分布。菱铁矿在图 8a中呈分散状形成于表面;在图 8b中呈较大的梯形块状;在图 8c中呈块状,少数与铁硫化物共生。铁硫化物在实验4和5中形成和分布较少,分别呈片状和块状(图 9a, b);图 9c中铁硫化物有较多的分布,呈棒状和圆饼状,与菱铁矿交互重叠共生。综合三组实验中矿物分布发现:2.5 MPa条件下自生碳酸盐分布最广,其次为5.0 MPa,7.5 MPa最少;自生铁硫化物的形成分布规律与碳酸盐相反。可以推断,压力提高,利于铁硫化物形成;相反,利于碳酸盐形成。

|
| 图 7 不同压力条件下碳酸钙矿的物形态(黄色方框圈出)(左至右分别放大1 600,1 000和1 900倍) Figure 7 SEM images of calcite minerals morphology under different pressures(minerals were surrounded by square)(they are amplified 1 600, 500 and 3 000 times from left to right, respectively) |

|
| 图 8 不同压力条件下菱铁矿的矿物形态(黄色箭头指向和黄色方框, 左至右分别放大500,2 000和1 800倍) Figure 8 SEM images of minerals morphology under different pressures (minerals were surrounded by square or pointed out by arrow) (they are amplified 1, 000, 2, 000 and 1, 800 times from left to right, respectively) |

|
| 图 9 不同压力条件下铁硫化物的矿物形态(黄色方框和黄色箭头指向) a.碳酸盐;b.菱铁矿;c.铁硫化物;分别放大3 000,1 800和1 400倍 Figure 9 SEM images of iron sulfide minerals morphology under different pressures (minerals were surrounded by square or pointed out by arrow) (amplified 1 900, 1 800 and 1 400 times from left to right, respectively) |
甲烷渗漏区沉积层中碳酸盐矿物的形成主要包含两个过程:1)微生物代谢产生HCO3-[8, 36-37](过程1)为自生碳酸盐矿物形成提供所需的CO32-离子);2)CO32-再与阳离子结合[31, 38](过程2)。碳酸盐矿物形成反应式如下:
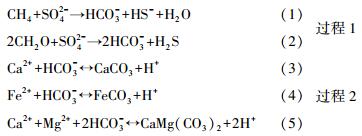
其中,(3)、(4)和(5)在pH变化时,可发生可逆反应上述。反应表明,碳酸盐矿物的形成是一系列复杂的生物地球化学过程,既有微生物的作用,又受环境因素的影响。这些因素中,温度和压力起着至关重要的作用。Westrich et al.[39]在研究海洋中硫酸盐还原时,发现其速率受温度控制。Nauhaus et al.[40]研究甲烷渗漏区微生物作用时发现,微生物代谢作用存在一个最佳温度,低于这个温度,温度升高时,产生HCO3-的速率越大。本实验中,温度升高,HCO3-浓度变化范围变小,但能达到的最大浓度升高(图 2A)。可以推断,实验温度的取值应不高于HCO3-产生的最佳温度(本次实验为15 ℃)。
Finneran[38]发现,温度和pCO2(p=Pressure)的增加可使方解石结晶的反应速率提升。本次不同温度的实验也表明,温度升高,碳酸盐矿物形成增加。综上,在富含微生物的体系内,温度通过控制微生物代谢产生HCO3-和阳离子的结合,从而控制自生碳酸盐的形成。
3.1.2 压力在甲烷渗漏区中,压力会影响孔隙水中物质的运移、交换和甲烷的溶解度。碳酸盐形成的第一阶段(离子生成),压力控制CH4溶解度。Zhang et al.[13]在研究压力对微生物代谢影响时发现,压力越大,甲烷厌氧氧化速率越大,生成的离子越多。实验结果与前人研究相似。第二阶段(矿物形成),压力控制着CO2的溶解度。Morse et al.[12]认为环境压力可以改变孔隙水中的pCO2,压力越大时,其值越高,即压力的提高,可促进碳酸盐的形成。本文不同压力实验,2.5 MPa和5.0 MPa实验形成的碳酸钙、菱铁矿和含钙、镁的碳酸盐多于7.5 MPa。S2-浓度的升高会抑制自生碳酸盐形成[5],可能是造成结果不同的原因。本次实验中,S2-浓度越高,碳酸盐形成越少。因此,碳酸盐形成的第二阶段,压力对其影响低于S2-浓度。
3.2 温度和压力对铁硫化物形成的影响 3.2.1 温度本文实验系统内,铁硫化物的形成经历两个阶段:1)微生物利用甲烷或有机物,还原硫酸盐,代谢产生S0, S22-, Sn2-和HS-,上述物质是铁硫化物形成的主要硫源[29];2)Fe2+与中间价态或低价硫结合形成铁硫化物[41],其反应式如下:
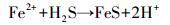 (6)
(6)
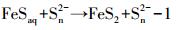 (7)
(7)
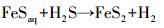 (8)
(8)
式(6)、(7)和(8)表明,铁硫化物的形成过程较为复杂。与自生碳酸盐类似,温度对铁硫化物形成的影响,首先体现在物源(硫源)上。研究和实验结果表明,温度的升高,可促进微生物代谢S2-[30, 40]。但是,在本系统内S2-浓度并不是无限增大的。当它浓度达到1 599 μg/L时,由于微生物代谢受抑制,其值开始下降(图 2B,10 ℃曲线)。这表明,当S2-浓度低于1 599 μg/L时,铁硫化物形成的第一个阶段才受到温度影响。因此,在三组不同温度实验中,10 ℃最有利于第一阶段的进行。
Millero et al.[42]研究认为,铁硫化物形成的第二个阶段,温度通过影响pK值(反应常数的负对数值)而控制其形成。pK是与温度(开尔文温度)和盐度(S)相关的函数,关系式如下:
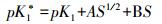 (9)
(9)
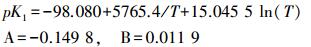 (10)
(10)
在本文的实验温度下,由式(9)和(10)可知,当盐度(S)一定时,温度越高,pK值越小,即铁硫化物形成反应越快。同时,温度升高也可以增强离子活度,促进铁硫化物生成。
研究发现,在还原环境中,ORP较大时,环境中形成的铁硫化物以FeS为主;其值降低,FeS与H2S或Sn2-结合形成Fe3S4;当ORP继续减小时,Fe3S4再与H2S或Sn2-结合形成FeS2[14, 43-44]。据此可以推断,实验形成的铁硫化物:实验1可能为FeS,实验2可能为Fe3S4和FeS2;实验3则可能是上述三者的混合物。
综上所述,温度升高促进铁硫化物生成,同时温度控制着铁硫化物的形成种类。
3.2.2 压力在海底沉积层中,压力控制着孔隙水中甲烷的饱和度。当温度恒定时,压力降低会导致甲烷水合物分解,释放的甲烷溶解于孔隙水中[45],作为甲烷厌氧氧化(AOM)的碳源[19]。在实验室模拟海底连续流,探讨压力对AOM的影响时也发现,甲烷压力从1.0 MPa到4.5 MPa再到8.0 MPa时,AOM的反应速率从3.46变为8.64再变为9.22 μm硫生成量/gdw/day,产生的吉布斯自由能分别为34.2,37.8,44.7 kJ/mol CH4[13]。本文实验发现,当实验压力从2.5到5.0再到7.5 MPa时,S2-浓度变化范围从125到173再到285 μg/L,这与上述研究类似。有关压力对铁硫化物生成形态和种类的影响的研究较少。分析结果表明,2.5 MPa,5.0 MPa和7.5 MPa实验中,压力越大,形成的铁硫化物分布越广,且形态越好(图 9a,b, c)。
4 结论通过上述实验结果分析和讨论,可以清晰地发现温度和压力对自生矿物生成存在重要影响,结果对研究甲烷渗漏区微生物地球化学作用及相关自生矿物形成机理具有一定的参考价值,主要结论如下:
(1) 实验中形成碳酸钙、菱铁矿和铁硫化物。温度和压力影响自生碳酸盐和铁硫化物形成,主要体现在两个方面:1)物源的生成;2)离子结合形成矿物。不同温压条件下,微生物的代谢能力都较好,保证了物源的形成;但离子结合形成自生矿物时,受到温压、水化学组分等条件控制。
(2) 在5 ℃,8 ℃和10 ℃实验中,温度升高,S2-浓度增大,ORP(负值)越大,HCO3-浓度变化范围变小,pH保持在一个稳定的区域内。碳酸钙形成分布较少,菱铁矿随温度升高而分布增加,铁硫化物形成分布随S2-浓度增加而变广,表明温度升高促进铁硫化物和菱铁矿的形成。温度还控制着铁硫化物的形成种类:5 ℃下可能形成FeS,8 ℃下可能形成Fe3S4和FeS2,10 ℃下可能形成上述三者的混合物。
(3) 压力升高,微生物代谢产物增加,HCO3-和S2-浓度变化范围都变大,铁硫化物生成增多且形态更好。2.5 MPa条件下自生碳酸盐分布最广,其次为5.0 MPa,7.5 MPa最少。碳酸盐的形成则受到S2-浓度的影响。
(4) ORP维持在-180.0 ~ -50.0 mV之间,pH保持在6.1~7.4之间,利于微生物的生长代谢。高的温度和压力,利于微生物的生长代谢,利于铁硫化物的形成。
| [1] |
Sassen R, Roberts H H, Carney R, et al. Free hydrocarbon gas, gas hydrate, and authigenic minerals in chemosynthetic communities of the northern Gulf of Mexico continental slope:relation to microbial processes[J]. Chemical Geology, 2004, 205(3/4): 195-217. |
| [2] |
Peckmann J, Reimer A, Luth U, et al. Methane-derived carbonates and authigenic pyrite from the northwestern Black Sea[J]. Marine Geology, 2001, 177(1/2): 129-150. |
| [3] |
Sakai H, Gamo T, Ogawa Y, et al. Stable isotopic ratios and origins of the carbonates associated with cold seepage at the eastern Nankai Trough[J]. Earth and Planetary Science Letters, 1992, 109(3/4): 391-404. |
| [4] |
Aloisi G, Pierre C, Rouchy J M, et al. Methane-related authigenic carbonates of eastern Mediterranean Sea mud volcanoes and their possible relation to gas hydrate destabilisation[J]. Earth and Planetary Science Letters, 2000, 184(1): 321-338. DOI:10.1016/S0012-821X(00)00322-8 |
| [5] |
Sun X L, Turchyn A V. Significant contribution of authigenic carbonate to marine carbon burial[J]. Nature Geoscience, 2014, 7(3): 201-204. DOI:10.1038/ngeo2070 |
| [6] |
Ferris F G, Fyfe W S, Beveridge T J. Bacteria as nucleation sites for authigenic minerals in a metal-contaminated lake sediment[J]. Chemical Geology, 1987, 63(3/4): 225-232. |
| [7] |
Ritger S, Carson B, Suess E. Methane-derived authigenic carbonates formed by subduction-induced pore-water expulsion along the Oregon/Washington margin[J]. GSA Bulletin, 1987, 98(2): 147-156. DOI:10.1130/0016-7606(1987)98<147:MACFBS>2.0.CO;2 |
| [8] |
Boetius A, Ravenschlag K, Schubert C J, et al. A marine microbial consortium apparently mediating anaerobic oxidation of methane[J]. Nature, 2000, 407(6804): 623-626. DOI:10.1038/35036572 |
| [9] |
Michaelis W, Seifert R, Nauhaus K, et al. Microbial reefs in the Black Sea fueled by anaerobic oxidation of methane[J]. Science, 2002, 297(5583): 1013-1015. DOI:10.1126/science.1072502 |
| [10] |
Postgate J R. The sulphate-reducing bacteria[M]. New York: Cambridge University Press, 1979: 1-145.
|
| [11] |
Morse J W, Wang Q W, Tsio M Y. Influences of temperature and Mg:Ca ratio on CaCO3 precipitates from seawater[J]. Geology, 1997, 25(1): 85-87. DOI:10.1130/0091-7613(1997)025<0085:IOTAMC>2.3.CO;2 |
| [12] |
Morse J W, He S L. Influences of T, S and PCO2 on the pseudo-homogeneous precipitation of CaCO3 from seawater:implications for whiting formation[J]. Marine Chemistry, 1993, 41(4): 291-297. DOI:10.1016/0304-4203(93)90261-L |
| [13] |
Zhang Y, Henriet J P, Bursens J, et al. Stimulation of in vitro anaerobic oxidation of methane rate in a continuous high-pressure bioreactor[J]. Bioresource technology, 2010, 101(9): 3132-3138. DOI:10.1016/j.biortech.2009.11.103 |
| [14] |
Rickard D, Luther Iii G W. Kinetics of pyrite formation by the H2S oxidation of iron (Ⅱ) monosulfide in aqueous solutions between 25 and 125℃:the mechanism[J]. Geochimica et Cosmochimica Acta, 1997, 61(1): 135-147. DOI:10.1016/S0016-7037(96)00322-5 |
| [15] |
魏铭聪, 许天福, 刘肖, 等. 甲烷渗漏环境中硫酸盐还原对水化学组分的影响[J]. 天然气地球科学, 2015, 26(12): 2372-2380. [ Wei Mingcong, Xu Tianfu, Liu Xiao, et al. The sulfate reduction effect on water chemical compositions in methane seeping environment[J]. Natural Gas Geoscience, 2015, 26(12): 2372-2380. DOI:10.11764/j.issn.1672-1926.2015.12.2372] |
| [16] |
Soetaert K, Hofmann A F, Middelburg J J, et al. The effect of biogeochemical processes on pH[J]. Marine Chemistry, 2007, 105(1/2): 30-51. |
| [17] |
Harrison B K, Zhang H S, Berelson W, et al. Variations in archaeal and bacterial diversity associated with the sulfate-methane transition zone in continental margin sediments (Santa Barbara Basin, California)[J]. Applied and Environmental Microbiology, 2009, 75(6): 1487-1499. DOI:10.1128/AEM.01812-08 |
| [18] |
Berner R A. Sedimentary pyrite formation:an update[J]. Geochimica et Cosmochimica Acta, 1984, 48(4): 605-615. DOI:10.1016/0016-7037(84)90089-9 |
| [19] |
Reeburgh W S. Oceanic methane biogeochemistry[J]. Chemical Reviews, 2007, 107(2): 486-513. DOI:10.1021/cr050362v |
| [20] |
Reeburgh W S. Methane consumption in Cariaco Trench waters and sediments[J]. Earth and Planetary Science Letters, 1976, 28(3): 337-344. DOI:10.1016/0012-821X(76)90195-3 |
| [21] |
陆红锋, 孙晓明, 张美. 南海天然气水合物沉积物矿物学和地球化学[M]. 北京: 科学出版社, 2011: 1-244. [ Lu Hongfeng, Sun Xiaoming, Zhang Mei. Nature gas hydrate sediment mineralogy and geochemistry in the South China Sea[M]. Beijing: Science Press, 2011: 1-244.]
|
| [22] |
Krüger M, Treude T, Wolters H, et al. Microbial methane turnover in different marine habitats[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2005, 227(1/2/3): 6-17. |
| [23] |
Zhang Y, Arends J B A, van de Wiele T, et al. Bioreactor technology in marine microbiology:from design to future application[J]. Biotechnology Advances, 2011, 29(3): 312-321. DOI:10.1016/j.biotechadv.2011.01.004 |
| [24] |
刘肖, 许天福, 魏铭聪, 等. 微生物诱导下甲烷厌氧氧化及碳酸盐矿物生成实验[J]. 中南大学学报(自然科学版), 2016, 47(5): 1473-1479. [ Liu Xiao, Xu Tianfu, Wei Mingcong, et al. Experiment on anaerobic oxidation of methane and precipitation of carbonate mediated by microbes[J]. Journal of Central South University (Science and Technology), 2016, 47(5): 1473-1479. DOI:10.11817/j.issn.1672-7207.2016.05.003] |
| [25] |
Rastogi A, Deka B, Bhattacharya G C, et al. Gas hydrates stability zone thickness map of Indian deep offshore areas: a GIS based approach[C]//The Third International Petroleum Conference and Exhibition. New Delhi: Vigyan Bhavan, 1999. http://agris.fao.org/agris-search/search.do?recordID=AV20120134359
|
| [26] |
Sloan E D Jr. Clathrate hydrates of natural gases[M]. New York: Marcel Dekker, 1990.
|
| [27] |
Davie M K, Zatsepina O Y, Buffett B A. Methane solubility in marine hydrate environments[J]. Marine Geology, 2004, 203(1/2): 177-184. |
| [28] |
Girguis P R, Cozen A E, Delong E F. Growth and population dynamics of anaerobic methane-oxidizing archaea and sulfate-reducing bacteria in a continuous-flow bioreactor[J]. Applied and Environmental Microbiology, 2005, 71(7): 3725-3733. DOI:10.1128/AEM.71.7.3725-3733.2005 |
| [29] |
Milucka J, Ferdelman T G, Polerecky L, et al. Zero-valent sulphur is a key intermediate in marine methane oxidation[J]. Nature, 2012, 491(7425): 541-546. DOI:10.1038/nature11656 |
| [30] |
Valentine D L, Reeburgh W S. New perspectives on anaerobic methane oxidation[J]. Environmental Microbiology, 2000, 2(5): 477-484. DOI:10.1046/j.1462-2920.2000.00135.x |
| [31] |
Hunter K S, Wang Y F, van Cappellen P. Kinetic modeling of microbially-driven redox chemistry of subsurface environments:coupling transport, microbial metabolism and geochemistry[J]. Journal of Hydrology, 1998, 209(1/2/3/4): 53-80. |
| [32] |
Knittel K, Boetius A. Anaerobic oxidation of methane:progress with an unknown process[J]. Annual Review of Microbiology, 2009, 63: 311-334. DOI:10.1146/annurev.micro.61.080706.093130 |
| [33] |
Cao J Y, Zhang G J, Mao Z S, et al. Influence of electron donors on the growth and activity of sulfate-reducing bacteria[J]. International Journal of Mineral Processing, 2012, 106-109: 58-64. DOI:10.1016/j.minpro.2012.02.005 |
| [34] |
Rodriguez N M, Paull C K, Borowski W S. Zonation of authigenic carbonates within gas hydrate-bearing sedimentary sections on the Blake ridge: offshore southeastern north America[C]//Paull C K, Matsumoto R, Wallace P J, et al. Proceedings of the Ocean Drilling Program, Scientific Results, Volume 164. College Station, TX: Ocean Drilling Program, 2000: 301-312.
|
| [35] |
Derkachev A N, Obzhirov A I, Bohrmann G, et al. Authigenic mineral formation in the cold gas seep structures within the Sea of Okhotsk[J]. Conditions of the Generation of Bottom Sediments and Related Mineral Deposits within Marginal Seas. Vladivostok, Dalnauka, 2002, 47: 60. |
| [36] |
Berner R A. Early diagenesis:a theoretical approach[M]. Princeton, NJ: Princeton University Press, 1980.
|
| [37] |
Zeebe R E. Modeling CO2 chemistry, δ13C, and oxidation of organic carbon and methane in sediment porewater:implications for paleo-proxies in benthic foraminifera[J]. Geochimica et Cosmochimica Acta, 2007, 71(13): 3238-3256. DOI:10.1016/j.gca.2007.05.004 |
| [38] |
Finneran D W. Calcite reaction kinetics in saline waters[D]. College Station, TX: Texas A & M University, 2010. http://hdl.handle.net/1969.1/ETD-TAMU-2010-12-8623
|
| [39] |
Westrich J T, Berner R A. The effect of temperature on rates of sulfate reduction in marine sediments[J]. Geomicrobiology Journal, 1988, 6(2): 99-117. DOI:10.1080/01490458809377828 |
| [40] |
Nauhaus K, Boetius A, Krüger M, et al. In vitro demonstration of anaerobic oxidation of methane coupled to sulphate reduction in sediment from a marine gas hydrate area[J]. Environmental Microbiology, 2002, 4(5): 296-305. DOI:10.1046/j.1462-2920.2002.00299.x |
| [41] |
Rickard D. Kinetics of pyrite formation by the H2S oxidation of iron (Ⅱ) monosulfide in aqueous solutions between 25 and 125℃:the rate equation[J]. Geochimica et Cosmochimica Acta, 1997, 61(1): 115-134. DOI:10.1016/S0016-7037(96)00321-3 |
| [42] |
Millero F J, Plese T, Fernandez M. The dissociation of hydrogen sulfide in seawater[J]. Limnology & Oceanography, 1988, 33(2): 269-274. |
| [43] |
朱而勤, 王琦. 海洋自生矿物[M]. 北京: 海洋出版社, 1988: 1-256. [ Zhu Erqin, Wang Qi. Marine authigenic mineral[M]. Beijing: China Ocean Press, 1988: 1-256.]
|
| [44] |
陈多福. 海底天然气渗漏系统水合物形成分解动力学及微生物作用[D]. 广州: 中国科学院研究生院(广州地球化学研究所), 2004: 1-104. [Chen Duofu. Kinetics of natural gas hydrate formation/dissolution and bacteria processes in the gas seeping system in marine environment[D]. Guangzhou: Graduate University of Chinese Academy of Sciences (Guangzhou Institute of Geochemistry), 2004: 1-104.] http://cdmd.cnki.com.cn/article/cdmd-80165-2004108903.htm
|
| [45] |
Kvenvolden K A. Gas hydrates-geological perspective and global change[J]. Reviews of Geophysics, 1993, 31(2): 173-187. DOI:10.1029/93RG00268 |
 2018, Vol. 36
2018, Vol. 36