扩展功能
文章信息
- 屈海洲, 周子坤, 张云峰, 陈薇, 张正红, 罗新生, 马超, 谭飞, 朱玉环
- QU HaiZhou, ZHOU ZiKun, ZHANG YunFeng, CHEN Wei, ZHANG ZhengHong, LUO XinSheng, MA Chao, TAN Fei, ZHU YuHuan
- 微生物碳酸盐岩孔隙研究进展
- Research Progress of Porosity in Microbial Carbonates
- 沉积学报, 2018, 36(4): 651-663
- ACTA SEDIMENTOLOGICA SINCA, 2018, 36(4): 651-663
- 10.14027/j.issn.1000-0550.2018.055
-
文章历史
- 收稿日期:2017-05-16
- 收修改稿日期: 2017-09-11
2. 西南石油大学 中国石油碳酸盐岩重点实验室沉积-成藏研究室, 成都 610500;
3. 中国石油杭州地质研究院, 杭州 310023;
4. 中国石油塔里木油田公司, 新疆库尔勒 841000
2. Branch of Depostion and Accumulation, PetroChina Key Laboratory of Carbonate Reservoir, Southwest Petroleum University, Chengdu 610500, China;
3. PetroChina Hangzhou Research Institute of Geology, Hangzhou 310023, China;
4. PetroChina Tarim Oilfield Company, Korla, Xinjiang 841000, China
微生物碳酸盐岩是底栖微生物(细菌、真菌、小型低等藻类及部分小型原生动物)的生长、新陈代谢等过程引发碳酸盐沉淀、自身发生钙化或者产生细胞外聚合物质(Excellular Polymeric Substances, EPS)黏结捕获周围的碎屑颗粒而形成的[1-5],这些微生物固着于底质形成生物膜,在层理面上形成纹层时就构成了微生物席生态系[6]。Riding[2]依据宏观组构将微生物碳酸盐岩划分为叠层石、凝块石、树形石、均一石四类;梅冥相[7]补充了核形石和纹理石;针对宏观组构模糊、难以归为上述类型者,韩作振等[8]补充了附枝菌格架岩类型。微生物碳酸盐岩不仅是研究古环境古气候和地质历史事件的重要材料[9-20],还是潜在的油气储集层[21-28]。
微生物碳酸盐岩主要组分包括钙化微生物、泥晶方解石、微亮晶和亮晶方解石、碎屑颗粒及孔隙[2]。微生物功能群既能对地质环境变化产生响应,又可通过元素循环或矿物转变等反馈方式影响环境。微生物碳酸盐岩有34.5亿年历史[29],通过沉积岩石学、地层古生物学、地球化学、地球生物学等研究手段,剖析泥晶方解石、微亮晶和亮晶方解石、碎屑颗粒组分中赋存的生物圈演化信息及经济价值的研究成果较丰富[30-52]。例如,近年来,在全球尤其是在南大西洋边缘的微生物碳酸盐岩中,油气勘探不断取得突破[21, 23, 26]。美国石油地质学家协会先后在2010年、2013年出版的专刊中,突出了裂谷盆地中湖相微生物碳酸盐岩的储层岩石学、孔隙特征及地质建模等研究[21]。2013年,伦敦地质学会组织针对性更强的会议,探讨了微生物碳酸盐岩的时空分布及在全球油气勘探开发中的应用[23]。2014年6月,巴西近海的桑托斯盆地下白垩统微生物碳酸盐岩中获得超过50万桶/天的高产原油,石油地质储量超过500亿桶。2015年,伦敦地质学会出版专辑“微生物碳酸盐岩的时空分布”,除了重点展示桑托斯盆地的湖相微生物碳酸盐岩储层地质的认识,还分时代对全球不同地区的微生物碳酸盐岩沉积、成岩、孔隙等进行了阐述[26]。我国学者对微生物碳酸盐岩的成因及地质意义研究较多,而对其应用价值,尤其是在石油勘探与开发方面提及较少。因此,笔者拟总结微生物碳酸盐岩孔隙研究进展,并就其发展趋势与应用提出一些拙见。
1 孔隙类型孔隙受到沉积作用、成岩作用及构造破裂作用等共同影响[53]。基于不同油气地质研究需要,Archie[54]、Choquette et al.[55]、Lucia[56-58]、Lønøy[59]等对碳酸盐岩孔隙进行了分类(表 1)。微生物碳酸盐岩形成包括微生物捕获黏结碎屑、生物诱导或影响的沉淀作用、非生物成因沉淀作用等三个过程,这些过程可以形成具有组构选择性的孔隙以及大量微米—亚毫米级微孔隙,例如粒间(溶)孔、晶间(溶)孔、遮蔽孔、鸟眼孔、晶洞、粒内孔及铸模孔、晶模孔等等(图 1)。受微生物群落类型及沉积环境等因素影响,不同沉积过程可以形成不同的孔隙类型。例如微生物捕获黏结碎屑颗粒,以粒间孔、粒内孔及铸模孔为主,而微生物诱导及影响的沉淀过程,如微生物自身钙化、微生物席内细菌诱导的沉淀作用等,容易形成格架孔、遮蔽孔及粒内孔等,而无生物参与的物理化学沉淀作用则可以形成晶间孔、粒内孔及泡状孔等。此外,受到沉积期、早成岩期的近地表成岩作用,还可以发育洞穴、裂缝及孔洞等非组构选择性孔隙。因而Choquette和Pray的孔隙分类方案[55]被广泛应用。随着微生物碳酸盐岩研究的深入,基于Riding[3, 60]将微生物成因沉积物分为微生物岩、填隙沉积物和周围沉积物,Corbett et al.[61]依据孔隙赋存的沉积物类型,将微生物碳酸盐岩中孔隙分为生物建造内孔隙、生物建造间孔隙和周围沉积物孔隙等,并以叠层石建造内孔隙为例,解剖了孔隙纵向形态变化等特征。这种基于微生物成因的针对性孔隙分类设想值得肯定,但仍需大量深入的探索。
| 提出者(年份) | 依据 | 方案 | 特点 | 适用性 |
| Archie(1952) | 可见性、孔隙大小 | 将基质孔分为可见孔和非可见孔,又将可见孔按孔隙大小分为极微小孔到大孔等 | 简单、直观 | 客观特征的描述,为岩石孔渗性和毛细管作用等提供参考 |
| Choquette和Pray(1970) | 组构与孔隙之间是否存在依赖关系 | 分为组构选择性孔隙(又可分为原生孔与次生孔;原生孔包括粒间孔、粒内孔、窗格孔、遮蔽孔和格架孔;次生孔包括晶间孔和铸模孔)和非组构选择孔隙(可分为裂缝、溶缝、溶孔和大溶洞) | 突出了孔隙及其形成时间与组构的关系,有利于研究孔隙成因与演化 | 适用于油气地质勘探阶段的岩石孔隙成因、演化及分布预测等研究 |
| Lucia (1983, 1995b, 1999) | 在Archie分类基础上,完善孔隙连通特征及其岩石组构相结合 | 分为粒间孔和溶孔,溶孔又可分为孤立溶孔(通过粒间孔相连)和连通溶孔(溶孔互相连通) | 准确反映岩石物理特征的差异,能够定量解释孔隙度、渗透率等岩石物理参数 | 是基于岩石物理研究需要的分类,可用于碳酸盐岩储层开发阶段的特征描述与地质建模 |
| Arve (2006) | 孔隙类型、大小以及分布特征 | 分为粒间孔、晶间孔、泥岩微孔、铸模孔、粒内孔和溶孔等6种主要孔隙类型,共20种孔隙 | 更好地将流体相关性质、成岩与沉积学特征相结合,强调单一孔隙类型的孔渗相关性研究 | 可用于油气田经济评估和储层评价,预测新区油气勘探前景 |
| Corbett et al (2015) | 在Riding划分的三种微生物成因沉积物的基础上,进一步划分孔隙类型 | 分为生物建造内孔隙、生物建造间孔隙和周围沉积物孔隙等三类;以叠层石为例,将其划分为叠层石内孔隙、叠层石间隙孔、生物侵蚀孔和碎屑孔 | 突出了微生物作用与其他沉积作用形成孔隙的差异,将生物建造内孔隙单独划分出来,强调了微生物在孔隙形成中的作用 | 可用于微生物碳酸盐岩孔隙的描述,但仍处于探索阶段,有待大量深入的研究 |

|
| 图 1 微生物碳酸盐岩中孔隙类型 a.凝块石的凝块结构(黄色箭头)之间发育大量粒间孔,孔隙内壁发育有等厚的亮晶胶结物,West Willow Creek油田,15-24B号岩芯,1 455.8 m[27];b.微生物生长位置的晶模孔、铸模孔,周边为致密碳酸盐泥。孔隙被镶边状微生物组构部分充填或桥接(浅棕色),灰泥沿着晶体生长面呈帘状分布,Skyline 16号岩芯,198.3 m[27];c.白云石晶间孔和菱形晶模孔,Skyline 16号岩芯,198.3 m[27];d.凝块石中发育的大量不规则窗格孔,整体呈层状分布,科罗拉多州Piceance盆地始新统Green River组[62];e.细菌成因的丛状组构内的微米级微孔隙,意大利Bagni di Tivoli地区[63];f.多面体状的粒内孔,欧洲西北部南二叠纪盆地Zechstein 2层的WK-8井SK.XVII 0.2号样品,3 109 m[64] Figure 1 Various Types of Pores in Microbial Carbonates |
微生物相关沉积可形成微型、中型、大型、巨型等不同规模的沉积组构[2, 21, 47],这些组构影响了孔隙的大小及空间分布(表 2)。真菌等组分的腐烂可以形成微孔隙[63]。核形石微生物作用形成致密包壳层后可阻止后期大气淡水等流体溶蚀核心,从而抑制铸模孔形成[21]。凝块石中凝块的大小、分选、排列等沉积结构的差异可导致不同凝块石孔隙度相差十余倍、渗透率相差两个数量级[65-66]。包壳状凝块石白云岩中可能以孤立溶孔为主、而泡沫绵层叠层石白云岩,则可能发育顺层分布的窗格孔[24]。巴西Campos盆地侏罗系和全新统中不规则凝块石结构,形成的孔隙形态复杂但连通性较高,而席状叠层石则具有简单孔隙形态和较低连通性,呈垂直结构分枝状叠层石孔隙形态简单但连通性中等—较低[65];阿曼盐盆新元古界微生物岩平行层状构造是高渗孔隙带发育部位。
| 微生物相关作用 | 因素 | 作用机理 | 影响 |
| 组构 | 组构的类型、分选、尺度及规模等影响孔隙类型、有效性及连通性等 | 例如:层状叠层石内孔隙简单、具有更好的连通性;凝块结构的大小、分选等差异使得凝块石孔渗性不同;若核形石的包壳层较致密,则会抑制溶蚀作用形成粒内溶孔 | |
| 沉积作用 | 微相叠置型式 | 反映了高频沉积旋回内微生物诱导的矿化作用、生理活动影响的矿化作用及黏结捕获碎屑沉积物等作用的演变,而组分、结构及构造的纵向变化则影响孔隙类型、体积及分布 | 持续的微生物相关沉积建造、或者与相对高能的颗粒滩叠置有利于孔隙发育,而与泥晶灰岩共生叠置的相关微相组合则孔隙发育一般较弱 |
| 环境及微地貌 | 微生物席发育环境广泛,导致微生物岩分布较广且其中的原生孔隙较复杂;微地貌起伏会导致早成岩大气淡水溶蚀等作用形成的次生孔隙发育分布的非均质性 | 浪基面之上或相对较高沉积地貌的微生物碳酸盐岩更易发育孔隙,其不仅具有更好的原生孔隙,且易受到早成岩大气淡水溶蚀改造;反之,则孔隙发育较弱 | |
| 白云石化作用 | 硫酸盐还原菌、甲烷厌氧细菌、需氧的嗜盐细菌等微生物,由于自身的生理活动和新陈代谢而促进白云石沉淀 | 可增加相同岩石体积中的孔隙度,且白云石可更好抵抗压实、压溶作用;若能受到后期有利的成岩作用改造,可形成大规模孔隙 | |
| 成岩作用 | 胶结作用 | 微生物诱导或影响的矿化作用,可形成不同的亮晶胶结物,进而影响微孔隙等原生孔隙的形成和充填 | 该作用一方面可能导致细菌等部分微生物死亡形成微孔隙,另一方面部分微生物形成甲烷等气体,可抑制无机成因胶结物的沉淀,保护原生孔隙 |
| 岩溶作用 | 开放的大气环境中微生物活动形成的微孔隙及酸等为岩溶作用的进行提供空间和增加流体的溶蚀性;封闭埋藏成岩环境中硫酸盐还原作用及其驱动硫酸盐岩溶解形成硫化氢,进而形成具有溶蚀性的氢硫酸 | 开放的大气环境中,微生物作用可以促进岩溶作用的发生,增加岩石孔隙度及其连通性;封闭的埋藏成岩环境,细菌的硫酸盐还原作用可增加与硫酸盐岩共生的碳酸盐岩的孔隙度 |
微生物种属、生长方式、矿化和黏结捕获能力、水体能量、底质及颗粒类型等等多种因素影响了岩石微相类型及共生叠置型式。这种纵向变化特征影响了赋存于其中的孔隙类型、体积、分布及厚度规模等。美国阿拉巴马州西南部的Little Cedar Creek油田上侏罗统Smackover组大量孔隙发育在凝块石/微生物成因颗粒灰岩/泥粒灰岩的叠置组合中[67],包括分布在沉积构造内的孔隙、孔洞及成岩改造孔隙等类型,孔隙度和渗透率最高可达20%、7 953×10-3 μm2。欧洲(丹麦、德国、英格兰)上二叠统Zechstein 2(Z2)地层中平坦层状叠层石/含鲕粒波状叠层石/凝块石/核形石灰岩叠置组合的孔隙度可达12%[68],微生物丝状体溶蚀形成的层状孔隙以及黏结捕获的颗粒的粒内孔、铸模孔是主要贡献者;至波兰西北部同样层位中,具缝合线、收缩缝和交错层理的叠层石/凝块石/鲕粒灰岩/核形石叠置组合的孔隙度最高仅为8%,而层状叠层石/凝块石/压扁构造的球粒白云岩的孔隙度小于2%。
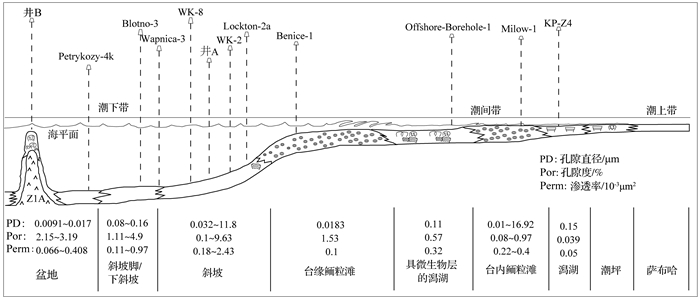
2.1.3 沉积环境及微地貌微生物碳酸盐岩及共生岩性的沉积环境和沉积地貌的不同,海水或早成岩大气淡水环境溶蚀—胶结作用次序及程度的差异,会对孔隙的形成、改造、规模及分布等造成影响(表 2)。微生物席可发育在深水海盆、斜坡、台地、缓坡、潮坪甚至是热泉、洞穴等极端环境中[19, 69],导致微生物岩横向分布及孔隙发育规律的复杂性。Słowakiewicz[64]发现Zechstein 2(Z2)地层的微生物碳酸盐岩中孔隙发育程度依次变差的相带为:斜坡上部、潮下—潮间带、台缘浅滩、斜坡脚及潟湖(图 2)。即使是同一相带,受高频沉积旋回及微地貌起伏的影响,也会导致微生物碳酸盐岩发育分布的差异性、孔隙分布的非均质性[70-71]。相对海平面波动的幅度及频率差异,不同相带微生物碳酸盐岩及共生岩相所处海水或大气水环境也有差异,导致胶结、溶蚀作用次序及程度不同。台地浪基面之上的水体能量高,可沉积微生物碳酸盐岩、微生物包壳粒—生屑灰岩等单元,粒间孔、粒内孔等原生孔隙中难充填灰泥,易形成内衬于孔隙壁或组构边缘的多形态早期胶结物,一定程度上可抵抗压实作用,保存原生孔隙[72-73]。浪基面之下斜坡带微生物相关沉积物的纵向加积—横向进积也可形成较厚的顶平透镜状丘体,但是原生孔隙多被灰泥充填。在相对海平面下降幅度较小且湿润古气候条件下,台地浅水沉积物中的文石等不稳定矿物更易于发生选择性溶蚀而形成大量次生孔隙[26]。但是受大气水溶蚀作用较弱的斜坡带,次生孔隙则多是埋藏成岩时形成的裂缝及相关溶蚀孔隙[21, 26]。美国阿拉巴马州Little Cedar Creek油田上侏罗统Smackover组处于建隆部位凝块石的孔隙形成优质储层,而建隆之间的致密凝块石则为隔夹层[67]。高分辨率地层格架中对比同一沉积相带内不同部位的微生物碳酸盐及相关微相组合,可以深化认识孔隙与微生物相关沉积关系。
|
| 图 2 欧洲西北部南二叠纪盆地Zechstein 2碳酸盐岩沉积模式[64] 几乎所有孔隙参数具有向盆地方向减小的趋势。Miłów-1和Benice-1井的数据来自具有薄的层状和波状构造的微生物碳酸盐岩,不是来自储层中的颗粒灰岩或泥粒灰岩,而盆地相的数据来自浅水盆地(海湾)相。各相中简易符号代表不同的微生物碳酸盐岩 Figure 2 Depositional model for the Zechstein 2 Carbonate (not to scale)[64] note that almost all petrophysical parameters decrease basinwards. Petrophysical data from wells Miłów-1 and Benice-1 are derived from thin planar and crinkly microbialites, not from ooid grainstones or packstones which may represent reservoir facies. Note that the petrophysical data for basin-plain facies are derived from shallow-basin (embayment) facies. The schematic symbolsrepresent different kinds of microbialite |
硫酸盐还原菌(Sulfate Reducing Bacteria, SRB)、甲烷厌氧细菌、需氧的嗜盐细菌等对原生白云石沉淀有着重要促进作用[74-80],根据微生物适氧条件,可以分为厌氧、需氧等两种微生物白云石化模式[81](表 2)。在富碳的有机质沉积物中,硫酸盐还原菌通过发酵作用将有机质转化成乳酸或丙酮酸[82-84],同时有机质还容易被蓝细菌等微生物氧化,产生氨气并被周围迅速吸收,增加了水体的pH值及CO32-的含量,最终促进白云石形成[85-87]。海洋环境中的产甲烷菌以H2为电子供体还原CO2,形成甲烷并提高水体的pH值[88],在甲烷厌氧古菌的厌氧氧化作用下,将先期产生的甲烷氧化成CO2并产生了HCO3-,促进了白云石沉淀[89-93]。与这些厌氧模式不同的是,需氧条件下的嗜盐好氧细菌依靠自身新陈代谢,氧化海水中的有机质,形成HCO3-,并提高胞外聚合物(EPS)基质的碱度,促进白云石沉淀[78]。微生物参与形成的白云石多呈哑铃状、球状、近球形或卵形,直径多为纳米至数十微米[74, 77-79, 94]。这些原生白云石具有更好的抗压实和压溶作用的能力,一旦处于有利的沉积相带如微生物礁(丘)—滩相等,受到早期大气淡水溶蚀作用形成大量组构选择性孔隙,则有利于这些早期孔隙的保存[22, 24, 28, 95-97]。
2.2.2 微生物胶结作用微生物诱导或影响的矿化作用,可形成不同的亮晶胶结物,不仅可以对残余的生长格架孔、遮蔽孔、粒间孔等进行支撑保护[98],还可以使微生物降解而形成原生的微孔隙(表 2)。微生物如细菌在其细胞壁外沉淀第一期碳酸盐,被无机成因的第二期碳酸盐亮晶胶结物包裹后,细菌快速降解形成微米甚至是纳米级别微孔隙[63, 99-100]。实验室内模拟发现,该过程可在4天内即可实现,这也是大量细菌化石未能保存的原因,仅能发现大量的微孔隙。例如与甲烷有关的微生物功能群包括产甲烷古菌、甲烷氧化古菌、甲烷氧化细菌等,在海洋、泥炭沼泽、热液喷口、冷泉等不同环境中,控制着大气甲烷的浓度,影响着碳的循环[101]。其中,以自养为主的产甲烷古菌,在海洋环境中的生理活动形成的甲烷气体,会使得原生孔隙内液相被驱替,形成气液两相流。当海相碳酸盐沉积物中孔隙17%的体积被甲烷气体占据时,孔隙内流体的传导性可在55年内降低50%,从而减少了胶结物沉淀所需的Ca2+、Mg2+、CO32-、SiO2等物质来源,进而抑制了早期胶结作用的进行,保护了原生孔隙[73]。此外,产甲烷菌在一定的埋藏环境还可以形成天然气,这也可能对微生物碳酸盐岩早期孔隙是一种保护作用。如85-102-12-01专题组[102]研究发现产甲烷菌具有低温型(< 40 ℃)、中温型(40 ℃ ~70 ℃)、嗜热型(>70 ℃)等不同类型,受环境的氧化还原特征、温度及盐度等影响,可分布在200~4 000 m的埋藏深度中,利用CO2及H2形成甲烷气,这对孔隙保存有积极作用[103-104]。
2.2.3 岩溶作用微生物在大气水环境及埋藏环境中,均可以对碳酸盐岩或共生的硫酸盐岩的岩溶作用产生重要影响,进而有利于次生孔隙的形成(表 2)。岩石微生物以相互协作或共生为主[105],它们可以在岩石表面钻孔形成微米级的连通孔隙,有利于微生物的定植及扩张成生物膜甚至是微生物席,再通过生理活动,既可以产酸,还可以实现岩石与雨水、空气中碳、氮及土壤颗粒等物质的交换,导致岩石的溶解、破裂,形成土粒,直至风化成土[40, 106-108]。此外,某些微生物如真菌菌丝的生长、钙化,或者吸收空气中的CO2,可以促进碳酸钙沉淀,充填孔隙。但是,总体而言,处于开放的大气成岩环境中的碳酸盐岩发生的岩溶作用,会显著增加洞穴、孔洞、裂缝等非组构选择性孔隙,而微生物起到促进作用。就封闭的埋藏成岩环境而言,与硫酸盐岩共生的碳酸盐岩层系中,微生物如细菌的硫酸盐还原作用及其驱动的硫酸盐岩溶解作用,可以促进硫酸盐岩岩溶的发育[109-112],形成的硫化氢溶于水形成的氢硫酸,对碳酸盐岩有着强烈的溶蚀性,可以增加孔隙度并增强孔隙的连通性[113-116]。
3 孔隙的研究方法技术样品代表性及定性—定量数据的精度是孔隙研究的关键[64, 117]。微生物碳酸盐岩中孔隙直径变化大,从纳米—亚微米级微孔隙到洞穴等均可发育,且赋存于不同尺度的结构、构造中或与之密切相关[2, 24, 28, 61, 63-66, 117-121]。例如,层状叠层石内各尺度孔隙均易呈似层状分布,指状—穹窿状叠层石中—大孔隙多集中于指状结构内部,而微孔隙仍可能在指状叠层石的纹层内呈似层状分布[27, 61]。凝块石内凝块结构发育部位可发育管穴状中—大孔隙,不发育部位多为毫米—微米级微孔隙[24, 27, 63]。核形石的核心可能被溶蚀形成中—大孔,而包壳的暗层内微生物降解则易形成微米级微孔隙[27]。微生物(如水下硫氧化细菌群落)定殖在碳酸盐表面通过新陈代谢形成的硫酸促进地下喀斯特作用,对洞穴形成起到积极作用[118]。
因此,若简单地根据所做测试项目样品的规格要求,采集的样品可能没有微生物沉积构造大,或者没有覆盖不同尺度沉积构造,导致数据无法反映不同尺度孔隙空间分布特征,难以解释微生物相关作用对孔隙的影响,进而难以分析孔隙成储机理。若全面研究不同尺度孔隙的类型、参数、分布及成因等特征,不仅需要采用露头、岩芯、成像测井、铸体薄片等定性—半定量技术手段,还应利用氦气孔隙度、高压压汞、恒速压汞、气体吸附等方法技术,获取孔隙度、渗透率及孔隙结构等定量数据。同时,应用扫描电镜、气体吸附、聚焦离子束电镜(FIB-SEM)等可以对亚微米—纳米级微孔隙进行表征。近年来,通过核磁共振成像、CT扫描等技术方法,不仅可以实现孔隙二—三维空间分布的直观成像,还能对孔隙孔径分布及对应孔隙度、孔喉结构等进行定量分析[117]。
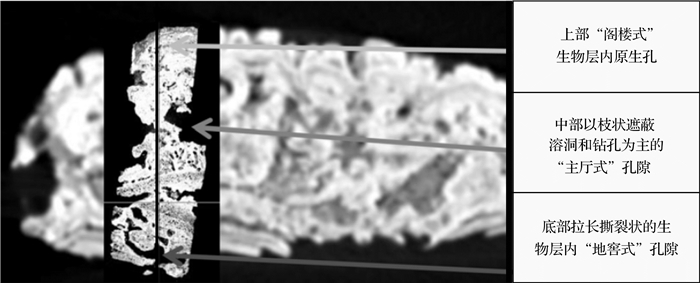
4 应用实例基于微生物沉积构造对孔隙影响的角度,Corbett et al.[61]以叠层石为例,提出典型单元体法(Representative Elementary Volume)。即采集含有完整微生物构造的典型叠层石样品,它们代表了不同大小、形态及溶蚀胶结程度等。利用薄片、CT扫描、图像分析等技术研究,可以研究叠层石内孔隙类型、体积、空间分布及耦合特征等,进而能较好地分析整个叠层石岩层的孔隙特征,减小局部样品测试带来的误差。运用医用CT获取8 cm×8 cm×4 cm岩样的较低分辨率的图像,在此基础上选取1 cm×1 cm×3 cm岩样,用微CT扫描获取高分辨率图像和数据,分析发现该地区叠层石灰岩生物沉积结构影响了层状分布的孔隙:底部生物层内的“地窖式”孔隙,呈拉长撕裂状,连通性最好;中部为“主厅式”孔隙,孔隙度最大,主要由枝状遮蔽溶洞和钻孔形成;上部“阁楼式”生物层内原生孔,孔隙度明显减少(图 3)。这些孔隙形态纵向演变特征,反映了生物结构不断演化对孔隙的控制,而这些演化又受到沉积水体深度、水动力条件等沉积因素的影响。
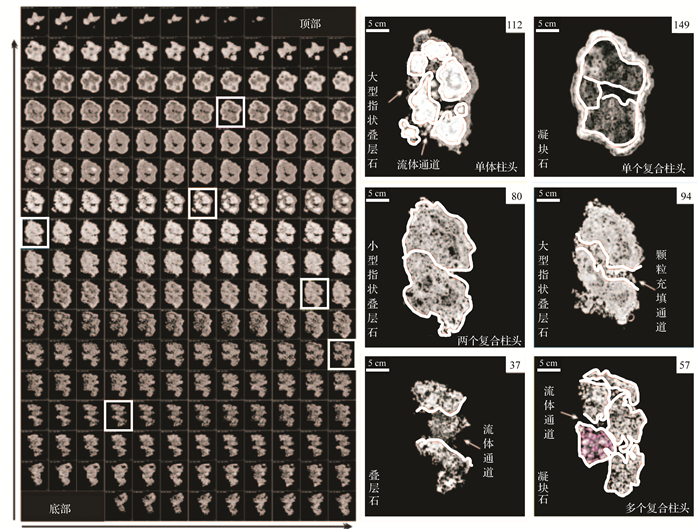
Rezende et al.[65]利用CT多次扫描微生物岩建造样品的横切面(间距1.22 mm),得到了198张相当于“时间切片”的图像(图 4)。每张图像反映了该层内部沉积组构和孔隙的分布及相互关系,对所有“时间切片”的连续分析可以探讨它们的纵向演化过程,再结合岩石学、碳氧同位素、阴极发光、岩石物理测试等,将微生物建造的三维模型与沉积、地层和岩石物理模型相结合,有助于改善储层孔隙模型质量,更好地表征储层相关属性,达到更完善开发资源的目的。
5 发展趋势运用多种技术方法,系统开展微生物碳酸盐岩孔隙研究,重建沉积—成岩等地质因素的成孔过程,预测孔隙分布及规模等。目前对孔隙分类、成因及表征等有益的探索表明,通过合理配置测试样品,综合多种技术方法定性—定量表征多尺度孔隙的空间结构及参数配置等耦合特征是重要基础。即应遵循宏观到微观的思路,保证样品的空间配置合理,
即通过岩芯描述、全直径岩芯的工业CT扫描、核磁共振成像等测试,获取中—大孔参数及分布,进而明确小柱塞样品位置,应用微米/纳米CT扫描、核磁共振、铸体薄片等多种实验手段,获取中—微孔数据及分布,最后运用扫描电镜、高压压汞等技术研究纳米—亚微米等微孔隙。合理融合获取的不同分辨率的孔隙参数数据,而不是简单地拼合数据,进而提高表征精度[117]。在此基础上,定性—定量探讨沉积特征对孔隙的影响,分析成岩作用对孔隙的改造,重建孔隙演化过程。
多学科结合,是准确评价微生物碳酸盐岩孔隙形成储集层的潜力的可靠途径。岩石组分、结构等变化会使得所有尺度上对其岩石物理参数的观测和测量产生一定的不可预测性,从而对勘探、储量计算等工作带来挑战[122-123],而微生物碳酸盐岩内生物结构的特殊性无疑增加了挑战难度。如岩石密度、P波速度,电阻率及磁导率等均与沉积物、成岩演化过程等有关,而这些参数的准确性又影响孔隙度、渗透率甚至是储集层厚度规模等计算结果。以岩石密度为例,与其他碳酸盐岩不同,微生物自身降解可以使得微生物岩中产生大量微孔隙,会影响密度的准确测定及其他相关的岩石物理参数的准确计算。因此,在多尺度孔隙表征数据融合基础上,运用不同训练模型对测得岩石物理数据的分析,分别预测岩石类型,并与相应深度岩芯微相分析结果进行对比分析,计算各模型预测的精度,进而选取高精度模型,对未取芯层段的岩性,进行基于岩石物理数据的解释,提高有利储集相带预测精度[124-128],为后续储层评价预测提供参考。可见,加强地质学科与地球物理学科的结合,是推动微生物碳酸盐岩油气地质研究和勘探开发生产工作的重要途径。
6 结语(1) 微生物诱导或影响的矿化作用、对颗粒的捕获黏结作用以及非生物沉淀作用等可形成粒间(溶)孔、晶间(溶)孔、遮蔽孔、鸟眼孔、晶洞、粒内孔及铸模孔、晶模孔等具有组构选择性的孔隙以及大量微米—亚毫米级微孔隙。针对微生物碳酸盐岩孔隙分类主要依据其与微生物沉积结构的关系,仍需要大量深入的研究。
(2) 微生物碳酸盐岩中孔隙受到微生物功能群落、相关沉积组构、微相叠置型式、沉积地貌及环境等微生物相关沉积过程及作用的影响,而微生物白云石化、胶结作用及岩溶作用等微生物相关的成岩作用,则对原生孔隙保存及改造形成的次生孔隙有积极意义。
(3) 微生物碳酸盐岩孔隙具有从纳米—亚微米级微孔隙到厘米甚至米级宏观孔隙等多个尺度,且与多尺度沉积结构构造有一定的耦合关系,系统而准确地表征各尺度孔隙需要合理配置不同尺度样品的空间分布,再运用多种方法技术进行综合分析测试,并增强数据的融合。加强地质学科与地球物理学科的结合,是推动微生物碳酸盐岩油气地质研究和勘探开发生产工作的重要途径。
致谢: 感谢中石油勘探开发研究院罗平教授、西南石油大学陈景山教授、胡广博士、李飞博士等在成文中给予的有益建议,感谢匿名审稿专家及编辑老师的宝贵意见。| [1] |
Burne R V, Moore L S. Microbialite:organosedimentary deposits of benthic microbial communities[J]. Palaios, 1987, 2(3): 241-254. DOI:10.2307/3514674 |
| [2] |
Riding R. Microbial carbonates:the geological record of calcified bacterial-algal mats and biofilms[J]. Sedimentology, 2000, 47(S1): 179-214. |
| [3] |
Riding R. Microbialites, stromatolites, and thrombolites[M]//Reitner J, Thiel V. Encyclopedia of Geobiology. Netherlands: Springer, 2011: 635-654.
|
| [4] |
Couradeau E, Benzerara K, Gérard E, et al. An Early-Branching microbialite cyanobacterium forms intracellular carbonates[J]. Science, 2012, 336(6080): 459-462. DOI:10.1126/science.1216171 |
| [5] |
Burne R V, Moore L S, Christy A G, et al. Stevensite in the modern thrombolites of Lake Clifton, Western Australia:a missing link in microbialite mineralization?[J]. Geology, 2014, 42(7): 575-578. DOI:10.1130/G35484.1 |
| [6] |
Gerdes G. What are microbial mats?[M]//Seckbach J, Oren A. Microbial Mats: Modern and Ancient Microorganisms in Stratified Systems. Dordrecht: Springer-Verlag, 2010: 3-25.
|
| [7] |
梅冥相. 微生物碳酸盐岩分类体系的修订:对灰岩成因结构分类体系的补充[J]. 地学前缘, 2007, 14(5): 222-234. [ Mei Mingxiang. Revised classification of microbial carbonates:complementing the classification of limestones[J]. Earth Science Frontiers, 2007, 14(5): 222-234.] |
| [8] |
韩作振, 陈吉涛, 张晓蕾, 等. 鲁西寒武系第三统张夏组附枝菌与附枝菌微生物灰岩特征研究[J]. 地质学报, 2009, 83(8): 1097-1103. [ Han Zuozhen, Chen Jitao, Zhang Xiaolei, et al. Characteristics of Epiphyton and Epiphyton microbialites in the Zhangxia Formation (Third Series of Cambrian), Shandong province[J]. Acta Geologica Sinica, 2009, 83(8): 1097-1103.] |
| [9] |
戴永定, 陈孟莪, 王尧. 微生物岩研究的发展与展望[J]. 地球科学进展, 1996, 11(2): 209-215. [ Dai Yongding, Chen Meng'e, Wang Yao. Development and perspective of research for microbolites[J]. Advance in Earth Sciences, 1996, 11(2): 209-215.] |
| [10] |
Webb G E. Was Phanerozoic reef history controlled by the distribution of non-enzymatically secreted reef carbonates (microbial carbonate and biologically induced cement)?[J]. Sedimentology, 1996, 43(6): 947-971. DOI:10.1111/sed.1996.43.issue-6 |
| [11] |
龚一鸣, 徐冉, 汤中道, 等. 晚泥盆世F-F之交菌藻微生物繁荣与集群绝灭的关系:来自碳同位素和分子化石的启示[J]. 中国科学(D辑):地球科学, 2005, 35(2): 140-148. [ Gong Yiming, Xu Ran, Tang Zhongdao, et al. Relationships between bacterial-algal proliferating and mass extinction in the Late Devonian Frasnian-Famennian transition:enlightening from carbon isotopes and molecular fossils[J]. Science China (Seri. D):Earth Sciences, 2005, 35(2): 140-148.] |
| [12] |
王永标, 童金南, 王家生, 等. 华南二叠纪末大绝灭后的钙质微生物岩及古环境意义[J]. 科学通报, 2005, 50(6): 552-558. [ Wang Yongbiao, Tong Jinnan, Wang Jiasheng, et al. Calcimicrobialite after end-Permian mass extinction in South China and its palaeoenvironmental significance[J]. Chinese Science Bulletin, 2005, 50(6): 552-558.] |
| [13] |
曹瑞骥, 袁训来. 叠层石[M]. 合肥: 中国科学技术大学出版社, 2006: 1-368. [ Cao Ruiji, Yuan Xunlai. Stromatolites[M]. Hefei: University of Science & Technology China Press, 2006: 1-368.]
|
| [14] |
吴亚生, 姜红霞, Yang W, 等. 二叠纪-三叠纪之交缺氧环境的微生物和微生物岩[J]. 中国科学(D辑):地球科学, 2007, 37(5): 618-628. [ Wu Yasheng, Jiang Hongxia, Yang W, et al. Microorganisms and microbial rocks of hypoxia environment across the Permian-Triassic boundary[J]. Science China (Seri.D):Earth Sciences, 2007, 37(5): 618-628.] |
| [15] |
谢树成, 殷鸿福, 王风平, 等. 若干重大地质环境突变的地球生物学过程[J]. 中国基础科学, 2015, 17(4): 30-34. [ Xie Shucheng, Yin Hongfu, Wang Fengping, et al. Geobiological processes during some critical environmental shifts in earth history[J]. China Basic Science, 2015, 17(4): 30-34.] |
| [16] |
Zhang Y Y, Li Y, Munnecke A. Late Ordovician microbial reefs in the Lianglitag Formation (Bachu, Tarim, NW China)[J]. Facies, 2014, 60(2): 663-684. DOI:10.1007/s10347-014-0396-2 |
| [17] |
Chen Z Q, Benton M J. The timing and pattern of biotic recovery following the end-Permian mass extinction[J]. Nature Geoscience, 2012, 5(6): 375-383. DOI:10.1038/ngeo1475 |
| [18] |
Kershaw S, Crasquin S, Li Y, et al. Microbialites and global environmental change across the Permian-Triassic boundary:a synthesis[J]. Geobiology, 2012, 10(1): 25-47. DOI:10.1111/j.1472-4669.2011.00302.x |
| [19] |
谢树成, 殷鸿福. 地球生物学前沿:进展与问题[J]. 中国科学(D辑):地球科学, 2014, 44(6): 1072-1086. [ Xie Shucheng, Yin Hongfu. Progress and perspective on frontiers of geobiology[J]. Science China (Seri. D):Earth Sciences, 2014, 44(6): 1072-1086.] |
| [20] |
梅冥相, 孟庆芬. 大气圈氧气含量水平上升的时间进程:一个与地球动力学过程紧密相关的地球生物学过程[J]. 古地理学报, 2016, 18(1): 1-20. [ Mei Mingxiang, Meng Qingfen. Timing of the rise of atmospheric oxygen content level:A geobiological process that is closely and genetically related to the geodynamics[J]. Journal of Palaeogeography, 2016, 18(1): 1-20. DOI:10.7605/gdlxb.2016.01.001] |
| [21] |
Mancini E A, Morgan W A, Harris P M, et al. Introduction:AAPG Hedberg research conference on microbial carbonate reservoir characterization:conference summary and selected papers[J]. AAPG Bulletin, 2013, 97(11): 1835-1847. DOI:10.1306/intro070913 |
| [22] |
罗平, 王石, 李朋威, 等. 微生物碳酸盐岩油气储层研究现状与展望[J]. 沉积学报, 2013, 31(5): 807-823. [ Luo Ping, Wang Shi, Li Pengwei, et al. Review and prospectives of microbial carbonate reservoirs[J]. Acta Sedimentologica Sinica, 2013, 31(5): 807-823.] |
| [23] |
Bosence D W J, Gibbons K A, Le Heron D P, et al. Microbial carbonates in space and time:implications for global exploration and production[M]. London: Geological Society, 2015.
|
| [24] |
宋金民, 罗平, 杨式升, 等. 塔里木盆地下寒武统微生物碳酸盐岩储集层特征[J]. 石油勘探与开发, 2014, 41(4): 404-413, 437. [ Song Jinmin, Luo Ping, Yang Shisheng, et al. Reservoirs of Lower Cambrian microbial carbonates, Tarim Basin, NW China[J]. Petroleum Exploration and Development, 2014, 41(4): 404-413, 437. DOI:10.11698/PED.2014.04.03] |
| [25] |
李朋威, 罗平, 宋金民, 等. 微生物碳酸盐岩储层特征与主控因素:以塔里木盆地西北缘上震旦统-下寒武统为例[J]. 石油学报, 2015, 36(9): 1074-1089. [ Li Pengwei, Luo Ping, Song Jinmin, et al. Characteristics and main controlling factors of microbial carbonate reservoirs:A case study of Upper Sinian-Lower Cambrian in the northwestern margin of Tarim Basin[J]. Acta Petrolei Sinica, 2015, 36(9): 1074-1089.] |
| [26] |
Bosence D, Gibbons K, Le Heron D P, et al. Microbial carbonates in space and time:introduction[J]. Geological Society, London, Special Publications, 2015, 418(1): 1-15. DOI:10.1144/SP418.14 |
| [27] |
Chidsey T C, van den Berg M D, Eby D E. Petrography and characterization of microbial carbonates and associated facies from modern Great Salt Lake and Uinta Basin's Eocene Green River Formation in Utah, USA[J]. Geological Society, London, Special Publications, 2015, 418(1): 261-286. DOI:10.1144/SP418.6 |
| [28] |
刘树根, 宋金民, 罗平, 等. 四川盆地深层微生物碳酸盐岩储层特征及其油气勘探前景[J]. 成都理工大学学报(自然科学版), 2016, 43(2): 129-152. [ Liu Shugen, Song Jinmin, Luo Ping, et al. Characteristics of microbial carbonate reservoir and its hydrocarbon exploring outlook in the Sichuan Basin, China[J]. Journal of Chengdu University of Technology (Science & Technology Edition), 2016, 43(2): 129-152.] |
| [29] |
Hofmann H J, Grey K, Hickman A H, et al. [1] Burne R V, Moore L S. Microbialite:organosedimentary deposits of benthic microbial communities[J]. GSA Bulletin, 1999, 111(8): 1256-1262. DOI:10.1130/0016-7606(1999)111<1256:OOGCSI>2.3.CO;2 |
| [30] |
Sheehan P M, Harris M T. Microbialite resurgence after the Late Ordovician extinction[J]. Nature, 2004, 430(6995): 75-78. DOI:10.1038/nature02654 |
| [31] |
Riding R. A hard life for cyanobacteria[J]. Science, 2012, 336(6080): 427-428. DOI:10.1126/science.1221055 |
| [32] |
Riding R. Microbial carbonate abundance compared with fluctuations in metazoan diversity over geological time[J]. Sedimentary Geology, 2006, 185(3/4): 222-238. |
| [33] |
颜佳新, 刘新宇. 从地球生物学角度讨论华南中二叠世海相烃源岩缺氧沉积环境成因模式[J]. 地球科学-中国地质大学学报, 2007, 32(6): 789-796. [ Yan Jiaxin, Liu Xinyu. Geobiological interpretation of the oxygen-deficient deposits of the Middle Permian marine source rocks in South China:a working hypothesis[J]. Earth Science-Journal of China University of Geosciences, 2007, 32(6): 789-796.] |
| [34] |
Dupraz C, Reid R P, Braissant O, et al. Processes of carbonate precipitation in modern microbial mats[J]. Earth-Science Reviews, 2009, 96(3): 141-162. DOI:10.1016/j.earscirev.2008.10.005 |
| [35] |
曹隽, 刘建波, 汪崎洋一, 等. 安徽东至早奥陶世红花园组生物礁:奥陶纪生物大辐射前的微生物礁[J]. 北京大学学报(自然科学版), 2009, 45(2): 279-288. [ Cao Jun, Liu Jianbo, Ezaki Y, et al. Lower Ordovician reefs in the Honghuayuan Formation at Dongzhi, Anhui:Microbial reefs just prior to the Ordovician biodiversification[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2009, 45(2): 279-288.] |
| [36] |
韩作振, 陈吉涛, 迟乃杰, 等. 微生物碳酸盐岩研究:回顾与展望[J]. 海洋地质与第四纪地质, 2009, 29(4): 29-38. [ Han Zuozhen, Chen Jitao, Chi Naijie, et al. Microbial carbonates:A review and perspectives[J]. Marine Geology & Quaternary Geology, 2009, 29(4): 29-38.] |
| [37] |
Shen J W, Webb G E, Qing H R. Microbial mounds prior to the Frasnian-Famennian mass extinctions, Hantang, Guilin, South China[J]. Sedimentology, 2010, 57(7): 1615-1639. DOI:10.1111/sed.2010.57.issue-7 |
| [38] |
Tunis G, Pugliese N, Jurkovšek B, et al. Microbialites as markers of biotic and abiotic events in the karst district, Slovenia and Italy[M]//Tewari V, Seckbach J. STROMATOLITES: Interaction of Microbes with Sediments. Dordrecht: Springer, 2011: 251-272.
|
| [39] |
邢智峰, 齐永安, 郑伟, 等. 从微观角度认识微生物席在中元古代的繁盛:以豫西云梦山组为例[J]. 沉积学报, 2011, 29(5): 857-865. [ Xing Zhifeng, Qi Yong'An, Zheng Wei, et al. Microscopic characteristics of extensive microbial mats in Mesoproterozoic Era:an example from the Yunmengshan Formation, Western Henan[J]. Acta Sedimentologica Sinica, 2011, 29(5): 857-865.] |
| [40] |
连宾, 袁道先, 刘再华. 岩溶生态系统中微生物对岩溶作用影响的认识[J]. 科学通报, 2011, 56(26): 2158-2161. [ Lian Bin, Yuan Daoxian, Liu Zaihua. Effect of microbes on karstification in karst ecosystems[J]. Chinese Science Bulletin, 2011, 56(26): 2158-2161.] |
| [41] |
Alshuaibi A, Duane M J, Mahmoud H. Microbial-activated sediment traps associated with oncolite formation along a peritidal beach, Northern Arabian (Persian) Gulf, Kuwait[J]. Geomicrobiology Journal, 2012, 29(8): 679-696. DOI:10.1080/01490451.2011.608110 |
| [42] |
汤冬杰. 华北地台中元古代微生物岩: 微组构、有机矿化过程及其古海洋环境研究[D]. 北京: 中国地质大学(北京), 2013. [Tang Dongjie. Mesoproterozoic microbialites from North China Platform: microfabrics, organomineralization processes and their palaeoenvironmental distribution[D]. Beijing: China University of Geosciences (Beijing), 2013.] http://cdmd.cnki.com.cn/Article/CDMD-11415-1013261816.htm
|
| [43] |
齐永安, 代明月, 常玉光, 等. 豫西渑池地区寒武系第三统馒头组二段的核形石[J]. 高校地质学报, 2013, 19(4): 634-641. [ Qi Yong'an, Dai Mingyue, Chang Yuguang, et al. The oncoids from the second member of Mantou Formation (the Third Series, Cambrian), Mianchi area, western Henan province[J]. Geological Journal of China Universities, 2013, 19(4): 634-641.] |
| [44] |
梅冥相. 微生物席的特征和属性:微生物席沉积学的理论基础[J]. 古地理学报, 2014, 16(3): 285-304. [ Mei Mingxiang. Feature and nature of microbial-mat:Theoretical basis of microbial-mat sedimentology[J]. Journal of Palaeogeography, 2014, 16(3): 285-304. DOI:10.7605/gdlxb.2014.03.026] |
| [45] |
常玉光, 白万备, 齐永安, 等. 豫西寒武纪叠层石微生物化石组合及其沉积环境[J]. 地球科学进展, 2014, 29(4): 456-463. [ Chang Yuguang, Bai Wanbei, Qi Yong'an, et al. Microfossil assemblage and its sedimentary environment in Cambrian stromatolites, Western He'nan[J]. Advances in Earth Science, 2014, 29(4): 456-463. DOI:10.11867/j.issn.1001-8166.2014.04.0456] |
| [46] |
胡文瑄, 朱井泉, 王小林, 等. 塔里木盆地柯坪地区寒武系微生物白云岩特征、成因及意义[J]. 石油与天然气地质, 2014, 35(6): 860-869. [ Hu Wenxuan, Zhu Jingquan, Wang Xiaolin, et al. Characteristics, origin and geological implications of the Cambrian microbial dolomite in Keping area, Tarim Basin[J]. Oil & Gas Geology, 2014, 35(6): 860-869. DOI:10.11743/ogg20140613] |
| [47] |
Chen J T, Lee J H. Current progress on the geological record of microbialites and microbial carbonates[J]. Acta Geologica Sinica (English Edition), 2014, 88(1): 260-275. DOI:10.1111/acgs.2014.88.issue-1 |
| [48] |
Druschel G K, Kappler A. Geomicrobiology and microbial geochemistry[J]. Elements, 2015, 11(6): 389-394. DOI:10.2113/gselements.11.6.389 |
| [49] |
郑伟, 邢智峰. 山西黎城中元古界常州沟组微生物成因构造(MISS)及其地质意义[J]. 现代地质, 2015, 29(4): 825-832. [ Zheng Wei, Xing Zhifeng. Characteristics and geological significance of microbially induced sedimentary structures (MISS) in Changzhougou Formation of Mesoproterozoic in Licheng County, Shanxi Province[J]. Geoscience, 2015, 29(4): 825-832.] |
| [50] |
殷鸿福, 王红梅, 邱轩. 微生物对沉积的作用[C]. 武汉: 全国沉积学大会沉积学与非常规资源论文摘要集, 2015. [Yin Hongfu, Wang Hongmei, Qiu Xuan. Microbial effects on sedimentation[C]. Wuhan: Sedimentology and Unconventional Resources Abstract Book of China National Conference of Sedimentology, 2015.] http://cpfd.cnki.com.cn/Article/CPFDTOTAL-CJDQ201510001532.htm
|
| [51] |
Bahniuk A M, Anjos S, França A B, et al. Development of microbial carbonates in the Lower Cretaceous Codó Formation (north-east Brazil):Implications for interpretation of microbialite facies associations and palaeoenvironmental conditions[J]. Sedimentology, 2015, 62(1): 155-181. DOI:10.1111/sed.12144 |
| [52] |
Yao L, Aretz M, Chen J T, et al. Global microbial carbonate proliferation after the end-Devonian mass extinction:mainly controlled by demise of skeletal bioconstructors[J]. Scientific Reports, 2016, 6: 39694. DOI:10.1038/srep39694 |
| [53] |
Ahr W M. Geology of carbonate reservoirs:the identification, description, and characterization of hydrocarbon reservoirs in carbonate rocks[M]. New Jersey: Wiley, 2008: 200-254.
|
| [54] |
Archie G E. Classification of carbonate reservoir rocks and petrophysical considerations[J]. AAPG Bulletin, 1952, 36(2): 278-298. |
| [55] |
Choquette P W, Pray L C. Geologic nomenclature and classification of porosity in sedimentary carbonates[J]. AAPG Bulletin, 1970, 54(2): 207-250. |
| [56] |
Lucia F J. Petrophysical parameters estimated from visual descriptions of carbonate rocks:a field classification of carbonate pore space[J]. Journal of Petroleum Technology, 1983, 35(3): 629-637. |
| [57] |
Lucia F J. Rock-fabric/Petrophysical classification of carbonate pore space for reservoir characterization[J]. AAPG Bulletin, 1995, 79(9): 1275-1300. |
| [58] |
Lucia F J. Carbonate reservoir characterization[M]. Berlin Heidelberg: Springer, 1999.
|
| [59] |
Lønøy A. Making sense of carbonate pore systems[J]. AAPG Bulletin, 2006, 90(9): 1381-1405. DOI:10.1306/03130605104 |
| [60] |
Riding R. The nature of stromatolites: 3, 500 million years of history and a century of research[M]//Reitner J, Quéric N V, Arp G. Advances in Stromatolite Geobiology. Berlin Heidelberg: Springer, 2011: 29-74.
|
| [61] |
Corbett P W M, Hayashi F Y, Alves M S, et al. Microbial carbonates: a sampling and measurement challenge for petrophysics addressed by capturing the bioarchitectural components[M]//Bosence D, Gibbons K, le Heron D, et al. Microbial Carbonates in Space and Time: Implications for Global Exploration and Production. London: Geological Society of London, 2015.
|
| [62] |
Sarg J F, Suriamin, Tänavsuu-Milkeviciene K, et al. Lithofacies, stable isotopic composition, and stratigraphic evolution of microbial and associated carbonates, Green River Formation (Eocene), Piceance Basin, Colorado[J]. AAPG Bulletin, 2013, 97(11): 1937-1966. DOI:10.1306/07031312188 |
| [63] |
Chafetz H S. Porosity in bacterially induced carbonates:focus on micropores[J]. AAPG Bulletin, 2013, 97(11): 2103-2111. DOI:10.1306/04231312173 |
| [64] |
Słowakiewicz M, Perri E, Tucker M E. Micro-and nanopores in tight Zechstein 2 carbonate facies from the Southern Permian Basin, NW Europe[J]. Journal of Petroleum Geology, 2016, 39(2): 149-168. DOI:10.1111/jpg.2016.39.issue-2 |
| [65] |
Rezende M F, Tonietto S N, Pope M C. Three-dimensional pore connectivity evaluation in a Holocene and Jurassic microbialite buildup[J]. AAPG Bulletin, 2013, 97(11): 2085-2101. DOI:10.1306/05141312171 |
| [66] |
Rezende M F, Pope M C. Importance of depositional texture in pore characterization of subsalt microbialite carbonates, offshore Brazil[J]. Geological Society, London, Special Publications, 2015, 418(1): 193-207. DOI:10.1144/SP418.2 |
| [67] |
Al Haddad S, Mancini E A. Reservoir characterization, modeling, and evaluation of Upper Jurassic Smackover microbial carbonate and associated facies in Little Cedar Creek field, southwest Alabama, eastern Gulf coastal plain of the United States[J]. AAPG Bulletin, 2013, 97(11): 2059-2083. DOI:10.1306/07081312187 |
| [68] |
Słowakiewicz M, Tucker M E, Pancost R D, et al. Upper Permian (Zechstein) microbialites:supratidal through deep subtidal deposition, source rock, and reservoir potential[J]. AAPG Bulletin, 2013, 97(11): 1921-1936. DOI:10.1306/06181312179 |
| [69] |
Brock T D, Madigan M T, Martinko J M, et al. Biology of microorganisms[M]. 7th ed. New Jersey: Prentice Hall, 1994.
|
| [70] |
Camoin G, Seard C. Genesis of microbialites as contemporaneous framework components of deglacial coral reefs, Tahiti (IODP 310):comment[J]. Facies, 2012, 58(1): 163-165. DOI:10.1007/s10347-011-0264-2 |
| [71] |
Reolid M, Duarte L V. Sponge-microbialite buildups from the Toarcian of the Coimbra region (Northern Lusitanian Basin, Portugal):paleoecological and paleoenvironmental significance[J]. Facies, 2014, 60(2): 561-580. DOI:10.1007/s10347-013-0389-6 |
| [72] |
Tedesco W A, Major R P. Influence of primary ooid mineralogy on porosity evolution in limestone and dolomite reservoirs:an example from the Eastern Gulf of Mexico Basin[J]. Pesquisa Agropecuaria Brasileira, 2012, 34(3): 493-498. |
| [73] |
Kenward P A, Goldstein R H, Brookfield A E, et al. Model for how microbial methane generation can preserve early porosity in dolomite and limestone reservoirs[J]. AAPG Bulletin, 2012, 96(3): 399-413. DOI:10.1306/06021111020 |
| [74] |
Vasconcelos C, Mckenzie J A, Bernasconi S, et al. Microbial mediation as a possible mechanism for natural dolomite formation at low temperatures[J]. Nature, 1995, 377(6546): 220-222. DOI:10.1038/377220a0 |
| [75] |
Roberts J A, Bennett P C, González L A, et al. Microbial precipitation of dolomite in methanogenic groundwater[J]. Geology, 2004, 32(4): 277-280. DOI:10.1130/G20246.2 |
| [76] |
Kenward P A, Goldstein R H, González L A, et al. Precipitation of low-temperature dolomite from an anaerobic microbial consortium:the role of methanogenic archaea[J]. Geobiology, 2009, 7(5): 556-565. DOI:10.1111/j.1472-4669.2009.00210.x |
| [77] |
Sánchez-Román M, Vasconcelos C, Schmid T, et al. Aerobic microbial dolomite at the nanometer scale:implications for the geologic record[J]. Geology, 2008, 36(11): 879-882. DOI:10.1130/G25013A.1 |
| [78] |
Sánchez-Román M, Vasconcelos C, Warthmann R, et al. Microbial dolomite precipitation under aerobic conditions: results from Brejo do Espinho Lagoon (Brazil) and culture experiments[M]//Swart P K, Eberli G P, Mckenzie J A. Perspectives in Carbonate Geology: A Tribute to the Career of Robert Nathan Ginsburg. London: John Wiley & Sons Ltd, 2009: 167-178.
|
| [79] |
Sánchez-Román M, Mckenzie J A, De Luca Rebello Wagener A, et al. Presence of sulfate does not inhibit low-temperature dolomite precipitation[J]. Earth and Planetary Science Letters, 2009, 285(1/2): 131-139. |
| [80] |
李红, 柳益群. "白云石(岩)问题"与湖相白云岩研究[J]. 沉积学报, 2013, 31(2): 302-314. [ Li Hong, Liu Yiqun. "Dolomite problem" and research of ancient lacustrine dolostones[J]. Acta Sedimentologica Sinica, 2013, 31(2): 302-314.] |
| [81] |
由雪莲, 孙枢, 朱井泉, 等. 微生物白云岩模式研究进展[J]. 地学前缘, 2011, 18(4): 52-64. [ You Xuelian, Sun Shu, Zhu Jingquan, et al. Progress in the study of microbial dolomite model[J]. Earth Science Frontiers, 2011, 18(4): 52-64.] |
| [82] |
Pisciotto K A, Mahoney J J. Isotopic survey of diagenetic carbonates, Deep Sea Drilling Project Leg 63[C]//Yeats R S, Haq B U. Initial Reports of the Deep Sea Drilling Project, Volume 63. Washington DC: Government Printing Office, 1981: 595-609. http://www.researchgate.net/publication/237435524_Isotopic_Survey_of_Diagenetic_Carbonates_Deep_Sea_Drilling_Project_Leg_63
|
| [83] |
Kelts K, Mckenzie J A. Diagenetic dolomite formation in Quaternary anoxic diatomaceous muds of Deep Sea Drilling Project Leg 64, Gulf of California[C]//Curray J R, Moore D G. Initial Reports of the Deep Sea Drilling Project, Volume 64. Washington DC: Government Printing Office, 1982: 553-569. http://www.researchgate.net/publication/284268591_Diagenetic_dolomite_formation_in_Quaternary_anoxic_diatomaceous_muds
|
| [84] |
Postgate J R. The sulphate-reducing bacteria[M]. Cambridge: Cambridge University Press, 1979: 1-155.
|
| [85] |
Slaughter M, Hill R J. The influence of organic matter in organogenic dolomitization[J]. Journal of Sedimentary Petrology, 1991, 61(2): 296-303. DOI:10.1306/D42676F9-2B26-11D7-8648000102C1865D |
| [86] |
Berner R A. Early diagenesis:a theoretical approach[M]. Princeton: Princeton University Press, 1980: 1-245.
|
| [87] |
Durand B. Kerogen:insoluble organic matter from sedimentary rocks[M]. Paris: Editions Technip, 1980: 1-560.
|
| [88] |
Thauer R K. Biochemistry of methanogenesis:a tribute to Marjory Stephenson:1998 Marjory Stephenson prize lecture[J]. Microbiology, 1998, 144(9): 2377-2406. DOI:10.1099/00221287-144-9-2377 |
| [89] |
Moore T S, Murray R W, Kurtz A C, et al. Anaerobic methane oxidation and the formation of dolomite[J]. Earth and Planetary Science Letters, 2004, 229(1/2): 141-154. |
| [90] |
Boetius A, Ravenschlag K, Schubert C J, et al. A marine microbial consortium apparently mediating anaerobic oxidation of methane[J]. Nature, 2000, 407(6804): 623-626. DOI:10.1038/35036572 |
| [91] |
Hinrichs K U, Hayes J M, Sylva S P, et al. Methane-consuming archaebacteria in marine sediments[J]. Nature, 1999, 398(6730): 802-805. DOI:10.1038/19751 |
| [92] |
Orphan V J, House C H, Hinrichs K U, et al. Methane-consuming archaea revealed by directly coupled isotopic and phylogenetic analysis[J]. Science, 2001, 293(5529): 484-487. DOI:10.1126/science.1061338 |
| [93] |
吴自军. 沉积物甲烷厌氧氧化: 从珠江河口至南海[D]. 广州: 中国科学院研究生院(广州地球化学研究所), 2006. [Wu Zijun. Anaerobic oxidation of methane in sediments from the Pearl River estuary to South China Sea[D]. Guangzhou: Graduate School of Chinese Academy of Sciences (Guangzhou Institute of Geochemistry), 2006.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1631497
|
| [94] |
Warthmann R, van Lith Y, Vasconcelos C, et al. Bacterially induced dolomite precipitation in anoxic culture experiments[J]. Geology, 2000, 28(12): 1091-1094. DOI:10.1130/0091-7613(2000)28<1091:BIDPIA>2.0.CO;2 |
| [95] |
姚根顺, 郝毅, 周进高, 等. 四川盆地震旦系灯影组储层储集空间的形成与演化[J]. 天然气工业, 2014, 34(3): 31-37. [ Yao Genshun, Hao Yi, Zhou Jingao, et al. Formation and evolution of reservoir spaces in the Sinian Dengying Fm of the Sichuan Basin[J]. Natural Gas Industry, 2014, 34(3): 31-37.] |
| [96] |
赵文智, 沈安江, 周进高, 等. 礁滩储集层类型、特征、成因及勘探意义:以塔里木和四川盆地为例[J]. 石油勘探与开发, 2014, 41(3): 257-265. [ Zhao Wenzhi, Shen Anjiang, Zhou Jingao, et al. Types, characteristics, origin and exploration significance of reef-shoal reservoirs:A case study of Tarim Basin, NW China and Sichuan Basin, SW China[J]. Petroleum Exploration and Development, 2014, 41(3): 257-265. DOI:10.11698/PED.2014.03.01] |
| [97] |
黄擎宇, 刘伟, 张艳秋, 等. 白云石化作用及白云岩储层研究进展[J]. 地球科学进展, 2015, 30(5): 539-551. [ Huang Qingyu, Liu Wei, Zhang Yanqiu, et al. Progress of research on dolomitization and dolomite reservoir[J]. Advances in Earth Science, 2015, 30(5): 539-551. DOI:10.11867/j.issn.1001-8166.2015.05.0539] |
| [98] |
Flügel E. Microfacies of carbonate rocks:analysis, interpretation and application[M]. New York: Springer, 2004: 267-334.
|
| [99] |
Krumbein W E, Cohen Y, Shilo M. Solar Lake (Sinai). 4. Stromatolitic cyanobacterial mats[J]. Limnology and Oceanography, 1977, 22(4): 635-656. |
| [100] |
Bosak T, Souza-Egipsy V, Corsetti F A, et al. Micrometer-scale porosity as a biosignature in carbonate crusts[J]. Geology, 2004, 32(9): 781-784. DOI:10.1130/G20681.1 |
| [101] |
谢树成, 杨欢, 罗根明, 等. 地质微生物功能群:生命与环境相互作用的重要突破口[J]. 科学通报, 2012, 57(1): 3-22. [ Xie Shucheng, Yang Huan, Luo Genming, et al. Geomicrobial functional groups:A window on the interaction between life and environments[J]. Chinese Science Bulletin, 2012, 57(1): 3-22.] |
| [102] |
惠荣耀, 连莉文. 产甲烷菌等微生物群体在中浅层天然气藏形成中的作用[J]. 天然气地球科学, 1994, 5(2): 38-39. [ Hui Rongyao, Lian Liwen. Effect of microbial community such as methanogenic bacteria on generation of mid-shallow biogenic gas[J]. Natural Gas Geoscience, 1994, 5(2): 38-39.] |
| [103] |
帅燕华, 张水昌, 赵文智, 等. 古菌细胞膜类脂化合物分析与初步应用:柴达木盆地沉积地层盐度与产甲烷菌分布[J]. 地质学报, 2007, 81(1): 16-22. [ Shuai Yanhua, Zhang Shuichang, Zhao Wenzhi, et al. Analysis of methanogen membrane lipids and its application to Sanhu depression, Qaidam Basin[J]. Acta Geologica Sinica, 2007, 81(1): 16-22.] |
| [104] |
林海, 李洋子, 汪涵, 等. 产甲烷菌的诱变及其对煤层气产出的影响[J]. 煤炭学报, 2012, 37(S2): 407-411. [ Lin Hai, Li Yangzi, Wang Han, et al. Mutagenesis of methanogen and the impact of coalbed methane outputting[J]. Journal of China Coal Society, 2012, 37(S2): 407-411.] |
| [105] |
Gorbushina A A. Life on the rocks[J]. Environmental Microbiology, 2007, 9(7): 1613-1631. DOI:10.1111/j.1462-2920.2007.01301.x |
| [106] |
Sterflinger K. Fungi as geologic agents[J]. Geomicrobiology Journal, 2000, 17(2): 97-124. DOI:10.1080/01490450050023791 |
| [107] |
Viles H A, Gorbushina A A. Soiling and microbial colonisation on urban roadside limestone:A three year study in Oxford, England[J]. Building and Environment, 2003, 38(9/10): 1217-1224. |
| [108] |
连宾. 碳酸盐岩风化成土过程中的微生物作用[J]. 矿物岩石地球化学通报, 2010, 29(1): 52-56. [ Lian Bin. Microbial roles in the genesis of soil from carbonate rock weathering[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2010, 29(1): 52-56.] |
| [109] |
Andrejchuk V N, Klimchouk A B. Geomicrobiology and redox geochemistry of the karstified Miocene gypsum aquifer, Western Ukraine:the study from Zoloushka Cave[J]. Geomicrobiology Journal, 2001, 18(3): 275-295. DOI:10.1080/01490450152467796 |
| [110] |
卢耀如, 张凤娥, 阎葆瑞, 等. 硫酸盐岩岩溶发育机理与有关地质环境效应[J]. 地球学报, 2002, 23(1): 1-6. [ Lu Yaoru, Zhang Feng'e, Yan Baorui, et al. Mechanism of karst development in sulphate rocks and its main geo-environmental impacts[J]. Acta Geoscientia Sinica, 2002, 23(1): 1-6.] |
| [111] |
Paskauskas R, Kucinskiene A, Zvikas A. Sulfate-reducing bacteria in gypsum karst lakes of northern Lithuania[J]. Microbiology, 2005, 74(6): 715-721. DOI:10.1007/s11021-005-0129-1 |
| [112] |
张凤娥, 张胜, 齐继祥, 等. 埋藏环境硫酸盐岩岩溶发育的微生物机理[J]. 地球科学-中国地质大学学报, 2010, 35(1): 146-154. [ Zhang Feng'E, Zhang Sheng, Qi Jixiang, et al. Bacterial mechanism of the development of sulfate karst in burial environment[J]. Earth Science-Journal of China University of Geosciences, 2010, 35(1): 146-154.] |
| [113] |
Hill C A. H2S-related porosity and sulfuric acid oil-field karst[M]//Budd D A, Saller A H, Harris P M. M 63: Unconformities and Porosity in Carbonate Strata. Washington DC: AAPG, 1995: 301-306.
|
| [114] |
朱光有, 张水昌, 梁英波, 等. TSR对深部碳酸盐岩储层的溶蚀改造:四川盆地深部碳酸盐岩优质储层形成的重要方式[J]. 岩石学报, 2006, 22(8): 2182-2194. [ Zhu Guangyou, Zhang Shuichang, Liang Yingbo, et al. Dissolution and alteration of the deep carbonate reservoirs by TSR:An important type of deep-buried high-quality carbonate reservoirs in Sichuan Basin[J]. Acta Petrologica Sinica, 2006, 22(8): 2182-2194.] |
| [115] |
刘全有, 金之钧, 高波, 等. 川东北地区酸性气体中CO2成因与TSR作用影响[J]. 地质学报, 2009, 83(8): 1195-1202. [ Liu Quanyou, Jin Zhijun, Gao Bo, et al. Origin of sour gas in the northeastern Sichuan Basin and fate action of thermochemical sulfate reduction (TSR) to natural gas[J]. Acta Geologica Sinica, 2009, 83(8): 1195-1202.] |
| [116] |
蔡春芳, 蔡镠璐, 张俊, 等. 川东北飞仙关组甲烷为主的TSR及其同位素分馏作用[J]. 岩石学报, 2012, 28(3): 889-894. [ Cai Chunfang, Cai Liulu, Zhang Jun, et al. H2S-generation by methane-dominated TSR and carbon isotope fractionation in Lower Triassic Feixianguan Formation, Northeast Sichuan Basin[J]. Acta Petrologica Sinica, 2012, 28(3): 889-894.] |
| [117] |
朱如凯, 吴松涛, 苏玲, 等. 中国致密储层孔隙结构表征需注意的问题及未来发展方向[J]. 石油学报, 2016, 37(11): 1323-1336. [ Zhu Rukai, Wu Songtao, Su Ling, et al. Problems and future works porous texture characterization of tight reservoirs in China[J]. Acta Petrolei Sinica, 2016, 37(11): 1323-1336. DOI:10.7623/syxb201611001] |
| [118] |
Engel A S, Stern L A, Bennett P C. Microbial contributions to cave formation:new insights into sulfuric acid speleogenesis[J]. Geology, 2004, 32(5): 369-372. DOI:10.1130/G20288.1 |
| [119] |
Olivier N, Lathuilière B, Thiry-Bastien P. Growth models of Bajocian coral-microbialite reefs of Chargey-lès-Port (eastern France):palaeoenvironmental interpretations[J]. Facies, 2006, 52(1): 113-127. DOI:10.1007/s10347-005-0022-4 |
| [120] |
Chen J T, Lee J H, Woo J. Formative mechanisms, depositional processes, and geological implications of Furongian (late Cambrian) reefs in the North China Platform[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2014, 414: 246-259. DOI:10.1016/j.palaeo.2014.09.004 |
| [121] |
Reolid M. Taphonomic features of Lenticulina as a tool for paleoenvironmental interpretation of midshelf deposits of the Upper Jurassic (Prebetic Zone, Southern Spain)[J]. Palaios, 2014, 23(7/8): 482-494. |
| [122] |
Fitch P J R, Lovell M A, Davies S J, et al. An integrated and quantitative approach to petrophysical heterogeneity[J]. Marine and Petroleum Geology, 2015, 63: 82-96. DOI:10.1016/j.marpetgeo.2015.02.014 |
| [123] |
Xie S Y, Cheng Q M, Ling Q C, et al. Fractal and multifractal analysis of carbonate pore-scale digital images of petroleum reservoirs[J]. Marine and Petroleum Geology, 2010, 27(2): 476-485. DOI:10.1016/j.marpetgeo.2009.10.010 |
| [124] |
Insua T L, Hamel L, Moran K, et al. Advanced classification of carbonate sediments based on physical properties[J]. Sedimentology, 2015, 62(2): 590-606. DOI:10.1111/sed.12168 |
| [125] |
Blum P. Physical properties handbook: a guide to the shipboard measurement of physical properties of deep-sea cores[C]. Texas: Ocean Drilling Program, 1997.
|
| [126] |
Huang Z, Nichol S L, Siwabessy J P W, et al. Predictive modelling of seabed sediment parameters using multibeam acoustic data:a case study on the Carnarvon Shelf, Western Australia[J]. International Journal of Geographical Information Science, 2012, 26(2): 283-307. DOI:10.1080/13658816.2011.590139 |
| [127] |
Inwood J, Lofi J, Davies S, et al. Statistical classification of log response as an indicator of facies variation during changes in sea level:Integrated Ocean Drilling Program Expedition 313[J]. Geosphere, 2013, 9(4): 1025-1043. DOI:10.1130/GES00913.1 |
| [128] |
Jarrard R D, Kerneklian M J. Data report: physical properties of the upper oceanic crust of ODP Site 1256: multisensor track and moisture and density measurements[C]//Teagled A H, Wilson D S, Acton G D, et al. Proceedings of the Ocean Drilling Program Scientific Results, Volume 206. College Station TX: Ocean Drilling Program, 2007: 1-11.
|
 2018, Vol. 36
2018, Vol. 36