扩展功能
文章信息
- 杨孝群, 李忠
- YANG XiaoQun, LI Zhong
- 微生物碳酸盐岩沉积学研究进展——基于第33届国际沉积学会议的综述
- Research Progress in Sedimentology of Microbial Carbonate Rocks: A review based on the 33rd International Sedimentological Congress
- 沉积学报, 2018, 36(4): 639-650
- ACTA SEDIMENTOLOGICA SINCA, 2018, 36(4): 639-650
- 10.14027/j.issn.1000-0550.2018.134
-
文章历史
- 收稿日期:2018-01-05
- 收修改稿日期: 2018-05-05
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
微生物岩是指由底栖微生物群落通过捕获与黏结碎屑沉积物,或经与微生物活动相关的无机或有机诱导矿化作用在原地形成的沉积物(岩)[1-8],其物质成分可由碳酸盐岩、磷块岩、硅质岩、铁岩、锰岩和有机质页岩组成,也可由硫化物、黏土岩和各种碎屑岩组成[9]。其中,微生物碳酸盐岩最为发育。微生物碳酸盐岩沉积受到国内外同行的重视和关注已经持续多年,多次成为国际沉积学会议的重要议题,如第17、18、19届国际沉积学大会[10-12]和第32届国际沉积学会议[13]等。即将于2018年8月13日—17日在加拿大魁北克召开的第20届国际沉积学大会也已确定将微生物碳酸盐岩作为主要议题之一。2017年10月9日—12日,第33届国际沉积学会议在法国图卢兹召开,来自64个国家的1 061位代表参加了会议,其中133位来自中国。会议共有331个口头报告和约700个展板,其中与微生物碳酸盐岩相关的约有40个口头报告和70个展板。会议所反映的研究热点主要包括微生物碳酸盐岩沉积机理(海相、湖相)、重力流沉积过程、古环境和古气候、沉积物时间记录、沉积盆地中非常规油气资源、源—汇系统、沉积与生物、构造相互作用、流体/沉积物相互作用和成岩作用等方面。此外,会议邀请了Ronald J. Steel,Rachel Wood和Paul Wignall三位著名专家做大会主题报告,题目分别为“陆缘沉积楔的表征”、“地质历史中碳酸盐岩矿物学的控制因素”和“二叠纪—三叠纪生物大灭绝及其后果:地狱中的重生”。这其中有两个邀请报告都强调了微生物作用在碳酸盐岩建造、大事件中的重要作用。
与微生物碳酸盐岩相关的专题主要有碳酸盐岩和生物建造(CB,Carbonates & Bioconstructions)下的碳酸盐岩和生物结构(CB1)、非热带和热带海洋碳酸盐岩系统的生物地质相互作用(CB3)、微生物碳酸盐岩和陆相碳酸盐岩:一种多学科的方法,以更好地理解现存和已灭绝的系统(CB4)子专题,而其他专题中也有部分子专题与微生物作用密切相关,如晚古生代环境、大灭绝以及向中生代的转变、侏罗纪—白垩纪气候、生物—事件和古地理:从数据到建模子专题等。从总体来看,主要涉及到微生物席矿化产物及序列、微生物碳酸盐岩沉积结构和沉积模式、微生物碳酸盐岩中主要元素的记录、微生物碳酸盐岩对环境和碳酸盐岩台地建造等的指示、研究的技术手段等方面。这些方面也是目前微生物碳酸盐岩沉积学的研究前沿。作为国际沉积学界高层次的学术会议,其对微生物碳酸盐岩沉积学的研究代表了该领域的最新进展及发展方向。显然,对相关会议成果和国际文献进行总结,不仅有助于跟踪国际前沿,也有助于国内沉积学学者拓展视野、明确研究方向。
1 微生物碳酸盐岩研究前沿及热点 1.1 微生物席矿化产物及序列微生物矿化机理一直是人们关注的重点[14-15]。现今微生物席的生态系统、早期矿化过程的研究对古老沉积岩沉积和早期成岩作用的研究具有很好的指示作用。Tucker et al.[16]在会上作了“现代微生物席矿物沉淀:微晶、球体、细菌和病毒”的报告,指出微生物席中发现的原生白云石使得沉积与微生物活动、细胞外聚合物(EPS,呈黏液状)联系起来。同时含有其他沉淀矿物,包括方解石(低Mg、高Mg、超高Mg)、文石、含铁、锰和钙的碳酸盐岩,镁—硅和黄铁矿等产物。并以卡塔尔现今的潮间微生物席为例,分析了矿化产物的序列。矿物沉淀开始于微生物席最上层,非定形的Mg-Si-Ca物质形成在细菌周围EPS内。随着微生物席的埋藏,发育为Mg-Si纤维和碳酸镁钙晶体。方解石晶体从成核的纳米点生长为锥形束。两种或两种以上的生长方向会产生哑铃和星形结构。锥状体先形成三角形,然后是六边形,最终形成指甲头型(菱形)方解石晶体,长度为5~30 μm[16]。
Pace et al.[17]对超盐环境中微生物矿化进行了研究,划分了三个阶段(图 1):1)活跃的有氧光合作用带pH值增高,结晶较差的Mg-Si泡状细胞胞外有机基质沉淀。2)在靠近硫酸盐还原的热泉附近,由于蓝藻菌和细胞外有机基质降解的结果,由硫酸盐还原细菌介导造成的文石块状成核。3)在中性到微酸性孔隙水环境下,部分文石发生白云石化。这可能是因为当有机基质中最顽固的部分被降解时,发生了溶解—沉淀反应。该种矿化途径为微生物的解释提供了关键的见解[17]。

|
| 图 1 大盐湖中微生物矿化的概念模型[17] A.微生物席在坚硬基底上发育; B.活跃的含氧光合作用带中胞外分泌有机物(EOM)上Mg-Si相成核。两种硅质来源:湖水溶解硅和最大光合作用区硅藻骨架的溶解(pH大于10)。C.EOM通过异养生物,特别是硫酸盐还原菌(SRB),发生退化,产生成核的文石。文石首先沉积在死去的球菌样细胞内,然后扩展到EOM(蓝箭头)。EOM的降解在微生物席的最深处产生了一个pH值低的区域,导致了部分文石的溶解。D.部分退化的EOM黏结Mg2+(来自孔隙水,可能来自于Mg-Si阶段)和Ca2+(来自文石溶解),导致在退化的EOM和之前沉淀的文石/Mg-Si相斑块结合的界面中白云石成核 Figure 1 Conceptual model of microbialite mineralisation in Great Salt Lake |
在以上微生物席矿化过程中,钙化作用最为普遍。微生物钙化机制是通过光合作用吸收CO2,提升局部的pH值和碳酸盐离子的浓度来诱导碳酸钙矿物的沉淀[18]。以蓝细菌钙化作用为例,其表现为蓝细菌鞘上或其内碳酸钙的成核作用[19],碳酸钙晶体成核发生在受保护的黏液鞘内,在细胞表面或者靠近细胞表面[20-21]。二氧化碳浓缩机制(CCMs)促使细胞在Rubisco(核酮糖二磷酸羧化酶)上富集CO2,从而固定碳,促进了钙化作用。影响钙化作用的环境因素有周围水体的Ca2+和Mg2+浓度、pH值、温度、溶解的无机碳浓度及可用成核点[22-23]。
1.2 微生物碳酸盐岩的元素记录虽然微生物碳酸盐岩中微量元素、稀土元素经常受到成岩作用的影响[24-29],但是仍有一些元素能够保留微生物参与碳酸盐岩沉积、成岩过程的信息。具体表现为C、O、N、P、S、Fe、Si、As等及其同位素特征,主要涉及与微生物相关的氧化还原性、营养元素和硫酸盐还原特性等方面。
微生物席代谢活动在地球早期生物地化循环方面起到了重要作用,影响了所需的营养和氧气[30-32]。大约23亿年前氧气浓度的急速增加可能是微生物光合作用吸收二氧化碳转换成有机质并产生氧气的结果[33-35]。光养微生物群落通过光合作用可以固定碳来为微生物席的生长和异养生物群落提供能量[36]。为了维持生命活动,氮、磷等其他的营养元素也是必需的。矿化后的岩石可以作为生物群落活动的场所。碳、氧、镁、氮、硅和硫元素在蓝细菌鞘体富集,碳、镁、氮和硫元素在毛状体和EPS内富集。不论是在现今的微生物席内还是在古老的叠层石中,氮和硫元素均富集[37]。以磷酸盐(PO43-)为例,可以被吸附在悬浮的碳酸钙颗粒上或者和碳酸钙一起沉积[38-39]。硫迁移是微生物席元素循环的重要组成[40-41]。微生物硫还原作用(MSR)可以产生硫化物。趋磁细菌、铁还原/氧化细菌和铁蛋白分别是研究细胞内、细胞外和生物大分子控制或诱导矿化的典范。一些微生物能够利用黏土矿物中的Fe3+,如甲烷菌、硫还原细菌和铁还原细菌等[42-43]。黄铁矿颗粒可以作为细菌硫酸盐还原作用产物的辅助证据[44]。海洋生物硅质骨架含有大量的硅,如海绵骨针、放射虫和硅藻等。在微生物碳酸盐岩微观结构中,常见晶形完整的自生石英发育,对于其成因也有多种解释,主要为:1)微生物作用相关。微生物群落,通过生物还原Fe3+,会导致蒙脱石的溶解和微石英晶体和伊利石的沉淀。这样的硅化可能发生在很晚的阶段(如降解后),因此被阻止矿化的微生物具有完美的外形细节[45]。2)生物成因的硅质流体内低温成岩[46]。溶解的硅质可能来自海洋生物硅质骨架,如海绵骨针或者放射虫。3)火山成因。作为典型的火山灰来源,石英晶体通常是双锥状β型[47-48]。微生物具有砷代谢能力可能始于34亿年前[49-50],Sforna et al.[51]研究了27亿年前叠层石中微生物对砷代谢和循环的记录,认为砷循环在地球大气圈和浅海充满氧气之前就已经广泛发育。Kurth et al.[52]运用宏观基因分析研究了安第斯高原Socompa湖现今高纬度叠层石的砷循环,相对于澳大利亚鲨鱼湾,具有较强的抗砷性。
1.3 微生物碳酸盐岩沉积结构由于微生物的广泛参与,微生物碳酸盐岩具有特殊的沉积结构,如纹层、凝块、树形等。前人也多据此划分岩石类型[3, 53-54],但是各种沉积结构形成的机制和指示的环境意义尚具有一定的争议。
亮暗纹层:Quijada et al.[55]通过对阿根廷地区硅质碎屑潮上带微生物席连续三年的观察,认识到季节变化对其影响显著。冬季水位上升,光合营养生物可能产生丰富的有机质,覆盖在粉砂层上。蓝杆菌的纤维丝表现为垂直地面方向。夏季蒸发强烈,方解石达到碳酸盐饱和度在层间边界沉淀,表现为垂向和水平方向的细丝。因此,微生物席相关的碳酸盐沉淀是微生物过程和环境因素相结合,使碳酸钙达到饱和的结果。更有学者对西班牙现今快速生长的(平均一年生长14 mm)河流相钙质叠层石进行了13年监测和记录[56],记录了沉积体系连续的6个月气候、水文物理和水文化学参数。大部分致密的纹层是在温暖的季节(4月至9月)形成的,而大多数多孔的复合层在寒冷的季节(10月到3月)发育。纹层随季节和温度变化,叠层石可以记录一年中不同级别、周期和非周期的环境参数的变化。这些结果对微生物构造的环境解释较为重要。Matìn-Bello et al.[57]对叠层石亮暗纹层碳同位素特征及其指示意义进行了分析。亮纹层相比暗色纹层具有较低的δ13C和δ18O值。温度对氧气分馏的影响是很难辨别的,在受强烈蒸发的封闭盆地中,可能会产生温度和蒸发相反的效果,使循环的18O变化平滑13C和18O之间的关系。沉积/蒸发比是短期盐碱湖的同位素演化主要的控制因素。因此,亮层对应湿润的气候,如雨季,具有较高的CO2输入量,而暗层纹则形成于干燥的气候。这些变化可能代表季节和年度的变化。微生物作用可以形成明显的纹层结构,也可以破坏纹层结构。此外,还要注意非生物成因的亮暗纹层,文石纤维等厚层与富有机质泥晶白云岩互层的现象反映了季节或者古气候的周期性变化,被认为是纯粹的无机条件下的产物[58]。反之,缺少纹层也可以是生物活动干扰的表征,如凝块结构[59]。
凝块结构:现今的凝块岩最先发现于澳大利亚西海岸Perth南部110 km处,超盐度中性pH值的Clifton湖[60-61]。凝块结构的成因也有多种观点,有学者认为是细胞膜文石结构[61]、钙化微生物[3],Burne et al.[62]认为凝块结构与硅镁石相关。美国大盆地寒武系凝块岩主要是受到了多种微生物和后生生物的综合影响[63]。
对于鲕粒灰岩是否为微生物作用的产物仍具有争议[64-66]。可分为微生物成因学说[64-67]、化学作用学说[68],和传统的机械作用(水动力)学说。当然也可能是微生物新陈代谢作用和物理、化学作用的协同效应产生的[66, 69]。Diaz et al.[67]通过对巴拿马地区现今海相鲕粒滩的研究发现,鲕粒含有丰富的微生物信息,多为与碳酸钙沉积相关的代谢过程,如脱氮作用、光合作用和硫酸盐还原作用等,并且鲕粒经历了复杂的成岩历史。认为鲕粒灰岩是未被认知的微生物碳酸盐岩,且其微生物的种类超过了叠层石—凝块岩体系。
此外在澳大利亚鲨鱼湾考察以及文献阅读的过程中,也发现了脓疱状、平滑状、胶状、脑状等现代微生物碳酸盐岩结构[70-71]。在砂岩和页岩相中也可以发现多种微生物岩结构,如象皮纹理,可能的宏观簇生微生物席、穹状建造、黄铁矿结构、盘状微生物菌落、水平席生长模式、皱纹结构、肯尼亚结构、线型类似砂岩结核的结构等[72]。微生物岩沉积结构主要受水体特征(化学、水动力、浑浊度、透光度以及水深等)、气候和碎屑物质的输入速率等影响[73]。
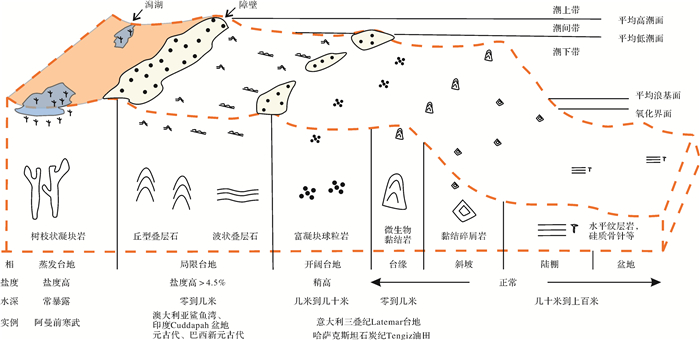
1.4 微生物碳酸盐岩沉积环境模式微生物碳酸盐岩是沉积环境和微生物共同作用的结果,主要受到地理/环境类型演变、盆地/台地构造—充填演化和地史演化等影响。以威尔逊碳酸盐岩台地模式(1975)为例,具有不同沉积结构的微生物碳酸盐岩同样具有很好的沉积相带分异性(图 2)。
蒸发台地:主要发育潮上带的潟湖环境,常见树枝状凝块岩、波状叠层石灰岩/云岩等微生物碳酸盐岩类型。如阿曼克恩阿拉姆地区新元古代蒸发潟湖主要发育树枝状凝块岩[74]。微生物碳酸盐岩提供了至少30亿年以来地球生命的记录,显示了生命在极干旱、蒸发环境的适应性。最新蒸发环境的初步结果表明纳米晶体聚集到微米晶体,早期成岩形成泥晶。微生物碳酸盐岩的化学信号可能是继承了沉积和随后的早期成岩作用。因此,早期的成岩作用保存了数十亿年的原始环境参数。微生物碳酸盐岩在特殊环境的沉积也受到大家的关注,如主动裂谷环境咸水湖泊中热泉碳酸盐岩沉积、冷水沉积等。
(半)局限台地:主要发育潮间带、潮下带,也是微生物碳酸盐岩最为发育的环境。适宜的温度和偏高的盐度浅水环境对微生物碳酸盐岩的发育较为有利。如澳大利亚鲨鱼湾现今叠层石发育,盐度约为8%,从潮间带到潮下带依次发育脓疱状、平滑状、胶状、脑状微生物岩类型[70]。巴西Irecê盆地新元古代缓坡台地潮间带主要发育叠层石生物层,浅水潮下带主要发育叠层石点礁和微生物席[75]。此外磷矿发育,这和塔里木盆地上震旦统奇格布拉克组具有相似的沉积环境和产物。阿曼克恩阿拉姆地区新元古代潮间带发育与厚层生物席相关的叠层石,潮下带发育与薄层生物席相关的波状纹层岩和水平纹层岩[74]。
向盆地方向延伸,伴随着水体变为开阔环境,海水盐度相对降低,微生物碳酸盐岩类型以黏结岩、凝块岩为主。开阔台地:潮下带,盐度正常或稍高,水深几米到几十米。常见凝块球粒结构,如意大利中晚三叠世Latemar台地[76]。台缘相:潮下高能带。意大利中晚三叠世Latemar台地台缘宽25~35 m,主要发育钙质海绵黏结岩、管壳石黏结岩、生物颗粒岩,微生物结构主要为叠层石、海绵黏结等[76]。斜坡相:潮下高能带。意大利中晚三叠世Latemar台地斜坡可见钙质海绵黏结岩微生物层,也可见台缘微生物黏结岩的碎屑[76]。通过对西班牙晚石炭世Asturias台地和哈萨克斯坦Tengiz油田泥盆纪—石炭纪台地对比,台地上斜坡发育黏结岩(水深大于300 m),下斜坡发育从台缘和上斜坡搬运来的黏结碎屑岩[77]。不像珊瑚礁型台缘受控于海平面或者风向,微生物黏结岩为主导的斜坡受到营养物质的影响[77]。陆棚和盆地:潮下较深水陆棚低能带。沉积岩性以泥页岩为主,可见硅质海绵骨针等[78]。
此外,不同类型的台地结构,微生物碳酸盐岩沉积模式也有所不同。主要的台地结构有缓坡、镶边台地、孤立台地等。典型的碳酸盐岩沉积模式主要考虑水动力强弱、水体深浅、岩性组合等因素,而对微生物作用类型的考虑较少。Braga et al.[79]对西班牙近岸混合碳酸盐沉积的岩相进行分析,相带成片状分布,可能与生物群落的分布相关。微生物对碳酸盐岩台地建造的作用有待进一步研究。海水的低镁钙比和氧气浓度的上升可能控制了生物矿化的部分过程,如前寒武纪白云岩—文石海洋。但是在生物大辐射的时候,生物能够超越海水镁钙比,成为影响碳酸盐岩工厂建造的主要因素。
2 国内微生物碳酸盐岩沉积学研究现状及趋向笔者在第33届国际沉积学会议(2017年10月9日—12日)、第六届全国沉积学大会(2017年10月28日—30日)以及澳大利亚鲨鱼湾现今叠层石考察(2017年11月2日—9日)的基础上,结合国内外文献调研,认为国内微生物碳酸盐岩沉积学在现今沉积研究相对薄弱,古老的微生物碳酸盐岩沉积已开展了大量工作。提出分类认识微生物碳酸盐岩现代沉积机理、重建古老微生物碳酸盐岩早期成岩过程、分类认识古老微生物碳酸盐岩沉积标志的研究方向。
2.1 现今微生物碳酸盐岩研究相对薄弱现今微生物碳酸盐岩包含丰富的气候、环境信息,也是了解微生物碳酸盐岩沉积、矿化机理的重要研究对象。我国现代海相、盐场和淡水叠层石微生物席发育[80],包括海南岛三亚盐沼区、青岛东风盐场、店北盐场、天津塘沽盐场、江苏台北盐场等[81]。淡水叠层石有川黔地区[81]、三峡地区[82]以及河北境内[83]。前人初步提出叠层石微生物席形态特征和微观结构(层理)的形成过程[84-85],并利用现代叠层石的微观结构生长推测了古代叠层石的生长过程[80]。田友萍等[81]对中国西南现生淡水石灰华叠层石纹层机理及其高分辨率环境气候记录进行了研究。研究认为石灰华叠层石的纹层特征是有沉积间断的季节纹层,其纹层厚度能够反映当地的年、季节降水量,可通过数纹层定年,而蓝藻藻席是石灰华叠层石形成的必要条件之一。国际上对澳大利亚鲨鱼湾、巴哈马台地、巴西等地现今微生物碳酸盐岩的研究相对成熟。以澳大利亚鲨鱼湾为例,其从潮上带、潮间带到潮下带可以识别出不同的微生物岩类型,探讨了不同形态微生物岩和水动力的关系[70]。在该地考察的过程中发现,其所建的世界历史博物馆也很好地保护了该地的生态系统。诸如此类的研究经验、举措值得借鉴。
重视现代微生物沉积,又要注意差别。一方面对解释一些古老微生物碳酸盐岩沉积、成岩机理具有较好的借鉴意义,另一方面又不能完全反应出古代微生物发育的类型及其海洋、大气环境等要素。新生代以前的叠层石中的微生物化石较为少见,只是以现在叠层石的生长来推测早期叠层石的成因,其“将今论古”的论断还有待进一步证实[86]。越来越多的科学家注意到现今的生物地质现象并不能完全反应古老微生物岩的特征,在第33届国际沉积学会议中提出“现今是了解过去的钥匙,但是过去才能讲清楚完整的故事”[87]以及“现今并不是了解过去的钥匙”[88]等观点。
2.2 古老微生物碳酸盐岩成果较为丰富众多学者对国内古老微生物碳酸盐岩开展了大量工作。对蓟县雾迷山—铁岭组叠层石[7, 89]、山东寒武系凝块岩[90-91]、塔里木盆地微生物岩[92-93]、四川盆地灯影组微生物岩[8, 94-95]等做了大量工作,同时由于古老微生物碳酸盐岩现象的丰富与典型,也吸引了国际同行前来开展研究工作[96-98]。在微生物组分、微生物矿化机理(如生物诱导矿化和生物控制矿化)、微生物岩古今对比、生长环境条件等方面取得了诸多进展[80]。
微生物碳酸盐岩显著的跨相与地史演变是其有别于其他沉积岩石类型的重要标志。国内华北、扬子、塔里木三大板块多个时期均有微生物碳酸盐岩的发育(表 1)。总的看来,在地史演化方面,微生物碳酸盐岩时间跨度大,主要发育在奥陶纪之前。奥陶纪之后,和后生生物总体呈此消彼长的格局。在沉积环境类型方面,微生物岩发育对应的古气候多为温暖甚至炎热、蒸发环境,当然也不排除冷水微生物碳酸盐岩的发育。微生物岩类型以叠层石灰岩/云岩、凝块岩为主。在构造—充填演化方面,以塔里木盆地为例,从震旦纪的裂谷、拗拉槽到寒武纪克拉通内碳酸盐岩台地,再到奥陶纪的周缘前陆构造背景[99],微生物碳酸盐岩表现为间歇性繁盛的特征。
| 地层 | 地区/盆地 | 构造背景 | 沉积环境 | 古气候 | 微生物种类 | 微生物岩构成 | 资料来源 |
| 更新世 | 河北阳原 | 断陷盆地,湖泊萎缩—消亡阶段湖水逐渐咸化 | 湖相 | 干燥、温暖 | 硅藻,颤藻科、色球藻科和念球藻科 | 叠层石 | 文献[100] |
| 中新世 | 柴达木盆地 | 遭受强烈挤压 | 湖相 | 温度较高、蒸发量较大而且较为干旱的时期 | 绿藻门, 管藻目, 独囊藻科枝管藻属的中国枝管藻,以及部分异枝藻 | 叠层石 | 文献[101] |
| 中三叠统雷口坡组 | 川西地区 | 印支期,拉张背景转向挤压背景 | 局限蒸发潮坪微生物席和微生物礁滩 | 气候炎热干燥 | P-T生物大灭绝后的恢复期,发育于局限环境中,类型较单一 | 凝块石、叠层石、泡沫绵层石、核形石 | 文献[94] |
| 奥陶系 | 塔里木盆地 | 周缘前陆、克拉通台地 | 局限蒸发潮坪微生物席 | 温暖湿润 | 蓝细菌 | 叠层石、凝块石、树枝石 | 文献[92, 99] |
| 寒武系 | 塔里木盆地 | 克拉通内台地 | 局限蒸发潮坪微生物席和微生物礁滩 | 温暖湿润与炎热干燥的交替 | 蓝细菌 | 叠层石、凝块石、树枝石 | 文献[93, 99] |
| 寒武系芙蓉统 | 河北承德 | 构造沉降 | 陆表海 | 气候温暖 | 葛万菌、附枝菌 | 叠层石生物丘 | 文献[84-85] |
| 寒武系Series 3 | 山东 | 克拉通 | 陆表海 | 气候温暖 | 葛万菌、附枝菌 | 凝块石 | 文献[90] |
| 寒武系 | 河南 | 克拉通 | 潮坪相碳酸盐岩 | 气候温暖 | 葛万菌、附枝菌、肾形菌 | 叠层石、凝块石 | 文献[86] |
| 上震旦统奇格布拉克组 | 塔里木盆地 | 裂谷、拗拉槽 | 局限蒸发潮坪微生物席 | 干旱、寒冷 | 蓝细菌 | 叠层石 | 文献[99, 102] |
| 上震旦统灯影组 | 四川地区 | 兴凯期,拉张背景 | 台地内部/台缘微生物丘 | 赤道低纬度带,CO2高,气候温暖 | 蓝细菌,多样,主导当时的生物界 | 叠层石、凝块石 | 文献[95] |
| 中元古蓟县系 | 天津 | 被动陆缘 | 陆表海 | 气候温暖 | 裂须藻科等 | 叠层石、凝块石 | 文献[103] |
| 中元古界雾迷山组 | 任丘油田 | 被动大陆边缘 | 局限潮坪微生物席和微生物礁滩 | 气候温暖 | 蓝细菌 | 凝块石、锥状叠层石、层纹石、核形石 | 文献[84-85] |
国内微生物碳酸盐岩沉积学对现今沉积研究相对薄弱,古老的微生物碳酸盐岩沉积成果较为丰富。分类认识微生物碳酸盐岩现代沉积机理、重建古老微生物碳酸盐岩早期成岩过程、分类认识古老微生物碳酸盐岩沉积标志是今后微生物碳酸盐岩沉积学研究的重点。
分类认识微生物碳酸盐岩现代沉积机理。前人对现今的叠层石(巴哈马台地、澳大利亚鲨鱼湾、巴西等)、凝块岩(澳大利亚Clifton湖)、鲕粒沉积(巴哈马鲕粒滩)进行了解剖,但对不同地区的纹层、凝块、鲕粒等沉积结构的生物、化学、物理成因还存在争议。加强国内现今微生物碳酸盐岩研究,是解决微生物碳酸盐岩沉积机理的必要手段。
重建古老微生物碳酸盐岩早期成岩过程。探讨已成岩的岩石微生物遗存的岩相特征以及微生物如何参与成岩的过程是亟待解决的问题[10, 104]。通过分析成岩作用的岩矿和古流体记录,研究和建立其埋藏演化的改造序列,有利于微生物碳酸盐岩典型结构的认知。
分类认识古老微生物碳酸盐岩沉积标志。在微生物碳酸盐岩沉积机理、早期成岩过程研究的基础上,明确不同类型微生物碳酸盐岩沉积标志。一方面是直接识别微生物残余矿化结构,另一方面由于残余结构不易识别,可以从微生物相关的矿化产物入手,如自生石英、黄铁矿、针铁矿等。微生物碳酸盐岩显著的跨相与地史演变是其有别于其他沉积岩石类型的重要标志,识别微生物碳酸盐岩形成的沉积结构,探索微生物类型、行为以及微生物控制/参与的沉积—早期成岩效应,反演形成环境,解析包括古生物、古气候、古环境和古构造(事件)等影响因素。在此过程中,多学科、多领域最新理论及技术方法的结合运用,对现代、古代微生物碳酸盐岩对比研究显得尤为必要。
3 结语微生物席矿化产物及序列、微生物岩相关元素的循环过程、沉积结构的成因机制、沉积环境等是当今微生物碳酸盐岩的研究热点。对纹层、凝块、鲕粒等沉积结构的生物、化学、物理成因还存在争议。国内微生物碳酸盐岩沉积学在现今沉积研究相对薄弱,古老的微生物碳酸盐岩沉积成果较为丰富,下步可以重点开展分类认识微生物碳酸盐岩现代沉积机理、重建古老微生物碳酸盐岩早期成岩过程、分类认识古老微生物碳酸盐岩沉积标志的研究工作。
致谢: 刘可禹、Anais Pages (联邦科学与工业研究组织)等专家在澳大利亚鲨鱼湾现代叠层石考察中进行了指导与交流。| [1] |
Burne R V, Moore L S. Microbialites:organosedimentary deposits of benthic microbial communities[J]. Palaios, 1987, 2(3): 241-254. DOI:10.2307/3514674 |
| [2] |
Riding R. Classification of microbial carbonates[M]//Riding R. Calcareous algae and stromatolites. Berlin: Springer, 1991: 21-51.
|
| [3] |
Riding R. Microbial carbonates:the geological record of calcified bacterial-algal mats and biofilms[J]. Sedimentology, 2000, 47: 179-214. DOI:10.1046/j.1365-3091.2000.00003.x |
| [4] |
Warusavitharana C, Parcell W C. Sedimentary features, occurrence and cyclicity of microbialite facies in the Roubidoux and Jefferson City Formations of Missouri and Kansas[J]. AAPG Bulletin, 2013, 97(97): 1849-1870. |
| [5] |
梁玉左, 朱士兴, 高振家, 等. 叠层石研究的新进展:微生物岩[J]. 中国区域地质, 1995(1): 57-65, 43. [ Liang Yuzuo, Zhu Shixing, Gao Zhenjia, et al. New prigress in the study of stratomalites——microbialite[J]. Regional Geology of China, 1995(1): 57-65, 43.] |
| [6] |
戴永定, 陈孟莪, 王尧. 微生物岩研究的发展与展望[J]. 地球科学进展, 1996, 11(2): 209-215. [ Dai Yongding, Chen Meng'e, Wang Yao. Development and perspective of research for microbolites[J]. Advence in Earth Sciences, 1996, 11(2): 209-215.] |
| [7] |
梅冥相. 从凝块石概念的演变论微生物碳酸盐岩的研究进展[J]. 地质科技情报, 2007, 26(6): 1-9. [ Mei Mingxiang. Discussion on advances of microbial carbonates from the terminological change of thrombolites[J]. Geological Science and Technology Information, 2007, 26(6): 1-9.] |
| [8] |
罗平, 王石, 李朋威, 等. 微生物碳酸盐岩油气储层研究现状与展望[J]. 沉积学报, 2013, 31(5): 807-823. [ Luo Ping, Wang Shi, Li Pengwei, et al. Review and prospectives of microbial carbonate reservoirs[J]. Acta Sedimentologica Sinica, 2013, 31(5): 807-823.] |
| [9] |
赵贵生. 华北中元古代雾迷山组微生物岩及其古海洋环境意义[D]. 北京: 中国地质大学(北京), 2011. [Zhao Guisheng. Mesoproterozoic micobialites from North China patform and their paleoceaographic significance[D]. Beijing: China University of Geosciences, Beijing, 2011.] http://cdmd.cnki.com.cn/Article/CDMD-11415-1011078615.htm
|
| [10] |
李忠. "从最高到最深":从第17届国际沉积学大会看沉积学研究前沿[J]. 沉积学报, 2006, 24(6): 928-933. [ Li Zhong. From the highest to the deepest:a review on research frontiers of sedimentology reflected from 17th International Sedimentological Congress[J]. Acta Sedimentologica Sinica, 2006, 24(6): 928-933.] |
| [11] |
吴因业, 朱如凯, 罗平, 等. 沉积学与层序地层学研究新进展:第18届国际沉积学大会综述[J]. 沉积学报, 2011, 29(1): 199-206. [ Wu Yinye, Zhu Rukai, Luo Ping, et al. Advance on sedimentology and sequence stratigraphy:A summary from 18th International Sedimentology Congress[J]. Acta Sedimentologica Sinica, 2011, 29(1): 199-206.] |
| [12] |
鲜本忠, 朱筱敏, 岳大力, 等. 沉积学研究热点与进展:第19届国际沉积学大会综述[J]. 古地理学报, 2014, 16(6): 816-826. [ Xian Benzhong, Zhu Xiaomin, Yue Dali, et al. Current hot topics and advances of sedimentology:A summary from 19th International Sedimentological Congress[J]. Journal of Palaeogeography, 2014, 16(6): 816-826.] |
| [13] |
朱筱敏, 李顺利, 潘荣, 等. 沉积学研究热点与进展:第32届国际沉积学会议综述[J]. 古地理学报, 2016, 18(5): 699-716. [ Zhu Xiaomin, Li Shunli, Pan Rong, et al. Current hot topics and advances of sedimentology:A summary from 32nd IAS meeting of sedimentology[J]. Journal of Palaeogeography, 2016, 18(5): 699-716.] |
| [14] |
Banfield J F, Nealson K H. Geomicrobiology:interaction between microbes and minerals, reviews in mineralogy and geochemistry[M]. Washington, DC: Mineralogical Society of America, 1997.
|
| [15] |
Dove P M, De Yoreo J J, and Weiner S. (Eds). Biomineralization: Reviews in Mineralogy and Geochemistry[M]. Washington, Mineralogical Society of America and the Geochemical Society, Volume 54. 2003.
|
| [16] |
Tucker M, Perri E, Slowakiewicz M, et al. Mineral precipitates in modern microbial mats: crystallites, spheroids, bacteria and viruses[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [17] |
Pace A, Bourillot R, Bouton A, et al. Initiation of Stromatolite Formation at the interface of oxygenic-anoxygenic phoyosynthesis[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [18] |
Merz-Preiß M. Calcification in cyanobacteria[M]//Riding R E, Awramik S M. Microbial sediments. Berlin: Springer, 2000: 50-56.
|
| [19] |
Pentecost A, Riding R. Calcification in cyanobacteria[M]//Leadbeater B S C, Riding R. Biomineralization in lower plants and animals. Oxford: Oxford University Press, 1986, 30: 73-90.
|
| [20] |
Thompson J B, Ferris F G. Cyanobacterial precipitation of gypsum, calcite, and magnesite from natural alkaline lake water[J]. Geology, 1990, 18(10): 995-998. DOI:10.1130/0091-7613(1990)018<0995:CPOGCA>2.3.CO;2 |
| [21] |
Merz M U. The biology of carbonate precipitation by cyanobacteria[J]. Facies, 1992, 26(1): 81-101. DOI:10.1007/BF02539795 |
| [22] |
Arp G, Reimer A, Reitner J. Photosynthesis-induced biofilm calcification and calcium concentrations in Phanerozoic oceans[J]. Science, 2001, 292(5522): 1701-1704. DOI:10.1126/science.1057204 |
| [23] |
Riding R. An atmospheric stimulus for cyanobacterial-bioinduced calcification ca. 350 million years ago?[J]. Palaios, 2009, 24(10): 685-696. DOI:10.2110/palo.2009.p09-033r |
| [24] |
Brand U, Veizer J. Chemical diagenesis of a multicomponent carbonate system-1:trace elements[J]. Journal of Sedimentary Research, 1980, 50(4): 1219-1236. |
| [25] |
Nothdurft L D, Webb G E, Kamber B S. Rare earth element geochemistry of Late Devonian reefal carbonates, Canning basin, western Australia:confirmation of a seawater REE proxy in ancient limestones[J]. Geochimica et Cosmochimica Acta, 2004, 68(2): 263-283. DOI:10.1016/S0016-7037(03)00422-8 |
| [26] |
Webb G E, Nothdurft L D, Kamber B S, et al. Rare earth element geochemistry of scleractinian coral skeleton during meteoric diagenesis:a sequence through neomorphism of aragonite to calcite[J]. Sedimentology, 2009, 56(5): 1433-1463. DOI:10.1111/sed.2009.56.issue-5 |
| [27] |
Webb G E, Kamber B S. Trace element geochemistry as a tool for interpreting microbialites[M]//Golding S D, Glikson M. Earliest life on earth: habitats, environments and methods of detection. New York: Springer, 2011: 127-170.
|
| [28] |
Azmy K, Brand U, Sylvester P, et al. Biogenic and abiogenic low-Mg calcite (bLMC and aLMC):evaluation of seawater-REE composition, water masses and carbonate diagenesis[J]. Chemical Geology, 2011, 280(1/2): 180-190. |
| [29] |
Li R, Jones B. Evaluation of carbonate diagenesis:a comparative study of minor elements, trace elements, and rare-earth elements (REE+Y) between Pleistocene corals and matrices from Grand Cayman, British West indies[J]. Sedimentary Geology, 2014, 314: 31-46. DOI:10.1016/j.sedgeo.2014.10.004 |
| [30] |
Hoehler T M, Bebout B M, Des Marais D J. The role of microbial mats in the production of reduced gases on the early Earth[J]. Nature, 2001, 412: 324-327. DOI:10.1038/35085554 |
| [31] |
Anbar A D, Knoll A H. Proterozoic ocean chemistry and evolution:a bioinorganic bridge?[J]. Science, 2002, 297(5584): 1137-1142. DOI:10.1126/science.1069651 |
| [32] |
Hayes J M, Waldbauer J R. The carbon cycle and associated redox processes through time[J]. Philosophical Transactions of the Royal Society B, 2006, 631(1470): 931-950. |
| [33] |
Bekker A, Holland H D, Wang P L, et al. Dating the rise of atmospheric oxygen[J]. Nature, 2004, 427(6970): 117-120. DOI:10.1038/nature02260 |
| [34] |
Canfield D E. The early history of atmospheric oxygen:homage to Robert M. Garrels[J]. Annual Review of Earth and Planetary Sciences, 2005, 33: 1-36. DOI:10.1146/annurev.earth.33.092203.122711 |
| [35] |
Dupraz C, Visscher P T. Microbial lithification in marine stromatolites and hypersaline mats[J]. Trends in Microbiology, 2005, 13(9): 429-438. DOI:10.1016/j.tim.2005.07.008 |
| [36] |
Gomes M L, Fike D A, Bergmann K D, et al. Environmental insights from high-resolution (SIMS) sulfur isotope analyses of sulfides in Proterozoic microbialites with diverse mat textures[J]. Geobiology, 2018, 16(1): 17-34. DOI:10.1111/gbi.2018.16.issue-1 |
| [37] |
Wacey D, Gleeson D, Kilburn M R. Microbialite taphonomy and biogenicity:new insights from NanoSIMS[J]. Geobiology, 2010, 8(5): 403-416. DOI:10.1111/gbi.2010.8.issue-5 |
| [38] |
Kitano Y, Okumura M, Idogaki M. Uptake of phosphate ions by calcium carbonate[J]. Geochemical Journal, 1978, 12: 29-37. DOI:10.2343/geochemj.12.29 |
| [39] |
Ishikawa M, Ichikuni M. Coprecipitation of phosphate with calcite[J]. Geochemical Journal, 1981, 15(5): 283-288. DOI:10.2343/geochemj.15.283 |
| [40] |
Fike D A, Finke N, Zha J, et al. The effect of sulfate concentration on (sub)millimeter-scale sulfide δ34S in hypersaline cyanobacterial mats over the diurnal cycle[J]. Geochimica et Cosmochimica Acta, 2009, 73(20): 6187-6204. DOI:10.1016/j.gca.2009.07.006 |
| [41] |
Fike D A, Bradley A S, Rose C V. Rethinking the ancient sulfur cycle[J]. Annual Review of Earth and Planetary Sciences, 2015, 43: 593-622. DOI:10.1146/annurev-earth-060313-054802 |
| [42] |
Dong H L, Jaisi D P, Kim J, et al. Microbe-clay mineral interactions[J]. American Mineralogist, 2009, 94(11/12): 1505-1519. |
| [43] |
Bishop M E, Dong H L, Kukkadapu R K, et al. Bioreduction of Fe-bearing clay minerals and their reactivity toward pertechnetate (Tc-99)[J]. Geochimica et Cosmochimica Acta, 2011, 75(18): 5229-5246. DOI:10.1016/j.gca.2011.06.034 |
| [44] |
Liu D, Dong H L, Bishop M E, et al. Reduction of structural Fe(Ⅲ) in nontronite by methanogen Methanosarcina barkeri[J]. Geochimica et Cosmochimica Acta, 2011, 75(4): 1057-1071. DOI:10.1016/j.gca.2010.11.009 |
| [45] |
Luo M, Chen Z Q, Shi G R, et al. Upper Lower Triassic stromatolite from Anhui, South China:geobiologic features and paleoenvironmental implications[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2016, 452: 40-54. DOI:10.1016/j.palaeo.2016.04.008 |
| [46] |
Kremer B, Kazmierczak J, Łukomska-Kowalczyk M, et al. Calcification and silicification:fossilization potential of cyanobacteria from stromatolites of Niuafo'ou's Caldera Lakes (Tonga) and implications for the early fossil record[J]. Astrobiology, 2012, 12(6): 535-548. DOI:10.1089/ast.2011.0742 |
| [47] |
Yin H F, Huang S J, Zhang K X, et al. The effects of volcanism on the Permo-Triassic mass extinction in South China[M]//Sweet W C, Yang Z Y, Dickins J M, et al. Permo-triassic events in the eastern Tethys. Cambridge: Cambridge University Press, 1992: 146-157.
|
| [48] |
Zhang S X, Peng Y Q, Yu J X, et al. Characteristics of claystones across the terrestrial Permian-Triassic boundary:evidence from the Chahe section, western Guizhou, South China[J]. Journal of Asian Earth Sciences, 2006, 27(3): 358-370. DOI:10.1016/j.jseaes.2005.04.007 |
| [49] |
Lebrun E, Brugna M, Baymann F, et al. Arsenite oxidase, an ancient bioenergetic enzyme[J]. Molecular Biology and Evolution, 2003, 20(5): 686-693. DOI:10.1093/molbev/msg071 |
| [50] |
Duval S, Ducluzeau A L, Nitschke W, et al. Enzyme phylogenies as markers for the oxidation state of the environment:the case of respiratory arsenate reductase and related enzymes[J]. BMC Evolutionary Biology, 2008, 8: 206. DOI:10.1186/1471-2148-8-206 |
| [51] |
Sforna M C, Philippot P, Somogyi A, et al. Evidence for arsenic metabolism and cycling by microorganisms 2.7 billion years ago[J]. Nature Geoscience, 2014, 7(11): 811-815. DOI:10.1038/ngeo2276 |
| [52] |
Kurth D, Amadio A, Ordoñez O F, et al. Arsenic metabolism in high altitude modern stromatolites revealed by metagenomic analysis[J]. Scientific Reports, 2017, 7(1): 1024. DOI:10.1038/s41598-017-00896-0 |
| [53] |
梅冥相. 微生物碳酸盐岩分类体系的修订:对灰岩成因结构分类体系的补充[J]. 地学前缘, 2007, 14(5): 222-234. [ Mei Mingxiang. Revised classification of microbial carbonates:Complementing the classification of limestones[J]. Earth Science Frontiers, 2007, 14(5): 222-234.] |
| [54] |
段凯波, 段东生, 陈留勤, 等. 微生物碳酸盐岩研究进展及存在的问题[J]. 西北地质, 2008, 41(1): 44-49. [ Duan Kaibo, Duan Dongsheng, Chen Liuqin, et al. Progress and problems in microbial carbonates research[J]. Northwestern Geology, 2008, 41(1): 44-49.] |
| [55] |
Quijada I E, Cuadrado D G, Maisano L, et al. Carbonate precipitation in microbial mats developed in a siliciclastic coastal environment of N Patagonia (Argentina)[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [56] |
Arenas C, Jones B. Temporal and environmental significance of microbial lamination:insights from Recent fluvial stromatolites in the River Piedra, Spain[J]. Sedimentology, 2017, 64(6): 1597-1629. DOI:10.1111/sed.2017.64.issue-6 |
| [57] |
Martìn-Bello L, Arenas C, Alonsozarza A M, et al. Lacustrine stromatolite lamination of the miocene in the sierra de alcubierre(Ebro Basin, Spain)[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [58] |
Vieira L C, Nedelec A, Fabre S, et al. Aragonite crystal fans in Neoproterozoic cap carbonates:A case study from Brazil and implications for the post-snowball earth coastal environment[J]. Journal of Sedimentary Research, 2015, 85(3): 285-300. DOI:10.2110/jsr.2015.21 |
| [59] |
Brasier A, Wacey D, Mercedesmartin R, et al. The fabric of continental carbonates: what have the microbes ever done for us?[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017. http://www.researchgate.net/publication/320386180_THE_FABRIC_OF_CONTINENTAL_CARBONATES_WHAT_HAVE_THE_MICROBES_EVER_DONE_FOR_US
|
| [60] |
Konishi Y, Prince J, Knott B. The fauna of thrombolitic microbialites, Lake Clifton, Western Australia[J]. Hydrobiologia, 2001, 457(3): 39-47. |
| [61] |
Moore L S, Burne R V. The modern thrombolites of lake clifton, western Australia[M]//Bertrand-Sarfati J, Monty C. Phanerozoic stromatolites Ⅱ. Dordrecht: Springer, 1994: 3-29.
|
| [62] |
Burne R V, Moore L S, Christy A G, et al. Stevensite in the modern thrombolites of Lake Clifton, western Australia:a missing link in microbialite mineralization?[J]. Geology, 2014, 42(7): 575-578. DOI:10.1130/G35484.1 |
| [63] |
Theisen C H, Sumner D Y. Thrombolite fabrics and origins:influences of diverse microbial and metazoan processes on Cambrian thrombolite variability in the Great Basin, California and Nevada[J]. Sedimentology, 2016, 63(7): 2217-2252. DOI:10.1111/sed.2016.63.issue-7 |
| [64] |
Gerdes G, Dunajtschik-Piewak K, Riege H, et al. Structural diversity of biogenic carbonate particles in microbial mats[J]. Sedimentology, 1994, 41(6): 1273-1294. DOI:10.1111/sed.1994.41.issue-6 |
| [65] |
Brehm U, Krumbein W E, Palinska K A. Biomicrospheres generate ooids in the laboratory[J]. Geomicrobiology Journal, 2006, 23(7): 545-550. DOI:10.1080/01490450600897302 |
| [66] |
梅冥相. 鲕粒成因研究的新进展[J]. 沉积学报, 2012, 30(1): 20-32. [ Mei Mingxiang. Brief introduction on new advances on the origin of ooids[J]. Acta Sedimentologica Sinica, 2012, 30(1): 20-32.] |
| [67] |
Diaz M R, Eberli G, Phillips B, et al. Ooids: the unrecognized microbialites[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [68] |
Duguid S M A, Kyser T K, James N P, et al. Microbes and ooids[J]. Journal of Sedimentary Research, 2010, 80(3): 236-251. DOI:10.2110/jsr.2010.027 |
| [69] |
Dupraz C, Reid R P, Braissant O, et al. Processes of carbonate precipitation in modern microbial mats[J]. Earth-Science Reviews, 2009, 96(3): 141-162. DOI:10.1016/j.earscirev.2008.10.005 |
| [70] |
Jahnert R J, Collins L B. Characteristics, distribution and morphogenesis of subtidal microbial systems in Shark Bay, Australia[J]. Marine Geology, 2012, 303-306: 115-136. DOI:10.1016/j.margeo.2012.02.009 |
| [71] |
Suosaari E P, Reid R P, Playford P E, et al. New multi-scale perspectives on the stromatolites of Shark Bay, western Australia[J]. Scientific Reports, 2016, 6: 20557. DOI:10.1038/srep20557 |
| [72] |
Aubineau J, El Albani A, Meunier A, et al. Unusual Structural Diversity of Mat-Related Structures and their implications for the Francevillian Biota (FB2 Formation, 2. 1 Ga, Gabon)[C]//Proceedings of the 33nd IAS meeting of sedimentology. Toulouse: IMS, 2017.
|
| [73] |
Hamon Y, Rohais S, Deschamps R, et al. Characterization and distribution of the microbialites within lacustrine series: the example of the maastrichtian-danian yacoraite FM, Salta Basin, Argentina[C]//Proceedings of the 33nd IAS meeting of sedimentology. Toulouse: IMS, 2017.
|
| [74] |
Mettraux M, Homewood P, Dos Anjos C, et al. Microbial communities and their primary to early diagenetic mineral phases; the record from Neoproterozoic microbialites of Qarn Alam, Oman[J]. Geological Society, London, Special Publications, 2015, 418(1): 123-154. DOI:10.1144/SP418.5 |
| [75] |
Caird R A, Pufahl P K, Hiatt E E, et al. Ediacaran stromatolites and intertidal phosphorite of the Salitre formation, Brazil:phosphogenesis during the Neoproterozoic Oxygenation Event[J]. Sedimentary Geology, 2017, 350: 55-71. DOI:10.1016/j.sedgeo.2017.01.005 |
| [76] |
Marangon A, Gattolin G, Porta G D, et al. The Latemar:a flat-topped, steep fronted platform dominated by microbialites and synsedimentary cements[J]. Sedimentary Geology, 2011, 240(3/4): 97-114. |
| [77] |
Kenter J A M, Harris P M, Porta G D. Steep microbial boundstone-dominated platform margins-examples and implications[J]. Sedimentary Geology, 2005, 178(1/2): 5-30. |
| [78] |
Yang X Q, Fan T L, Wu Y. Lithofacies and cyclicity of the lower Cambrian Niutitang shale in the mayang Basin of Western Hunan, South China[J]. Journal of Natural Gas Science and Engineering, 2016, 28: 74-86. DOI:10.1016/j.jngse.2015.11.007 |
| [79] |
Braga J, Sola F, Sælen G. Patchy Distribution of factory facies in late Miocene nearshore mixed carbonate-terrigenous deposits in Sierra De Gádor, Almeria, SE Spain[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [80] |
常玉光, 齐永安, 郑伟, 等. 叠层石微生物席生态系研究进展[J]. 河南理工大学学报(自然科学版), 2013, 32(3): 356-364. [ Chang Yuguang, Qi Yong'an, Zheng Wei, et al. Research progress on microbial mat ecosystem of stromatolites[J]. Journal of Henan Polytechnic University (Natural Science), 2013, 32(3): 356-364.] |
| [81] |
田友萍, 何复胜. 川黔地区地表钙华中发现现代淡水叠层石及藻席[J]. 地质论评, 2000, 46(5): 549-555. [ Tian Youping, He Fusheng. Present freshwater stromatolites and algal mats in surface calcareous tufa in the Sichuan and Guizhou areas[J]. Geological Review, 2000, 46(5): 549-555.] |
| [82] |
王自强, 全秋琦. 宜昌峡东地区的现代叠层石[J]. 地质科学, 1982, 10(4): 403-407. [ Wang Ziqiang, Quan Qiuqi. Modern stromatolites in eastern part of the yangtse gorges, Yichang[J]. Chinese Journal of Geology, 1982, 10(4): 403-407.] |
| [83] |
阂隆瑞, 迟振卿, 朱关祥, 等. 阳原县泥河湾地层中的新发现[J]. 第四纪研究, 1998(2): 183-196. [ He Longrui, Chi Zhenqing, Zhu Guanxiang, et al. New discovery in Nihewan beds[J]. Quaternary Sciences, 1998(2): 183-196.] |
| [84] |
朱士兴. 中国叠层石[M]. 天津: 天津大学出版社, 1993: 1-263. [ Zhu Shixing. The stromatolites of China[M]. Tianjin: Tianjin University Press, 1993: 1-263.]
|
| [85] |
曹瑞骥, 袁训来. 叠层石[M]. 合肥: 中国科学技术大学出版社, 2006. [ Cao Ruiji, Yuan Xunlai. Stromatolites[M]. Hefei: China Science and Technology University Press, 2006.]
|
| [86] |
常玉光, 齐永安, 郑伟, 等. 中国豫西寒武系馒头组叠层石的沉积特征及其古环境意义[J]. 沉积学报, 2013, 31(1): 10-19. [ Chang Yuguang, Qi Yong'an, Zheng Wei, et al. Sedimentary characteristics and palaeoenvironmental significance on stromatolites of Mantou Formation in Cambrian, western Henan, China[J]. Acta Sedimentologica Sinica, 2013, 31(1): 10-19.] |
| [87] |
Bracchi V, Basso D. The role of the substrate in coralligenous development: examples from the present and the past[C]//Proceedings of the 33rd international meeting of sedimentology. Toulouse: IMS, 2017. http://hdl.handle.net/10281/176157
|
| [88] |
Wood R. What has controlled carbonate mineralogy through geological time?[C]//Proceedings of the 33rd IAS international meeting of sedimentology. Toulouse: IMS, 2017.
|
| [89] |
汤冬杰, 史晓颖, 蒋干清, 等. 中元古代微指状叠层石:超微组构和有机矿化过程[J]. 地质论评, 2012, 58(6): 1001-1016. [ Tang Dongjie, Shi Xiaoying, Jiang Ganqing, et al. Mesoproterozoic microdigitate stromatolites:ultra-fabrics and organomineralization[J]. Geological Review, 2012, 58(6): 1001-1016.] |
| [90] |
Yan Z, Liu J B, Ezaki Y, et al. Stacking patterns and growth models of multiscopic structures within Cambrian Series 3 thrombolites at the Jiulongshan section, Shandong province, northern China[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 474: 45-47. DOI:10.1016/j.palaeo.2016.07.009 |
| [91] |
唐鑫萍, 黄文辉, 邓宏文, 等. 山东平邑盆地古近系湖相微生物碳酸盐岩形成机理[J]. 古地理学报, 2012, 14(3): 355-364. [ Tang Xinping, Huang Wenhui, Deng Hongwen, et al. Formation mechanisms of the Paleogene lacustrine microbial carbonate rocks in Pingyi Basin, Shandong province[J]. Journal of Palaeogeography, 2012, 14(3): 355-364.] |
| [92] |
Liu L J, Wu Y S, Yang H J, et al. Ordovician calcified cyanobacteria and associated microfossils from the Tarim Basin, Northwest China:systematics and significance[J]. Journal of Systematic Palaeontology, 2016, 14(3): 183-210. DOI:10.1080/14772019.2015.1030128 |
| [93] |
由雪莲, 孙枢, 朱井泉. 塔里木盆地中上寒武统叠层石白云岩中微生物矿化组构特征及其成因意义[J]. 中国科学(D辑):地球科学, 2014, 44(8): 1777-1790. [ You Xuelian, Sun Shu, Zhu Jingquan. Significance of fossilized microbes from the Cambrian stromatolites in the Tarim Basin, Northwest China[J]. Science China(Seri.D):Earth Sciences, 2014, 44(8): 1777-1790.] |
| [94] |
杨帅, 陈洪德, 钟怡江, 等. 川西南地区晚震旦世微生物岩及其对桐湾运动Ⅰ幕的响应[J]. 岩石学报, 2017, 33(4): 1148-1158. [ Yang Shuai, Chen Hongde, Zhong Yijiang, et al. Microbolite of Late Sinian and its response for Tongwan movement episode I in Southwest Sichuan, China[J]. Acta Petrologica Sinica, 2017, 33(4): 1148-1158.] |
| [95] |
刘树根, 宋金民, 罗平, 等. 四川盆地深层微生物碳酸盐岩储层特征及其油气勘探前景[J]. 成都理工大学学报(自然科学版), 2016, 43(2): 129-152. [ Liu Shugen, Song Jinmin, Luo Ping, et al. Characteristics of microbial carbonate reservoir and its hydrocarbon exploring outlook in the Sichuan Basin, China[J]. Journal of Chengdu University of Technology (Science & Technology Edition), 2016, 43(2): 129-152.] |
| [96] |
Riding R, Fan J S. Ordovician calcified algae and cyanobacteria, northern Tarim Basin subsurface, China[J]. Palaeontology, 2010, 44(4): 783-810. |
| [97] |
Tosti F, Riding R. Current molded, storm damaged, sinuous columnar stromatolites:mesoproterozoic of northern China[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 465: 93-102. DOI:10.1016/j.palaeo.2016.10.019 |
| [98] |
Tosti F, Riding R. Fine-grained agglutinated elongate columnar stromatolites:Tieling Formation, ca 1420Ma, North China[J]. Sedimentology, 2017, 64(4): 871-902. DOI:10.1111/sed.2017.64.issue-4 |
| [99] |
林畅松, 李思田, 刘景彦, 等. 塔里木盆地古生代重要演化阶段的古构造格局与古地理演化[J]. 岩石学报, 2011, 27(1): 210-218. [ Lin Changsong, Li Sitian, Liu Jingyan, et al. Tectonic framework and paleogeographic evolution of the Tarim Basin during the Paleozoic major evolutionary stages[J]. Acta Petrologica Sinica, 2011, 27(1): 210-218.] |
| [100] |
吉云平, 杨振京, 赵华, 等. 河北阳原盆地井儿洼剖面常量元素地球化学特征揭示的中更新世晚期以来气候变化[J]. 古地理学报, 2016, 18(3): 487-496. [ Ji Yunping, Yang Zhenjing, Zhao Hua, et al. Climate change since the late Middle Pleistocene indicated by geochemical characteristics of major elements of Jing'erwa section in Yangyuan Basin, Hebei province[J]. Journal of Palaeogeography, 2016, 18(3): 487-496.] |
| [101] |
温志峰, 钟建华, 王冠民, 等. 柴达木盆地古近纪-新近纪湖相叠层石与藻礁的沉积组合特征与意义[J]. 地质学报, 2005, 79(4): 444-452. [ Wen Zhifeng, Zhong Jianhua, Wang Guanmin, et al. Miocene stromatolites associated with lacustrine algal reefs:Qaidam Basin, China[J]. Acta Geologica Sinica, 2005, 79(4): 444-452.] |
| [102] |
李朋威, 罗平, 陈敏, 等. 塔里木盆地西北缘上震旦统微生物碳酸盐岩储层特征与成因[J]. 石油与天然气地质, 2015, 36(3): 416-428. [ Li Pengwei, Luo Ping, Chen Min, et al. Characteristics and origin of the Upper Sinian microbial carbonate reservoirs at the northwestern margin of Tarim Basin[J]. Oil & Gas Geology, 2015, 36(3): 416-428.] |
| [103] |
潘建国, 曲永强, 马瑞, 等. 华北地块北缘中新元古界沉积构造演化[J]. 高校地质学报, 2013, 19(1): 109-122. [ Pan Jianguo, Qu Yongqiang, Ma Rui, et al. Sedimentary and tectonic evolution of the Meso-Neoproterozoic strata in the northern margin of the North China Block[J]. Geological Journal of China Universities, 2013, 19(1): 109-122.] |
| [104] |
孟繁莉. 热水沉积岩及微生物与地质环境的协同作用[C]//全国沉积学大会. 南京, 2017. [Meng Fanli. The synergistic effect of hot water sedimentary rock and microorganism and geological environment[C]//National sedimentological congress. Nanjing, 2017.]
|
 2018, Vol. 36
2018, Vol. 36