扩展功能
文章信息
- 程熊, 侯读杰, 徐长贵, 王飞龙
- CHENG Xiong, HOU DuJie, XU ChangGui, WANG FeiLong
- 庙西凹陷严重生物降解原油序列中三环萜烷的异常分布成因初探
- Abnormal Distributions of Tricyclic Terpanes and Its Genesis in Severely Biodegraded Oils from the Miaoxi Depression, Bohai Bay Basin
- 沉积学报, 2017, 35(1): 193-202
- ACTA SEDIMENTOLOGICA SINCA, 2017, 35(1): 193-202
- 10.14027/j.cnki.cjxb.2017.01.019
-
文章历史
- 收稿日期:2016-03-25
- 收修改稿日期: 2016-05-09
2. 中国地质大学(北京)能源学院/页岩气勘察与评价国土资源部重点实验室, 北京 100083;
3. 中海石油(中国)有限公司天津分公司, 天津 300452
2. Key Laboratory of Shale Gas Exploration and Evaluation, Ministry of Land and Resources, School of Energy Resources, China University of Geosciences, Beijing 100083, China;
3. Tianjin Branch of CNOOC, Tianjin 300452, China
1969年Winters et al.[1]将油藏中原油正构烷烃的损失归因于微生物作用,自此微生物降解作用成为被广泛接受的概念。Hunt[2]认为全球已知油藏中的1/5以上可能被生物降解作用改造或破坏过。生物降解作用严重影响了原油的化学组成和物理性质。随生物降解作用增强,原油饱和烃含量、API度降低,黏度、密度、硫含量、酸值以及极性化合物含量逐渐增加[3-7]。实验室和经验的观察表明原油的生物降解作用是一个准阶梯式的过程,生物标志化合物会依不同的的优先次序被消耗掉[8-11]。一般认为,生物标志化合物抵御生物降解的能力由弱到强的顺序为:正构烷烃、异构烷烃、类异戊二烯烷烃、二环倍半萜烷、藿烷(形成25-降藿烷)、甾烷、藿烷(不形成25-降藿烷)、重排甾烷、芳香甾烷、卟啉。
三环萜烷作为来源于原生动物细胞膜的三环六异戊二烯醇或三萜类的降解产物,广泛分布于烃源岩和原油中[4]。Anders et al.[12]首先在Uinta盆地绿河页岩中检测到C20~C26三环萜烷。前人在诸多甾烷与藿烷被不同程度生物降解的原油与油砂抽提物中检测到三环萜烷未被微生物侵蚀,因而认为它们具有非常强的抗生物降解能力[10-16],并据此提出三环萜烷可用于生物降解原油的油源对比研究。但值得注意的是,在一些深度生物降解的原油与油砂或微生物降解作用模拟实验中均发现了三环萜烷被微生物降解的直接或间接证据。Connan[3]发现St Aubin沥青中甾烷类、藿烷系列与三环萜烷被微生物完全消除;Jiang et al.[17]在克拉玛依油田强烈生物降解原油中检测到C19~C28脱甲基三环萜烷,并认为它们是由三环萜烷经微生物降解作用所形成的;Cassani[18]与Alberdi et al.[19]分别委在内瑞拉Cerro Negro与Bolivar Coastal油田重质原油中检测到C22~C29脱甲基三环萜烷,也认为它们来源于微生物作用下三环萜烷的脱甲基化作用;Bost et al.[20]在喜氧细菌模拟生物降解作用的实验中发现C28三环萜烷相对于C29~C30三环萜烷被优先降解。Alberdi et al.[19]的研究表明,C26~C30三环萜烷每一对非对映异构体中后洗脱的异构体被优先降解;Peters et al.[21]在Maturin盆地强烈生物降解原油中也检测到类似的现象,但与Alberdi et al.[19]的检测结果不同的是,该原油中尽管也存在丰富的脱甲基藿烷,但却不含脱甲基三环萜烷,表明三环萜烷的生物降解并非总是脱去C-10位的角甲基形成17-降三环萜烷。
上述实例表明,三环萜烷系列化合物可以被微生物降解是客观存在的现象,但在强烈生物降解条件下不同碳数三环萜烷(尤其是C19~C26三环萜烷)对生物降解作用易感性的研究仍较为薄弱,三环萜烷的生物降解机理也尚无定论。
笔者在研究渤海湾盆地原油时,在一系列生物降解原油和油砂抽提物中发现4个深度降解的原油(庙西北凸起PL15-8D井与PL9-4井原油)饱和烃馏分中三环萜烷的分布十分异常。深入剖析这些原油中三环萜烷系列与其他生物标志化合物的分布特征,对强烈生物降解原油生物降解级别的精细度量、三环萜烷的生物降解机理、不同碳数三环萜烷对微生物降解作用的易感性以及将三环萜烷等生物标志化合物作为生物降解原油油源对比参数有效性的确定均有所裨益。
1 样品与实验本文中三环萜烷遭受生物降解的原油样品采自渤海湾盆地东部庙西北凸起的PL15-8D井与PL9-4井,其埋深分别介于1 031~1 758 m、967~982 m,层位包括明化镇组上段(N2mu)与下段(N2mL)。
首先用正己烷沉淀原油中的沥青质,然后用柱色层把脱沥青质原油分离成饱和烃(正己烷作冲洗剂)、芳香烃(甲苯作冲洗剂)和非烃(甲苯+乙醇作冲洗剂)。然后对饱和烃馏分进行色谱、色谱-质谱(GC-MS)分析。
色谱分析:HP6890N气相色谱仪,HP-PONA毛细柱,0.23 mm×50 m,膜厚0.5 μm,初始温度50℃,恒温3 min,以5 ℃/min速率升温至300℃后恒温25 min,氮气流速为1.0 mL/min,分流比为20:1,进样温度300℃,FID检测器温度为300℃。
饱和烃色谱-质谱分析条件:色谱-质谱仪型号为HP GC 6890/5973MSD。色谱柱为HP-5MS弹性石英毛细柱(30 m×0.25 mm×0.25 μm),以脉冲不分流方式进样,脉冲压力为15 psi,进样器温度300℃,He为载气,流速1 mL/min。升温程序如下:初始温度50℃,恒温2 min后,以3 ℃/min的速率升温至310℃,并维持恒温18 min,EI电离方式,电离能量70eV,采用内标法对正构烷烃进行定量,正构烷烃的标样为C24D50,甾萜类标样为5α-雄甾烷。
2 结果与讨论 2.1 链烷烃链烷烃是原油中的优势组分,包括正构烷烃和支链烷烃,也是最易遭受生物降解的一类化合物。在正常原油中链烷烃的相对含量常大于50%,在遭受生物降解作用以后,其含量则大幅降低,在色谱图上链烷烃不同程度的缺失,甚至是形成大量未分辨的复杂混合物(Unresolved Complex Mixture, UCM)[22],使色谱基线抬升形成一个大鼓包,即UCM鼓包。如图 1所示,4个油样饱和烃馏分中正构烷烃与类异戊二烯烷烃均被完全消除,色谱基线抬升,形成大的UCM鼓包,表明这些原油至少遭受了PM4级生物降解作用[4]。
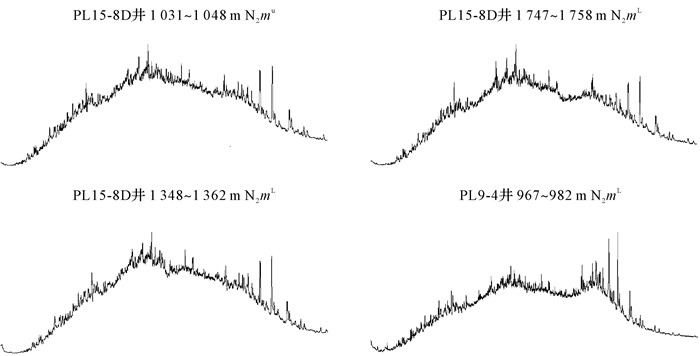
|
| 图 1 原油饱和烃馏分气相色谱图 Figure 1 Gas chromatograms of saturate fractions of crude oils |
甾烷类化合物作为一种来源于真核生物的生物标记物被广泛用于有机质生源、热演化程度与油源对比等研究。一般认为规则甾烷较重排甾烷、孕甾烷与升孕甾烷对生物降解作用更为敏感[4],即生物降解作用进行到一定程度时,细菌优先消除规则甾烷,从而导致重排甾烷、孕甾烷与升孕甾相对于规则甾烷富集。
PL15-8D与PL9-4井四个生物降解原油甾烷类分布特征相似,C27~C29规则甾烷均被大量侵蚀,仅残留较低丰度的C27ααα20S与C29ααα20S甾烷异构体(图 2)。重排甾烷与孕甾烷未受生物降解影响,并相对富集成为优势化合物,四个油样C27重排甾烷/∑C27~C29规则甾烷比值分布范围为1.08~1.46,(孕甾烷+升孕甾烷)/∑C27~29规则甾烷比值介于0.54~0.74。尽管PL15-1井1 683~1 695 m明下段原油C27~C29规则甾烷各异构体分布较为完整,但其藿烷被微生物降解,形成了较高丰度的25-降藿烷,并且孕甾烷与C27重排甾烷丰度相对较高,推测规则甾烷可能被轻微生物降解。
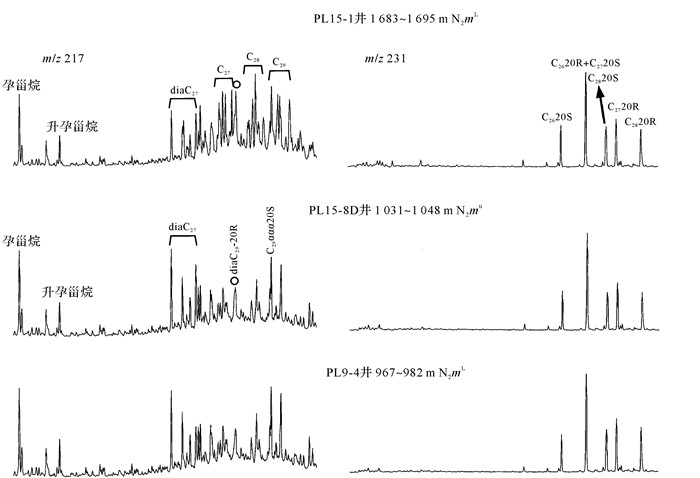
|
| 图 2 生物降解原油甾烷类与三芳甾烷分布特征 Figure 2 Mass fragmetograms (m/z177 and m/z231) showing steranes and triaromatic steroids in crude oils |
通常三芳甾烷具有非常强的抗生物降解能力,只有在C27~C29规则甾烷,藿烷与C27~C29重排甾烷被严重降解时三芳甾烷才会被明显降解。因此,该类化合物被广泛用于油源对比和烃源岩与原油的成熟度研究[4]。
如图 2所示,PL15-1井1 683~1 695 m明下段原油与PL15-8D、PL9-4井原油具有相似的三芳甾烷分布特征,均以C2620R+C2720S为主峰,C2620S、C2820S、C2720R与C2820R异构体丰度相当,这些油样C26~C28三芳甾烷均未受生物降解影响,而普遍缺失C20与C21三芳甾烷则可能是因为它们优先在水洗作用过程中被消除。由于三芳甾烷未受生物降解影响,其分布的一致性可以作为这些原油具有相同来源的有利证据。
2.3 藿烷系列藿烷类化合物是来源于细菌生源、广泛分布于地质体中的一类生物标志化合物[4]。藿烷抗生物降解能力强于链烷烃、无环类异戊二烯烷烃和二环倍半萜烷等。当原油遭受严重生物降解时,藿烷脱去C-10位的甲基形成25-降藿烷[13-14, 22-25],但也有研究表明藿烷受生物降解作用并非一定形成25-降藿烷[3, 16, 20, 26]。藿烷系列生物标志物分子结构中,在失去了C-10位上的角甲基后即转变成25-降藿烷系列。失去了C-10位角甲基的藿烷系列标志物在离子源遭受电子轰击后发生断裂时,其基峰由原来的m/z 191变成了m/z 177[4, 27]。
如图 3、图 4所示,PL15-8D与PL9-4井四个原油样品藿烷系列分布特征十分相似,在m/z191质量色谱图上,常规藿烷系列化合物(C27、C29~C35藿烷),尤其是C31~C35升藿烷,几乎被完全消除,仅残留低丰度的Ts、Tm、C29降藿烷与C30藿烷同系物,而C2925-降藿烷则占绝对优势。原油饱和烃馏分m/z177质量色谱图上均检测出完整的25-降藿烷系列化合物(图 3中D26~D34)。25-降藿烷系列化合物分布特征与常规藿烷相似,只是向下移动一个碳数。C3017α(H), 21β(H)-藿烷的单个差向异构体对应于C2925-降-17α(H), 21β(H)-藿烷(D29),而每对C31-C3517α(H), 21β(H)-藿烷(22S+22R)的差向异构体对应两个C30-C3425-降藿烷(D30~D34)差向异构体,有所不同的是,25-降藿烷系列以C2917α(H), 21β(H)-降藿烷脱甲基形成的C2825-降藿烷(D28)为主峰。25-降藿烷相对丰度的差异反映了原油生物降解程度的差别,生物降解越严重,藿烷消耗越多,25-降藿烷系列化合物相对越富集。PL15-8D井由浅到深3个油样的25-降藿烷/C30藿烷比值依次递增,分别为5.88、5.91、6.16,表明原油生物降解程度依次增加。PL9-4井原油25-降藿烷/C30藿烷比值为7.24,反映了原油生物降解作用之强烈。
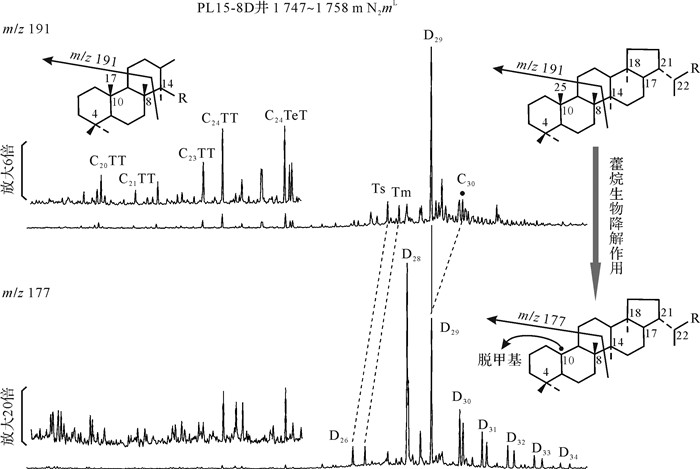
|
| 图 3 严重生物降解原油三环萜烷、藿烷与25-降藿烷系列化合物(m/z191, m/z177)分布特征及藿烷生物降解机理示意图 Figure 3 Mass fragmetograms (m/z191 and m/z177) showing tricyclic terpanes, hopanes and 25-norhopanes in saturate fractions of crude oils and biodegradation mechanism of hopanes |
研究表明,渤海湾盆地渤中凹陷、渤东凹陷以及庙西凹陷主要发育有沙河街组烃源岩(包括沙一段与沙三段)与东营组烃源岩。沙河街组烃源岩三环萜烷(TT)系列的分布特征较相似,呈以C21或C23为主峰的正态分布。东营组烃源岩三环萜烷呈以C21为主峰的正态分布,但其中来源于高等植物生源的C19、C20三环萜烷与C24四环萜烷(C24TeT)丰度相对高于沙河街组烃源岩。此前在渤海湾盆地已发现的正常原油和生物降解原油三环萜烷也均呈以C21或C23为主峰的正态分布①, ②[28-37]。如图 4(a)所示,PL15-1井1 683~1 695 m明下段原油具有典型的沙河街组烃源岩的三环萜烷分布特征。
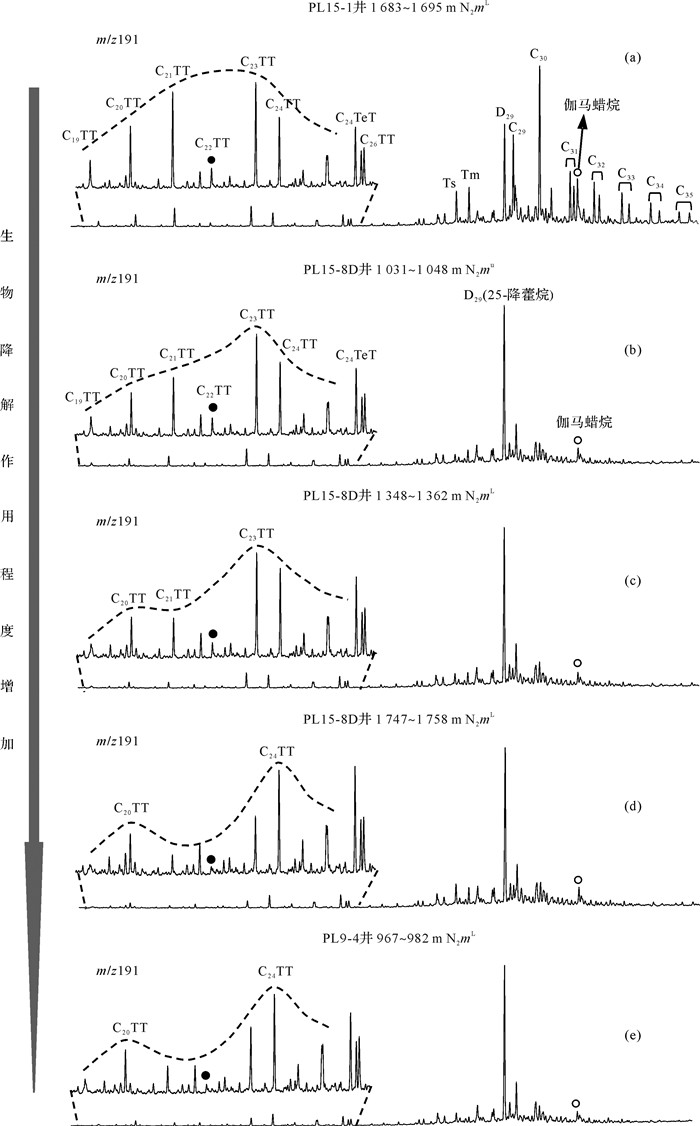
|
| 图 4 生物降解原油三环萜烷与藿烷系列化合物(m/z191)分布特征图 Figure 4 Mass fragmetograms (m/z191) showing tricyclic diterpanes and pentacyclic triterpanes in saturate fractions of crude oils |
①张敏等.庙西北洼生烃潜力研究及有利成藏区带预测. 2014.
②侯读杰等.黄河口东洼-庙西南洼资源评价及有利成藏区带预测. 2016.
本次研究中发现PL15-8D与PL9-4井四个严重生物降解原油三环萜烷的分布与前人报道的具有显著的差异性。如图 4所示,PL15-8D井1 031~1 048 m明化镇组上段(b)原油C19~C21三环萜烷丰度相对较低,呈以C23为主峰的后峰型分布;1 348~1 362 m明化镇组下段(c)原油C21三环烷烃丰度明显偏低,呈以C20和C23为主峰的微弱双峰型分布;PL15-8D井1 031~1 048 m明化镇组下段(d)与PL9-4井967~982 m明化镇组下段(e)原油C21与C23三环萜烷丰度更低,而C20三环萜烷相对丰度变化不大,形成以C20和C24为主峰的双峰型分布。
2.5 三环萜烷异常分布的成因原油的物理性质与化学组成取决于其母岩的性质,运移分馏以及在储层中的次生变化。PL15-8D与PL9-4井生物降解原油与沙河街组以及东营组烃源岩三环萜烷明显不同,因此,三环萜烷的这一异常分布模式不可能是继承于某一套烃源岩或由多套烃源岩多期生排烃混合所致。三环萜烷为非极性化合物,在运移过程中不会发生运移分馏效应,因而运移不会导致三环萜烷系列分布面貌的改变。前已述及原油规则甾烷与藿烷系列几乎被微生物消耗殆尽,重排甾烷与三芳甾烷未受影响,按照Peters与Moldowan的评价标准[4],其降解级别已达到7~8级。在如此强烈的生物降解作用下,三环萜烷很有可能发生生物降解,从而形成这一异常分布特征。
如图 4(a)所示,PL15-1原油具有典型的三环萜烷分布特征,尽管藿烷系列被大量侵蚀,形成了高丰度的25-降藿烷,但三环萜烷的分布并未受生物降解作用影响。PL15-8D井(b)原油生物降解程度明显增加,藿烷几乎被消耗殆尽,m/z191质量色谱图以C29 25-降藿烷(D29)占绝对优势。该原油C19~C21TT被轻微降解,C23~C26TT与C24TeT相对未受降解影响。PL15-8D井(c)原油C19~C23TT,尤其是C21TT,相对于C24~C26TT与C24TeT进一步损失。PL15-8D井(d)与PL9-4井(e)原油生物降解程度更高,其C21~C23TT被大量侵蚀,C20TT受降解影响相对较小,而C24TT~C26TT与C24TeT仍无明显被侵蚀的迹象。从三环萜烷的分布来看,这四个原油三环萜烷的降解程度依次增加,并且C19~C23三环萜烷相对于C24+三环萜烷异常优先地被生物降解。
图 5a、5b为C19~C26三环萜烷分别与孕甾烷、C27重排甾烷(diaC27)比值随生物降解作用程度的变化趋势图。图 5中(a)代表三环萜烷未受降解的PL15-1井原油,(b)~(d)代表三环萜烷被生物降解的PL15-8D井原油,其深度与层位信息见图 4。从图中可知的C19~C26三环萜烷相对丰度均随生物降解程度增加而逐渐降,这表明C19~C26三环萜烷的微生物降解作用是同步进行的。但C19~C23TT的相对丰度降低幅度较大,而C24~C26TT相对丰度仅有少量降低,表明C19~C23三环萜烷相对于C24~C26三环萜烷优先被微生物降解。
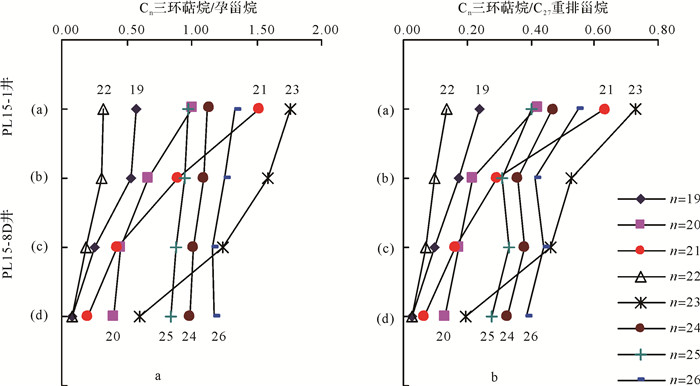
|
| 图 5 三环萜烷相对丰度随生物降解程度变化趋势 Figure 5 Diagram showing the biodegradation of C19 to C26 tricyclic terpanes in the severely biodegraded oils |
研究表明,三环萜烷被生物降解的PL15-8D与PL9-4井四个原油以及三环萜烷未遭受微生物侵蚀的PL9-2、PL9-4、PL9-5、PL13-1D、PL15-1、PL20-1井原油均来源于沙河街组烃源岩(未发表的数据)。图 6a、6b分别这些原油C19~C23/C26三环萜烷、C24~C25/C26三环萜烷比值与25-降藿烷/C30藿烷比值的关系图。图 6b中(b)~(e)代表PL15-8D与PL9-4井四个油样,其深度与层位信息见图 4。由图 6a、6b可知,随生物降解程度增加,C19~C23三环萜烷相对C26三环萜烷丰度显著降低,而C24~C25三环萜烷相对丰度变化不大,但PL15-8D井三个油样C24TT/C26TT与C25TT/C26TT比值略有降低。这表明C19~C23三环萜烷抗生物降解能力明显弱于C24~C26三环萜烷,C24与C25三环萜烷抗生物降解能力相对弱于C26三环萜烷。
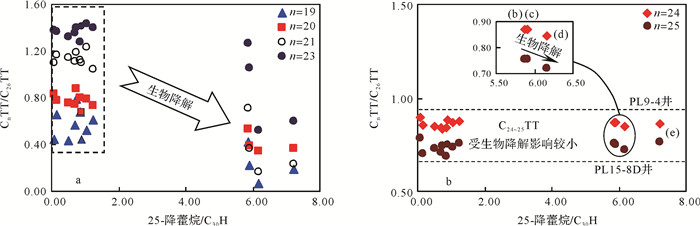
|
| 图 6 C19~C25三环萜烷相对丰度与生物降解作用程度的相关关系 Figure 6 Relationship between alteration of C19 to C25 tricyclic terpanes (Cn/C26TT, n=19 to 25) and biodegradation of C30 hopane (C2925-norhopane/C30 hopane) in crude oils |
图 7a为PL15-8D井三个油样((b)~(d),深度层位信息见图 4)中C19~C26三环萜烷的绝对浓度分布图。由图可知,三个油样中C19与C21~C23三环萜烷绝对浓度随生物降解程度的增加而大量降低;C20三环萜烷绝对浓度缓慢降低;而C24~C26三环萜烷绝对浓度变化不大,随降解程度增加先少量增加,随后略有降低。这一变化规律与图 4~6是一致的,均表明C19~C23三环萜烷的抗生物降解能力弱于C24~C26三环萜烷,而C20三环萜烷抗生物降解能力似乎强于C19与C21~C23三环萜烷。
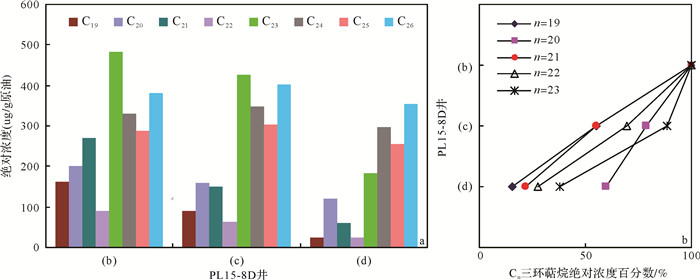
|
| 图 7 PL15-8D井原油C19~C26三环萜烷绝对浓度分布 Figure 7 The absolute concentration of C19 to C26 tricyclic terpanes in oil samples from Well PL15-8D |
将PL15-8D井(b)油样C19~C23三环萜烷绝对浓度当做100%,对(c)与(d)油样C19~C23三环萜烷绝对浓度进行折算,折算后的三环萜烷绝对浓度相对百分数如图 7b所示。由图 7b可知,随PL15-8D井(b)~(d)原油三环萜烷降解程度逐渐增加,C19~C23三环萜烷绝对浓度均逐渐降低,除C20三环萜烷外,C19~C21与C23三环萜烷绝对浓度相对百分数降低的速率随碳数增加而减小。这表明除C20外,C19~C23三环萜烷的降解速率随碳数的增加而降低,即碳数增加,三环萜烷的抗生物降解能力增强。
将同源的、三环萜烷未遭受生物降解原油的CnTT/C26TT (n=19~23)比值的平均值(Rn)定为100%,利用公式(1)可以计算出原油样品中三环萜烷同系物生物降解损失相对百分含量ΔRn (%)。
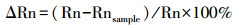 (1)
(1)
图 8为PL15-8D与PL9-4井四个油样C19~C23三环萜烷被生物降解所损失的相对百分含量ΔRn分布图。在三环萜烷降解的初始阶段((b)原油),C19~C21TT相对于C22~C23TT被优先降解,随着生物降解程度增加,C19TT与C21~C23TT降解程度大幅增加,而C20TT受生物降解影响变化不大,这似乎表明C20TT的抗生物降解能力强于C19TT与C21~C23TT,亦有可能是在强烈生物降解过程中有C20TT形成,改变了生物降解对其分布面貌的影响,但是何种化合物降解形成C20TT尚不明确。C21~C23TT则始终具有随碳数增加降解相对损耗降低的趋势,这与其绝对浓度的变化规律是一致的。但C19三环萜烷生物降解损失百分含量却并非总是最大的,这可能是由于C26TT被轻微降解所引起的ΔRn计算误差。前已述及这四个原油中C24~C26TT受生物降解影响较小,并且C24TT与C25TT优先于C26TT被降解,结合Bost et al.[13]的模拟实验结果,推断三环萜烷系列(除C20TT外)对生物降解作用的易感性具有随碳数增加而降低的趋势。
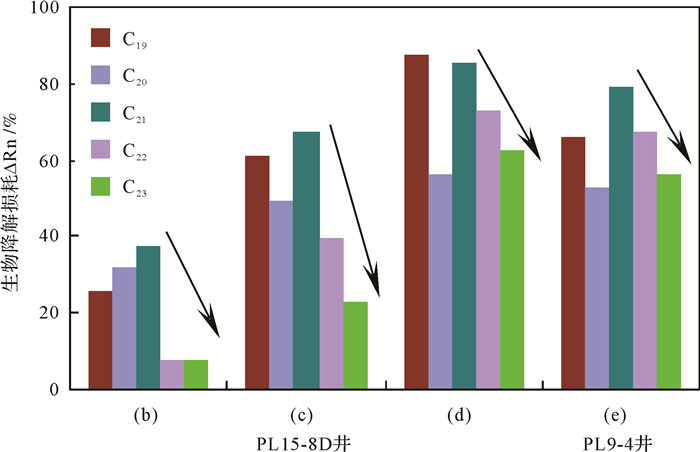
|
| 图 8 不同生物降解程度下C19~C23三环萜烷生物降解损耗相对百分含量(ΔRn, %)分布图 Figure 8 Relative depletion of C19~C23tricyclic terpanes of crude oils with different biodegradation levels |
Howell et al.[38]首次在Los Llanos盆地的轻微生物降解原油和正常原油中检测到碳数分布范围为C22~C28的脱甲基三环萜烷,并认为它们来源于烃源岩成烃母质或三环萜烷的生物降解作用。然而Jiang et al.[17], Cassani et al.[18]与Alberdi et al.[19]的研究表明,脱甲基三环萜烷是由三环萜烷失去C-10位上的甲基基团而形成,其形成机理类似于藿烷的微生物蚀变产生25-降藿烷(图 3)。
如图 3所示,在m/z191质量色谱图上,藿烷几乎被完全消除,C19~C23三环萜烷也被大量侵蚀。在m/z177质量色谱图上可见分布完整的25-降藿烷系列化合物(D26~D34),但并未检测到脱甲基三环萜烷。这表明,三环萜烷可能与藿烷一样,也可以在不形成脱甲基化合物的情况下被降解[21]。
参考藿烷的生物降解途径[39],推测三环萜烷可能具有以下几种生物降解途径(以C23三环萜烷为例):①三环萜烷支链末端的甲基被氧化,形成三环萜烷酸;②三环萜烷直接脱去C-10位的甲基,形成脱甲基三环萜烷,即17-降三环萜烷;③首先按途径①形成三环萜烷酸,三环萜烷酸再脱去C-10位的甲基,形成脱甲基三环萜烷酸,然后发生脱羧反应,形成脱甲基三环萜烷(图 9)。由于PL15-8D与PL9-4井原油中未检测到脱甲基三环萜烷,据此推测三环萜烷可能是按途径①发生的生物降解作用。
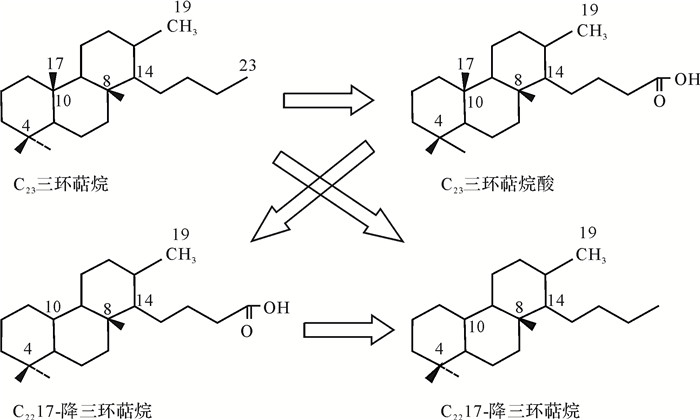
|
| 图 9 三环萜烷生物降解途径(以C23三环萜烷为例) Figure 9 Biodegradation pathways of C23 tricyclic terpane |
此外,需要指出的是,将三环萜烷用于生物降解原油的油源对比研究的前提是三环萜烷未受生物降解的影响。而上述四个强烈生物降解原油中三环萜烷已被微生物不同程度的改造,其宏观分布特征及其构建的各种参数已不能反映原油的原始生源构成,沉积环境和热演化程度等地球化学信息。因此,在研究生物降解原油,尤其是降解程度较高的原油时,首先要判断所用的生物标志物或芳烃是否被生物降解作用所改造,慎重选择未受生物降解作用影响的化合物构建相应地球化学指标。
3 结论(1) PL15-8D与PL9-4井原油发生强烈生物降解作用,C27~C29规则甾烷与藿烷系列几乎被消耗殆尽,C19~C23三环萜烷相对C24+三环萜烷异常优先地被侵蚀,形成了以C23为主峰的后峰型、以C20与C23为主峰的微弱双峰型以及以C20和C24为主峰的双峰型的异常分布模式。
(2) C19~C26三环萜烷/孕甾烷、C19~C26三环萜烷/C27重排甾烷、C19~C25三环萜烷/C26三环萜烷比值与三环萜烷绝对浓度的变化规律表明,不同碳数三环萜烷的生物降解作用是同时发生的,三环萜烷系列化合物抗生物降解能力随碳数增加而增强,而C20三环萜烷似乎具有比C21~C23三环萜烷更强的抗生物降解能力,亦或是在生物降解过程中某类高分子化合物降解时形成了C20三环萜烷。
(3) 原油中C19~C26三环萜烷被不同程度地降解,但并未检测到脱甲基三环萜烷,表明三环萜烷可以在不形成脱甲基化合物的情况下被降解。其生物降解途径可能是C环支链末端的甲基被微生物氧化成羧基,从而形成三环萜烷酸。
(4) 三芳甾烷蕴含丰度的地质地化信息,且未受生物降解影响,适用于研究区严重生物降解原油的油源对比研究。
| [1] | Winters J C, Williams J A. Microbiological alteration of crude oil in the reservoirs[C]//Symposium on Petroleum Transformation in Geologic Environments, American Chemical Society, Division of Petroleum Chemistry. New York, Paper PETR, 1969:E22-E31. |
| [2] | Hunt J M. Petroleum Geochemistry and Geology[M]. San Francisco: W. H. Freeman & Co Ltd, 1979: 387. |
| [3] | Connan J. Biodegradation of crude oils in reservoirs[M]//Brooks J, Welte D H. Advances in Petroleum Geochemistry. London:Academic Press, 1984, 1:299-335. |
| [4] | Peters K E, Walters C C, Moldowan J M. The Biomarker Guide:Biomarkers and Isotopes in the Environment and Human History[M]. 2nd ed. London: Cambridge University Press, 2005. |
| [5] | López L. Study of the biodegradation levels of oils from the Orinoco oil belt (Junin area) using different biodegradation scales[J]. Organic Geochemistry, 2014, 66: 60–69. DOI: 10.1016/j.orggeochem.2013.10.014 |
| [6] | Meredith W, Kelland S J, Jones D M. Influence of biodegradation on crude oil acidity and carboxylic acid composition[J]. Organic Geochemistry, 2000, 31(11): 1059–1073. DOI: 10.1016/S0146-6380(00)00136-4 |
| [7] | Head I M, Jones D M, Larter S R. Biological activity in the deep subsurface and the origin of heavy oil[J]. Nature, 2003, 426(6964): 344–352. DOI: 10.1038/nature02134 |
| [8] | Volkman J K, Alexander R, Kagi R I, et al. Demethylated hopanes in crude oils and their applications in petroleum geochemistry[J]. Geochimica et Cosmochimica Acta, 1983, 47(4): 785–794. DOI: 10.1016/0016-7037(83)90112-6 |
| [9] | Wenger L M, Davis C L, Isaksen G H. Multiple controls on petroleum biodegradation and impact in oil quality[J]. SPE Reservoir Evaluation & Engineering, 2002, 5(5): 375–383. |
| [10] | Williams J A, Bjorøy M, Dolcater D L, et al. Biodegradation in South Texas Eocene oils-effects on aromatics and biomarkers[J]. Organic Geochemistry, 1986, 10(1/2/3): 451–461. |
| [11] | Larter S, Huang Haiping, Adams J, et al. A practical biodegradation scale for use in reservoir geochemical studies of biodegraded oils[J]. Organic Geochemistry, 2012, 45: 66–76. DOI: 10.1016/j.orggeochem.2012.01.007 |
| [12] | Anders D E, Robinson W E. Cycloalkane constituents of the bitumen from Green River Shale[J]. Geochimica et Cosmochimica Acta, 1971, 35(7): 661–678. DOI: 10.1016/0016-7037(71)90065-2 |
| [13] | Reed W E. Molecular compositions of weathered petroleum and comparison with its possible source[J]. Geochimica et Cosmochimica Acta, 1977, 41(2): 237–247. DOI: 10.1016/0016-7037(77)90231-9 |
| [14] | Seifert W K, Moldowan J M. The effect of biodegradation on steranes and terpanes in crude oils[J]. Geochimica et Cosmochimica Acta, 1979, 43(1): 111–126. DOI: 10.1016/0016-7037(79)90051-6 |
| [15] | Connan J. Biodegradation of crude oil in the Aquitaine basin[J]. Physics and Chemistry of the Earth, 1980, 12: 1–17. DOI: 10.1016/0079-1946(79)90084-3 |
| [16] | Goodwin N S, Park P J D, Rawlinson A P. Crude oils biodegradation under simulated and natural conditions[M]//Bjorøy M. Advances in Organic Geochemistry. London:Wiley, 1983:650-658. |
| [17] | Jiang Zhusheng, Fowler M G, Lewis C A, et al. Polycyclic alkanes in a biodegraded oil from the Kelamayi oilfield, northwestern China[J]. Organic Geochemistry, 1990, 15(1): 35–46. DOI: 10.1016/0146-6380(90)90183-Z |
| [18] | Cassani F, Eglinton G. Organic geochemistry of Venezuelan extra-heavy crude oils 2. Molecular assessment of biodegradation[J]. Chemical Geology, 1991, 91(4): 315–333. DOI: 10.1016/0009-2541(91)90093-7 |
| [19] | Alberdi M, Moldowan J M, Peters K E, et al. Stereoselective biodegradation of tricyclic terpanes in heavy oils from the Bolivar Coastal Fields, Venezuela[J]. Organic Geochemistry, 2001, 32(1): 181–191. DOI: 10.1016/S0146-6380(00)00130-3 |
| [20] | Bost F D, Frontera-Suau R, McDonald T J, et al. Aerobic biodegradation of hopanes and norhopanes in Venezuelan crude oils[J]. Organic Geochemistry, 2001, 32(1): 105–114. DOI: 10.1016/S0146-6380(00)00147-9 |
| [21] | Peters K E. Petroleum tricyclic terpanes:predicted physicochemical behavior from molecular mechanics calculations[J]. Organic Geochemistry, 2000, 31(6): 497–507. DOI: 10.1016/S0146-6380(00)00029-2 |
| [22] | Alexander R, Kagi R I, Woodhouse G W, et al. The geochemistry of some biodegraded crude oils[J]. APEA J, 1983, 23: 53–63. |
| [23] | Rullkötter J, Wendisch D. Microbial alteration of 17α(H)-hopanes in Madagascar asphalts:removal of C-10 methyl group and ring opening[J]. Geochimica et Cosmochimica Acta, 1982, 46(9): 1545–1553. DOI: 10.1016/0016-7037(82)90313-1 |
| [24] | Bennett B, Fustic M, Farrimond P, et al. 25-norhopanes:formation during biodegradation of petroleum in the subsurface[J]. Organic Geochemistry, 2006, 37(7): 787–797. DOI: 10.1016/j.orggeochem.2006.03.003 |
| [25] | Wang Guangli, Wang T G, Simoneit B R T, et al. Sulfur rich petroleum derived from lacustrine carbonate source rocks in Bohai Bay Basin, East China[J]. Organic Geochemistry, 2013, 41(4): 340–354. |
| [26] | Michael G E, Lin L H, Kovachev G, et al. Biodegradation of tar-sand bitumens from the Ardmore and Anadarko Basins, Carter County, Oklahoma[J]. Organic Geochemistry, 1989, 14(5): 511–523. DOI: 10.1016/0146-6380(89)90031-4 |
| [27] | 包建平, 梅博文. 25-降藿烷系列的"异常"分布及其成因[J]. 沉积学报, 1997, 15 (2): 179–183. [ Bao Jianping, Mei Bowen. The abnormal distribution and the origin of 25-norhopane series[J]. Acta Sedimentologica Sinica, 1997, 15(2): 179–183. ] |
| [28] | 李友川, 黄正吉, 张功成. 渤中坳陷东下段烃源岩评价及油源研究[J]. 石油学报, 2001, 22 (2): 44–48, 122. [ Li Youchuan, Huang Zhengji, Zhang Gongcheng. Evaluation of the lower Dongying source and oil source research in Bozhong depression[J]. Acta Petrolei Sinica, 2001, 22(2): 44–48, 122. ] |
| [29] | 王培荣, 张大江, 宋孚庆, 等. 区分渤中坳陷三套烃源岩的地球化学参数组合[J]. 中国海上油气, 2004, 16 (3): 157–160. [ Wang Peirong, Zhang Dajiang, Song Fuqing, et al. The comprehensive geochemical parameters for distinguishing three sets of source rock in Bozhong depression[J]. China Offshore Oil and Gas, 2004, 16(3): 157–160. ] |
| [30] | 贾楠, 刘池洋, 张东东. 渤海湾盆地庙西凹陷烃源岩评价及油源分析[J]. 西北大学学报:自然科学版, 2013, 43 (3): 461–465. [ Jia Nan, Liu Chiyang, Zhang Dongdong. Study on hydrocarbon source rock characteristics and oil-source correlation in Miaoxi depression, Bohaiwan Basin[J]. Journal of Northwest University:Natural Science Edition, 2013, 43(3): 461–465. ] |
| [31] | 包建平, 张功成, 朱俊章, 等. 渤中凹陷原油生物标志物特征与成因类型划分[J]. 中国海上油气(地质), 2002, 16 (1): 11–18. [ Bao Jianping, Zhang Gongcheng, Zhu Junzhang, et al. Biomarker composition and origin classification of crude oil in Bozhong sag, Bohai Sea[J]. China Offshore Oil and Gas (Geology), 2002, 16(1): 11–18. ] |
| [32] | 文志刚, 唐友军, 李浮萍, 等. 渤中凹陷凝析油地球化学特征及油源研究[J]. 石油天然气学报(江汉石油学院学报), 2005, 27 (3): 293–295. [ Wen Zhigang, Tang Youjun, Li Fuping, et al. Study on geochemical characteristics of condensate and oil-source correlation in Bozhong depression, Bohai Bay Basin[J]. Journal of Oil and Gas Technology (Journal of Jianghan Petroleum Institute), 2005, 27(3): 293–295. ] |
| [33] | 陈丹, 文志刚, 唐友军, 等. 渤海海域中西部地区气藏伴生油地球化学特征和油源研究[J]. 矿物岩石地球化学通报, 2006, 25 (3): 250–253. [ Chen Dan, Wen Zhigang, Tang Youjun, et al. Geochemistry and source of oil associated with gas reservoirs in the western Bohai Bay Basin[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2006, 25(3): 250–253. ] |
| [34] | 邹华耀, 周心怀, 郝芳. 渤中地区蓬莱19-3油田油源分析及其成藏与勘探意义[J]. 西安石油大学学报:自然科学版, 2009, 24 (1): 13–16. [ Zou Huayao, Zhou Xinhuai, Hao Fang. Oil origin analysis of PL19-3 oilfield in Bozhong area and its significance to oil accumulation and exploration[J]. Journal of Xi'an Shiyou University:Natural Science Edition, 2009, 24(1): 13–16. ] |
| [35] | 倪春华, 包建平. 渤海湾盆地渤中凹陷原油地球化学特征研究[J]. 地质学刊, 2009, 33 (4): 359–365. [ Ni Chunhua, Bao Jianping. Study on geochemical characteristics of crude oil from Bozhong sag in Bohai Bay Basin[J]. Journal of Geology, 2009, 33(4): 359–365. ] |
| [36] | 庞雄奇, 郭永华, 姜福杰, 等. 渤海海域优质烃源岩及其分布预测[J]. 石油与天然气地质, 2009, 30 (4): 393–397. [ Pang Xiongqi, Guo Yonghua, Jiang Fujie, et al. High-quality source rocks and their distribution prediction in the Bohai Sea waters[J]. Oil & Gas Geology, 2009, 30(4): 393–397. ] |
| [37] | 赵春花.渤海海域原油地球化学特征研究[D].杭州:浙江大学, 2010. [ Zhao Chunhua. The study of geochemical characteristics of crude oils in Bohai Sea area[D]. Hangzhou:Zhejiang University, 2010. ] |
| [38] | Howell V J, Connan J, Aldridge A K. Tentative identification of demethylated tricyclic terpanes in nonbiodegraded and slightly biodegraded crude oils from the Los Llanos Basin, Colombia[J]. Organic Geochemistry, 1984, 6: 83–92. DOI: 10.1016/0146-6380(84)90029-9 |
| [39] | Lamorde U A, Parnell J, Bowden S A. Constraining the genetic relationships of 25-norhopanes, hopanoic and 25-norhopanoic acids in onshore Niger Delta oils using a temperature-dependent material balance[J]. Organic Geochemistry, 2015, 79: 31–43. DOI: 10.1016/j.orggeochem.2014.12.004 |
 2017, Vol. 35
2017, Vol. 35


