2. 中国科学院 合肥物质科学研究院, 安徽 合肥 230031
2. Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031, China
经颅直流电刺激(transcranial direct current stimulation,tDCS)是一种利用恒定、低强度直流电非侵入性调控大脑神经元活动的技术.神经可塑性和兴奋性的改变是许多神经系统疾病重要的发病机制,因此使用tDCS治疗神经疾病具有重要的潜在价值[1].上世纪70年代,研究人员就发现在健康受试者和精神疾病患者的头皮表面施加一定强度的直流电刺激,可影响大脑的生理功能[2, 3].研究至今,tDCS逐渐被开发成为调节人脑活动的重要工具.
功能磁共振成像(functional magnetic resonance imaging,fMRI)是一种在MRI的基础上,直观反映大脑经历某刺激前后区域活动变化的成像方法,其主要特点是可以在短时间内以非侵入性手段采集大脑各脑区的活动信号,实时呈现大脑各区域在处理外部刺激或静息状态下的表现.fMRI自1990年由Ogawa[4]首次提出以来,已经在认知神经科学、临床精神病学、心理学和临床诊断等领域得到广泛应用.
2001年,fMRI被首次应用于tDCS研究[5],之后因其无创伤、高分辨率的优势逐渐受到关注.有更多的研究者开始使用fMRI评估人和实验动物在tDCS刺激下大脑皮层区域和远端结构所受到的影响.将tDCS与fMRI结合[6]是tDCS研究中的一个突破,利用fMRI技术可更直观了解tDCS机制和功能之间的相关性.本文主要讨论了近十年来fMRI技术在tDCS研究中的应用进展,并展望了该领域未来的研究方向.
1 tDCS技术介绍经颅电刺激疗法历史悠久,早在古罗马时代,就有通过电鳐放电治疗头痛的记载.在十一世纪末期,由波斯医生Ibn-Sidah正式提出使用电鳐治疗癫痫的建议.1964年,Bindman等[7]的大鼠实验表明,在感觉皮层和运动皮层上施加直流电刺激,可改变神经元活动和皮层兴奋性,这些影响与刺激的极性有关,并在刺激结束后可持续数小时.2000年,Nitsche等[8]对人脑的初级运动皮层(M1)施加tDCS,发现阳极tDCS可增加运动皮层的兴奋性,而阴极tDCS则可降低其兴奋性,该结论在后续研究中得到多次验证.
tDCS的主要作用机制是使神经元细胞膜静息电位产生去极化或超极化的阈下改变.它并非直接诱导神经元产生电信号,而是调节神经元的静息电位,所以tDCS的效应很大程度上受被刺激部位自身活动状态的影响.一般来说,阳极tDCS使得刺激部位兴奋,阴极tDCS则使刺激部位抑制.这种tDCS极性对皮层兴奋性的正负向调节规律在多数情况下可被当作先验知识直接使用,但不具有绝对性,因为研究[9]表明亦有因素可将兴奋性调节转变为抑制性效应,反之亦然.例如,Kabakov等[10]研究tDCS对大鼠离体海马的作用,发现tDCS的正负性效应和神经元轴突与电场的相对方向有关;而Batsikadze等[11]发现将刺激强度从1 mA增加到2 mA,可以将阴极tDCS对M1的抑制作用转换为兴奋作用.影响tDCS效应的因素除了刺激强度、刺激时间、重复频次等参数外,还包括刺激靶点、靶点的投射区域、靶点周围结构、神经结构的病理改变、药物作用和个体遗传等多方面因素.
tDCS形成的电场分布难以预测,很大程度上受到个体头部解剖结构和组织生物物理学的影响.因此,电流无法聚焦作用于体积较小的关注脑区.针对这一问题,已有小组通过计算机电磁仿真和磁共振电阻抗成像(magnetic resonance electrical impedance tomography,MREIT)研究tDCS电流在脑部的矢量分布.计算机仿真技术依据MRI、电子计算机断层扫描(computed tomography,CT)等图像数据对颅脑进行三维重建,给皮肤、颅骨、脑脊液、灰质、白质等组织设置电导率,配置电极并设定刺激参数,再借助有限元分析法预测tDCS引起的电流密度分布.Wagner等[12]利用MRI重建人脑三维模型,用有限元分析方法求解模型,发现tDCS电流经颅后在脑内不同组织的电流密度不同,虽然电流密度大小不足以产生动作电位,但也产生了相应的生物效应.MREIT技术将电阻抗成像与MRI结合,对组织内电流密度成像;tDCS会引起一个电流密度分布,进而产生磁通密度分布,该激发磁场的分量对MRI主磁场产生扰动并影响磁共振回波信号的相位,形成相位积累;获得磁共振相位图像数据后,应用安培定律即可计算组织内电流密度,这就是MREIT的基本工作原理.Kwon等[13]运用磁共振T1加权成像和扩散张量成像构建头部三维模型,再使用MREIT定量测定各组织内电流密度,获得了精确的tDCS颅内电流密度分布的横截面图像.随着tDCS研究的不断深入,fMRI与脑电图(electroencephalogram,EEG)等成像技术在该领域内得到了广泛应用.
tDCS效应有时具有空间上的延展性和时间上的持续性,即tDCS的作用不仅限于目标区域,而且还影响与作用部位相连接的较远端的皮层和皮层下神经网络等结构的功能连接(如置于M1的tDCS可影响皮质-纹状体通路[14]);并且长时间持续tDCS(10~30 min)产生的效应可能维持数小时或更长时间.有研究[12]认为这种持续影响是由于tDCS引起了谷氨酸能神经元兴奋性的改变,进而诱导长时程增强或长时程抑制,但具体机制尚不清楚.
tDCS的另一个作用方式是通过电流影响非神经组织.有研究表明tDCS产生的电场可影响神经胶质细胞跨膜电位,导致神经递质浓度失衡[15],同时也可募集少突胶质细胞前体[16]和诱导小胶质细胞形态发生改变[17].另外,适当强度的电场会诱导阿兹海默病患者脑内β-淀粉样蛋白和其他病理蛋白的构象发生改变[18],使其更容易降解.
tDCS的安全性较高,仅有少数受试者产生轻度头痛和局部瘙痒等轻微不适,目前未发现诸如认知障碍之类的严重不良反应[19].由于具有无创伤调节神经活动的优势,tDCS已经应用于某些神经系统疾病的治疗.临床上应用tDCS时,通常根据10~20国际电极系统[20]确定电极安放位置(图 1),阳极常置于背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC)、M1、枕叶等区域,阴极常置于右侧眶上区、中央区、上肢等部位[21].tDCS的电流强度通常为1~2 mA,刺激时间一般持续5~30 min.随着研究的深入,tDCS的临床应用范围越来越广,目前已涉及抑郁症、疼痛、失语症、脑卒中等多种神经系统疾病,其中对非耐药性重度抑郁症、纤维肌痛症的临床治疗效果较为显著[1].
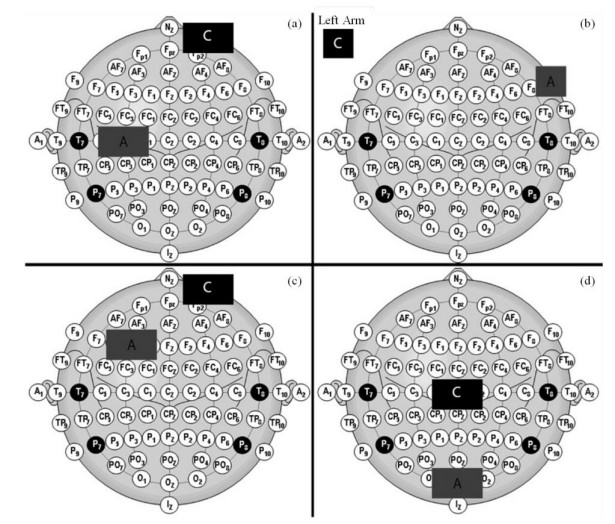
|
图 1 4种tDCS电极位置方案示例.(a)运动皮层刺激方案;(b)右下额皮质(IFC)刺激方案;(c)背外侧前额叶皮层(DLPFC)刺激方案;(d)枕叶皮质刺激方案.A代表阳极;C代表阴极.图与说明出自文献[20] Fig. 1 Four different examples of tDCS electrode placements are shown. (a) Motor cortex stimulation protocol; (b) Right inferior frontal cortex (IFC) stimulation protocol; (c) Dorsolateral prefrontal cortex (DLPFC) stimulation protocol; (d) Occipital cortex stimulation protocol. A = Anode; C = Cathode. The figure and caption were reproduced from Ref. [20] |
fMRI是一种以MRI技术为基础,直观反应大脑功能区域活动变化的成像方法,其最基本成像原理与MRI一致:在磁场中进动的原子核被施加与自身拉莫尔频率相同的交变磁场时,原子核发生共振吸收.射频脉冲取消后,原子核磁矩又将所吸收能量的一部分以电磁波形式发射出来,即共振发射,此共振吸收与共振发射的过程称为核磁共振.采集磁共振产生的电磁波并进行分析,得到被测物体中原子核的位置与种类,便可对被测物体进行成像.MRI原理是利用磁场梯度实现磁共振频率的空间编码.利用某方向(z方向)梯度磁场作为层面选择梯度,确定扫描层面.在y方向上用梯度磁场使氢核形成有规律的相位差,该过程称相位编码(phase encoding);在x方向上用梯度磁场致使不同位置磁矩的进动频率不同,该过程为频率编码(frequency encoding).通过相位编码与频率编码,可确定层面内的坐标位置.之后将采集到的信号填入k空间中,利用傅里叶变换得到图像数据.因为人或动物约70%是由水组成,所以活体MRI技术主要依赖于氢核成像.
随着MRI技术的快速发展,为了探究活体大脑功能活动的变化,fMRI应运而生.fMRI目前主要指血氧水平依赖磁共振成像(blood oxygenation level dependent fMRI,BOLD-fMRI),其成像机制基于对脑内氧合血红蛋白/脱氧血红蛋白比例变化的检测:由于血流供应和神经代谢之间存在紧密耦合关系,神经活动增加导致大脑局部血供增多,但输送到活跃神经结构的血氧只有小部分被利用,故该区域血氧水平相较于未活化区域有大幅提升[22].以上变化导致过多的氧合血红蛋白富集于较活跃的神经结构附近,因而局部脑结构的活动变化伴随着该部位血流变化和氧合血红蛋白/脱氧血红蛋白比例的变化[23].氧合血红蛋白是抗磁性的,脱氧血红蛋白是顺磁性的.顺磁性的脱氧血红蛋白可产生横向磁化弛豫缩短效应(preferential T2 proton relaxation effect,PT2PRE),使T2加权像信号减弱.所以当神经元活动增强时,脱氧血红蛋白的比例降低,引起T2加权像信号增强[24].因此,在T2加权成像中,神经元活动水平强的区域信号较强,而神经元活动水平弱的区域信号较弱,信号对比即产生BOLD-fMRI图像.
通过实验采集到的功能磁共振图像数据需要进行一系列处理分析才能获得大脑各功能区域的动态过程.fMRI的数据处理处理步骤主要分为:数据预处理、数据后处理以及功能连接分析.数据预处理是为了减小一些生理体征对采集信号的影响,包括时间校正、头动校正、空间平滑和滤波等.在预处理的数据基础上进行包括低频振幅(amplitude of low frequency fluctuation,ALFF)、比率低频振幅(fractional amplitude of low frequency fluctuation,fALFF)及局部一致性(regional homogeneity,ReHo)等后处理计算.常见的功能统计分析方法包括独立成分分析(independent component analysis,ICA)、感兴趣区域(region of interest,ROI)分析、主成分分析(principal component analysis,PCA)和分级群聚(hierarchical clustering,HC)分析等.
在实际操作中,由于实验需求的不同,可对实验对象进行外部刺激,捕捉大脑应对刺激时的活动情况;也可不做任何刺激,采集静息状态下的脑活动情况.因此fMRI方法分为任务态fMRI(task based fMRI,task-fMRI)和静息态fMRI(resting-state fMRI,rs-fMRI).task-fMRI要求受试者执行学习、情绪处理、记忆、语言等方面的认知任务,并在受试者执行任务时进行fMRI序列扫描,得到反映脑活动的信号图像.rs-fMRI则用于描绘大脑在静息状态下各区域的相互作用和功能连接(functional connectivity,FC).FC是指在静息状态下或处理外部刺激时,不同脑区神经元参数在时间上的相关性[25].rs-fMRI已被广泛用于默认模式网络、凸显网络、基底神经节网络、视觉网络等大脑功能网络的研究[26].
3 fMRI在tDCS研究中的应用fMRI的主要优点在于其无创性和相对较高的时空分辨率,即以非侵入手段动态反应大脑活动变化.正因如此,fMRI自诞生后便迅速而广泛地应用于神经科学等领域.2001年,Baudewig等[5]首次使用BOLD-MRI观察tDCS对人体感觉和运动的调节.他们让大脑左半球运动皮质接受过tDCS刺激的受试者进行对指实验,并在实验过程中进行fMRI扫描,结果发现阴极tDCS引起了全脑兴奋性降低.该研究证实了阴极tDCS减弱神经元兴奋性的作用,并且可抑制皮质间的相互连接,开创了fMRI应用于tDCS研究的先河.
尽管tDCS可以改变受试者在各种任务中的行为表现,改善某些临床症状,但人们对它的有效性仍持怀疑态度.一些针对tDCS的生理学研究为tDCS的临床疗效提供了预测和参考,但它们缺乏直接证据表明tDCS的神经调节作用与受试者产生的行为学改变具有功能上的相关性.反之,纯粹的行为学研究可以验证tDCS对受试者临床表现的影响,却无法解释tDCS在生理水平产生效应的原因.所以,fMRI技术的应用有助于深入了解tDCS的神经调节作用和相关行为学影响.迄今为止,已有多种fMRI与tDCS相结合的研究范式,如使用rs-fMRI观测tDCS引起的神经活动改变;或将task-fMRI与行为学实验相结合,观察受试者tDCS干预前后行为学变化和相关脑区BOLD信号变化,在神经生理和行为学层面上评估tDCS的作用效果[27].本文结合了实验动物模型研究, 综合分析了近十年临床上使用fMRI探索tDCS作用机制的相关文献(表 1),较完整地总结了其应用成果.
| 表 1 使用fMRI技术探索tDCS在神经系统疾病中的作用机制 Table 1 Mechanisms of tDCS for neurological diseases explored by fMRI technology |
无创性经颅电刺激已经越来越多地应用于临床和研究工作中,其目标包括以下3个方面:明确认知和运动过程涉及的大脑区域;探讨神经可塑性及生物学机制;改善患有神经精神疾病患者的行为和认知功能[68, 69].目前,研究者主要通过对简单模型系统的推断以及神经活动的间接测量了解tDCS对人类的影响,tDCS是否以及如何影响人类大脑神经元活动的基本问题仍未解决.在此科研背景下,为了深入了解tDCS的功能机制,动物模型实验是不可或缺的.灵长类动物大脑是所有动物模型中最接近人类的大脑模型,但由于其资源稀缺、成本高以及易受实验动物伦理的制约等因素,进展缓慢,目前罕见tDCS的灵长类动物实验报道.Krause等[70]证明了tACS能诱导单个神经元的尖峰活动,该作用受刺激频率的影响,并且作用范围局限.但实验数据仅来自2只成年雄性恒河猴(猕猴),可见灵长类动物模型的珍贵.另一方面表明在非人灵长类动物研究中将MRI技术与tDCS相结合将是一个非常有潜力的研究方向.
MRI应用于tDCS大鼠研究已有相关报道.Edemann-Callesen等[71]利用大鼠脑高分辨率磁共振图像定位,研究了tDCS对大鼠感觉运动皮层-纹状体回路的影响.Kim等[72]研究了tDCS对重复性轻度创伤性脑损伤大鼠模型的影响,其间使用T2加权MRI观察是否出现结构性脑损伤.成像结果表明tDCS组和对照组的大鼠均未产生明显的脑部器质性病变.Takano等[73]使用fMRI评估大电极tDCS对大鼠脑活动的影响,实验中对两组大鼠的额叶皮层分别进行400 μA或40 μA的阳极tDCS刺激,并在刺激前后10 min对大鼠进行fMRI扫描,结合扫描获得的脑图谱和已有动物解剖图像,确定各脑区大小和边界,测量分析各脑区的信号强度,选取额叶皮层(即前额)、左半球皮层、右半球皮层、眶额皮层(眼眶区域)、伏隔核、纹状体、丘脑、下丘脑作为ROI(图 2).计算每个ROI在tDCS刺激前后的fMRI平均信号强度,并以tDCS作用后平均信号强度与tDCS作用前平均信号强度的比值代表信号强度的变化率,对比tDCS前后的信号强度变化以及400 μA组与40 μA组之间的信号强度变化的差异,实验结果显示,与40 μA tDCS相比,400 μA阳极tDCS显著增加了额叶皮层和伏隔核的信号强度(图 3),说明tDCS可以诱导目标区域额叶的神经元活性发生改变,且通过投射影响了伏隔核的兴奋性,该结论与tDCS对人类大脑的影响一致[74].
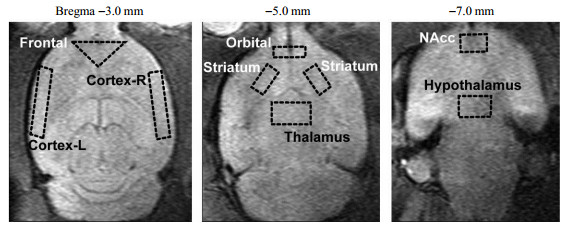
|
图 2 文献[73]中使用fMRI评估大电极tDCS对大鼠脑活动影响的研究中的感兴趣区域(ROIs).黑色虚线为脑区边界.Bregma:前囟;Frontal:前额;Cortex-R:右半球皮层;Cortex-L:左半球皮层;Orbital:眼眶;Striatum:纹状体;Thalamus:丘脑;NAcc:伏隔核;Hypothalamus:下丘脑.图与说明出自文献[73] Fig. 2 ROIs in the study of Ref [73]. Black lines are regional borderlines with the brain-region name. The figure and caption were reproduced from Ref. [73] |
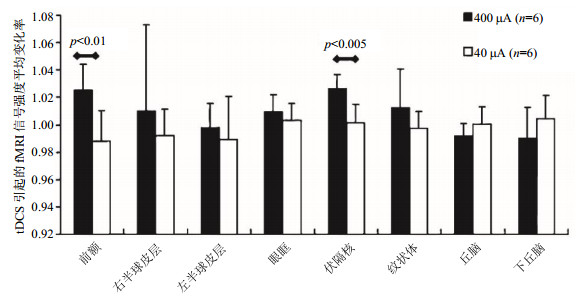
|
图 3 大鼠头部阳极tDCS引起fMRI信号强度的改变.误差条表示标准差.400 μA组与40 μA组相比,前额皮层和伏隔核信号强度有显著差异.图与说明出自文献[73] Fig. 3 Activations of signal intensities of fMRI by anodal tDCS to the top of rat head. The error bars show standard deviations. Compared between 400 and 40 μA, the differences in signal intensities in the frontal cortex and nucleus accumbens were significant. The figure and caption were reproduced from Ref. [73] |
通过调研发现,目前fMRI在tDCS动物研究中的应用十分缺乏,其产生的原因可能有以下几点:首先,大多数实验动物的脑体积较小,要达到足够的分辨率,就需要更精密的成像设备和更高的磁场强度.人体fMRI使用的磁场强度多在3.0 T以内[75],而应用于大鼠fMRI的磁场强度已可达到9.4 T甚至更高[76],相比之下动物fMRI对成像平台的要求较高.其次,实验动物的脑结构与人脑有一定差异,比如灵长类与人类的额叶皮层区域在神经连接和投射方式上存在区别[77],而人体的某些神经疾病(如失语症)的发生机制是人体特有脑功能区域(语言中枢)的损伤,这种疾病无法建立动物模型[78];最后,由于fMRI和tDCS分别为非侵入性检测手段与干预手段,对人体损伤小,可以直接用于临床实验.
但临床前动物研究依然是必要的,因为动物模型实验在安全性、研究时间和研究成本上都较临床实验有巨大优势[79].首先,在样本方面,人类受试者样本量通常受到地域、时间、疾病发病率的限制,如帕金森病的发病率仅0.12%[80],而模型动物如小鼠、大鼠等可以通过多次建模达到足够多的样本数目.同时,人类受试者由于受样本量和伦理学等原因限制,难以对样本充分筛选,模型动物则可以通过行为学实验和按月龄筛选的方法保证样本均一性.此外,人类一些脑结构如大脑皮层远比模型动物复杂,其中的神经纤维广泛投射至许多脑区,这增加了对纤维束追踪的难度和复杂性,而实验动物的脑结构可以看作是人脑的简化模型[81],对研究tDCS的神经结构基础有所帮助.最后,由于tDCS的作用部位缺乏特异性,所以在动物试验中,可以通过重新设计电极的大小、形状以缩小刺激范围,并适当增加刺激电流,达到对目标区域精确作用的目的.
3.2 fMRI在tDCS临床研究中的应用虽然在本世纪初,tDCS已经应用于部分神经系统疾病的治疗,但研究成果质量参差不齐,且tDCS对一些疾病的疗效缺乏证据支持.因此,研究tDCS对神经系统疾病的作用机制为阐明tDCS的疗效具有重要意义.目前临床主要通过观察tDCS对大脑皮层的作用及皮层下连接的影响,研究tDCS对抑郁症、偏头痛、纤维肌痛症、精神分裂症、脑卒中、帕金森病、阿兹海默病的作用效果及相关机制.
3.2.1 tDCS对大脑皮层的影响tDCS可通过刺激大脑皮层,影响其活动而达到治疗神经疾病的目的.tDCS的主要作用靶点有前额叶皮层(prefrontal cortex,PFC)、M1、枕叶、额下回(inferior frontal gyrus,IFG)等,其中PFC和M1是临床上最常用的刺激部位.
PFC与个体的生存意愿、认知行为、性格表达、决策、社会行为以及语言等方面有关[64],是tDCS的主要刺激区域之一,目前已被应用于阿兹海默病[62-64]、抑郁症[28-33]、精神分裂症[43-46]等精神疾病的临床研究中.Meinzer等[63]研究了tDCS刺激PFC对阿兹海默病导致的轻度认知障碍(mild cognitive impairment,MCI)的影响.将健康受试者与MCI患者分别列为对照组和患者组,患者组又分为假刺激组和tDCS组;然后分别对假刺激组和对照组受试者的PFC进行假刺激,对tDCS组进行阳极tDCS刺激;在tDCS过程中同时做task-fMRI扫描和语义词检索测试,结果表明患者组的正确语义词检索结果明显低于健康受试者,而阳极tDCS明显提高了MCI患者的语义词检索正确率.之后在双侧PFC中选取4个ROI:左腹侧额下回(ventral inferior frontal gyrus,VIFG)、右VIFG、右额中回(middle frontal gyrus,MFG)和左背侧额下回(dorsal inferior frontal gyrus,DIFG)进行ANOVA分析,发现与健康受试者相比,假刺激组MCI患者的4个ROI在执行认知测试时均有活动增强的表现;tDCS组4个ROI的活动水平显著低于假刺激组,与对照组ROI活动水平相当(图 4).该研究证明PFC的阳极tDCS刺激能抑制PFC过度活跃,改善MCI患者的认知功能.

|
图 4 与健康的老年人相比,接受假刺激的MCI患者的4个ROI的fMRI信号均表现出活动增强.接受阳极tDCS的MCI患者4个ROI的活动水平均显著降低至健康对照组水平.数据以平均数±标准差表示,*p < 0.05. VIFG:腹侧额下回;MFG:额中回;DIFG:背侧额下回.图与说明出自文献[63] Fig. 4 Results of the priori region of interest (ROI) analysis: compared with healthy older adults, mild cognitive impairment (MCI) patients showed enhanced activity in all four ROIs during sham-tDCS. Significantly reduced activity in all four ROIs during anodal-tDCS in the MCI group resulted in comparable activity between patients and healthy controls. Data show mean ± standard error of the mean, *p < 0.05. VIFG (ventral inferior frontal gyrus), MFG (middle frontal gyrus), DIFG (dorsal inferior frontal gyrus). The figure and caption were reproduced from Ref. [63] |
tDCS刺激DLPFC可用于治疗抑郁症,其主要神经结构基础是与突显网络相关的一系列神经结构.fMRI研究表明,tDCS可增强皮质-纹状体-丘脑通路的活动[33, 82],纠正大脑左右半球前额叶皮层间的神经活动失衡[28].然而,tDCS对PFC的调节作用似乎缺乏稳定性与一致性.一项对PFC-tDCS受试者的rs-fcMRI研究结果显示,阳极tDCS刺激DLPFC的重测信度较低[83].其原因可能是因为PFC具有多种功能,执行不同的认知功能时,其活动状态也会有所不同,而tDCS的影响很大程度上取决于PFC自身的状态;另外,受试者本身的生理差异也是一个重要原因[84].
M1是中枢运动系统的主要区域.在tDCS研究中,M1是治疗疼痛和运动障碍的常用刺激部位,通常对疼痛产生的对侧半球或在弥漫性疼痛中对右侧半球的M1施加阳极刺激可获得明显效果.对M1进行tDCS刺激(M1-tDCS)可以通过兴奋或抑制中央前回中各种连接涉及疼痛处理的感觉神经中枢(如丘脑或DLPFC)的神经回路来减轻疼痛.Naegel等[35]对健康受试者施加M1-tDCS之后使用fMRI观测受试者对三叉神经痛感刺激的神经反应,结果表明疼痛刺激明显特异性激活了疼痛处理相关的脑区,包括丘脑、基底神经节、杏仁核、扣带皮层、前额叶皮层等.阳极tDCS提高了上述区域的兴奋性,而阴极tDCS使这些区域的兴奋性降低.另外,一项针对纤维肌痛症患者的rs-fMRI研究[42]也发现阳极M1-tDCS可降低腹外侧丘脑、内侧前额叶和辅助运动皮层之间的功能连接,而这些结构间功能连接的减少与受试者疼痛减轻相关.tDCS治疗脑卒中的可能机制是增强病灶周围和对侧半球同一区域的神经的代偿功能及可塑性,且两侧M1的活动性及彼此之间的相互作用对于运动学习和运动功能重建至关重要[48],这种相互作用与局部γ-氨基丁酸(GABA)能神经元的兴奋性有关[49].有研究在阴极M1-tDCS刺激后对双侧M1进行弥散张量成像(diffusion tensor imaging,DTI),结果显示阴极M1-tDCS可削弱对侧M1对受刺激侧M1的抑制作用,这种抑制作用与两侧M1间胼胝体的神经纤维连接强度呈正相关[50].
除M1和PFC之外,也有学者报道了其它皮层的相关研究.Ficek等[65]研究了IFG的重复tDCS刺激对原发性进行性失语(primary progressive aphasia,PPA)的疗效,及该刺激对语言网络功能连接的改变.PPA患者在语言测试(包括书面命名及拼写)前后进行了rs-fMRI序列扫描,然后进行为期三周的tDCS或假刺激,期间结合常规治疗.疗程结束后对患者进行第二次语言测试和rs-fMRI扫描,比较前后差异.该研究显示大脑功能连接与tDCS治疗效果呈负相关,而阳极tDCS刺激IFG可显著降低语言网络和默认模式网络(default mode network,DMN)的功能连接.Fiori等[66]报道了IFG-tDCS对动词学习的影响以及相关的神经机制.将健康受试者分组后执行动词学习任务和task-fMRI扫描,期间分别对两组进行左侧IFG阳极tDCS和假刺激.结果发现,相对于假刺激,阳极tDCS显著降低了左侧IFG与学习任务相关的活动,表明阳极tDCS可显著降低左侧IFG和右侧岛叶之间与任务相关的功能连接,而该区域功能连接的减弱与被试者学习任务完成度的提高显著相关.该研究结果同样证明了IFG-tDCS引起的行为学改变与IFG活动状态和语言网络内的有效连接有关.此外,Alekseichuk等[67]设计了一项交叉双盲实验,观察枕叶经颅电刺激的在线效应和后效应引起的视皮层BOLD信号变化.在健康成年人的枕叶皮质上施加阳极tDCS和10 Hz经颅交流电刺激(transcranial alternating current stimulation,tACS)10 min,并设立假刺激对照组,然后进行fMRI扫描.研究发现视皮层阳极tDCS刺激可产生在线效应,该效应可引起BOLD信号强度逐渐增大,但从fMRI图像中未观测到tDCS的后效应.相对而言,tACS(10 Hz)无在线效应,但具有后效应,在成像中反映出枕叶、颞叶和额叶区域广泛的BOLD信号减弱.随着更多针对大脑皮层fMRI与tDCS联合研究的开展,研究者将对tDCS对大脑皮层的调控有更深入的认识.
3.2.2 tDCS对皮质下连接的影响尽管对独立的皮层和功能核团的tDCS研究成果颇丰,但近年来越来越多的实验证据表明大多数的认知功能是由广泛分布的多个脑区共同协调的,这些结构各自独立分布但彼此存在功能上的联系[85].tDCS不仅可以影响局部目标区域,也可调节远端或者深层的神经结构的活动,其机制可能是tDCS对皮层和包括基底神经节、小脑在内的核团之间的结构连接及功能连接具有调控作用.
基底神经节包含纹状体、丘脑下核及黑质,上行投射到运动皮层,参与随意运动的调节.M1-tDCS对帕金森病和疼痛的治疗作用,可能是通过诱导基底神经节功能活性改变所产生的[55];因此有研究者提出,tDCS可通过刺激M1进而调节基底神经节及其相关连接[40].Polanıa等[14]对接受M1-tDCS的健康受试者进行rs-fMRI扫描,阳极刺激后左侧丘脑和同侧M1之间的功能连接显著增加,并且左侧尾状核与顶叶联合皮质之间的功能连接也有相同的表现.相反,阴极tDCS降低了左侧M1与对侧壳核之间的功能连接.该研究首次表明tDCS可通过刺激M1进而对基底神经节所参与的皮质-纹状体-丘脑-皮质回路起到调节作用.Sandrini等[86]使用task-fMRI与rs-fMRI观测tDCS对PFC的调控作用,该研究对tDCS受试者在tDCS刺激前后进行rs-fMRI扫描,并在tDCS刺激后对受试者进行“停止-信号”(stop-signal task)行为学实验,在实验过程中使用fMRI扫描受试者脑部.task-fMRI结果显示tDCS增强了受试者对“停止”信号产生反应时大脑前辅助运动区和丘脑底核的功能连接;rs-fMRI结果则反映了tDCS刺激后下额叶皮质、尾状核、前辅助运动区、背外侧前额叶皮质之间的内在连接发生了改变.以上结果均说明阳极tDCS可调节基底神经节的神经元活动以及功能连接.
小脑参与运动的产生和调节、语义处理和预测,以及功能上与大脑运动皮层和语言中枢相连.tDCS对小脑的刺激可改变小脑与其它结构的功能连接[56].D'Mello等[57]探究了小脑tDCS对语句处理过程中神经激活模式和网络功能连接的影响.将健康受试者分为tDCS组和假刺激组,分别进行20 min的小脑阳极tDCS刺激和假刺激;刺激前后对受试者分别进行rs-fMRI扫描和语句预测实验,该实验检测语义推断能力,要求受试者对预测性语句和非预测性语句均做出反应.语言预测实验期间进行task-fMRI扫描.扫描结束后,在task-fMRI图像数据中选取最具统计意义的体素创建ROI,包括小脑右Crus I小叶,左IFG,左缘上回(supramarginal gyrus,SMG),左额上回(superior frontal gyrus,SFG)和左唇在M1的投射区域,再以ROI作为种子,对种子内的体素进行静息态功能连接(resting-state functional connectivity,rsFC)分析.task-fMRI结果显示tDCS组在语句预测期间小脑右侧VI / Crus I小叶的激活程度比假刺激组更高(图 5).rs-fMRI结果表明与假刺激组相比,阳极tDCS加强了小脑右Crus I小叶与楔叶、IFG与左SMG、SMG与右IFG、SMG与左侧顶上小叶/楔前叶之间的功能连接(图 6).行为学实验结果表明受试者接受tDCS刺激后,对非预测性语句的反应速度明显变快(t=10.08,p < 0.001).该研究表明小脑tDCS可以影响语义预测时小脑的活动,调控语言网络相关节点间的功能连接,进而调节小脑语言处理功能.

|
图 5 阳极tDCS促进了小脑右侧Crus I/II的活动.与刺激前语义预测区域重叠的簇中,阳极tDCS组小脑右侧VI/Crus I小叶(青色)在tDCS刺激后对预测性语句做出反应时活动增强.图与说明出自文献[57] Fig. 5 Anodal tDCS increased activation in right Crus I/II of the cerebellum during predictive processing. Post-tDCS, during predictive sentences, the anodal group had increased activation in right VI/Crus I (cyan) in a cluster that overlapped with pre-tDCS predictive processing regions in the cerebellum. The figure and caption were reproduced from Ref. [57] |

|
图 6 小脑tDCS可调节静息态网络.上排图像:彩色区域代表从tDCS前fMRI处理结果中选取的种子区域.下排图像:与假刺激相比,阳极tDCS增加了语义预测和语言网络相关主要节点间的rsFC,SFG和M1唇部投射区种子的rsFC无变化.Cuneus:楔叶;M1:初级运动皮层;mSFG:内侧额上回;pOrb:眶部;PC:楔前叶;SMG:缘上回;SPL:顶上小叶.图与说明出自文献[57] Fig. 6 Cerebellar tDCS modulates resting-state networks. Top, Seeds from predictive language nodes, identified in the pre-tDCS data. Bottom, Anodal (post > pre) > Sham (post > pre) rsFC. No changes in rsFC were noted for the SFG or the primary motor cortex lip representation seeds. M1, primary motor cortex; mSFG, medial superior frontal gyrus; pOrb, pars orbitalis; PC, precuneus; SMG, supramarginal gyrus; SPL, superior parietal lobule. The figure and caption were reproduced from Ref. [57] |
在神经系统疾病的研究中,应用fMRI分析tDCS对大脑皮层的调节和tDCS对皮质下连接的影响,有助于探究tDCS的作用机制,以及观测tDCS的行为学效应与相关神经活动之间的相关性.因为具有高度的时间特异性和空间特异性,以及无创、伤害小等优点,fMRI目前已应用于超过80%针对人类的tDCS研究[87]中.基于行为学实验的task-fMRI应用最为广泛,rs-fMRI也越来越多地用于探究tDCS对神经网络的影响.然而在tDCS的动物研究中,fMRI依然鲜见报道,因此这是一个具有广阔前景的研究方向.
fMRI的应用极大推动了tDCS的研究进程,加快了tDCS这一新兴神经疾病治疗方法研究的步伐.随着科研工作者不断的突破创新,有望在神经系统疾病的治疗上取得更大成绩.
| [1] | LEFAUCHEUR J P, ANTAL A, AYACHE S, et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS)[J]. Clin Neurophysiol, 2017, 128(1): 56-92. DOI: 10.1016/j.clinph.2016.10.087. |
| [2] | LOLAS F. Brain polarization-behavioral and therapeutic effects[J]. Biol Psychiatry, 1977, 12(1): 37-47. |
| [3] | DYMOND A M, COGER R W, SERAFETINIDES E A. Intracerebral current levels in man during electrosleep therapy[J]. Biol Psychiatry, 1975, 10(1): 101-104. |
| [4] | OGAWA S, LEE T M, NAYAK A S, et al. Oxygenation-sensitive contrast in magnetic resonance image of rodent brain at high magnetic fields[J]. Magn Reson Med, 1990, 14(1): 68-78. DOI: 10.1002/mrm.1910140108. |
| [5] | BAUDEWIG J, NITSCHE M A, PAULUS W, et al. Regional modulation of BOLD MRI responses to human sensorimotor activation by transcranial direct current stimulation[J]. Magn Reson Med, 2001, 45(2): 196-201. DOI: 10.1002/1522-2594(200102)45:2<196::AID-MRM1026>3.0.CO;2-1. |
| [6] | CAVALIERE C, AIELLO M, DI PERRI C, et al. Functional connectivity substrates for tdcs response in minimally conscious state patients[J]. Front Cell Neurosci, 2016, 10: 257. |
| [7] | BINDMAN L J, LIPPOLD O C, REDFEARN J W. The action of brief polarizing currents on the cerebral cortex of the rat (1) during current flow and (2) in the production of long-lasting after-effects[J]. J Physiol, 1964, 172(3): 369-382. DOI: 10.1113/jphysiol.1964.sp007425. |
| [8] | NITSCHE M A, PAULUS W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation[J]. J Physiol, 2000, 527(Pt 3): 633-639. |
| [9] | KASAHARA K, TANAKA S, HANAKAWA T, et al. Lateralization of activity in the parietal cortex predicts the effectiveness of bilateral transcranial direct current stimulation on performance of a mental calculation task[J]. Neurosci Lett, 2013, 545: 86-90. DOI: 10.1016/j.neulet.2013.04.022. |
| [10] | KABAKOV A Y, MULLER P A, PASCUAL-LEONE A, et al. Contribution of axonal orientation to pathway-dependent modulation of excitatory transmission by direct current stimulation in isolated rat hippocampus[J]. J Neurophysiol, 2012, 107(7): 1881-1889. DOI: 10.1152/jn.00715.2011. |
| [11] | BATSIKADZE G, MOLIADZE V, PAULUS W, et al. Partially non-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans[J]. J Physiol, 2013, 591(7): 1987-2000. DOI: 10.1113/jphysiol.2012.249730. |
| [12] | WAGNER T, FREGNI F, FECTEAU S, et al. Transcranial direct current stimulation:a computer-based human model study[J]. Neuroimage, 2007, 35(3): 1113-1124. DOI: 10.1016/j.neuroimage.2007.01.027. |
| [13] | KWON O I, SAJIB S Z K, SERSA I, OH T I, et al. Current density imaging during transcranial direct current stimulation using DT-MRI and MREIT:Algorithm development and numerical simulations[J]. IEEE Trans Biomed Eng, 2016, 63(1): 168-175. |
| [14] | POLANIA R, PAULUS W, NITSCHE M A. Modulating cortico-striatal and thalamo-cortical functional connectivity with transcranial direct current stimulation[J]. Hum Brain Mapp, 2012, 33(10): 2499-2508. DOI: 10.1002/hbm.21380. |
| [15] | DYMOND A M, COGER R W, SERAFETINIDES E A. Intracerebral current levels in man during electrosleep therapy[J]. Biol Psychiatry, 1975, 10(1): 101-104. |
| [16] | RUOHONEN J, KARHU J. tDCS possibly stimulates glial cells[J]. Clin Neurophysiol, 2012, 123(10): 2006-2009. DOI: 10.1016/j.clinph.2012.02.082. |
| [17] | BRAUN R, KLEIN R, WALTER H L, et al. Transcranial direct current stimulation accelerates recovery of function, induces neurogenesis and recruits oligodendrocyte precursors in a rat model of stroke[J]. Exp Neurol, 2016, 279: 127-136. DOI: 10.1016/j.expneurol.2016.02.018. |
| [18] | PELLETIER S J, LAGACE M, ST-AMOUR I, et al. The morphological and molecular changes of brain cells exposed to direct current electric field stimulation[J]. Int J Neuropsychopharmacol, 2015, 18(5): pyu090. DOI: 10.1093/ijnp/pyu090. |
| [19] | TOSCHI F, LUGLI F, BISCARINI F, et al. Effects of electric field stress on a beta-amyloid peptide[J]. J Phys Chem B, 2009, 113(1): 369-376. |
| [20] | COFFMAN B A, CLARK V P, PARASURAMAN R. Battery powered thought:enhancement of attention, learning, and memory in healthy adults using transcranial direct current stimulation[J]. Neuroimage, 2014, 85(3): 895-908. |
| [21] |
ZHOU P, WEI J W, SUN C, et al. Research advancements in the regulation of transcranial direct current stimulation (tDCS) for cerebral cognitive function[J].
Chinese J Biomedical Engineering, 2018, 37(2): 208-214.
周鹏, 魏晋文, 孙畅, 等. 经颅直流电刺激调控大脑认知功能的研究进展[J]. 中国生物医学工程学报, 2018, 37(2): 208-214. |
| [22] | FILIPPI M, AGOSTA F. Diffusion tensor imaging and functional MRI[M]//Neuroimaging Part II. Handb Clin Neurol, 2016, 136: 1065-1087. |
| [23] | CORDES D, TURSKI P A, SORENSON J A. Compensation of susceptibility-induced signal loss in echo-planar imaging for functional applications[J]. Magn Reson Imaging, 2000, 18(9): 1055-1068. DOI: 10.1016/S0730-725X(00)00199-5. |
| [24] |
NIU M, LIU J L, ZHANG L. Modern Medicine & Health, 2008, 24(18): 2754-2756.
牛猛, 刘嘉利, 张磊. FMRI脑功能磁共振成像的原理及应用进展[J].现代医药卫生, 2008, 24(18): 2754-2756. |
| [25] | FRISTON K. Causal modelling and brain connectivity in functional magnetic resonance imaging[J]. PLoS Biol, 2009, 7(2): e33. |
| [26] | SMITHA K A, AKHIL RAJA K, ARUN K M, et al. Resting state fMRI:A review on methods in resting state connectivity analysis and resting state networks[J]. Neuroradiol J, 2017, 30(4): 305-317. DOI: 10.1177/1971400917697342. |
| [27] | WOODS A J, HAMILTON R H, KRANJEC A, et al. Space, time, and causality in the human brain[J]. Neuroimage, 2014, 92: 285-297. DOI: 10.1016/j.neuroimage.2014.02.015. |
| [28] | DEBENER S, BEAUDUCEL A, NESSLER D, et al. Is resting anterior EEG alpha asymmetry a trait marker for depression? Findings for healthy adults and clinically depressed patients[J]. Neuropsychobiology, 2000, 41(1): 31-37. DOI: 10.1159/000026630. |
| [29] | BULUBAS L, PADBERG F, BUENO P V, et al. Antidepressant effects of tDCS are associated with prefrontal gray matter volumes at baseline:Evidence from the ELECT-TDCS trial[J]. Brain Stimul, 2019, 12(5): 1197-1204. DOI: 10.1016/j.brs.2019.05.006. |
| [30] | PADBERG F, KUMPF U, MANSMANN U, et al. Prefrontal transcranial direct current stimulation (tDCS) as treatment for major depression:study design and methodology of a multicenter triple blind randomized placebo controlled trial (DepressionDC)[J]. Eur Arch Psychiatry Clin Neurosci, 2017, 267(8): 751-766. DOI: 10.1007/s00406-017-0769-y. |
| [31] | CSIFCSAK G, BOAYUE N M, PUONTI O, et al. Effects of transcranial direct current stimulation for treating depression:A modeling study[J]. J Affect Disorders, 2018, 234: 164-173. DOI: 10.1016/j.jad.2018.02.077. |
| [32] | PALM U, HASAN A, STRUBE W, et al. tDCS for the treatment of depression:a comprehensive review[J]. Eur Arch Psychiatry Clin Neurosci, 2016, 266(8): 681-694. DOI: 10.1007/s00406-016-0674-9. |
| [33] | KOENIGS M, GRAFMAN J. The functional neuroanatomy of depression:Distinct roles for ventromedial and dorsolateral prefrontal cortex[J]. Behav Brain Res, 2009, 201(2): 239-243. DOI: 10.1016/j.bbr.2009.03.004. |
| [34] | THIBAUT A, CARVALHO S, MORSE L R, et al. Delayed pain decrease following M1 tDCS in spinal cord injury:A randomized controlled clinical trial[J]. Neurosci Lett, 2017, 658: 19-26. DOI: 10.1016/j.neulet.2017.08.024. |
| [35] | NAEGEL S, BIERMANN J, THEYSOHN N, et al. Polarity-specific modulation of pain processing by transcranial direct current stimulation-a blinded longitudinal fMRI study[J]. J Headache Pain, 2018, 19(1): 99. DOI: 10.1186/s10194-018-0924-5. |
| [36] | NGUYEN J P, NIZARD J, KERAVEL Y, et al. Invasive brain stimulation for the treatment of neuropathic pain[J]. Nat Rev Neurol, 2011, 7(12): 699-709. DOI: 10.1038/nrneurol.2011.138. |
| [37] | NEEB L, BAYER A, BAYER K E, et al. Transcranial direct current stimulation in inflammatory bowel disease patients modifies resting-state functional connectivity:A RCT[J]. Brain Stimul, 2019, 12(4): 978-980. DOI: 10.1016/j.brs.2019.03.001. |
| [38] | LIN R L, DOUAUD G, FILIPPINI N, et al. Tracey I. Structural connectivity variances underlie functional and behavioral changes during pain relief induced by neuromodulation[J]. Sci Rep, 2017, 7: 41603. DOI: 10.1038/srep41603. |
| [39] | ANTAL A, KRIENER N, LANG N, et al. Cathodal transcranial direct current stimulation of the visual cortex in the prophylactic treatment of migraine[J]. Cephalalgia, 2011, 31(7): 820-828. DOI: 10.1177/0333102411399349. |
| [40] | MANOLA L, ROELOFSEN B H, HOLSHEIMER J, et al. Modelling motor cortex stimulation for chronic pain control:electrical potential field, activating functions and responses of simple nerve fibre models[J]. Med Biol Eng Comput, 2005, 43(3): 335-43. DOI: 10.1007/BF02345810. |
| [41] | CASTILLO-SAAVEDRA L, GEBODH N, BIKSON M, et al. Clinically effective treatment of fibromyalgia pain with high-definition transcranial direct current stimulation:phase II open-label dose optimization[J]. J Pain, 2016, 17(1): 14-26. DOI: 10.1016/j.jpain.2015.09.009. |
| [42] | CUMMIFORD C M, NASCIMENTO T D, FOERSTER B R, et al. Changes in resting state functional connectivity after repetitive transcranial direct current stimulation applied to motor cortex in fibromyalgia patients[J]. Arthritis Res Ther, 2016, 18: 40. DOI: 10.1186/s13075-016-0934-0. |
| [43] | KANI A S, SHINN A K, LEWANDOWSKI K E, et al. Converging effects of diverse treatment modalities on frontal cortex in schizophrenia:A review of longitudinal functional magnetic resonance imaging studies[J]. Psychiatr Res, 2017, 84: 256-276. DOI: 10.1016/j.jpsychires.2016.10.012. |
| [44] | MONDINO M, HAESEBAERT F, POULET E, et al. Fronto-temporal transcranial Direct Current Stimulation (tDCS) reduces source-monitoring deficits and auditory hallucinations in patients with schizophrenia[J]. Schizophr Res, 2015, 161(2, 3): 515-516. |
| [45] | MONDINO M, JARDRI R, SUAUD-CHAGNY M F, et al. Effects of Fronto-temporal transcranial direct current stimulation on auditory verbal hallucinations and resting-state functional connectivity of the left temporo-parietal junction in patients with schizophrenia[J]. Schizophr Bull, 2016, 42(2): 318-326. DOI: 10.1093/schbul/sbv114. |
| [46] | PALM U, KEESER D, BLAUTZIK J, et al. Prefrontal transcranial direct current stimulation (tDCS) changes negative symptoms and functional connectivity MRI (fcMRI) in a single case of treatment-resistant schizophrenia[J]. Schizophr Res, 2013, 150(2-3): 583-585. DOI: 10.1016/j.schres.2013.08.043. |
| [47] | LANG N, SIEBNER H R, WARD N S, et al. How does transcranial DC stimulation of the primary motor cortex alter regional neuronal activity in the human brain?[J]. Eur J Neurosci, 2005, 22(2): 495-504. DOI: 10.1111/j.1460-9568.2005.04233.x. |
| [48] | DI PINO G, PELLEGRINO G, ASSENZA G, et al. Modulation of brain plasticity in stroke:a novel model for neurorehabilitation[J]. Nat Rev Neurol, 2014, 10(10): 597-608. DOI: 10.1038/nrneurol.2014.162. |
| [49] | NOWAK M, HINSON E, VAN EDE F, et al. Driving human motor cortical oscillations leads to behaviorally relevant changes in local GABA(A) inhibition:A tACS-TMS study[J]. J Neurosci, 2017, 37(17): 4481-4492. DOI: 10.1523/JNEUROSCI.0098-17.2017. |
| [50] | BACHTIAR V, JOHNSTONE A, BERRINGTON A, et al. Modulating regional motor cortical excitability with noninvasive brain stimulation results in neurochemical changes in bilateral motor cortices[J]. Neurosci, 2018, 38(33): 7327-7336. DOI: 10.1523/JNEUROSCI.2853-17.2018. |
| [51] | FIGLEWSKI K, BLICHER J U, MORTENSEN J, et al. Transcranial direct current stimulation potentiates improvements in functional ability in patients with chronic stroke receiving constraint-induced movement therapy[J]. Stroke, 2017, 48(1): 229-232. |
| [52] | WARD N S. Non-invasive brain stimulation for stroke recovery:ready for the big time?[J]. J Neurol Neurosur Ps, 2016, 87(4): 343-344. DOI: 10.1136/jnnp-2015-311991. |
| [53] | KLOMJAI W, LACKMY-VALLEE A, ROCHE N, et al. Repetitive transcranial magnetic stimulation and transcranial direct current stimulation in motor rehabilitation after stroke:an update[J]. Ann Phys Rehabil Med, 2015, 58(4): 220-224. DOI: 10.1016/j.rehab.2015.05.006. |
| [54] | ALLMAN C, AMADI U, WINKLER A M, et al. Ipsilesional anodal tDCS enhances the functional benefits of rehabilitation in patients after stroke[J]. Sci Transl Med, 2016, 8(330): 330r. |
| [55] | BENNINGER D H, LOMAREV M, LOPEZ G, et al. Transcranial direct current stimulation for the treatment of Parkinson's disease[J]. J Neurol Neurosur Ps, 2010, 81(10): 1105-1111. DOI: 10.1136/jnnp.2009.202556. |
| [56] | GALEA J M, JAYARAM G, AJAGBE L, et al. Modulation of cerebellar excitability by polarity-specific noninvasive direct current stimulation[J]. Neurosci, 2009, 29(28): 9115-9122. DOI: 10.1523/JNEUROSCI.2184-09.2009. |
| [57] | D'MELLO A M, TURKELTAUB P E, STOODLEY C J. Cerebellar tDCS modulates neural circuits during semantic prediction:A combined tDCS-fMRI Study[J]. Neurosci, 2017, 37(6): 1604-1613. DOI: 10.1523/JNEUROSCI.2818-16.2017. |
| [58] | FERRUCCI R, CORTESE F, BIANCHI M, et al. Cerebellar and motor cortical transcranial stimulation decrease levodopa-induced dyskinesias in Parkinson's disease[J]. Cerebellum, 2016, 15(1): 43-47. DOI: 10.1007/s12311-015-0737-x. |
| [59] | FRESNOZA S, PAULUS W, NITSCHE M A, et al. Nonlinear dose-dependent impact of D1 receptor activation on motor cortex plasticity in humans[J]. Neurosci, 2014, 34(7): 2744-2753. |
| [60] | VALENTINO F, COSENTINO G, BRIGHINA F, et al. Transcranial direct current stimulation for treatment of freezing of gait:a cross-over study[J]. Mov Disord, 2014, 29(8): 1064-1069. DOI: 10.1002/mds.25897. |
| [61] | SCHOELLMANN A, SCHOLTEN M, WASSERKA B, et al. Anodal tDCS modulates cortical activity and synchronization in Parkinson's disease depending on motor processing[J]. Neuroimage Clin, 2019, 22: 101689. DOI: 10.1016/j.nicl.2019.101689. |
| [62] | CESPON J, RODELLA C, MINIUSSI C, et al. Behavioural and electrophysiological modulations induced by transcranial direct current stimulation in healthy elderly and Alzheimer's disease patients:A pilot study[J]. Clin Neurophysiol, 2019, 130(11): 2038-2052. DOI: 10.1016/j.clinph.2019.08.016. |
| [63] | MEINZER M, LINDENBERG R, PHAN M T, et al. Transcranial direct current stimulation in mild cognitive impairment:Behavioral effects and neural mechanisms[J]. Alzheimers Dement, 2015, 11(9): 1032-1140. DOI: 10.1016/j.jalz.2014.07.159. |
| [64] | BYSTAD M, GRONLI O, RASMUSSEN I D, et al. Transcranial direct current stimulation as a memory enhancer in patients with Alzheimer's disease:a randomized, placebo-controlled trial[J]. Alzheimers Res Ther, 2016, 8(1): 13. DOI: 10.1186/s13195-016-0180-3. |
| [65] | FICEK B N, WANG Z, ZHAO Y, et al. The effect of tDCS on functional connectivity in primary progressive aphasia[J]. Neuroimage Clin, 2018, 19: 703-715. DOI: 10.1016/j.nicl.2018.05.023. |
| [66] | FIORI V, KUNZ L, KUHNKE P, et al. Transcranial direct current stimulation (tDCS) facilitates verb learning by altering effective connectivity in the healthy brain[J]. Neuroimage, 2018, 181: 550-559. DOI: 10.1016/j.neuroimage.2018.07.040. |
| [67] | ALEKSEICHUK I, DIERS K, PAULUS W, et al. Transcranial electrical stimulation of the occipital cortex during visual perception modifies the magnitude of BOLD activity:A combined tES-fMRI approach[J]. Neuroimage, 2016, 140: 110-117. DOI: 10.1016/j.neuroimage.2015.11.034. |
| [68] | ROSSI S, ROSSINI P M. TMS in cognitive plasticity and the potential for rehabilitation[J]. Trends Cogn Sci, 2004, 8(6): 273-279. DOI: 10.1016/j.tics.2004.04.012. |
| [69] | FLÖEL A. tDCS-enhanced motor and cognitive function in neurological diseases[J]. Neuroimage, 2014, 85: 934-947. DOI: 10.1016/j.neuroimage.2013.05.098. |
| [70] | KRAUSE M R, VIEIRA P G, CSORBA B A, et al. Transcranial alternating current stimulation entrains single-neuron activity in the primate brain[J]. Proc Natl Acad Sci U S A, 2019, 116(12): 5747-5755. DOI: 10.1073/pnas.1815958116. |
| [71] | EDEMANN-CALLESEN H, HABELT B, WIESKE F, et al. Non-invasive modulation reduces repetitive behavior in a rat model through the sensorimotor cortico-striatal circuit[J]. Transl Psychiatry, 2018, 8(1): 11. DOI: 10.1038/s41398-017-0059-5. |
| [72] | KIM H J, HAN S J. Anodal Transcranial direct current stimulation provokes neuroplasticity in repetitive mild traumatic brain injury in rats[J]. Neural Plast, 2017: 1372946. |
| [73] | TAKANO Y, YOKAWA T, MASUDA A, et al. A rat model for measuring the effectiveness of transcranial direct current stimulation using Fmri[J]. Neurosci Lett, 2011, 491(1): 40-43. DOI: 10.1016/j.neulet.2011.01.004. |
| [74] | BEWERNICK B H, HURLEMANN R, MATUSCH A, et al. Nucleus accumbens deep brain stimulation decreases ratings of depression and anxiety in treatment-resistant depression[J]. Biol Psychiatry, 2010, 67(2): 110-116. DOI: 10.1016/j.biopsych.2009.09.013. |
| [75] | ANTONENKO D, THIELSCHER A, SATURNINO G B, et al. Towards precise brain stimulation:Is electric field simulation related to neuromodulation?[J]. Brain Stimul, 2019, 12(5): 1159-1168. DOI: 10.1016/j.brs.2019.03.072. |
| [76] | CIOBANU L, SOLOMON E, PYATIGORSKAYA N, et al. fMRI contrast at high and ultrahigh magnetic fields:insight from complementary methods[J]. Neuroimage, 2015, 113: 37-43. DOI: 10.1016/j.neuroimage.2015.03.018. |
| [77] | SALLET J, MARS R B, NOONAN M P, et al. The organization of dorsal frontal cortex in humans and macaques[J]. J Neurosci, 2013, 33(30): 12255-12274. DOI: 10.1523/JNEUROSCI.5108-12.2013. |
| [78] | MINKINA I, ROSENBERG S, KALINYAK-FLISZAR M, et al. Short-term memory and aphasia:from theory to treatment[J]. Semin Speech Lang, 2017, 38(1): 17-28. |
| [79] | CLARK M, STEGER-HARTMANN T. A big data approach to the concordance of the toxicity of pharmaceuticals in animals and humans[J]. Regul Toxicol Pharmacol, 2018, 96: 94-105. DOI: 10.1016/j.yrtph.2018.04.018. |
| [80] | TYSNES OB, STORSTEIN A. Epidemiology of Parkinson's disease[J]. J Neural Transm-supp, 2017, 124(8): 901-905. DOI: 10.1007/s00702-017-1686-y. |
| [81] | OLSON H, BETTON G, ROBINSON D, et al. Concordance of the toxicity of pharmaceuticals in humans and in animals[J]. Regul Toxicol Pharmacal, 2000, 32(1): 56-67. DOI: 10.1006/rtph.2000.1399. |
| [82] | DUNLOP K, HANLON CA, DOWNAR J. Noninvasive brain stimulation treatments for addiction and major depression[J]. Ann N Y Acad Sci, 2017, 1394(1): 31-54. DOI: 10.1111/nyas.12985. |
| [83] | WORSCHING J, PADBERG F, HELBICH K, et al. Test-retest reliability of prefrontal transcranial direct current stimulation (tDCS) effects on functional MRI connectivity in healthy subjects[J]. Neuroimage, 2017, 155: 187-201. DOI: 10.1016/j.neuroimage.2017.04.052. |
| [84] | TREMBLAY S, LEPAGE J F, LATULIPE-LOISELLE A, et al. The uncertain outcome of prefrontal tDCS[J]. Brain Stimul, 2014, 7(6): 773-783. DOI: 10.1016/j.brs.2014.10.003. |
| [85] | SPORNS O. Contributions and challenges for network models in cognitive neuroscience[J]. Nat Neurosci, 2014, 17(5): 652-660. DOI: 10.1038/nn.3690. |
| [86] | SANDRINI M, XU B, VOLOCHAYEV R, et al. Transcranial direct current stimulation facilitates response inhibition through dynamic modulation of the fronto-basal ganglia network[J]. Brain Stimul, 2020, 13(1): 96-104. DOI: 10.1016/j.brs.2019.08.004. |
| [87] | ESMAEILPOUR Z, SHEREEN A D, GHOBADI-AZBARI P, et al. Methodology for tDCS integration with fMRI[J]. Hum Brain Mapp, 2019, 41(4): 1950-1967. |
 2020, Vol. 37
2020, Vol. 37 
