主-客体分子识别和组装是当今超分子化学的研究热点之一.2008年,Ogoshi[1]以廉价易得的芳香族原料合成了一类结构新颖的芳香族大环化合物,由于其具有刚性的柱状结构,因而得名柱芳烃(pillar arenes).柱芳烃的发现掀起了超分子化学领域的研究热潮,各类柱芳烃衍生物,例如羧基柱芳烃、磷酸化柱芳烃、季铵化柱芳烃等被大量报道.柱芳烃具备易于修饰、具有不同尺寸大小的刚性空腔[1-3]、热稳定性高、配体作用专一、结构刚性强、高度对称等特点,与客体分子表现出独特的主客体络合性能[4, 5].因此,它成为继冠醚[6-9]、环糊精[10-12]、杯芳烃、葫芦脲[13, 14]之后的第5代经典大环宿主分子[15].经过十多年的发展,有关柱芳烃的研究已经从合成方法上的探索转移到了应用研究,如今,柱芳烃已在荧光检测[16]、电化学传感[17]、跨膜通道[18-20]、药物递送[21-25]和吸附材料[26]等领域得到了广泛应用.
基于大环分子与荧光染料的主-客体络合研究已被广泛报道[27],例如葫芦脲与荧光染料的络合行为的光谱学研究[28, 29].Zhou等[30]通过分子荧光光谱(molecular fluorescence spectroscopy,MFS)研究吖啶橙(acridine orange,AO)与葫芦脲[7]在水溶液中的主-客体络合行为,发现葫芦脲[7]与AO具有较强的络合能力.刘青等[31]报道了葫芦脲[8]与AO的相互作用,构建了葫芦脲[8]与AO主-客体络合物,并将其作为荧光探针,用于生物细胞内多菌灵的识别检测.杨红瑞等[32]报道了β-环糊精通过主-客体相互作用与亚甲基蓝形成络合物,该络合物可以作为增敏剂测定左氧氟沙星的含量.林梁斌等[33]报道了共轭芳香基桥联的双杯[4]芳烃与染料维多利亚蓝和橙黄Ⅰ的主-客体络合行为,结果表明杯芳烃与两种染料均可形成主-客体络合物,可用于染料的快速识别.严祯曦等[34]研究了结构与识别性能独特的杯[4]芳烃衍生物与4种有机染料分子(橙黄Ⅰ、茜绿素、维多利亚蓝和亚甲基蓝)的主-客体络合作用,结果表明其对4种有机染料均显示出较强的络合能力.Yang等[35]构建了一种水溶性磷酸盐柱[6]芳烃功能化石墨烯与AO的主-客体络合物,并将该络合物用于农药百草枯的检测.Hua等[36]报道了阴离子水溶性柱[6]芳烃与AO通过主-客体电荷-转移的相互作用形成络合物,并将络合物应用于胆碱类化合物的检测和酶促反应的监测.但是目前,关于阴离子大环水溶性磷酸盐柱[5]芳烃(water-soluble phosphate salt pillar[5]arene,PP5A)与阳离子型染料AO的主-客体络合行为的光谱学研究还未见报道.
特定的荧光染料在水溶液中与大环主体发生主-客体相互作用后,会呈现出明显的荧光变化.但是pH会影响主-客体络合时的荧光光谱变化及络合物的稳定性,为了讨论AO与PP5A形成的络合物的稳定性,本文研究了pH对其络合行为的影响.染料是环境水体中含量较高的有机污染物,表面活性剂的加入可以改变水溶液的微观环境和物理化学性质,它的加入对AO与PP5A络合行为的影响也有待研究,且具有重要意义.
本文通过紫外光谱(ultraviolet spectrum,UV)、红外吸收光谱(infrared absorption spectrum,IR)、MFS、一维和二维核磁共振(nuclear magnetic resonance,NMR)波谱(包括1H NMR和NOESY)技术确定了PP5A与AO在水溶液中络合时的荧光强度变化、络合常数、化学位移变化及化学计量比等,并通过分子对接模拟计算出二者的络合模式和络合能.同时进一步研究了pH以及两种表面活性剂,包括十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)对AO/PP5A络合体系的影响,该研究可为荧光传感器的设计提供理论.
1 实验部分 1.1 仪器与试剂仪器:Bruker Avance 400型NMR谱仪(瑞士Bruker公司),Agilent 8453紫外-可见分光光度计(美国安捷伦公司),Agilent CARY ECLIPS荧光分光光度计(美国安捷伦公司),Nicolet IS10红外光谱仪(美国Thermo科技有限公司).
试剂:氢醌二(2-羟基乙基)醚、四溴化碳(CBr4)、三苯基磷(PPh3)、多聚甲醛、AO、SDS和CTAB、无水硫酸钠、乙腈、甲醇、三氟化硼乙醚络合物(BF3·(OEt)2)、乙醇、1, 2-二氯乙烷、二氯甲烷、亚磷酸三乙酯(P(OEt)3)、三甲基溴硅烷(TMSBr)、丙酮、氨水、溴化钾均为分析纯试剂,购于上海泰坦科技有限公司,实验用水为超纯水.
1.2 PP5A的合成
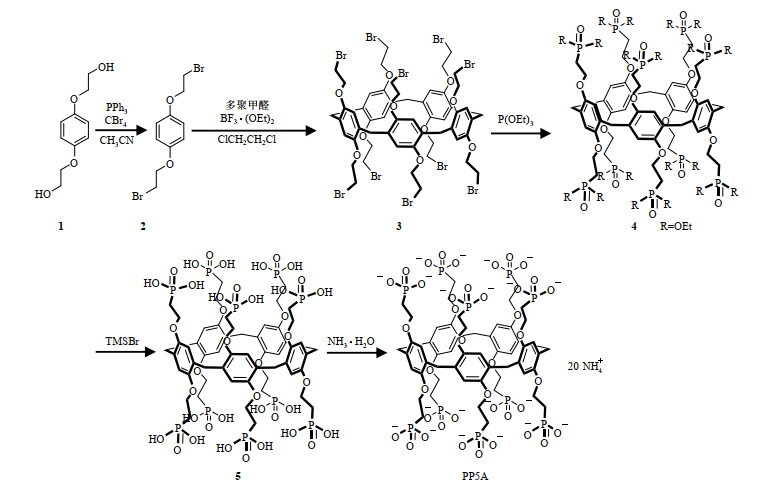
|
图 1 PP5A的合成 Fig. 1 The synthetic route of PP5A |
先后称取氢醌二(2-羟基乙基)醚(化合物1)(5.0 g,25.25 mmol)和PPh3(13.23 g,50.45 mmol)于250 mL双口烧瓶中,加入新蒸乙腈(CH3CN)120 mL.搅拌活化15 min后冰浴静置;再称取CBr4(16.73 g,0.45 mmol)至恒压漏斗中,加入新蒸乙腈30 mL使其完全溶解;N2保护下向上述双口烧瓶中逐滴加入CBr4乙腈溶液后,室温条件下反应约4 h;薄层色谱(thin layer chromatography,TLC)监测至反应完全后,冰浴条件下向上述混合液中加入冰水2 mL,观察有白色沉淀析出,过滤收集沉淀物,并先后用无水乙醇、石油醚充分洗涤沉淀物,真空干燥后得到固体化合物2,产率72%.
称取化合物2(3.24 g,10 mmol)和多聚甲醛(0.90 g,30 mmol)溶于100 mL新蒸的1, 2-二氯乙烷(ClCH2CH2Cl)中,N2保护下搅拌活化15 min;用一次性注射器吸取1.5 mL BF3·(OEt)2(10 mmol),于冰浴条件下缓慢加入至上述溶液后,室温条件下反应3~4 h;TLC监测至反应完全后,加入5 mL水使反应淬灭;将反应液过滤,滤液用饱和食盐水进行萃取,合并有机相,加入无水硫酸钠进行干燥,过滤,减压蒸馏除去溶剂,柱层析纯化(石油醚:二氯甲烷=1:1,v/v)得到白色固体化合物3,产率50%.
称取化合物3(3.0 g,2 mmol)和P(OEt)3(6.8 g,40 mmol),在N2保护下165 ℃搅拌反应72 h,将混合液减压浓缩,柱层析纯化(甲醇:乙酸乙酯=1:2,v/v)得浅黄色油状物4,产率90%.
冰浴和N2保护下,将TMSBr(28.50 g,186.2 mmol)加至化合物4(6.0 g,2.66 mmol)的80 mL二氯甲烷溶液中,室温下搅拌反应72 h;反应结束后减压浓缩除去溶剂,加入60 mL水继续搅拌反应30 min;浓缩干燥后将得到的浅黄色固体用丙酮洗涤,即得白色固体化合物5,产率75%.
称取化合物5(0.2 g,0.118 mmol)和100 mL氨水于250 mL的圆底烧瓶中,室温下搅拌反应12 h;减压浓缩除去溶剂,真空干燥,得到淡黄色透明固体PP5A(0.2 g,0.09 mmol),产率98%.1H NMR(400 MHz,D2O):δH 6.92(s,10H),4.15(m,20H),3.86(s,10H),2.20(m,20H);13C NMR(100 MHz,D2O):δC 150.8,131.7,120.2,70.0,31.2,29.9,29.8;31P NMR(162 MHz,D2O):δP 17.00.
1.3 UV光谱检测 1.3.1 PP5A、AO、AO/PP5A溶液的UV光谱检测纯水配制10 mL 4×10-5 mol/L的AO溶液、PP5A溶液,以及AO/PP5A体系(4×10-5 mol/L AO+4×10-5 mol/L PP5A),摇匀静置后室温25 ℃下测定其吸光度.
1.3.2 UV光谱滴定实验向7支比色管中分别移取400 μL浓度为1×10-3 mol/L的AO溶液,依次加入3、4、5、6、7、8、9 eq.(PP5A与AO的摩尔浓度比)的PP5A溶液,纯水定容至10 mL(AO终浓度为4×10-5 mol/L,PP5A终浓度为1.2×10-4~3.6×10-4 mol/L),摇匀静置后室温25℃下测定其490 nm处的吸光度.
1.4 IR光谱检测IR光谱能鉴别化合物中特征官能团,根据特征波数与吸收强度的变化可以判断络合物是否形成.将0.026 35 g AO与0.213 6 g PP5A(摩尔比为1:1)混合于玛瑙研钵中,滴加1~2滴超纯水,充分研磨后制得AO/PP5A络合物,将AO/PP5A络合物、KBr、AO和PP5A于红外灯下干燥1 h,采用压片法将样品与KBr以1:100的质量比混合后研磨成粉,压成薄片,室温25 ℃下测定IR光谱.
1.5 MFS光谱检测 1.5.1 PP5A溶液和AO溶液的MFS检测纯水配制10 mL 8×10-6 mol/L的PP5A溶液和2×10-6 mol/L的AO溶液,摇匀静置后分别测定其荧光强度.参数设置为:①PP5A:激发波长为290 nm、激发狭缝和发射狭缝分别为5 nm和10 nm;②AO、AO/PP5A:激发波长为452 nm,激发狭缝和发射狭缝均为10 nm.
本文后续实验中PP5A、AO、AO/PP5A的MFS检测均使用以上参数.
1.5.2 MFS滴定实验分别向9支比色管中移取1mL浓度为2×10-5 mol/L的AO溶液,依次加入0、1、2、3、4、5、6、8、10 eq.的PP5A溶液,纯水定容至10 mL(AO终浓度为2×10-6 mol/L,PP5A终浓度为0~2×10-5 mol/L),摇匀静置后测定AO/PP5A体系荧光强度.
1.5.3 动力学实验分别向两支比色管中移取1 mL浓度为2×10-5 mol/L的AO溶液.向其中一支比色管加入200 μL浓度为1×10-3 mol/L的PP5A溶液,自加入PP5A溶液的瞬间开始计时,纯水定容至10 mL,摇匀,1 min时测定AO/PP5A体系的荧光强度,每间隔1 min测定一次,测定30次.另外一支比色管纯水定容至10 mL,摇匀后测定AO的荧光强度,作为对照.
1.5.4 Job曲线测定分别配制50 mL 2×10-6 mol/L的AO溶液与PP5A溶液,分别向11支5 mL比色管中移取5、4.5、4、3.5、3、2.5、2、1.5、1、0.5、0 mL的AO溶液,然后再依次加入0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 mL的PP5A溶液,摇匀后测定AO/PP5A体系的荧光强度.
1.5.5 pH对络合行为的影响采用pH 3~13的水溶液(由0.1 mol/L的HCl和NaOH调节得到)配制2×10-6 mol/L AO、2×10-5 mol/L PP5A和AO/PP5A(2×10-6 mol/L AO+2×10-5 mol/L PP5A,AO与PP5A物质的量比为1:10)的待测溶液后,测定各自的荧光强度.
1.5.6 CTAB、SDS对络合行为的影响向7支比色管中加入40 μL浓度为1×10-3 mol/L的PP5A溶液,分别加入3、4、5、6、7、8、9 eq.的CTAB溶液,纯水定容至10 mL(PP5A的终浓度为4×10-6 mol/L,CTAB的终浓度为1.2×10-5~3.6×10-5 mol/L),摇匀静置后测定其荧光强度.测试条件与PP5A一致.
向另外11支比色管中加入80 μL浓度为1×10-3 mol/L的PP5A溶液,分别加入0、10、20、30、40、50、60、70、80、90、100 eq.的SDS溶液,纯水定容至10 mL(PP5A的终浓度为8×10-6 mol/L,SDS的终浓度为0~8×10-4 mol/L),摇匀静置后测定其荧光强度.测试条件与PP5A一致.
向9支比色管中分别加入1.2 mL AO/PP5A体系(1mL浓度为2×10-5 mol/L的AO溶液+0.2 mL浓度为1×10-3 mol/L的PP5A溶液),再分别加入0、0.5、1、1.5、2、2.5、3、4、5 mL浓度为2×10-5 mol/L的CTAB或SDS溶液,纯水定容至10 mL,摇匀静置后测定其荧光强度,测试条件与AO/PP5A一致.
1.6 AO/PP5A的1H NMR及NOESY谱图测定配制40 μL浓度为20 mmol/L的PP5A(20 μL 40 mmol/L PP5A+20 μL D2O)、AO(20 μL 40 mmol/L AO+20 μL D2O)和AO/PP5A络合物(20 μL 40 mmol/L AO的D2O溶液与20 μL 40 mmol/L PP5A的D2O溶液混合,超声10 min得到AO/PP5A络合物)的D2O溶液,以三甲基硅基丙酸盐(trimethylsilyl propionic acid,TMSP,D2O中含量为0.05%)为内标.1H核共振频率为400.21 MHz,测试温度为25 ℃. 1H NMR谱宽为10 330.58 Hz.2D NOESY谱图采集采用标准脉冲程序,两维谱宽均为2 894.6 Hz,采样数据点阵t2×t1=2 048×256,累加次数为48.
1.7 分子对接模拟采用分子对接计算了PP5A与AO和CTAB的络合模式.首先使用Gaussian View构建PP5A、AO及CTAB的初始结构,通过MM2力场优化得到最稳定的初始构型.设置PP5A受体的格点盒子尺寸为:2.5 nm×2.5 nm×3.5 nm,盒子中心坐标为(0.219,-0.387,0.024),网格间距为0.037 5 nm,采用半柔性对接和拉马遗传算法,将AO和CTAB对接到PP5A的空腔中对接完成后进行聚类分析.分子对接利用AutoDock 4.2程序[38]完成.
2 结果与讨论 2.1 AO/PP5A络合物形成的确定 2.1.1 PP5A溶液与AO溶液的UV光谱分析本文首先通过UV光谱滴定实验研究了PP5A与AO的络合行为(图 2).AO水溶液在490 nm处有紫外吸收峰,如图 2(a)和2(b)所示,随着溶液中PP5A浓度的升高,AO的吸光度逐渐增大;且在一定浓度范围内,吸光度与PP5A浓度具有良好的线性关系,拟合方程为y=0.62+0.498x,R=0.9910,这表明PP5A通过形成络合物提高了AO单体的吸光度.由AO溶液、PP5A溶液与AO/PP5A络合体系的UV光谱[图 2(c)]可以看出与PP5A络合时,AO的UV光谱中266 nm处出现电荷转移特征吸收峰,说明两者之间存在电荷转移,也说明AO进入到PP5A空腔中.根据以上结果推测,UV光谱的变化可能是由PP5A与AO形成络合物引起的.

|
图 2 (a) PP5A滴定AO的UV光谱;(b) AO 490 nm处的吸光度与PP5A浓度的关系;(c) PP5A、AO、AO/PP5A水溶液的UV光谱 Fig. 2 (a) UV spectra of PP5A titration to AO; (b) The relationship between the absorbance of AO at 490 nm and PP5A concentration; (c) UV spectra of AO, PP5A, and AO/PP5A |
AO、PP5A和AO/PP5A的IR光谱如图 3所示.AO在1 596和1 506 cm-1处有特征吸收峰,与PP5A络合之后依然存在该特征吸收峰(1 598和1 503 cm-1处);AO在1 200~919 cm-1之间有两个吸收峰(1 171、919 cm-1),络合物在该区域内存在AO的两个特征吸收峰(1 166、919 cm-1)及PP5A的特征吸收峰(1 031 cm-1);AO在813 cm-1处有吸收峰,而络合物中并不存在该吸收峰.PP5A位于1 403、1 213、1 039 cm-1处吸收峰在络合物中依然存在(1 405、1 212、1 031 cm-1),强度有所变化.AO/PP5A络合物与AO、PP5A的峰在波数及强度上存在一定差异,这也进一步证实了AO/PP5A络合物的形成.
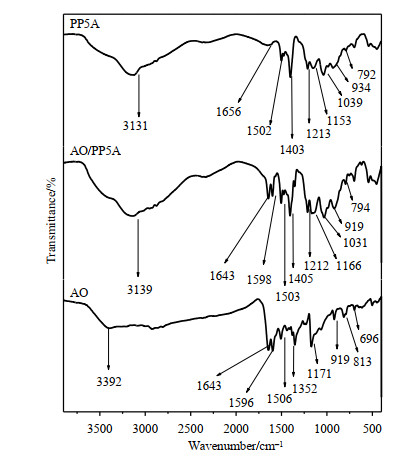
|
图 3 AO、PP5A和AO/PP5A的IR光谱 Fig. 3 IR spectra of AO, PP5A and AO/PP5A |
由于PP5A本身有荧光,为了确定PP5A与AO的荧光发射无重叠,我们分别测试了PP5A水溶液与AO水溶液的MFS光谱.如图 4(a)所示,PP5A在290 nm处激发,在327 nm处产生较强荧光;而AO水溶液在452nm处激发,在525 nm处荧光强度较强,两者荧光发射无重叠.
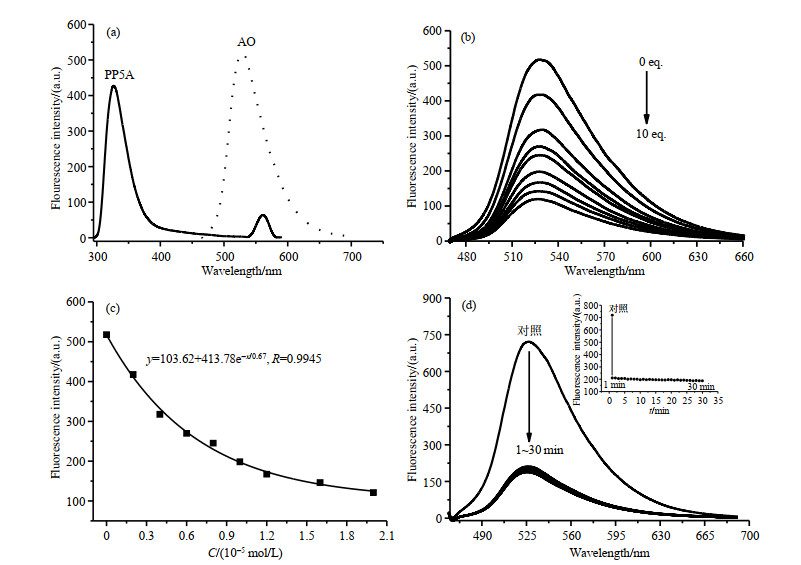
|
图 4 (a) AO水溶液和PP5A水溶液的荧光光谱,EX(AO)=452 nm,EX(PP5A)=290 nm;(b) PP5A滴定AO的荧光光谱;(c) AO荧光强度与PP5A浓度的关系;(d) AO与PP5A络合的动力学曲线 Fig. 4 (a) Fluorescence spectra of AO and PP5A solutions. EX(AO)=452 nm, EX(PP5A)=290 nm; (b) Fluorescence spectra of PP5A titration to AO; (c) The relationship between the fluorescence intensity of AO and PP5A concentration, (d) Kinetic curves of AO/PP5A complex |
我们进一步采用滴定实验研究了在452 nm处激发,AO与PP5A的主-客体络合行为.如图 4(b)所示,在AO中加入不同当量(0~10 eq.)的PP5A时,AO的荧光强度随着PP5A浓度的升高而显著降低.由图 4(c)可以看出,在一定浓度范围内,荧光强度与PP5A浓度呈良好的非线性关系y=103.62+413.78e-x/0.67,相关系数R=0.994 5.PP5A为阴离子大环,AO是阳离子型染料,两者之间可以通过静电和π-π作用形成AO/PP5A络合物,从而使AO的荧光强度发生变化.
为进一步研究与PP5A络合时,AO荧光强度改变与时间的关系,我们进行了动力学测试. 以525 nm处荧光强度为纵坐标,相应时间为横坐标绘制动力学曲线,如图 4(d)所示,在AO溶液中加入PP5A时,AO的荧光强度瞬间降低,说明AO与PP5A的络合在短时间内完成,不具有时间响应性.
2.3 络合比分析本文采用等摩尔连续变化法[39](Job曲线)推断PP5A与AO的络合比.实验过程中AO和PP5A以不同摩尔比混合,但体系总浓度保持不变,以AO与PP5A二者的荧光强度差值(ΔF)×比例系数(XHost=[PP5A]/([PP5A]+[AO]))为纵坐标,二者的比例系数为横坐标绘制的Job曲线如图 5所示,从图 5可知,最大相对荧光强度发生在比例系数=0.5时,由此可推断AO与PP5A的络合比为1:1.
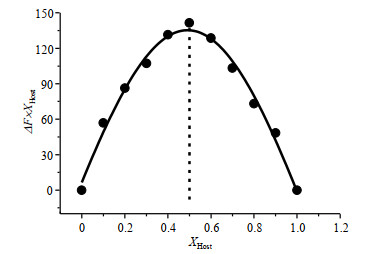
|
图 5 AO与PP5A的Job曲线 Fig. 5 Job's plot of AO and PP5A |
pH对络合体系的荧光强度存在较大影响,本文探索了不同pH条件下PP5A、AO及AO/PP5A络合物的荧光强度(图 6),290 nm处激发,测定PP5A 327 nm处的荧光强度;452 nm处激发测定AO、AO/PP5A 525 nm处的荧光强度.结果显示在pH=3~6范围内时,AO和AO/PP5A的荧光强度随着pH值的增大呈现降低的趋势;在pH=7~9范围内时,AO荧光强度增加,基本达到最大值,而AO/PP5A体系荧光强度基本保持在400~500之间,表明此范围内形成的络合物较稳定;在pH=9~12范围内时,AO和AO/PP5A的荧光强度变化先减弱后增强,AO/PP5A体系荧光强度在pH=12基本达到最大值;pH > 12时,大量OH-与AO结合导致了负电荷增加,使AO与PP5A络合作用减弱、荧光强度降低.值得注意的是,PP5A的荧光强度在pH=3~13范围内基本不变.

|
图 6 不同pH溶液中,AO,PP5A,AO/PP5A络合物的荧光强度 Fig. 6 Fluorescence intensity of AO, PP5A and AO/PP5A complex in solutions with different pH values |
此外,在pH=3~11范围内,PP5A均能使AO的荧光强度发生减弱或淬灭,推测使AO荧光强度发生变化是由于AO与PP5形成AO/PP5A络合物所导致的,也进一步说明在较宽pH范围内AO与PP5A能形成AO/PP5A络合物.
2.5 SDS和CTAB对络合行为的影响为了进一步考察AO与PP5A的络合能力,本文分别选择了阴离子型(SDS)和阳离子型(CTAB)两种表面活性剂对络合体系的影响进行了研究.
由图 7(a)可以看出,SDS的添加对AO/PP5A的荧光强度基本没有影响,说明带负电荷的SDS并不能促进AO从AO/PP5A络合物体系的解离;而CTAB的加入对AO/PP5A体系的荧光强度有影响,但影响不大,这可能是由于CTAB与PP5A的络合能力小于AO与PP5A的络合能力.在本文实验条件下,PP5A与AO的络合在瞬间完成,且加入PP5A后AO的MFS光谱发生显著变化,综上所述,PP5A在水中能快速识别AO.

|
图 7 (a) AO/PP5A的荧光强度随表面活性剂加入量的变化;(b) PP5A荧光强度随SDS浓度的变化;(c) CTAB滴定PP5A的MFS光谱;(d) PP5A荧光强度随CTAB浓度的变化 Fig. 7 (a) Fluorescence intensity change of AO/PP5A with the volume added of surfactants; (b) Fluorescence intensity change of PP5A with SDS concentration; (c) Fluorescence spectra of CTAB titration to PP5A; (d) Fluorescence intensity change of PP5A with CTAB concentration |
由图 7(b)~7(d)可以看出:SDS的添加对PP5A荧光强度影响不大;而添加适量的CTAB后,PP5A荧光强度明显增强,而且在一定浓度范围内,荧光强度与CTAB浓度具有良好的线性拟合关系,y=504.88+94.24x,R=0.997 7,这可能是PP5A与CTAB形成络合物所引起的.
如图 8所示,AO是醌亚胺类有机分子,其能提供孤对电子对,当AO进入PP5A空腔时,两者通过静电相互作用、π-π相互作用使得AO被包裹在PP5A空腔中.因此,AO在与PP5A形成络合物时,AO的荧光强度和吸光度均发生变化.此外,SDS和CTAB的加入不会对AO/PP5A络合体系荧光强度产生显著影响,我们推测是由于PP5A与CTAB的络合能力较弱,而SDS由于电荷排斥作用无法与阴离子大环PP5A形成主-客体络合物.
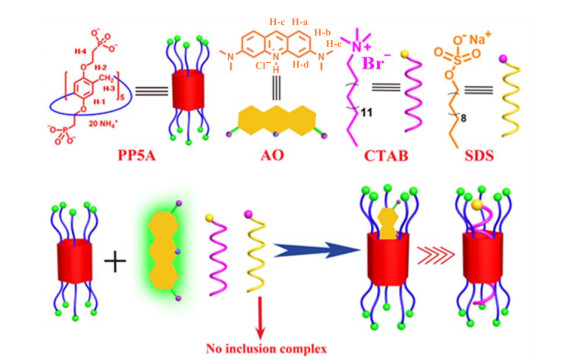
|
图 8 PP5A、AO、CTAB、SDS的结构及AO/PP5A、CTAB/PP5A的荧光变化示意图 Fig. 8 The structures of PP5A, AO, CTAB, SDS, and schematic diagram of fluorescence sensing of AO/PP5A and CTAB/PP5A |
求解络合常数对于推测AO与PP5A的络合行为具有重要意义,AO与PP5A的络合比为1:1,则满足(1)式平衡;络合常数可定义为(2)式,然后根据Benesi-Hildebrand曲线法[40],即(3)式可求得络合常数.
| ${\rm{AO}} + {\rm{PP5A}} \to {\rm{AO}}/{\rm{PP5A}}$ | (1) |
| ${K_{{\rm{AO}}/{\rm{PP5A}}}} = \frac{{{C_{{\rm{AO}}/{\rm{PP5A}}}}}}{{{C_{{\rm{AO}}}} \times {C_{{\rm{PP5A}}}}}}$ | (2) |
| $\frac{1}{{F - {F_{\rm{0}}}}} = \frac{1}{{({F_\infty } - {F_{\rm{0}}}){K_{{\rm{AO}}/{\rm{PP5A}}}}{C_{{\rm{PP5A}}}}}} + \frac{1}{{{F_\infty } - {F_{}}}}$ | (3) |
(1)~(3)式中,

|
图 9 (a) AO/PP5A和(b) CTAB/PP5A络合常数判断 Fig. 9 Complexing constants determination of (a) AO/PP5A and (b) CTAB/PP5A |
此外,我们还对比了不同大环主体,如葫芦[7]脲、羧酸盐柱[6]芳烃、磷酸盐柱[6]芳烃与AO的络合常数(表 1).对比发现AO与PP5A的络合能力较强,也进一步说明PP5A的空腔对AO具有较好的匹配性.
| 表 1 AO与不同大环化合物的络合常数对比 Table 1 Comparison of complexing constants between AO and different macrocyclic compounds |
NMR是研究物质结构最有力的方法之一[41, 42],PP5A、AO及AO/PP5A络合物的1H NMR谱及各质子化学位移变化如图 10和表 2所示:由图 10可知,AO/PP5A络合物的1H NMR中能检测到AO和PP5A的质子信号,且AO的H-a、H-b、H-c、H-d和H-e明显向低场方向移动,而PP5A的H-1、H-2、H-3和H-4向高场方向移动.由表 2可知,络合前后,PP5A和AO的质子化学位移变化较大.由此可推断客体分子AO进入到PP5A空腔之中.判断AO与PP5A之间络合行为的NOESY谱如图 11(a)所示,PP5A的H-1、H-2、H-3和H-4均与AO的H-e存在明显的核Overhauser效应(NOE)相关,推断出AO从烷基链一端进入到PP5A空腔中,并推测其络合模式如图 11(b)所示.
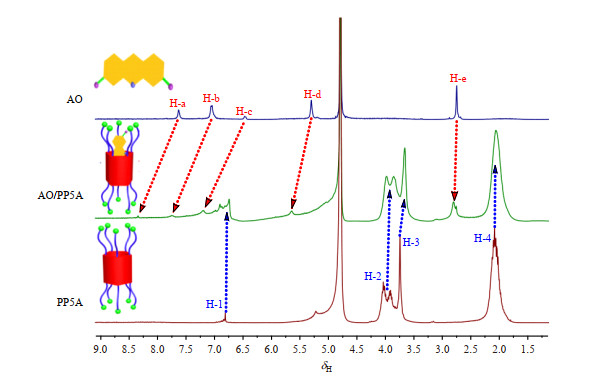
|
图 10 PP5A、AO、AO/PP5A(1:1络合)的1H NMR谱图(D2O) Fig. 10 1H NMR spectra (D2O) of PP5A, AO, AO/PP5A (1:1 complexing) |
| 表 2 PP5A络合AO前后AO及PP5A质子化学位移变化 Table 2 The chemical shift changes of protons in PP5A and AO before and after complexing |
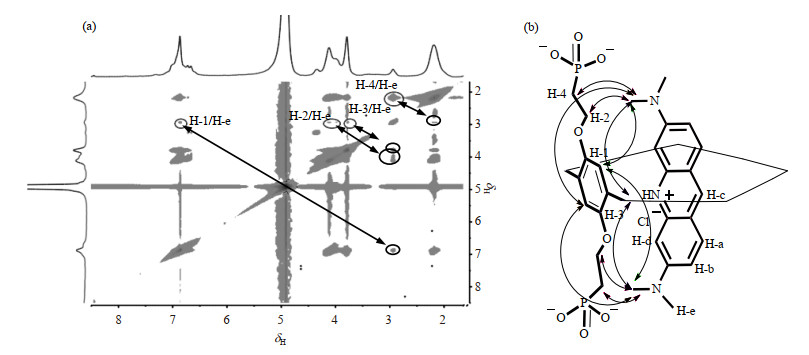
|
图 11 (a) AO/PP5A络合物的NOESY谱(D2O);(b) AO/PP5A络合物可能的络合模式与NOE相关 Fig. 11 (a) NOESY spectrum of AO/PP5A complex (D2O); (b) Possible complexing mode and NOE correlation of AO/PP5A |
经聚类分析发现,PP5A与AO、CTAB形成的最稳定主客体对接模式如图 12所示.由图可知AO和CTAB分子并没有从PP5A空腔中脱离出来,说明PP5A与AO、CTAB均可在电荷驱动作用下形成络合物.PP5A与AO、CTAB客体分子形成的最稳定络合构型具有相似的特征,即PP5A与AO和CTAB的几何中心并没有重叠,两个分子均处于PP5A空腔的一端.AO分子斜靠于PP5A内壁,而CTAB只有带正电荷的一端进入到PP5A空腔中,烷基链的一端裸露在空腔外.AO/PP5A与CTAB/PP5A结合能分别为322.17 kJ/mol和32.43 kJ/mol,这也进一步从理论上解释了CTAB的加入不会对AO/PP5A荧光强度产生影响,因此PP5A是AO更好的寄主.
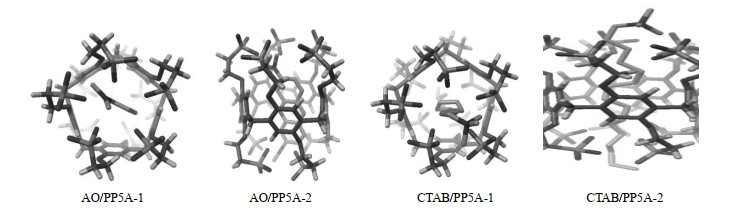
|
图 12 PP5A与AO、CTAB的分子对接络合模式:AO/PP5A-1和CTAB/PP5A-1代表俯视图;AO/PP5A-2和CTAB/PP5A-2代表正视图 Fig. 12 Molecular docking conformation diagram of PP5A with AO and CTAB. AO/PP5A-1 and CTAB/PP5A-1 represent the top view, AO/PP5A-2 and CTAB/PP5A-2 represent the front view |
本文构建了PP5A与AO的主-客体络合物,通过UV光谱、IR光谱、MFS光谱、1H NMR与NOESY技术研究了PP5A与AO的络合行为,以及PP5A与AO络合时的荧光性质、络合常数、络合比和络合模式.此外,还进一步研究了pH以及两种表面活性剂CTAB和SDS对AO/PP5A络合体系的影响.结果表明,AO与PP5A形成1:1的主-客体络合物,络合常数为1.55×105 L/mol;在较宽pH范围内(pH=3~11),PP5A的加入使得AO的荧光强度显著发生变化;SDS和CTAB的加入并不会对AO/PP5A络合体系的荧光强度产生显著影响,这是由于PP5A与SDS由于静电斥力并不会发生主客体络合,而CTAB虽然能与PP5A发生主-客体络合,但络合常数远小于AO与PP5A的络合常数.分子对接计算的结果也说明PP5A与AO的络合强于PP5A与CTAB.AO与PP5A络合时的荧光变化可为荧光传感器的设计提供理论参考.
| [1] | OGOSHI T, KANAI S, FUJINAMI S, et al. Para-bridged symmetrical pillar[5]arenes:their synthesis and host-guest property[J]. J Am Chem Soc, 2008, 130(15): 5022-5023. DOI: 10.1021/ja711260m. |
| [2] | CHI X D, JI X F, HUANG F H, et al. A dual-responsive supra-amphiphilic polypseudorotaxane constructed from a water-soluble pillar[7]arene and an azobenzene-containing random copolymer[J]. J Am Chem Soc, 2015, 137(4): 1440-1443. DOI: 10.1021/ja512978n. |
| [3] | YU G, ZHAO R, WU D, et al. Pillar[5]arene-based amphiphilic supramolecular brush copolymer:fabrication, controllable self-assembly and application in self-imaging targeted drug delivery[J]. Polym Chem, 2016, 7(40): 6178-6188. DOI: 10.1039/C6PY01402J. |
| [4] | WEI T B, CHENG X B, Li H, et al. Novel functionalized pillar[5]arene:synthesis, assembly and application in sequential fluorescent sensing for Fe3+ and F- in aqueous media[J]. Rsc Adv, 2016, 6(25): 20987-20993. DOI: 10.1039/C5RA26240B. |
| [5] | CHEN J F, CHENG X B, LI H, et al. A copillar[5]arene-based fluorescence "on-off-on" sensor is applied in sequential recognition of an iron cation and a fluoride anion[J]. New J Chem, 2017, 41(5): 2148-2153. DOI: 10.1039/C6NJ03380F. |
| [6] | NOUJEIM N, ZHU K, VUKOTIC V N, et al. [2]Pseudorotaxanes from t-shaped benzimidazolium axles and crown-8wheels[J]. Org Lett, 2012, 14(10): 2484-2487. DOI: 10.1021/ol300761q. |
| [7] | CHEN L, TIAN Y K, DING Y, et al. Multistimuli responsive supramolecular cross-linked networks on the basis of thebenzo-21-Crown-7/secondary ammonium salt recognition motif[J]. Macromolecules, 2012, 45(20): 8412-8419. DOI: 10.1021/ma3016486. |
| [8] | LI S J, HUANG J Y, COOK T R, et al. Formation of [3]catenanes from 10 precursors via multicomponent coordination-driven self-assembly of metallarectangles[J]. J Am Chem Soc, 2013, 135(6): 2084-2087. DOI: 10.1021/ja3118812. |
| [9] | HAN Y, MENG Z, MA Y X, et al. Iptycene-derived crown ether hosts for molecular recognition and self-assembly[J]. Accounts Chem Res, 2014, 47(7): 2026-2040. DOI: 10.1021/ar5000677. |
| [10] |
YANG Y H, DU Y, YING F X, et al. Inclusion behavior of naringenin/-cyclodextrin supramolecular complex[J].
Chinese J Magn Reson, 2019, 36(3): 319-330.
杨云汉, 杜瑶, 应飞祥, 等. 柚皮素/β-环糊精超分子体系的包合行为[J]. 波谱学杂志, 2019, 36(3): 319-330. |
| [11] |
DU Y, ZHOU S Y, YANG Y H, et al. Study on molecular recognition of pinocembrin with methylated-β-cyclodextrin[J].
Chinese J Anal Chem, 2019, 47(03): 371-379.
杜瑶, 周树娅, 杨云汉, 等. 松属素与甲基化-β-环糊精的分子识别研究[J]. 分析化学, 2019, 47(03): 371-379. |
| [12] |
DENG Y H, SU L N, PANG Y H, et al. Preparation, characterization and water solubility of Inclusion complexes of daidzein with amino-modified β-cyclodextrins[J].
Chinese J Anal Chem, 2017, 45(5): 648-653.
邓颖慧, 苏丽娜, 庞艳华, 等. 大豆苷元与氨基修饰β-环糊精包合物的制备、表征及水溶性[J]. 分析化学, 2017, 45(5): 648-653. |
| [13] |
LIU X B, LIN J L, WANG H, et al. Water-solubilization of acyclic cucurbiturils for arenes and aromatic aldehydes and the promotion for the generation of two hydrazine-based macrocycles[J].
Chinese J Org Chem, 2020, 40: 663-668.
刘旭波, 林佳乐, 王辉, 等. 开环葫芦脲在水中对芳烃和芳醛的增溶和对腙大环形成的促进作用[J]. 有机化学, 2020, 40: 663-668. |
| [14] |
MA J, ZHANG X Z, LIU S M. Characteristics of cucurbit[8]uril host-guest Inclusion complexes and determination of thebinding constants of metal ions with cucurbit[8]uril[J].
J Anal Sci, 2019, 35(1): 41-46.
马军, 张雄志, 刘思敏. 葫芦[8]脲主客体包合物特性及对金属离子键合常数测定[J]. 分析科学学报, 2019, 35(1): 41-46. |
| [15] | GUO D S, LIU Y. Calixarene-based supramolecular polymerization in solution[J]. Chem Soc Rev, 2012, 41(18): 5907. DOI: 10.1039/c2cs35075k. |
| [16] | MA X Q, WANG Y, WEI T B, et al. A novel AIE chemosensor based on quinoline functionalized pillar[5]arene for highly selective and sensitive sequential detection of toxic Hg2+ and CN-[J]. Dyes Pigments, 2019, 164: 279-286. DOI: 10.1016/j.dyepig.2019.01.049. |
| [17] | YU G C, MA Y J, HAN C Y, et al. A sugar-functionalized amphiphilic pillar[5]arene:synthesis, self-assembly in water, and application in bacterial cell agglutination[J]. J Am Chem Soc, 2013, 135(28): 10310-10313. DOI: 10.1021/ja405237q. |
| [18] | SI W, CHEN L, HU X B, et al. Selective artificial transmembrane channels for protons by formation of water wires[J]. Angew Chem Int Edit, 2011, 123(52): 12772-12776. DOI: 10.1002/ange.201106857. |
| [19] | HU X B, CHEN Z, TANG G, et al. Single-molecular artificial transmembrane water channels[J]. J Am Chem Soc, 2012, 134(20): 8384-8387. DOI: 10.1021/ja302292c. |
| [20] | ZHANG F, MA J K, SUN Y, et al. Construction of a switchable nanochannel for protein transport via a pillar[5]arene-based host-guest system[J]. Anal Chem, 2018, 90(13): 8270-8275. DOI: 10.1021/acs.analchem.8b01948. |
| [21] | DUAN Q P, CAO Y, LI Y, et al. pH-responsive supramolecular vesicles based on water-soluble pillar[6]arene and ferrocene derivative for drug delivery[J]. J Am Chem Soc, 2013, 135(28): 10542. DOI: 10.1021/ja405014r. |
| [22] | CAO Y, HU X Y, LI Y, et al. Multistimuli-responsive supramolecular vesicles based on water-soluble pillar[6]arene and saint complexation for controllable drug release[J]. J Am Chem Soc, 2014, 136(30): 10762-10769. DOI: 10.1021/ja505344t. |
| [23] | YU C, YAN L, HU X Y, et al. Supramolecular nanoparticles constructed by dox-based prodrug with water-soluble pillar[6]arene for self-catalyzed rapid drug release[J]. Chem Mater, 2016, 27(3): 1110-1119. |
| [24] |
XU Z Y, ZHANG Y C, LIN J L, et al. Supramolecular self-assembly applied for the design of drug delivery[J].
Systems Prog Chem, 2019, 11: 1-10.
徐子悦, 张运昌, 林佳乐, 等. 药物输送体系构筑中的超分子组装策略[J]. 化学进展, 2019, 11: 1-10. |
| [25] | YU G C, YU W, SHAO L, et al. Fabrication of a targeted drug delivery system from a pillar[5]arene-based supramolecular diblock copolymeric amphiphile for effective cancer therapy[J]. Adv Funct Mater, 2016, 26(48): 1-9. |
| [26] |
YANG Y H, YANG J L, LU J J, et al. Preparation of cationic water-pillar[5]arene modified zeolite and its adsorption to bromocresol purple[J].
Chinese J Anal Chem, 2019, 47(12): 1922-1930.
杨云汉, 杨俊丽, 鲁佳佳, 等. 阳离子化柱[5]芳烃改性沸石对溴甲酚紫的吸附研究[J]. 分析化学, 2019, 47(12): 1922-1930. |
| [27] |
LI P, ZHANG D W, JIA Q. Research advances in supramolecular macrocyclic compounds for dye adsorption[J].
Chinese J Chro, 2020, 38(3): 297-306.
李萍, 张大伟, 贾琼. 超分子大环化合物用于染料吸附的研究进展[J]. 色谱, 2020, 38(3): 297-306. |
| [28] | WAGNER B D, STOJANOVIC N, DAY A I, et al. Hostproperties of cucurbit[7]uril:fluorescence enhancement of anilinon aphthalene ulfonates[J]. J Phys Chem B, 2003, 107: 10741-10746. DOI: 10.1021/jp034891j. |
| [29] | MOHANTY J, BHASIKUTTAN A C, NAU W M, et al. Host-guest complexation of neutral red with macrocyclic host molecules:contrasting pKa shifts and binding affinities for cucurbit[7]uril and b-cyclodextrin[J]. J Phys Chem, 2006, 110: 5132-5238. DOI: 10.1021/jp056411p. |
| [30] | ZHOU Y Y, YU H P, ZHANG L, et al. Host properties of cucurbit[7]uril:fluorescence enhancement of acridine orange[J]. J Incl Phenom Macro, 2008, 61(3, 4): 259-260. |
| [31] |
YANG M, LIU Q, TANG Q, et al. Water-soluble supramolecular fluorescent probe for sensing carbendazim and its application in living cell imaging[J].
Chem Res Chinese U, 2018, 39(12): 2665-2672.
杨梅, 刘青, 唐青, 等. 水溶性超分子荧光探针对多菌灵的识别及细胞成像[J]. 高等学校化学学报, 2018, 39(12): 2665-2672. |
| [32] |
LIU Q, YANG H R, WANG A J. Sensitive fluorescence method for the determination of levofloxacin in pharmaceuticals using bromate-bromide, methylene blue and β-cyclodextrin as reagents[J].
Anal Lab, 2012, 31(5): 6-9.
刘奇, 杨红瑞, 王爱军. β-环糊精增敏亚甲基蓝荧光法测定左氧氟沙星[J]. 分析试验室, 2012, 31(5): 6-9. |
| [33] |
LIN L B, GUO H Y, YANG F F, et al. Novel biscalix[4]arene with large conjugated aromatic bridges:synthesis and complexation properties for dyes[J].
Chinese J Org Chem, 2016, 36(8): 1863-1868.
林梁斌, 郭红玉, 杨发福, 等. 大共轭芳香基桥联双杯[4]芳烃的合成与染料配合性能[J]. 有机化学, 2016, 36(8): 1863-1868. |
| [34] |
YAN Z X, GUO H Y, YANG F F, et al. Syntheses and dyes complexation properties of multiple-azo calix[4]arene derivatives containing thiourea groups[J].
Chinese J Org Chem, 2016, 36(5): 1088-1093.
严祯曦, 郭红玉, 杨发福, 等. 含硫脲基的多重氮杂杯[4]芳烃衍生物的合成与有机染料配合性能[J]. 有机化学, 2016, 36(5): 1088-1093. |
| [35] | QIAN X C, ZHOU X J, YANG L, et al. One-step and green strategy for exfoliation and stabilization of graphene by phosphate pillar[6]arene and its application for fluorescence sensing of paraquat[J]. Microchem J, 2019, 150: 104203. DOI: 10.1016/j.microc.2019.104203. |
| [36] | HUA B, SHAO L, ZHANG Z H, et al. Pillar[6]arene/acridine orange host-guest complexes as colorimetric and fluorescence sensors for choline compounds and further application in monitoring enzymatic reactions[J]. Sensor Actuat B-Chem, 2018, 255: 1430-1435. DOI: 10.1016/j.snb.2017.08.141. |
| [37] | HU X Y, LIU X, ZHANG W, et al. Controllable construction of biocompatible supramolecular micelles and vesicles by water-soluble phosphate pillar[5, 6]arenes for selective anti-cancer drug delivery[J]. Chem Mater, 2016, 28: 3778. DOI: 10.1021/acs.chemmater.6b00691. |
| [38] | MORRIS G M, HUEY R, LINDSTROM W, et al. Autodock4 and autodocktools4:automated docking with selective receptor flexibility[J]. Comput Chem, 2009, 30: 2785. DOI: 10.1002/jcc.21256. |
| [39] | VENKATESAN M, SATHIYANARAYANAN K I. Highly selective chemosensor for the detection of Ru3+ ion by fluorescentturn-on response and its bioimaging recognition in living cellsSens[J]. Sensor Actuat B-Chem, 2018, 18: 267-373. |
| [40] | XIAO X D, SHI L, GUO L H, et al. Determination of dopamine hydrochloride by host-guest interaction based on water-soluble pillar[5]arene[J]. Spectrochim Acta A, 2017, 173: 6. DOI: 10.1016/j.saa.2016.08.050. |
| [41] |
ZHOU Z G, YUAN Y Y, LIU H B, et al. An NMR study on prucalopride[J].
Chinese J Magn Reson, 2018, 35(1): 119-127.
周中高, 元洋洋, 刘红波, 等. 普卡必利的NMR研究[J]. 波谱学杂志, 2018, 35(1): 119-127. |
| [42] |
FAN H Y. Spectral analyses of a novel ibuprofen-phillygenin ester[J].
Chinese J Magn Reson, 2018, 35(1): 98-108.
樊宏宇. 新型连翘脂素-布洛芬酯合物的波谱学数据解析[J]. 波谱学杂志, 2018, 35(1): 98-108. |
 2020, Vol. 37
2020, Vol. 37 
