1938年,Rabi[1]率先通过测量分子束来描述核磁共振(Nuclear Magnetic Resonance,NMR)现象,通过扩展Stern-Gerlach实验研发了连续波NMR波谱仪,并因此获得1944年诺贝尔物理学奖[2].1966年,Ernst等[3]将傅里叶变换技术应用到NMR技术之中,研发了脉冲傅里叶变换NMR波谱仪,即现在普遍使用的NMR波谱仪.此方法最初源于多通道谱仪的应用,将脉冲产生的时域信号进行傅里叶变换就得到了常规的频域谱,因此傅里叶变换相当于一个多通道接收机.通过合理地选择脉冲参数可以使射频脉冲的频率覆盖分子中磁性核的共振频率范围[4].这一技术的出现不仅提高了NMR谱图分辨率,也使得NMR开始应用于各个领域[5],尤其在食品[6]、化学化工[7]、生命科学[8]等领域.
由于原位NMR可以精准的记录瞬间反应时刻下的局部化学变化,利用该技术能够更加微观地观测到高分子体系复杂的结构、动力学以及相互作用[9],更好地将高分子材料的性质和功能联系起来,因此在高分子聚合物的结构与动力学研究领域,原位NMR技术已显得日趋重要[10].
1 原位NMR技术简介NMR的原理是磁矩不为0的原子核与它们所在的磁场间的相互作用引起特征频率变化[11].在强磁场下,具有磁性的原子核由于吸收特定频率的射频辐射从而发生共振,记录的原子核从高能级恢复到低能级过程中的自由感应衰减(Free Induction Decay,FID)信号经过傅里叶变换即可得到NMR波谱[12].“原位”一词最初来自拉丁文situ(意为“现场”),in situ表示现场跟踪;而目前原位NMR波谱的英文变更为in operando NMR spectroscopy,拉丁文“operando”意为“操作”,因此in operando引申为“现场原位”[13].原位NMR检测在常规NMR检测的基础上,通过实验参数优化以及合理设置相邻两张谱图扫描的间隔时间,可在非离体状态下实时观测实验体系的物理化学变化过程.
质子天然丰度高,NMR灵敏度较高;而且1H NMR谱峰较窄.因此原位NMR中最常用的方法是1H NMR波谱.与常规1H NMR检测类似,可通过谱峰的化学位移推断氢原子所处的化学环境,通过分析吸收峰裂分情况分辨所研究氢原子受到的邻近基团原子自旋状态的影响,从而推导官能团信息[14].综合以上两点可以获得分子骨架上氢原子的相对数目和分子构型等有效信息.而且原位1H NMR由于采样时间短,体系内部发生变化导致的弛豫时间改变通常并不影响谱图中的峰面积,并且可通过计算特征峰与内标峰[例如四甲基硅烷(Tetramethylsilane,TMS)]的积分面积之比获知目标峰的含量,实现定量检测.利用13C NMR波谱可直接获得分子骨架信息.另外,应用全去耦技术可以消除氢原子对于碳原子的耦合作用,减弱旋转边带,对于聚合物也可以得到线宽较窄的NMR谱图.但是13C核天然丰度较低,且磁旋比较小,因此13C NMR的扫描时间远大于1H NMR.而且原位13C NMR多用于固体NMR实验.所以原位NMR检测原则是优先进行原位1H NMR检测,若存在特殊的基团(例如叔碳)或者常温下很难溶于有机试剂的聚合物(如交联体系),则考虑进行原位13C NMR检测.以上两种检测方式对于高分子领域均有重要意义,特别是原位1H NMR,被广泛应用于反应动力学测量、反应机理阐释等.
与常规NMR技术相同,原位NMR也具有如下优势.(1)基团之间的磁性核会相互耦合而产生精细结构裂分[15];NMR谱图的积分面积与其浓度呈正比,通过特征峰归一化积分强度的改变可推导反应动力学.这种独特又通用的技巧能够在时间和空间上很好的阐述结构与动力学,且使用范围比较广[16].(2)聚合过程会导致NMR谱峰变宽,但可以通过分析峰型变宽的原因直接跟踪反应过程,并获知其影响因素.(3)可以在不同温度下跟踪实验过程,根据过动力学结果推导出活化能等热力学系数.(4)可以表征链末端的位点选择性.但相比常规NMR检测,原位NMR检测还具有如下优点,并因此在高分子聚合物研究中得到广泛应用:(1)可以实时记录实验体系在不同时间点对应的谱图,其优势在于可跟踪均匀体系的反应过程或者物理变化,实时追踪由化学环境的改变引起的化学位移、峰的耦合裂分及峰面积的改变,这样获得的数据比离线NMR检测获得的数据更加准确.(2)相比于离线NMR检测通过配制等量储存溶液在不同时间点将反应停止分别采集信号,原位NMR检测不需要多次锁场、匀场、调谐以及设置参数,可以不间断地采集信号,从反应的最初阶段进行跟踪.
原位液体NMR用于研究聚合物时常通过选择合适溶剂、提升实验温度和应用高场NMR仪器等手段提高谱图分辨率.含有活泼氢基团的聚合物,比如醛、酸等,会与氘代试剂中氢原子进行交换,因此很难定量计算基团浓度.通过将这些聚合物溶解在强酸里将基团上的氧原子质子化,若质子化速度够慢就可以在1H NMR谱图上检测到活泼质子的特征峰,从而进行定量分析.在研究难以溶解在氘代试剂的聚合物时,通常也可采用原位固体NMR[17]技术.魔角旋转[18](Magic-Angle Spinning,MAS)和高功率去耦[19]等是提高原位固体NMR谱图分辨率的有效手段.利用MAS技术可消除由各向异性相互作用导致的峰型展宽,在常温下模拟液体NMR检测时各向同性的均匀环境,获得类似液体NMR采集到的自旋多重化精细谱图,便于跟踪加工过程中聚合物结构与形态的变化;利用交叉极化提高灵敏度或偶极去耦消除C-H之间的耦合作用,可用于区分一些材料的结晶区与无定型区;利用弛豫时间区分化学位移相近的信号峰,如热塑性弹性体的软硬段,可用于检测共聚物或者共混物的组成.原位固体NMR多用于检测物理变化导致的交联聚合物性能(例如构象、结晶性等)的变化.Schnell等[20]利用原位固体NMR研究超分子体系中的氢键重排过程,使用双量子同核重耦技术研究了超分子体系基于双官能团单体体系下两个受核酸引发的脲基嘧啶酮部分产生的氢键网络,证实官能团可以形成四重氢键,产生线性的超分子,同时氢键在热熔融和涂料里又可以进行重排,这被称为在固体里的氢键部分的细节表征,作者还计算了热力学与动力学参数.
除常规的原位液体或固体1H NMR和13C NMR检测外,越来越多的原位NMR及其优化方法、分离技术与原位NMR联用手段也已经开始应用于高分子聚合物研究领域:(1)二维NMR谱图.它可以进一步提高分辨率,分辨空间序列结构,鉴别多阶J偶合产生的谱图不对称或者不符合n+1规则的峰型.二维谱常用于检测聚合物的序列与构象,在确定有机化合物的绝对构型、检测手性化合物结构等领域具有明显优势.(2)原位杂核NMR技术,例如17O NMR、19F NMR、7Si NMR、31P NMR、129Xe NMR等.李森等[21]利用原位变温1H NMR、19F NMR和31P NMR检测了1-丁基-3-甲基咪唑阳离子与六氟磷酸根阴离子组成的室温离子液体在不同温度下的热分解机理,并且定量了生成卡宾复合物时体系内部的摩尔浓度变化.Zaheer等[22]利用原位129Xe NMR技术,以连续流动相里有效溶解在反应介质中的超极化氙原子为探针,跟踪混溶动力学过程,观察亚微米尺度的相分离变化.油-甲醇的混合也可类比工业催化酯交换、相转移催化[23]等过程,因此,在高分子领域内超极化探针也可应用于微乳液等部分混溶性液体检测[24].(3)脉冲与硬件的优化与改进.在检测天然丰度很低或者结构复杂的化合物时[25],除了对常规的实验脉冲进行参数优化外,还可以使用多核脉冲序列,对探头、线圈、NMR样品管等NMR硬件进行改进,以达到更好的分辨率.(4)原位NMR与其它仪器联用.联用技术多用于分析共聚物或共混物的摩尔质量组成、观察共聚物的微观结构.
本文将着重阐述在高分子领域内,原位液体NMR技术在动力学推导、阐述反应机理、分析共聚物化学组成和微观构成等方面的典型应用,还将介绍原位液体NMR与其它方法的联用技术在高分子领域的应用.
2 原位液体NMR技术的应用 2.1 原位液体NMR技术用于跟踪反应动力学原位液体NMR是聚合反应动力学最常见的表征方式.袁丽等[26]利用原位液体1H NMR研究了L-缬氨酸诱导苯胺形成花状纳米聚苯胺的过程.实验设计L-缬氨酸与苯胺的物质的量的浓度比分别为2:1、1:1、3:1,在25 ℃下以过硫酸铵为引发剂原位跟踪聚合过程,每3 min采一次样(为了更好的说明体系的变化,图 1中的相邻两张NMR谱图间隔时间为15 min).利用自旋回波技术消除外磁场不均匀导致的信号变宽.利用DOSY实验得到的扩散系数评定了分子平动、物质的运动行为及相对聚集尺寸的大小;利用反转恢复实验测定的纵向弛豫时间(T1)结果显示苯胺与L-缬氨酸的T1均随着L-缬氨酸浓度的增加而增加,但是L-缬氨酸的增幅更大.当L-缬氨酸与苯胺的浓度比为2:1时,原位1H NMR实验显示在反应初期类胶束结构内形成具有吩嗪结构的苯胺低聚物与苯胺单体:低聚物的NMR信号没有随着反应时间而改变,但苯胺单体因不断吸收质子,其特征峰向低场移动;被活化的苯胺在非极性环境下被L-缬氨酸的疏水羟基包围,L-缬氨酸在极性环境中被水分子包围.原位1H NMR实验也证实在反应中期,苯胺的谱峰开始变宽,这是由于缺电子的吩嗪结构低聚体的稠环与富电子的苯胺单体发生了π-π重叠形成聚集体,在缬氨酸的引导下开始形成花状纳米材料形貌.至此,通过原位1H NMR与电镜技术都没有观察到L-缬氨酸参与反应,而且L-缬氨酸很好的将苯胺包裹在疏水基团中,对应谱图中的水峰只呈现一种峰型.因此可以将L-缬氨酸视作表面活性剂.这一结果与Wang等[27]所提出的随着苯胺胶束内包裹水分子,在1H NMR谱中可观察到两种水峰不同.反应150 min后,苯胺的信号已经完全变为宽峰,观察不到耦合作用信息.但如图 1所示,L-缬氨酸的α-CH只有在比例为2:1时才表现为宽峰.缬氨酸的长疏水链导致其CH峰型变宽,这种双亲性链段结构最终导致聚合物形貌为花状纳米结构.苯胺质子化过程中其邻间位质子的化学位移变化与时间的呈线性关系,而与L-缬氨酸浓度无关.但是,1:1和3:1浓度的反应体系在反应初期没有观察到吩嗪结构的苯胺低聚体,在反应150 min时也没有观察到L-缬氨酸的α-CH谱峰变宽,电镜同样无法观察到花状纳米结构.
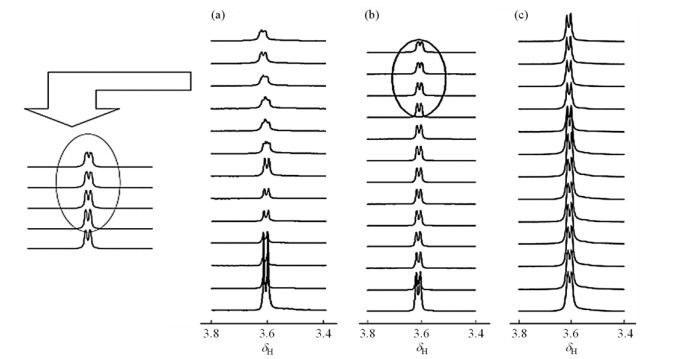
|
图 1 不同浓度的L-缬氨酸诱导苯胺(0.043 mol/L)形成花状纳米聚苯胺的过程中,L-缬氨酸α-CH的原位1H NMR谱.L-缬氨酸的浓度分别为(a) 0.086 mol/L;(b) 0.043 mol/L;(c) 0.129 mol/L [26] Fig. 1 The in operando 1H NMR spectra of α-CH in L-valine during forming flower like nanostructured polyaniline from aniline (0.043 mol/L) introduced with (a) 0.086 mol/L, (b) 0.043 mol/L, and (c) 0.129 mol/L of L-valine, respectively[26] |
杨薇蔓等人[28]利用原位液体1H NMR与13C NMR技术表征了四苯基卟啉氯化铝催化的环氧丙烷配位开环聚合过程.催化剂与单体(浓度比为10:1)都溶解在氘代氯仿中,将配置好的溶液等体积的移入到五根NMR样品管后,分别在15 ℃、25 ℃、30 ℃、35 ℃和40 ℃下反应.由于环氧丙烷开环插入催化剂的Al-O键中,因受催化剂上卟啉环的屏蔽作用,环氧丙烷聚合物甲基质子出现在δH -2.33处,不与其它脂肪族饱和碳原子信号重叠,而且裂分为双峰.因此选用与铝原子连接的环氧丙烷聚合物支链甲基质子作为定量测定聚合物的特征峰.原位1H NMR谱中以催化剂卟啉环上质子归一化积分面积作为基准,以甲基与催化剂卟啉质子的积分面积之比定量分析浓度变化;利用原位13C NMR技术分析了聚合物的立体构型.通过积分计算出全同、间同与无规结构的比例,从而计算了三元异构体的竞聚率.绘制转化率与时间的关系曲线得到不同温度下的速率常数,再将不同温度带入阿伦尼乌斯方程得到了反应活化能.
乳液聚合反应比常见的自由基聚合动力学更加复杂[29].由于反应体系是非均相,所以转化率与时间的动力学曲线的获得以及摩尔质量的定量检测都更加困难.Vargas等[30]通过低场(20 MHz)原位液体1H NMR分析了丙烯酸丁酯的乳液聚合过程,通过跟踪丙烯酸丁酯(双键,δH 6.5)和聚丙烯酸丁酯(δH 2.1)的信号强度计算得到聚合速率常数,从而阐明该体系的动力学模型.反应温度设置为70 ℃以下,反应体系由单体(丙烯酸丁酯)、乳化剂(十二烷基苯磺酸钠)、缓冲剂(碳酸氢钠)和引发剂(过硫酸铵)组成,各组分按照一定比例加入流动池.由于循环延迟时的流动效应导致注入乳液的有效弛豫时间小于静态弛豫时间,因此可以按照静态NMR实验设置参数.采用单脉冲序列,90°脉冲宽度为7.5 μs,采集时间为400 ms,循环延迟为0.9 s,扫描32次,每两张谱图之间相隔60 s,反应总时间为130 min.在反应过程中随着联合物分子量的增加,分子的运动模式发生改变,翻转频率减小.运动性降低导致邻近质子的有效或者残存的偶极耦合作用增强.由于线宽与横向弛豫速率相关,且随着偶极耦合作用增强而增加.因此,可基于1H NMR线宽跟踪聚合产物的增长过程.如图 2所示,原位液体1H NMR跟踪监测得到的转化率随时间的变化曲线可分为三个不同的速率区间.在H2O与D2O中,转化率为0~15%区间对应的速率常数为0;15~52%区间为反应时间,聚合发生在胶束内;而转化率大于52%后,聚合物的分子量几乎不再增加,因此该乳液聚合为介于零级与一级反应之间的动力学模型.
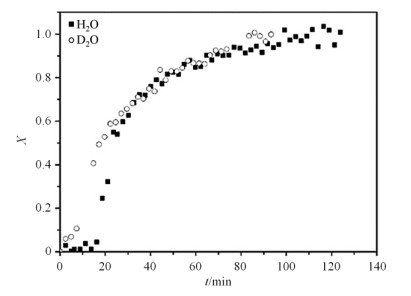
|
图 2 不同溶剂中,丙烯酸丁酯的脂肪族特征峰转化率(X)随反应时间的变化[30] Fig. 2 The conversion (X) of the specific aliphatic signal changes with reaction time during butyl acrylate polymerization with water and D2O as solvents[30] |
自由基聚合是最常见的制备聚合物的技术[31],然而应用原位液体NMR技术对其进行表征却存在很多困难:(1)快速形成高分子聚合物,峰型变宽,丧失了1H NMR窄峰精细化的优势;(2)体系粘度随着聚合物分子量增加而增加,有时体系相态还会发生变化;(3)分子量分布太宽导致聚合物的端基、支链官能团信号在NMR谱图中很难同时被捕捉到;(4)反应速率太快,在匀场、锁场、脉冲参数设置完成前,反应已经进行到一定程度.因此,原位NMR技术通常不适于表征自由基聚合体系.为了克服由自由基聚合动力学引起的表征困难,郑安呐等[32]发明了活性自由基聚合(Living Radical Polymerization,LRP)实验,例如阳离子聚合或阴离子聚合.LRP是一种链增长过程,不包含链终止和链转移反应,避免了自由基聚合过程中分子量过宽、反应速率太快等问题.但是常见的LRP实验条件太过苛刻,且适用该体系的单体种类太少,又过分依赖含有顺磁性分子的引发剂体系,因此原位液体NMR仍然不适合作为聚合动力学表征的通用手段.
为了解决适用LRP体系的单体过少的问题,有研究者发明了活性/可控自由基聚合技术.2012年,国际理论(化学)与应用化学联合会(IUPAC)建议将活性/可控自由基聚合命名为可逆-失活自由基聚合(Reversible-Deactivation Radical Polymerization,RDRP)[33],避免了与活性自由基聚合混淆.可逆加成断裂链转移聚合(Reversible Addition-Fragmentation Transfer Polymerization,RAFT)[34]属于RDRP.RAFT聚合[35]过程存在可逆终止或者可逆失活,通过将自由基变成暂时失活的休眠种降低反应速率和自由基的浓度,以达到实验可控的目的[36].与其它聚合方法相比,RAFT具有聚合反应条件温和、单体适用性高等优点,因此可以利用原位液体NMR技术进行表征.RAFT聚合的可控主要体现在反应初期,而在主平衡阶段由于链长增加导致的峰型变化则难以区分.链转移剂(Chains Transfer Agents,CTA)的存在也会导致RAFT中间体不确定.而且共聚单体的竞聚率差异和带电形式的不同会产生共聚选择性,此外体系内各组分相互作用产生的诱导期与聚合延迟现象也会导致动力学行为发生偏差等问题.因此,目前一些研究者仅利用原位液体NMR技术研究RAFT聚合初期过程.
2.2.1 原位液体NMR技术用于研究RAFT均聚RAFT均聚使用硫代羰基硫代化合物作为CTA,聚合单体只有一种.反应时引发剂将单体活化为初级自由基,被CTA捕捉形成休眠种,然后通过可逆平衡变为活性种.活性中心在具有高转移常数的CTA作用下实现增长链和中间自由基之间的快速加成-断裂平衡过程[37].Vana等[38]提出RAFT聚合过程存在阻聚作用和速率延阻现象,可利用原位液体1H NMR技术跟踪苯乙烯(Styrene,St)的RAFT均聚.McLeary等[39]用氰基异丙基二硫代苯甲酸酯(将氰基异丙基简称为D,二硫代苯甲酸酯简称为A,氰基异丙基二硫代苯甲酸酯简称AD)作为CTA调节St的RAFT均聚.通过比较70 ℃与84 ℃下非自由基物种的浓度变化研究由偶氮二异丁腈(2, 2'-Azobis-2-Methylpropionitrile,AIBN)引发的早期动力学行为.由于体系的化学诱导极化作用很小,可以获得很高的信噪比,因此可以对很多强度较小的信号峰进行积分.由图 3可观察到一个St单体插入RAFT试剂后产生一个手性中心,随着单体的不断插入,手性中心也不断增长,其对应峰也以1:1的比例增长.随着二聚体三聚体的产生,手性结构也呈比例增加.图 4显示在反应初期,RAFT试剂(AD)全部消耗完之前,体系中没有聚合度大于1的低聚物生成,单体被引发剂AIBN活化后就被CTA“捕捉”,St自由基插入D的叔碳键与A的硫原子之间,生成第一单体加成物AStD,而非进行链增长.引发阶段St的被捕捉速率大于RAFT的平衡速率,由于含有叔碳基团的D的稳定性在多种中间态自由基中最高,因此对于单体具有高度选择性.实验进行50 min后,RAFT试剂完全消耗,此时可观察到苯乙烯二聚体ASt2D的NMR信号.因此RAFT试剂消耗完之前的时期称为RAFT聚合的引发时期.原位1H NMR实验证实该阶段聚合具有高度选择性,而非阻聚效应.随着实验进行,积分强度显示分子量和转化率都随着时间线性增长,符合RDRP动力学行为.
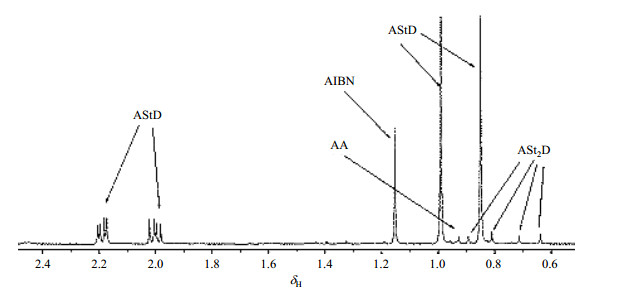
|
图 3 70 ℃下引发阶段结束时,δH 0.5~2.5区域的原位1H NMR谱图. AStD是第一单体加成物;ASt2D是苯乙烯二聚体;AA是两个氰基异丙基自由基之间的终止反应的产物;AIBN是引发剂偶氮二异丁腈[39] Fig. 3 The in operando 1H NMR spectrum with the region of δH 0.5~2.5 after initialization at 70 ℃. AStD represents the styrene adducts of the cyanisopropyl and dithiobenzoate; ASt2D represents the dimer of styrene; AA represents the product of the termination reaction between two cyanisopropyl radicals; AIBN is the initiator——2, 2'-azobis-2-methylpropionitrile [39] |
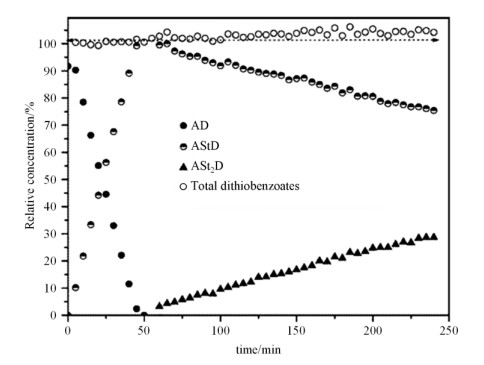
|
图 4 70 ℃在CTA调控下,二硫代苯甲酸酯类中甲基质子的相对浓度与时间的关系曲线[39] Fig. 4 The relationship between the relative concentrations of methyl protons in dithiobenzoate species and reaction time in the presence of CTA[39] |
为了研究中间自由基的信号不能被捕捉到是因为反应过程中发生的终止反应导致其NMR信号不能被采集,还是由于其稳定性低于叔碳自由基而不能稳定的存在于体系中.Calitz等[40]设计在84 ℃下使用枯基二硫代苯甲酸酯(Cumyl Dithiobenzoate,CDB)作为CTA,用超出常规浓度的引发剂与CDB进行RAFT合成低聚物,这样可以一直保持较低的增长自由基浓度.结合原位液体13C NMR定性分析与无畸变极化转移增益法(Distortionless Enhancement by Polarization Transfer,DEPT)观察中间自由基的终止过程.通过对二硫酯上的碳原子进行标记,检测到了常规浓度RAFT聚合检测不到的中间体.实验结果表明,虽然将中间体产物的信号强度提高了88倍,但是信号强度依然很弱.通过峰的归属分析,发现中间体一般以交叉终止形式生成三臂或四臂低聚物,但在正常的RAFT聚合配比下,这一产物的浓度低于仪器的检测线,这也证明了RAFT聚合在反应初期具有高度选择性.
除了探究反应初期的动力学,Zheng等[41]利用原位液体1H NMR技术研究了溶剂效应对RAFT聚合过程动力学的影响.选择单体为4-乙烯基吡啶(4-Vinylpyridine, 4-VP),加入小于10%单体含量的交联剂——二乙烯基苯(Divinylbenzene,DVB),引发剂为AIBN,选择二硫代苯甲酸酯封端的聚苯乙烯(Polystyrene,PSt)作为大分子链转移剂(macroCTA)调节RAFT聚合,溶剂分别为四氢呋喃(Tetrahydrofuran,THF)与环己烷.结果发现在不同溶剂下RAFT聚合过程动力学行为完全不同.4-VP在THF中产生凝胶,反应5 h后体系粘度增加,逐渐变得不透明.而由于环己烷是PSt与聚4-乙烯基吡啶的良好溶剂,因此体系一直呈透明溶液状态.对原位液体1H NMR谱图进行积分得到的动力学曲线不符合RAFT聚合速率与时间以及转化率与分子量的线性关系.这是由于在超过临界溶解聚合度后,4-VP嵌段部分开始聚集,形成具有核壳结构的胶束,导致了随着聚合度增加,体系相态发生变化,从而导致单体发生聚合的位置发生改变,因此动力学曲线在反应5 h时出现了拐点,表明在聚合物的不良溶剂中可以发生自组装现象.
2.2.2 原位液体NMR技术用于研究RAFT共聚RAFT共聚[42]是在RAFT均聚基础上引申出的聚合方法,可以将两种及以上的单体进行聚合,是制备嵌段、星形、接枝共聚物常用手段,但是聚合机理更加复杂,涉及到CTA对于单体的选择性差异、调控共聚物微观组成、聚合物功能化等问题.利用原位液体1H NMR和13C NMR技术主要研究嵌段聚合物合成过程中动力学模型分析等问题.
St和马来酸酐(Maleic Anhydride,MAh)在共聚时主要遵循两种动力学模型:倒数第二单元模型(Penultimate Unit,PU)[43]和电子转移模型(Charge Transfer Complex,CTC)[44].PU模型假设共聚是一种或两种共聚单体具有更强的极性取代基,则聚合物自由基的反应性可能受到倒数第二个插入单体的影响.CTC模型认为富电子单体与缺电子单体在共聚时会组成电子复合物.Du等[45]利用电子自旋共振(Electron Spin Resonance,ESR)发现,当用苄基二硫代苯甲酸酯为CTA调节等摩尔量的MAh与St共聚合时,链增长表现为CTC形式.Zhu等[46]通过一锅煮的方法将St与MAh一步法RAFT共聚,同样也提出CTC模型理论.两个团队都认为这是由于St是富电子单体,MAh是缺电子单体,因此它们在溶液中以电子复合物CTC中间体形式形成共聚自由基.
但Van Den Dungen等[47]选择2-氰基丙-2-基二硫代苯甲酸酯(2-Cyanoprop-2-yl Dithiobenzoate,CIPDB)和CDB作为CTA调节St与MAh共聚,利用原位液体1H NMR研究动力学行为及嵌段组成时,实时跟踪反应体系自由基变化结果表明St与MAh的RAFT共聚不是CTC模型.首先在70 ℃下用CIPDB调节等摩尔比的St与MAh的RAFT共聚,引发剂为AIBN,溶剂是氘代苯.图 5示出离去基团甲基区域(δH 0.7~1.6)的原位液体1H NMR谱图.可以发现,在聚合引发阶段,与RAFT均聚相同,体系具有极强的选择性.St作为第一单体加成物,在RAFT试剂消耗完之前,体系内只有聚合度为1的St加成物,MAh在此实验条件下无法均聚.而在RAFT试剂(CIPDB)完全消耗后,由于St自由基活化MAh的速率常数远大于活化St自身,因此实验进行到30 min才形成St与MAh二聚体(St-MAh).随后MAh的增长速率越来越快,St则开始变慢,这在三聚体St-MAh-St出现之前达到极值.之后两者的增长速率趋相同.因此St与MAh是严格交替共聚.这一点通过TOCSY实验得到验证.而通过原位液体1H NMR研究发现,以CDB作为CTA引发共聚时,在其消耗完之前,体系中只有MAh单体聚合度为1的加成物,如图 6所示,CDB对于MAh的具有高度选择性,表明第一单体是MAh;CDB消耗结束,St才开始消耗.在形成二聚体MAh-St后,两单体消耗增长速率差达到极值,三聚体MAh-St-MAh生成后两单体的聚合速率区域相同,同样形成严格交替的共聚.两者在有机溶剂中易形成为PU模型.在上述实验中,CDB的离去基团是亲核的,它充当MAh的电子供体;而CIPDB的离去基团是亲电的,充当St的电子受体,所以观察到不同CTA对于第一单体的选择性不同.但是不论是St还是MAh,在CTA消耗完之前都只存在聚合度为1的加成物.因此选择正确的CTA可以提高共聚引发速率,调控链段末端.原位1H NMR结合二维谱研究立体构型还发现,用CIPDB作为CTA调节St与MAh共聚时,在反应初期,St插入CTA后产生手型结构,这与均聚结果相同.
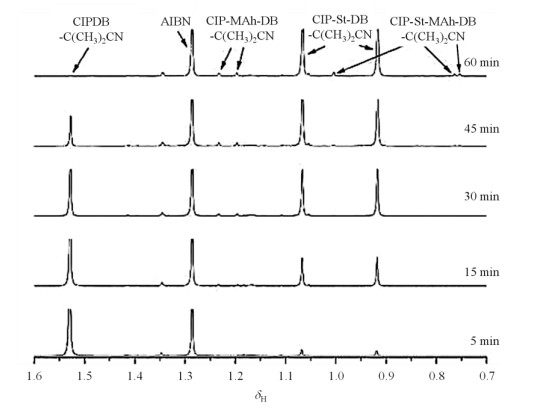
|
图 5 70 ℃下CIPDB调节St和MAh共聚时,离去基团DB-C(CH3)2CN甲基区域(δH 0.7~1.6)的原位1H NMR谱图[47] Fig. 5 The enlarged in operando 1H NMR spectra of the methyl proton (δH 0.7~1.6) in the leaving group DB-C(CH3)2CN during CIPDB-mediated St and MAh copolymerization at 70 ℃[47] |
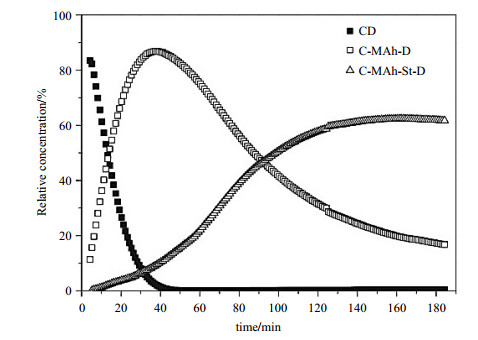
|
图 6 原位液体1H NMR追踪60 ℃下CDB调节St和MAh共聚合时,各产物相对浓度随时间变化曲线.CD代表初始CTA,C-MAh-D和C-MAh-St-D分别是第一和第二单体加合物[47] Fig. 6 Relative concentration of the products change with the reaction time during CDB-mediated St and MAh copolymerization at 60 ℃ by in operando 1H NMR spectroscopy. CD represents the initial CTA; C-MAh-D and C-MAh-St-D are the first and second monomer adducts, respectively[47] |
刘娜等[48]选择S-正十二烷基-S'-甲基丙酸基三硫代碳酸酯为CTA,溶剂为氘代丙酮,在四种温度下选用AIBN为引发剂一锅煮进行St与MAh的RAFT共聚,St和MAh的摩尔浓度比为2:1.在共聚阶段与Van Den Dungen等[47]报道的选择性与动力学相同.不同的是刘娜等人加入了过量的St,因此在St与MAh共聚结束后形成P(St-alt-MAh).但是该共聚物仍然具有活性,可以作为macroCTA引发St均聚,最后得到P(St-alt-MAh)-b-PSt两嵌段共聚物.通过原位液体1H NMR得到四个温度下的动力学曲线,并通过计算各自的活化速率得到此实验条件下的反应聚合活化能E=141 kJ/mol,高于同实验条件下的自由基聚合活化能(E=72.1 kJ/mol),推测可能是由于离去基团的空间位阻较大造成的.因此通过RAFT聚合可以一锅煮制备嵌段共聚物.
郭鸣明[49]结合原位液体1H NMR与DOSY实验,在室温下选择偶氮二咪唑啉基丙烷二盐酸盐为引发剂、水溶性羧基封端三硫酯为CTA,采样两步法进行4-丙烯酰吗啉(4-Acryloylmorpholine,AML)与丙烯酸(Acrylic Acid,AA)的RAFT共聚.在AML完全消耗完后加入第二单体AA,利用DOSY分析扩散系数发现AA消耗完后,体系内扩散系数很大的只有水分子,无任何单体均聚物,证实成功制备了PAML-b-PAA-b-PAML双亲性三嵌段共聚物.
虽然RAFT聚合体系没有其他RDRP那么复杂,但实验中间过程却十分复杂,改变CTA、单体种类、共聚温度和引发剂浓度都会在很大程度上改变反应进程,因此利用原位液体NMR技术进行反应跟踪可以优化实验步骤,利于制备目标聚合物.
3 原位液体NMR技术与其他仪器或技术联用仪器或技术联用已经成为分析领域的研究热点,常见的联用表征手段有红外-热重联用[50]、气相色谱-质谱联用[51]等.NMR存在灵敏度低等缺陷,与其他仪器或技术联用,可以使得聚合物表征精确度得以提升.
3.1 原位液体NMR与色谱技术联用在高分子共聚物组成分析领域,原位液体NMR技术最早用于检测聚丙烯的等规指数[52],通过对1H NMR谱图中的特征峰进行多次归一化积分取平均值,以消除手动积分产生的误差,得到聚合物微观组成;然后,利用等规指数反推聚丙烯的结晶程度.随着共聚物结构的复杂化,共聚物与共混物组成的多元化,原位液体NMR与色谱技术的联用已经在共聚物共混物化学组成分析领域应用得越来越广泛[53].原位液体NMR与色谱联用时,经色谱分离后的待测样品随流动相直接流入NMR谱仪.色谱流动相使用价格昂贵的氘代试剂会极大的增加检测成本,但在原位NMR实验中使用非氘代试剂会引起灵敏度降低、溶剂信号与目标峰重叠等问题,而且不同体积和不同流速的色谱流动相对应的最优NMR检测参数不同等一系列冲突,导致色谱仪和NMR检测探头都要进行相应改造和优化.本小节将简要阐述这种表征手段的具体应用及相应问题的解决办法.
原位高效液体色谱-核磁共振波谱(High Performance Liquid Chromatography-Nuclear Magnetic Resonance,HPLC-NMR)联用使用的垂直流动池[54]如图 7(a)所示,NMR探头为固定的双鞍式亥姆霍兹线圈,并配有热电偶,因此可以进行变温实验.“反向”连续流动探头包含一个额外的同轴线圈与13C核共振频率匹配,围绕1H检测线圈,可以进行异核1H/13C相关脉冲实验.然而,流动池的体积较大,需要的洗脱溶剂较多,色谱分辨率较低.大多数HPLC采用反相模式,多使用二元溶剂,如乙腈/水或甲醇/水,作为流动相.由HPLC进入NMR谱仪中的溶剂与待测样品的信号强度比约为10000:1,需要使用溶剂抑制技术压制溶剂信号.将色谱分离的待测样品的保留时间设为Y轴、原位1H NMR测量的化学位移作为X轴,峰强度以等高线形式表示,绘制待测样品特征峰的等高线二维谱.原位1H NMR谱图采集的时间间隔与色谱保留时间的比值作为时间分辨率.由于色谱仪的分离时间较短,因此要求样品浓度较高,这样原位NMR才能在采样次数较少时获得信噪比较高的谱图.也可以通过在色谱仪与NMR之间设置一个切换阀,当流动相中的浓度较低时,将溶液储存起来,而非直接进入NMR谱仪,并将原位NMR检测改为离线NMR检测,对原位NMR的检测结果进行验证.
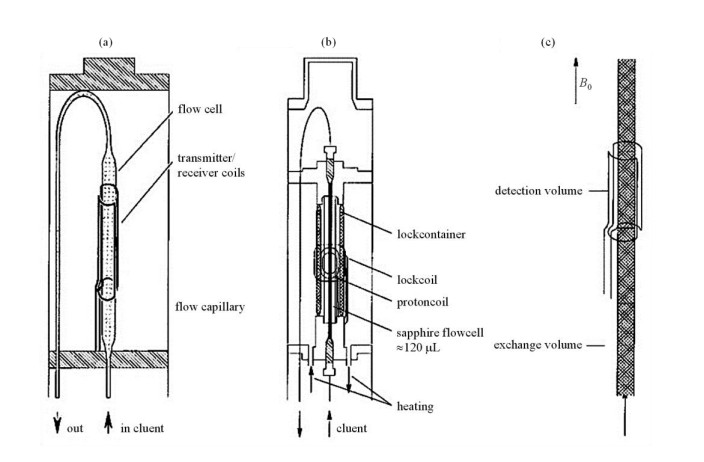
|
图 7 适用于(a) HPLC-NMR、GPC-NMR[54],(b) SFC-NMR[60]和(c)毛细管HPLC-NMR[61]联用系统的连续流动NMR探头 Fig. 7 The designed continuous-flow NMR probes suitable for (a) HPLC-NMR and GPC-NMR[54], (b) SFC-NMR[60], and (c) capillary HPLC-NMR[61] coupling systems |
Hiller等[55]用临界点液相色谱(Liquid Chromatography at Critical Conditions,LCCC)与原位1H NMR偶联来分析PSt和聚甲基丙烯酸甲酯(Polymethyl Methacrylate,PMMA)的共混物以及它们的共聚物(PSt-co-PMMA).在PSt的色谱临界点将其和PMMA分离;共聚物中甲基丙烯酸甲酯(Methyl Methacrylate,MMA)嵌段的链长按照尺寸排斥体积理论进行分离.因此利用原位LCCC-NMR系统可同时测量质量分布、化学组成分布和微观结构.原位1H NMR采集使用反向检测探头,配有屏蔽脉冲场梯度线圈,用WET抑制溶剂的质子信号,PMMA嵌段部分特征峰的α-CH3与PSt嵌段部分的芳香族质子不受溶剂抑制的影响.因此通过绘制保留时间-化学位移二维谱可以直接确定化学组成分布,同时计算PMMA的立体构型.在此分离条件下,共混物中最先出峰的是共聚物PSt-co-PMMA,然后是PMMA,最后是PSt.分析在不同洗脱时间下的原位1H NMR谱图,发现共混物中的PMMA摩尔质量越高,则分离的越早.由于共聚物中MMA嵌段部分链长与共混物中的PMMA链长不同,可以利用尺寸排斥体积理论将两者区分,从而分析共聚物真实化学组成,而不是直接测量共聚物的PMMA平均摩尔质量.Hiller等[56]又利用LCCC测量了同样的共混物,但更换了洗脱溶剂,却得到了同样的实验结果.由此可见,利用原位LCCC-NMR可以直接定量、定性分析嵌段共聚物的真实化学组成与摩尔质量分布.
在此基础上,Hiller等[57]利用尺寸排斥色谱(Size Exclusion Chromatography,SEC)-原位1H NMR联用(SEC-NMR)系统表征了阴离子聚合物PSt-co-PMMA、PSt和PMMA共混物的摩尔质量参数:重均分子量MW、数均分子量MN和峰值分子量MP,也测定了均聚物与共聚物的摩尔质量分布.原位1H NMR实验在500 MHz仪器上进行,90°脉冲宽度为7 μs.作者测定了不同流速、循环延迟和脉冲角度下的T1,结果显示T1随着流速增加而减小.由于PSt芳香质子的τ值比间同结构PMMA的τ值更接近理论τ值.因此选择PSt的τ值作为参数进行实验设定.但是PMMA的T1相对于PSt短很多,不适用小角度脉冲和过长的延迟时间.因此作者选择使用90°脉冲与0.69 s的延迟时间以兼顾PSt与PMMA的T1,在这种条件下采集的该体系的NMR谱图分辨率最高.通过绘制保留时间-化学位移二维谱,可以清晰的观察到St的芳香环质子与PMMA的全同、间同以及无规的α-CH3信号.并获得其归一化积分面积,从而判断混合物的摩尔质量组成,再对摩尔质量加权即可测得数均分子量和重均分子量.通过分析MMA中的α-CH3峰得出PMMA嵌段部分的微观结构包含全同、间同以及无规三种,但是不同的化学组成对于PMMA嵌段的摩尔质量却没有影响,因此得出MMA的聚合是线性增加的过程,自由基的活性没有随着反应而改变.这与使用Li+作为缓冲离子的极性溶剂进行聚合得到间同结构PMMA的离线1H NMR表征结果相似[58].
Hiller等[59]还将LCCC与液体吸收色谱(Liquid Adsorption Chromatography,LAC)联合为二维色谱.通过LCCC对基团的选择性将具有不同末端基团的聚环氧乙烷(Poly Ethylene Oxide,PEOs)分离;之后基团相同的PEOs进入LAC,对不同链长的分子链进行分离;最后,经二维色谱分离得到的不同组分流入NMR中,通过原位1H NMR获得定量的摩尔组成分布与化学组成信息.该工作选用质子化的水与乙醇混合溶剂溶解PEOs,抑制了溶剂峰的同时,也没有影响聚合物特征峰.
Albert等[60]将超临界流体色谱(Supercritical Fluid Chromatography,SFC)与NMR联用.将流动池改为直径为5 mm的蓝宝石NMR管,检测体积为120 μL,探针用钛管代替聚四氟乙烯(Poly Tetra Fluoroethylene,PTFE)毛细管,固定在流动池外的双调谐氘代质子线圈上,如图 7(b)所示.不同于其它色谱-NMR联用,在原位SFC-1H NMR实验中,常用超临界CO2作为非质子溶剂代替非氘代溶剂,但是需要精确控制压力.SFC探针的出口不直接连接色谱仪,而是连接到背压调节器以保证检测池中的超临界条件.在321 K和165 bar的实验条件下,作者采集了五种增塑剂的保留时间-化学位移的二维谱,在不同时间洗脱的增塑剂都具有不与溶剂信号产生重叠的特征峰.值得注意的是,由于梯度压力场的存在导致弛豫时间发生变化,每条FID最多扫描16次.
Schlotterbeck等[61]用原位毛细管HPLC-NMR表征St与丙烯酸酯的共聚物化学组成与分子量之间的关系.使用250*40 mm的色谱柱,以二氯甲烷作为洗脱液,在0.4 mL/min的流速下对浓度为7.5%的100 μL共聚物溶液进行分离.原位1H NMR检测时将180 μm内径的熔融石英毛细管直接插入2.0 mm微探头中,在NMR射频线圈内产生200 nL的检测体积,装置如图 7(c)所示.毛细管HPLC-NMR整体联用分析仅需要几毫升氘代试剂,避免了用氘代试剂作为流动相时成本过高的问题.
凝胶渗透色谱(Gel Permeation Chromatography,GPC)-原位NMR联用(GPC-NMR)系统使用的NMR探头与HPLC-NMR相同.GPC-NMR可以用来直接表征共聚物与聚合物共混物,降低峰值色散效应对GPC的影响.Hiller等[62]使用高温GPC-NMR联用技术,表征聚烯烃的共聚物以及共混物的组成.由于聚烯烃的半结晶性,原位液体1H NMR实验温度在100 ℃以上.在GPC与NMR连接处加入截留阀,用于原位NMR与离线NMR检测切换.通过绘制化学位移-保留时间二维谱,得到和洗脱顺序对应的特征峰的化学位移.在共混物PE (1100 g/mol)+PMMA+PE-b-PMMA[PE为聚乙烯(Poly Ethylene)]中最先洗脱的是摩尔质量最高的PMMA,随后是PE-PMMA的共聚物,最后是低摩尔质量的PE.共混物PE (60 000g/mol)+PMMA+PE-b-PMMA也是按照摩尔质量从高到低的顺序洗脱的.由于色谱柱的轴向分散,不同摩尔质量的聚合物NMR信号会有部分重叠,导致谱图分辨率降低.而且GPC是根据流体力学体积,而不是严格的摩尔质量洗脱,因此在单张原位1H NMR谱中会观察到不同信号的特征峰.选取聚合物特征峰信号最强的1H NMR谱进行微观组成分析,发现PMMA为全同结构,PE-co-PMMA中MMA嵌段也为全同结构.虽然PE的端甲基(δH 0.86)信号也可以采集到,但是信噪比较低,不能精确计算摩尔组成.为了区分δH 1.3附近乙烯的CH2与MMA的α-CH3,通过异核单量子相干检测(Heteronuclear Single Quantum Coherence,HSQC)对于重叠峰进行分离可对各个峰进行归属,最后计算得出所有共聚物的化学组成.
以上部分证实原位NMR与色谱联用在分离聚合物并剖析其结构方面有着天然的优势.
3.2 原位液体NMR技术与色谱之外的仪器联用原位核磁共振波谱电化学技术(in situ NMR Spectroelectrochemistry)是一种新兴的仪器联用手段.Cao等[63]将原位液体NMR与电化学相结合,跟踪循环伏安法中电位扫描过程中的分子结构变化,设计了对苯二醌体系的氧化还原过程在双室薄层电解池装置.Bussy等[64]利用原位核磁共振波谱电化学技术跟踪非那西丁的电化学氧化的反应途径,跟踪在电还原中的π键的聚合过程,在不使用自由基捕捉技术的情况下检测到了中间体醌亚胺,特征峰的积分结果显示在电氧化过程,醌亚胺是作为前驱体与氧化剂.
Beweries等[65]结合原位液体1H NMR与紫外-可见吸收光谱(Ultraviolet and Visible Spectrophotometry, UV Vis)研究金属环戊烷的形成.饱和金属环(如金属环戊烷或金属环庚烷)在乙烯的低聚反应中可以直接将乙烯聚合为直链烯烃,第4族金属的金属环络合物用作该反应的活性催化剂,因此研究金属环化物的形成具有重要意义.原位液体1H NMR与UV Vis联用证明了含有第四主族金属的二茂钛炔烃络合物与乙烯的反应过程.通过原位跟踪发现去除乙烯之前体系内存在稳定的锆环丙烯,并且研究了二茂钛炔烃络合物与烯烃的聚合过程,证明了存在双π键络合物的中间体.
Favier等[66]将原位傅里叶变换-近红外(Fourier Transform-Near Infra-Red,FT-NIR)和液体1H NMR进行联用对AIBN引发的醋酸乙烯酯聚合反应进行了表征,选择O-异丙基黄原酸酯作为CTA,在60 ℃下进行RAFT聚合.不同于之前讨论过的St,醋酸乙烯酯是一种高活性单体,易受杂质影响,所以在聚合过程中可能会出现阻聚与延迟效应交替出现的现象[67].阻聚过程由阻聚剂浓度,以及自由基极性和浓度决定.为了定量分析该体系聚合过程的动力学,选择内标含有三恶烷的氘代氯仿作为定量基准,并建立转化率与时间的函数关系.原位FT-NIR分辨率设置为4 cm-1,扫描区域为8 000~4 000 cm-1,12次扫描叠加干涉,每隔7.5 min扫描一次,反应持续6 h.原位FT-NIR与1H NMR联用的表征结果证实聚合进行至5 h后,转化率达到90%,无任何阻聚诱导现象;但是转化率达到50%时,体系产生自动加速现象;转化率达到40%后,分子量趋于稳定;使用RAFT产生的聚合物分子量分散指数(Polydispersity Index,PDI)通常在1~1.3之间,但是该反应在转化率达到80%后,PDI达到1.5,这是由于醋酸乙烯酯自由基的活性很高,CTA浓度下降引起的其捕捉自由基能力的下降导致产生了大量的醋酸乙烯酯低聚物.O-异丙基黄原酸酯具有稳定的Z基团二硫代苯甲酸酯,作为CTA可以充分活化C=S键,并且保证单体插入CTA的速率与聚合增长速率足够快,将中间体的量控制到最小[68],提高中间自由基的浓度,从而放大阻聚与延迟效应,便于跟踪体系中的杂质对于体系的影响.使用高断裂系数的CTA可以有效减少速率延迟效应.进一步设计对比实验发现,在不去氧的情况下进行原位跟踪,速率延迟效应明显且PDI明显增加.但是由于温度与溶剂都会改变氧气在体系中的含量,因此实验结果很难重复.使用未纯化的CTA会导致阻聚效应重复出现,使得聚合物的分子量降低.这也取决于CTA副产物的性质,若是该硫化物为不可逆转移剂,则对于分子量影响显著,而对于动力学模型影响较小,对于可逆硫化物反之亦然.此外,通过改变引发剂与CTA的浓度比例发现,引发剂的比例越小,对应产物的分子量越大,分子量与PDI与理论值贴合.这是因为RAFT聚合物链的数目多由CTA决定.对于醋酸乙烯酯这种高活性单体,引发剂减少还可以降低双基终止.
3.3 原位液体NMR仪器的改造对于NMR仪器本身的改造也使得原位液体NMR研究变得更加便利.王虎[4]利用原位液体1H NMR跟踪光引发RAFT聚合,将紫外-可见光引入与NMR探头内部,选择S-正十二烷基-S'-甲基丙酸基三硫代碳酸酯作为CTA,高选择性的调节St与MA的均聚过程,发现聚合过程中反应时间与转化率呈线性关系,遵循RAFT反应动力学模型,最终产物的PDI在1.2左右.另外,还进一步研究了不同溶剂对于MA的RAFT聚合过程影响:在氘苯中进行聚合,CTA上的亚甲基质子和单体中双键上质子的积分区域发生重叠;当溶剂换为氘代氯仿后,对于单体的选择性更好,分辨率也大大提升;而将氘代氯仿改为氘代二甲基亚砜后,RAFT聚合选择性下降,CTA消耗完之前,聚丙烯酸甲酯已经存在,这是由于单体受到二甲基亚砜极化作用后被引发活化能的降低进而自身裂解生成自由基,或者溶剂本身光照下产生自由基引发单体,因此不再遵循RAFT聚合机理,可以观察到热引发聚合时无法观察到的现象.
4 结论与展望不论是研究聚合反应动力学、描述反应机理,还是阐述聚合物微观结构,原位液体NMR都具有独特的优势.而且,通过与其他仪器或技术的联用,原位液体NMR技术可更全面、更精确的对聚合物进行表征,这对于高分子材料的制备、加工与改性具有指导意义.
目前,制约原位液体NMR更加广泛应用的因素依然是分辨率与灵敏度.随着NMR技术不断的改进和优化,例如超高场磁体技术的日趋成熟、动态核极化技术(Dynamic Nuclear Polarization,DNP)的发展、探头的改进以及样品处理手段的优化等等,将会进一步扩展原位液体NMR技术在高分子领域的应用,例如刺激响应性的聚合物凝胶和网络、界面和密闭环境中的聚合物、聚合物离子导体、传感器和信息处理器、用于药物递送和生物医学装置的大分子系统等.
| [1] | RABI I I, ZACHRIAS J R, MILLMAN S, et al. A new method of measuring nuclear magnetic moment[J]. Phys Rev, 1938, 53(4): 318. |
| [2] | THE NOBEL FOUNDATION. Nobel lectures including presentation speeches and laureates' biographies-physics 1942-1962[M]. Amsterdam: Elsevier Publishing Company, 2013: 20. |
| [3] | ERNST R R, ANDERSON W A. Application of Fourier transform spectroscopy to magnetic resonance[J]. Rev Sci Instrum, 1966, 37(1): 93-102. DOI: 10.1063/1.1719961. |
| [4] | 王虎.光引发活性自由基聚合反应的原位核磁跟踪研究[D].合肥: 中国科学技术大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10358-1014139712.htm |
| [5] | AlAM T M, ALAM M K. Chemometric analysis of NMR spectroscopy data: A review[J]. Annual Reports on NNR Spectroscopy, 2004, 54: 41-80. DOI: 10.1016/S0066-4103(04)54002-4. |
| [6] | CONSONN R, CAGLIANI L R. Geographical characterization of polyfloral and acacia honeys by nuclear magnetic resonance and chemometrics[J]. J Agri Food Chem, 2008, 56(16): 6873-6880. DOI: 10.1021/jf801332r. |
| [7] |
DENG F, XIAO L Z, TAO Y, et al. Low-field and on-line NMR detection for fluid molecular structure[J].
Chinese J Magn Reson, 2017, 34(2): 91-99.
邓峰, 肖立志, 陶冶, 等. 低场核磁共振流体分子结构在线探测技术[J]. 波谱学杂志, 2017, 34(2): 91-99. |
| [8] | UEKI R, YAMAGUCHI K, NONAKA H, et al. H-1 NMR probe for in situ monitoring of dopamine metabolism and its application to inhibitor screening[J]. J Am Chem Soc, 2012, 134(30): 12398-12401. DOI: 10.1021/ja305051u. |
| [9] | HAW J F. In-situ spectroscopy in heterogeneous catalysis[M]. Wiley-VCH Verlag GmbH & Co. KGaA, 2004. |
| [10] | EMSLEY L. Advances in magnetic resonance: from stem cells to catalytic surfaces[J]. J Am Chem Soc, 2013, 135(22): 8089-8091. DOI: 10.1021/ja404269a. |
| [11] | 张正行. 有机光谱分析[M]. 北京: 人民卫生出版社, 2009. |
| [12] | 陈厚. 高分子材料分析测试与研究方法[M]. 北京: 化学工业出版社, 2011. |
| [13] |
FENG Y X, CHU X L, XU Y P, et al. Process nuclear magnetic resonace technology and its applications[J].
Modern Scientific Instruments, 2013(6): 109-109.
冯云霞, 褚小立, 许育鹏, 等. 在线核磁共振过程分析技术及其应用[J]. 现代科学仪器, 2013(6): 109-109. |
| [14] | 宁永成. 有机波谱学谱图解析[M]. 北京: 科学出版社, 2010. |
| [15] | NAJAFI V, ZIAEE F, KABIRI K, et al. Aqueous free-radical polymerization of PEGMEMA macromer: kinetic studies via an on-line H NMR technique[J]. Iran Polym J, 2012, 21(10): 683-688. DOI: 10.1007/s13726-012-0072-8. |
| [16] | HEROLD H, HARDY E H, RANFT M, et al. Online Rheo-TD NMR for analysing batch polymerisation processes[J]. Micropor Mesopor Mat, 2013, 178(13): 74-78. |
| [17] | HANSEN M R, GRAF R, SPIESS H W. Solid-state NMR in macromolecular systems: insights on how molecular entities move[J]. Accounts Chem Res, 2013, 46(9): 1996-2007. DOI: 10.1021/ar300338b. |
| [18] | WALTER E D, QI L, CHAMAS A, et al. Operando MAS NMR reaction studies at high temperatures and pressures[J]. J Phys Chem C, 2018, 122(15): 8209-8215. DOI: 10.1021/acs.jpcc.7b11442. |
| [19] |
ZHANG X Q, PAN Y J, LI Y. The application of NMR on hign molecular polymers[J].
Modern Scientific Instruments, 2001(6): 29-33.
张雪芹, 潘远江, 李杨. 核磁共振方法在高分子聚合物方面的应用[J]. 现代科学仪器, 2001(6): 29-33. DOI: 10.3969/j.issn.1003-8892.2001.06.009. |
| [20] | SCHNELL I, LANGER B, SONTJENS S H M, et al. Quadruple hydrogen bonds of ureido-pyrimidinone moieties investigated in the solid state by 1H double-quantum MAS NMR spectroscopy[J]. Phys Chem Chem Phys, 2002, 4: 3750-3758. DOI: 10.1039/b203333j. |
| [21] |
LI S, ZHENG J P, GUO M M. In situ variable-temperature multi-nuclear NMR studies of the thermal decomposition mechanism of ionic liquid[J].
Chinese J Magn Reson, 2017, 34(2): 156-163.
李森, 郑俊鹏, 郭鸣明. 离子液体热分解机理的原位变温多核核磁共振研究[J]. 波谱学杂志, 2017, 34(2): 156-163. |
| [22] | ZAHEER M A, ZILL J C, MATYSIK J, et al. In situ and in operando characterization of mixing dynamics in liquid-phase reactions by 129Xe NMR spectroscopy[J]. Chemphyschem, 2017, 18(12): 1513-1516. DOI: 10.1002/cphc.201700080. |
| [23] | STEINRUCK H P, WASSERSCHEID P. Ionic liquids in catalysis[J]. Catal Lett, 2015, 145(1): 380-397. DOI: 10.1007/s10562-014-1435-x. |
| [24] | PERA-TITUS M, LECLERCG L, CLACENS J M, et al. Pickering interfacial catalysis for biphasic systems: from emulsion design to green reactions[J]. Angew Chem Int Ed, 2015, 54(7): 2006-2021. DOI: 10.1002/anie.201402069. |
| [25] |
ZHU Y C, LIU B, XU D Y, et al. Application of nuclear magnetic resonance and its combined technology in qualitative and quantitative analysis of natural products[J].
Modern Pharmmacy and Clinic, 2009, 24(4): 193-197.
朱颖超, 刘斌, 徐冬艳, 等. 核磁共振及其联用技术在天然产物定性定量分析中的应用[J]. 现代药物与临床, 2009, 24(4): 193-197. |
| [26] |
YUAN L, LIU K, BEI F L, et al. Formation mechanism of flower-like nanostructured polyaniline prepared under guidance of L-valine[J].
Acta Polymerica Sinica, 2017, 49(4): 605-615.
袁丽, 刘空, 卑凤利, 等. 原位核磁共振技术考察L-缬氨酸导引下合成花状纳米结构聚苯胺形成机理的研究[J]. 高分子学报, 2017, 49(4): 605-615. DOI: 10.11777/j.issn1000-3304.2017.16206. |
| [27] | WANG R R, WANG C S, LIU K, et al. Nucleation of polyaniline nano-/macrotubes from anilinium composed micelles[J]. J Phys Chem B, 2014, 118(9): 2544-2552. DOI: 10.1021/jp411235u. |
| [28] |
YANG W M, WANG H Q, YAN X Z, et al. NMR study on reaction kinetics of ring-opening polymerization of propylene oxide (PO)[J].
Acta Polymerica Sinica, 1993, 1(4): 456-462.
杨薇蔓, 汪汉卿, 颜星中, 等. 原位核磁研究环氧丙烷的开环聚合反应动力学[J]. 高分子学报, 1993, 1(4): 456-462. |
| [29] | MAIWALD M, FISCHER H H, KIM Y K, et al. Quantitative high-resolution on-line NMR spectroscopy in reaction and process monitoring[J]. J Magn Reason, 2004, 166(2): 135-146. DOI: 10.1016/j.jmr.2003.09.003. |
| [30] | VARGAS M A, CUDAJ M, HAILU K, et al. Online low-field 1H NMR spectroscopy: monitoring of emulsion polymerization of butyl acrylate[J]. Macromolecules, 2010, 43(13): 5561-5568. DOI: 10.1021/ma1006599. |
| [31] |
QIU K Y. Progress of free radical polymerization in recent years[J].
Polymer Bulletin, 2008(7): 15-28.
丘坤元. 自由基聚合近20年的发展[J]. 高分子通报, 2008(7): 15-28. |
| [32] |
ZHENG A N, GUAN Y, WEI D F, et al. Current situation and breakthrough efforts of the anionic polymerization of olefins after the development for 60 years[J].
Journal of Founctional Polymers, 2017(4): 367-421.
郑安呐, 管涌, 危大福, 等. 烯烃阴离子聚合发展60年的现状与释疑的努力[J]. 功能高分子学报, 2017(4): 367-421. |
| [33] | JENKINS A D, JONES R G, MOAD G. Terminology for reversible-deactivation radical polymerization previously called " controlled" radical or " living" radical polymerization (IUPAC Terminology 2010)[J]. Pure Appl Chem, 2010, 82: 483-491. |
| [34] | CHIEFARI J, CHONG Y K, ERCOLE F, et al. Living free-radical polymerization by reversible addition−fragmentation chain transfer: The RAFT process[J]. Macromolecules, 1998, 31(16): 5559-5562. DOI: 10.1021/ma9804951. |
| [35] | GRUBBS R B, GRUBBS R H. 50th anniversary perspective: living polymerization—emphasizing the molecule in macromolecules[J]. Macromolecules, 2017, 50(18): 6979-6997. DOI: 10.1021/acs.macromol.7b01440. |
| [36] |
WEI X L, WEI YL, GONG G B, et al. Applications of controlled radcial polymerization technology in polymer materials synthesis[J].
China Synthetic Rubber Industry, 2016, 39(4): 338-344.
魏绪玲, 魏玉玲, 龚光碧, 等. 可控自由基聚合技术在合成高分子材料中的应用[J]. 合成橡胶工业, 2016, 39(4): 338-344. DOI: 10.3969/j.issn.1000-1255.2016.04.018. |
| [37] | PERRIER S. 50th anniversary perspective: raft polymerization—a user guide[J]. Macromolecules, 2017, 50(19): 7433-7447. DOI: 10.1021/acs.macromol.7b00767. |
| [38] | VANA P, QUINN J F, DAVIS T P, et al. Recent advances in the kinetics of reversible addition fragmentation chain-transfer polymerization[J]. Aust J Chem, 2002, 55(7): 425-431. DOI: 10.1071/CH02042. |
| [39] | MCLEARY J B, CALITZ F M, MCKENZIE J M, et al. Beyond inhibition: A 1H NMR investigation of the early kinetics of RAFT-mediated polymerization with the same initiating and leaving groups[J]. Macromolecules, 2004, 37(7): 2383-2394. DOI: 10.1021/ma035478c. |
| [40] | CALITZ F M, MCLEARY J B, MCKENZIE J M, et al. Evidence for termination of intermediate radical species in raft-mediated polymerization[J]. Macromolecules, 2003, 36(26): 9687-9690. DOI: 10.1021/ma0353787. |
| [41] | ZHENG G H, PAN C Y. Reversible addition−fragmentation transfer polymerization in nanosized micelles formed in situ[J]. Macromolecules, 2006, 39(1): 95-102. DOI: 10.1021/ma0517897. |
| [42] | KEDDIE D J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization[J]. Chem Soc Rev, 2014, 43(2): 496-505. |
| [43] | CHEN S A, CHANG G Y. Kinetics of the copolymerization of styrene with maleic anhydride in ethyl methyl ketone[J]. Macromol Chem Phys, 1986, 187(7): 1597-1602. DOI: 10.1002/macp.1986.021870704. |
| [44] | SANAYEI R A, O'DRISCOLL K F, KLUMPERMAN B. Pulsed laser copolymerization of styrene and maleic anhydride[J]. Macromolecules, 1994, 27(20): 5577-5582. DOI: 10.1021/ma00098a010. |
| [45] | DU F S, ZHU M Q, GUO H Q, et al. An ESR study of reversible addition-fragmentation chain transfer copolymerization of styrene and maleic anhydride[J]. Macromolecules, 2002, 35(17): 6739-6741. DOI: 10.1021/ma0202179. |
| [46] | ZHU M Q, WEI L H, LI M, et al. A unique synthesis of a well-defined block copolymer having alternating segments constituted by maleic anhydride and styrene and the self-assembly aggregating behavior thereof[J]. Chem Commun, 2001, 4(4): 365-366. |
| [47] | VAN DEN DUNGEN E T A, RINQUEST J, PRETORIUS N O, et al. Investigation into the initialization behavior of RAFT-mediated styrene—maleic anhydride copolymerizations[J]. Aust J Chem, 2007, 38(6): 742-748. |
| [48] |
LIU N, GUO M M. Application of in situ in research of RAFT-mediated styrene-maleic anhydride copolymerization[J].
China Synthetic Resin and Plastics, 2018, 35(1): 1-5.
刘娜, 郭鸣明. 用原位核磁研究苯乙烯与马来酸酐的RAFT共聚合[J]. 合成树脂及塑料, 2018, 35(1): 1-5. DOI: 10.3969/j.issn.1002-1396.2018.01.001. |
| [49] | 郭鸣明.原位核磁共振及DOSY研究室温附近RAFT聚合水溶性高分子4-Acryloylmorpholine(AML)及其嵌段共聚物AML-b-AA-b-AML[C]//中国物理学会波谱专业委员会, 第十八届全国波谱学学术年会论文集. 2014. |
| [50] |
LI W, HUANG K, DONG Y Y, et al. Influence study of pyrolysis kinetics and volatile product characteristics of eucalyptus on slagging based on Tg-DTg-FTIR technique[J].
Acta Energiae Solaris Sinica, 2016, 37(12): 3233-3239.
李薇, 黄奎, 董艳艳, 等. 热重-红外联用技术分析桉树热解动力学及挥发产物对结渣影响研究[J]. 太阳能学报, 2016, 37(12): 3233-3239. |
| [51] |
WANG D L, WANG H J, WANG L N, et al. Analysis and comparison of polycyclic aromatic hydrocarbons by gas chromatography-mass spectrometry and high performance liquid chromatography[J].
Henan Chemical Industry, 2018(5): 53-55.
王大陆, 汪宏杰, 王丽娜, 等. 气相色谱-质谱联用和高效液相色谱法对多环芳烃的分析及对比[J]. 河南化工, 2018(5): 53-55. |
| [52] |
YU H. The investigation of NMR determination for isotactic index of homopolypropylene[J].
Petrochemcial Industry Technology, 2011, 18(4): 17-19.
于红. 核磁共振法测定均聚聚丙烯等规指数[J]. 石化技术, 2011, 18(4): 17-19. DOI: 10.3969/j.issn.1006-0235.2011.04.005. |
| [53] | ALBERT K. On-line use of NMR detection in separation chemistry[J]. J Chromatogr A, 1995, 703(1, 2): 123-147. |
| [54] | ALBERT K, DACHTLER M, GLASER T, et al. On-line coupling of separation techniques to NMR[J]. J Sep Sci, 2015, 22(3): 135-143. |
| [55] | HILLER W, SINHA P, PASCH H. Online HPLC-NMR of PS-b-PMMA and blends of PS and PMMA, 2-LCCC-NMR at critical conditions of PS[J]. Macromolecular Chemistry & Physics, 2010, 208(18): 1965-1978. |
| [56] | HILLER W, SINHA P, PASCH H. Online HPLC-NMR of PS-b-PMMA and blends of PS and PMMA, 2-LCCC-NMR at critical conditions of PMMA[J]. Macromolecular Chemistry & Physics, 2010, 210(8): 605-613. |
| [57] | HILLER W, HEHN M, HOFE T, et al. Online size exclusion chromatography-NMR for the determination of molar mass distributions of copolymers[J]. Anal Chem, 2010, 82(19): 8244-8250. DOI: 10.1021/ac1013095. |
| [58] | HSIEH H L. Anionic polymerization-principles and practical applications[J]. Biomedical Applications of Electroactive Polymers, 1996, 44(6): 591-621. |
| [59] | HILLER W, HEHN M, SINHA P, et al. Online coupling of two-dimensional liquid chromatography and NMR for the analysis of complex polymers[J]. Macromolecules, 2012, 45(19): 7740-7748. DOI: 10.1021/ma301494c. |
| [60] | ALBERT K, BRAUMANN U, STRECK R, et al. Application of direct on-line coupling of HPLC and SFC with 1H NMR spectroscopy for the investigation of monomeric acrylates[J]. Fresen J Anal Chem, 1995, 352(5): 521-528. DOI: 10.1007/BF00323378. |
| [61] | SCHLOTTERBECK G, TSENG LH, HÄNDEL H, et al. Direct on-line coupling of capillary HPLC with 1H NMR spectroscopy for the structural determination of retinyl acetate dimers: 2D NMR spectroscopy in the nanoliter scale[J]. Anal Chem, 1997, 69(7): 1421-1425. DOI: 10.1021/ac960902b. |
| [62] | HILLER W, PASCH H, MACKO T, et al. On-line coupling of high temperature GPC and 1H NMR for the analysis of polymers[J]. J Magn Reson, 2006, 183(2): 290-302. |
| [63] | CAO S H, NI Z R, HUANG L, et al. In situ monitoring potential-dependent electrochemical process by liquid NMR spectroelectrochemical determination: a proof-of-concept study[J]. Anal Chem, 2017, 89(7): 3810-3813. DOI: 10.1021/acs.analchem.7b00249. |
| [64] | BUSSY U, GIRAUDEAU P, SILVESTRE V, et al. -In situ NMR spectroelectrochemistry for the structure elucidation of unstable intermediate metabolites[J]. Anal Bioanal Chem, 2013, 405(17): 5817-5824. DOI: 10.1007/s00216-013-6977-z. |
| [65] | BEWERIES T, FISCHER C, PEITZ S, et al. Combination of spectroscopic methods: in situ NMR and UV/Vis measurements to understand the formation of group 4 metallacyclopentanes from the corresponding metallacyclopropenes[J]. J Am Chem Soc, 2009, 131(12): 4463-4469. DOI: 10.1021/ja809368s. |
| [66] | FAVIERA, BARNER-KOWOLLIK C, DAVIS T P, et al. A detailed on-line FT/NIR and 1H NMR spectroscopic investigation into factors causing inhibition in xanthate-mediated vinyl acetate polymerization[J]. Macromolecular Chemistry & Physics, 2010, 205(7): 925-936. |
| [67] | ODIAN G. Principles of polymerization[M]. Fourth Edition. America: Wiley-Interscience, 2004. |
| [68] | SCHILLI C, LANZENDÖRFER M G, MÜLLER A H E. Benzyl and cumyl dithiocarbamates as chain transfer agents in the RAFT polymerization of N-isopropylacrylamide. In situ FT-NIR and MALDI-TOF MS investigation[J]. Macromolecules, 2002, 35(18): 6819-6827. DOI: 10.1021/ma0121159. |
 2019, Vol. 36
2019, Vol. 36 
