2. 云南民族大学 电气信息工程学院, 云南 昆明 650500
2. School of Electrical and Information Technology, Yunnan Minzu University, Kunming 650500, China
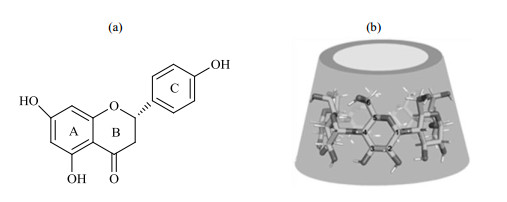
大环化学作为超分子化学发展的重要驱动力量,一直以来备受关注.冠醚[1]、环糊精[2-4]、杯芳烃[5]、葫芦脲[6]以及柱芳烃[7]作为五代经典的大环分子,已经在医药、材料、环境等领域得到长足发展.其中,β-环糊精(βCD,图 1)呈截顶圆锥状,具有内亲脂外亲水的结构特点,且自身无毒性.因此在药物制剂工业中,环糊精可用于增强药物水溶性,改善药物的理化性能[8],是被广泛应用的药物载体[9].柚皮素(NAR,图 1)属于二氢黄酮类化合物,存在于芸香科植物中[10, 11].NAR有多种生物活性,例如:抗肿瘤[12]、抗病毒[13]、抗氧化[14]和降血脂[15]等.同时,NAR在农学、医学和食品科学等领域也存在着广泛的应用.但是由于NAR的水溶性差(34 μg/mL)[16],在兔体内的生物利用度仅为4% [10],限制了其在临床上的应用.在前期的研究工作中,本课题组曾报道了具有优良水溶性与热稳定性的NAR/βCD超分子包合物[17],但并没有采用理论计算和实验相结合的方法对包合物的结合模式进行详细的研究.计算化学的发展为研究物质的微观特性提供了有力手段,清晰的包合物构型有助于研究超分子药物的定量构效关系.其中,半经验PM3方法被广泛用于研究天然药物与环糊精的包合模式[18].它避免了求解复杂的量子力学方程,但对于研究复杂的有机大分子体系来说依然十分有利.
|
图 1 (a) 柚皮素与(b) β-环糊精的结构 Fig. 1 The structures of (a) NAR and (b) βCD |
本文首先采用超声法制备NAR与βCD的超分子包合物,并运用粉末-X射线衍射(XRD)、红外吸收光谱(IR)和核磁共振(NMR)技术对该超分子包合物进行结构表征.同时,结合半经验PM3方法研究NAR与βCD的包合行为、热力学参数和前线轨道等.为提高计算的准确度,对稳定包合物的构型进一步执行ONIOM分层计算.此外,还使用分子对接模拟研究主客体最优的结合模式.
1 实验部分 1.1 仪器与试剂实验所用仪器分别为:TTR-18kW转靶X射线衍射仪(日本理学公司);Bruker Avance 600型NMR波谱仪(瑞士Bruker公司);Nicolet IS10红外光谱仪(美国Thermo科技有限公司);SK8200BT超声仪(上海科导超声仪器有限公司);BSA224S-CW分析天平(德国Sartorius公司).
NAR[C15H12O5,相对分子质量(FW)= 272.25,质量分数(PC) > 98%]购于南京泽朗医药科技有限公司,βCD(C42H70O35,FW=1 134.98,PC > 99%)购于北京百灵威科技有限公司;所用纯水为自制超纯水,其余试剂为市售分析纯试剂.
1.2 实验条件与计算详情 1.2.1 NAR/βCD包合物与物理混合物的制备按照摩尔比为3:1的比例准确称取NAR(0.03 mmol,8.20 mg)与β-CD(0.01 mmol,11.35 mg).将NAR与βCD放入25 mL圆底烧瓶,用体积比为1:4的乙醇/水溶解后置于超声仪中超声1 h;然后采用孔径为0.45 μm的微孔膜过滤;滤液于50 ℃温度下旋转蒸发除去多余的溶剂后,真空干燥12 h,即得白色固体包合物.按照相同的摩尔比准确称取NAR与β-CD,充分混匀并真空干燥12 h,即得NAR与βCD的物理混合物.
1.2.2 NAR/βCD包合物的XRD测定XRD具有样品可回收、结果分析对比直观等特点,被广泛用于包合物的表征,主要是依据包合前后主客体晶型结构的差异、衍射峰位和强度的变化来判断包合物的形成.实验参数设置如下:Cu Kα(K=1 546 nm),管电流为100 mA,管电压为40 kV,扫描速率为5˚/min,步长2θ扫描范围为3˚~50˚.
1.2.3 NAR/βCD包合物的IR测定IR光谱能够定性测定包合物中的特征基团及其相互作用,根据包合前后主客体特征峰波数与吸收强度的变化可判断包合物的形成.首先将KBr、NAR、βCD、NAR/βCD包合物和物理混合物等样品在红外灯下干燥1 h,采用压片法将样品与KBr(质量比约为1:100)混合后研磨成粉,在压片机中压成薄片,然后测定IR光谱.
1.2.4 NAR/βCD包合物的1H NMR与ROESY测定将一定量的βCD和NAR/βCD包合物样品溶于D2O,以TMS为内标,在工作频率为600.17 MHz、实验温度为25 ℃,谱宽为10 330.58 Hz的条件下测定其1H NMR谱.二维谱(2D ROESY)采用标准脉冲程序,采样数据点阵t2×t1 = 2 048×256,累加次数为48.
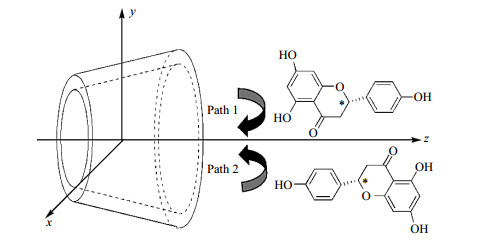
1.2.5 量子化学计算NAR的初始结构由Gaussian View构建,βCD的结构取自剑桥晶体数据库,分别采用B3LYP/6-31G(d)和半经验PM3方法,在没有任何对称性条件约束下进行结构优化以获取几何平衡结构.通过Gaussian View构建NAR与βCD的包合过程:把βCD的氧苷原子所围成的圆放置在xy坐标平面上,圆心定义为整个坐标的原点,然后,将NAR放置在z轴的正方向上.主客体之间的距离即坐标原点与NAR标记碳原子C*之间的距离,图 2显示了NAR穿越βCD空腔的两条可能路径:路径1和路径2,使C*原子带动整个NAR分子从z轴的正方向进入βCD的空腔并穿越至z轴负方向. 主客体之间的距离由+1 nm到-1 nm变化,每步移动0.1 nm.采用PM3方法对每一步所形成的主客体包合物进行全优化.由此,两条路径的结合能[(1)式]曲线被大致的扫描出来.为了提高计算的准确度,对两条路径中最稳定结构进行ONIOM分层计算,把NAR/βCD包合物的结构分为两层:低层为βCD,高层为NAR.采用ONIOM[B3LYP/6-31G(d):PM3]和ONIOM[HF/6-31G(d):PM3]方法[19]计算这两个稳定包合物的构型及相互作用能[(3)式].此外,进一步将βCD的所有羟基部分列为高层[20],βCD的其余部分列为低层,采用ONIOM[WB97XD/6-31G(d):PM3]计算两个稳定包合物的构型及相互作用能,以便进一步确定最优包合模式.量化计算使用Gaussian 09软件包[21]完成.
| $ \mathit{\Delta} E = {E_{{\rm{complex }}}}-({E_{\beta {\rm{CD}}}}+ {E_{{\rm{NAR}}}}) $ | (1) |
| $ \mathit{\Delta} G = \mathit{\Delta} H - T\mathit{\Delta} S $ | (2) |
| $\mathit{\Delta} {E_{{\rm{Binding}}}} = {E_{{\rm{ONIOM}}}}{\rm{ - }}{E_{{\rm{LL}}}}{\rm{ - }}{E_{{\rm{HL}}}} $ | (3) |
|
图 2 NAR穿越βCD空腔的两条可能路径 Fig. 2 Two possible paths of NAR passing through the βCD cavity |
上述式中对应的物理量分别为:ΔE—包合物的结合能;Ecomplex、EβCD和ENAR—包合物体系、βCD和NAR的生成热;ΔG—自由能相对值;ΔH—包合物体系的焓变值;T—温度;ΔS—包合物体系的熵变值;ΔEBinding—分层计算下的结合能;ELL—计算的低层体系的能量;EHL—计算的高层体系的能量.
1.2.6 分子对接模拟采用分子对接模拟,进一步研究主客体包合模式[22].以1.2.5节中经优化后的结构做为分子对接的初始构型.将βCD设置为刚性受体分子,NAR则作为配体分子允许柔性扭转.设置βCD受体的格点间距盒子尺寸为4 nm×4 nm×4 nm,网格间距为0.037 5 nm,βCD分子的几何中心即为盒子的几何中心.基于拉马克遗传算法(Lamarckian,GA 4.2)将NAR对接到βCD的空腔中,执行100次构象搜索,maximum number of evals设为2.5×107,其他参数使用默认值.对接完成后,将均方根偏差(Root Mean Square Deviation,RMSD) < 0.2 nm的构像归为一簇进行聚类分析.分子对接采用AutoDock 4.2程序[23]完成.
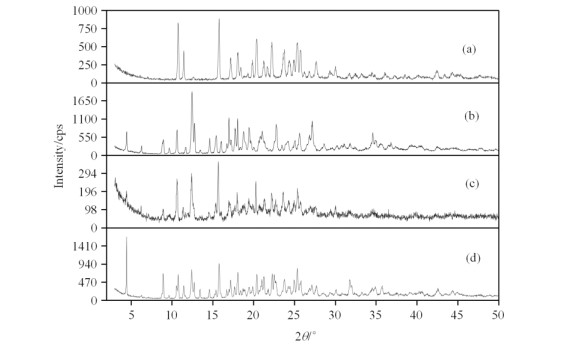
2 结果与讨论 2.1 NAR/βCD包合物的XRD分析通过包合物形成前后主客体晶型结构的变化可判断包合物的形成.NAR、βCD、NAR/βCD包合物和物理混合物的XRD结果如图 3所示.NAR与βCD均呈现出晶型结构,NAR与βCD的物理混合物仅是两种物质衍射峰的简单叠加,NAR/βCD包合物[图 3(c)]则呈现出部分晶型与无定形的结构,与NAR、βCD和NAR/βCD物理混合物的晶型结构有着明显的差异.βCD在4.47˚处有个衍射峰,经物理混合后4.45˚处依然存在该衍射峰,在包合物中该衍射峰的强度明显减弱;NAR在15.79˚处存在最强衍射峰,经βCD包合后该衍射峰的2θ值变为15.68˚,而在NAR与βCD的物理混合物中该衍射峰的2θ值仅有0.02˚的微小变化.βCD在12.47˚处有最强的衍射峰,在12.79˚处有一伴峰,在包合物形成后伴峰消失,原来的最强衍射峰向更低的2θ(12.40˚)值移动,在NAR/βCD物理混合物中原来的最强峰位差值变化仅为0.04˚,且伴峰依然存在.同时,βCD在34.59˚处有一个明显的衍射峰,在物理混合物中该衍射峰的2θ值变为34.92˚,在包合物中该衍射峰已消失.总的来说,包合前后衍射峰位置与强度的改变意味着形成的包合物具有不同于主体或客体的新结构.
|
图 3 X-射线粉末衍射(XRD)图. (a) NAR; (b) βCD; (c) NAR/βCD包合物; (d) NAR/βCD物理混合物 Fig. 3 XRD patterns. (a) NAR; (b) βCD; (c) NAR/βCD inclusion complex; (d) NAR/βCD physical mixture |
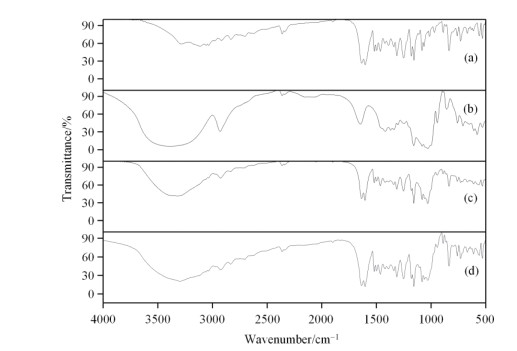
NAR、βCD、NAR/βCD包合物和物理混合物的IR光谱如图 4所示.βCD在3 380 cm-1处有一个较宽的-OH吸收峰,形成包合物后蓝移至3 313 cm-1处,且峰强度减弱.NAR在2 500~3 000 cm-1之间共有3个吸收峰(2 702 cm-1、2 830 cm-1和2 918 cm-1),但在包合物形成后该区域内仅有2 924 cm-1处的一个吸收峰,而NAR/βCD物理混合物的IR光谱中依然同时存在2 830 cm-1处的吸收峰,NAR在1 633 cm-1和1 602 cm-1处苯环的碳骨架振动吸收在物理混合物中并没有发生变化,但是在包合物的IR光谱中,这两个峰的强度明显减弱,且波数变为1 634 cm-1和1 603 cm-1.NAR/βCD包合物的整体峰强度比NAR、βCD,及其物理混合物的峰强度更弱;此外,红外吸收波数上存在一定的差异,这证实了包合物的形成.
|
图 4 红外吸收(IR)光谱. (a) NAR; (b) βCD; (c) NAR/βCD包合物; (d) NAR/βCD物理混合物 Fig. 4 IR spectra. (a) NAR; (b) βCD; (c) NAR/βCD inclusion complex; (d) NAR/βCD physical mixture |
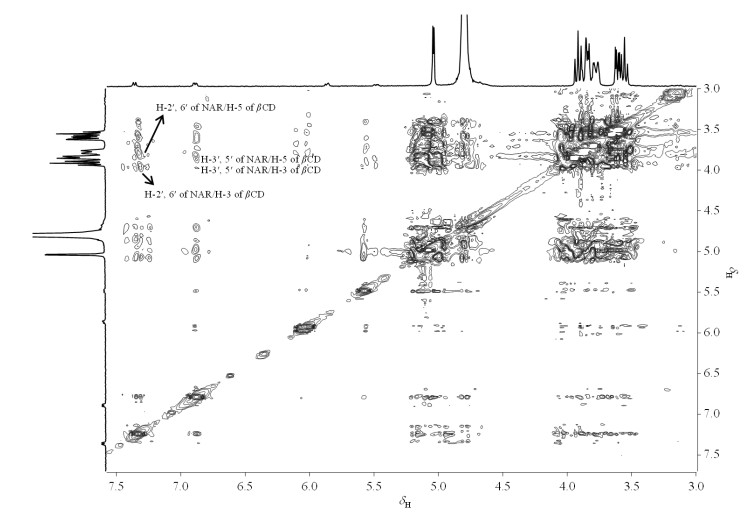
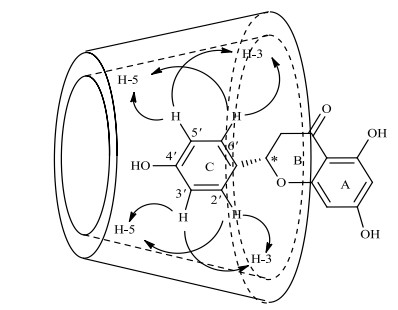
NMR是研究物质结构最有力的方法[24, 25],βCD包合NAR前后的1H NMR谱及各质子的化学位移变化分别如图 5和表 1所示,NAR的溶解度较差,在重水中无法检测到其质子信号.但NAR与βCD形成超分子包合物后,NAR的水溶性极大增强,因此,可以在NAR/βCD包合物的1H NMR谱中检测到NAR的质子信号.βCD的H-1、H-2、H-4和H-6均位于其空腔外,而H-3位于βCD宽口端的内侧,H-5位于窄口端内侧.由表 1可知,包合前后βCD的H-3和H-5的化学位移变化较H-1、H-2和H-4的大,说明NAR与βCD的相互作用为包埋型机理,即客体分子NAR插入到了主体分子βCD的空腔中.根据H-3和H-5的化学位移变化大小可初步确定客体小分子进入βCD的取向:H-3变化较大,则NAR从βCD的宽口端进入;H-5变化较大,则NAR从βCD的窄口端进入.包合前后H-3的化学位移变化为0.07,H-5的化学位移的变化为0.05,由此可初步判定NAR分子是从βCD的宽口端进入.可判断NAR与βCD之间配位包合行为的ROESY谱如图 6所示,NAR分子C环上的H-2′,6′均与βCD上的H-3,5存在着较强的核Overhauser效应(NOE)相关,NAR环上的H-3′,5′与βCD上的H-5同样存在较强的相关,但是与βCD分子上的H-3相关较弱.所以可推断出NAR是以C环从βCD的宽口端进入其空腔的,可能的包合模式及关键的NOE相关如图 7所示.
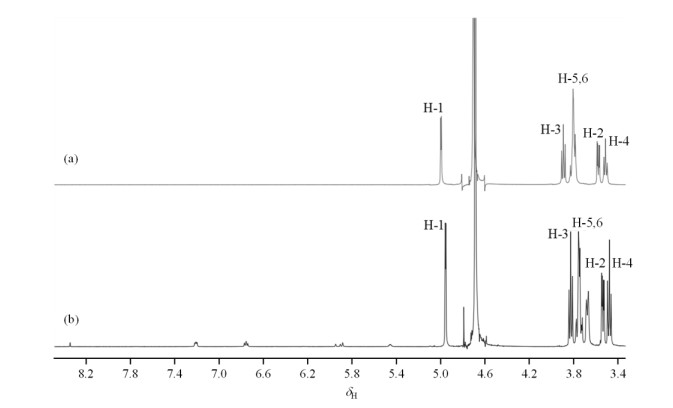
|
图 5 βCD与NAR/βCD包合物的核磁共振氢谱(D2O) Fig. 5 1H NMR spectra of βCD and NAR/βCD inclusion complex (D2O) |
| 表 1 βCD包合NAR前后同一质子的化学位移变化 Table 1 The chemical shifts change (ΔδH) of the protons of βCD and NAR/βCD inclusion complex |
|
图 6 NAR/βCD包合物的ROESY谱(D2O) Fig. 6 ROESY spectrum of NAR/βCD inclusion complex (D2O) |
|
图 7 NAR/βCD包合物的可能包合模式与关键的NOE相关 Fig. 7 Possible inclusion mode and key NOE correlations of NAR/βCD inclusion complex |
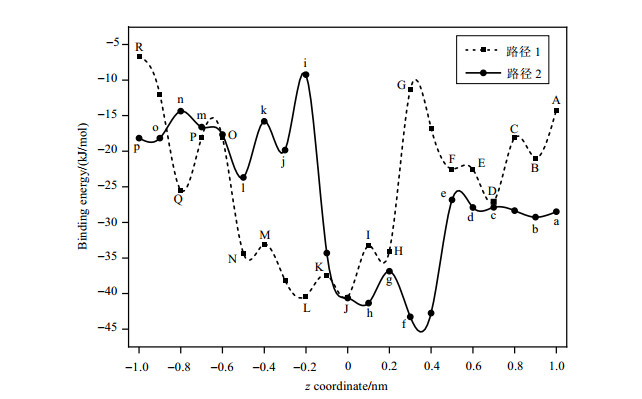
NAR沿着z轴从+1 nm至-1 nm,不断地接近并穿越βCD的空腔,每步移动0.1 nm,一共移动20步,共有21个驻点,每一个驻点的结构均用PM3方法进行全优化.根据Rajendiran等[26]的方法,以结合能为评价指标,分析βCD与NAR包合物的最稳定构型,结合能越负就表示包合物越稳定[27]. 两条路径(路径1和路径2)穿越过程中结合能的变化如图 8所示:路径1(NAR以A环从z轴的正方向进入)的结合能在-6.66 kJ/mol~-40.48 kJ/mol的范围内波动.而路径2(NAR以C环从z轴的正方向进入)的结合能在-9.17 kJ/mol~-43.25 kJ/mol的范围内波动.两条路径的能量曲线都具有类似的变化趋势:当NAR不断进入βCD空腔时,包合物体系的结合能绝对值升高,随着NAR脱离βCD空腔时,包合物体系的结合能绝对值降低.从图 8中可以看出,两条路径中最稳定的结构分别为:路径1中0 nm处J点(-40.48 kJ/mol)和路径2中0.3 nm处f点(-43.25 kJ/mol)所对应的构型.
|
图 8 NAR穿越βCD空腔过程时的结合能变化曲线 Fig. 8 Changes of binding energy during NAR passing through the βCD cavity |
采用PM3和ONIOM方法,在298.15 K和1 atm的条件下计算出NAR、βCD和两条路径中最稳定包合物的偶极矩、前线分子轨道和相关热力学参数等列于表 2.NAR和βCD未形成包合物时的偶极矩分别为2.817 D和6.352 D,但是在形成包合物后偶极矩发生了变化,Sakina等[28]曾提出包合物的稳定性与其偶极矩的强度之间存在一定的相关性.前线分子轨道(FMOs)被广泛用于分析包合物的物理或化学性质.越大的最高占据轨道(EHOMO)能级代表包合物失电子的能力越强,而越小的最低空轨道(ELUMO)能级意味着包合物得到电子的能力越强.最高占据轨道与最低空轨道之间的差值即为能隙(EHOMO-ELUMO),能隙值越大,电子跃迁越困难,包合物就越稳定.包合物J的能隙值为7.940 9 eV,包合物f的能隙值为7.965 1 eV,显然,包合物f要比包合物J更加稳定.包合物J的结合能为-40.48 kJ/mol,而包合物f的结合能为-43.25 kJ/mol,越稳定的包合物具有越负的结合能,因此,包合物f要比包合物J更加稳定,这与能隙的分析结果一致.包合物J、f的自由能相对值[(2)式]分别为-37.44 kJ/mol和-40.49 kJ/mol,也证明包合物f比包合物J更加稳定.为验证PM3的分析结果,采用ONIOM[B3LYP/6-31G(d):PM3]和ONIOM[HF/6-31G(d):PM3]方法对包合物J和包合物f进行分层计算.结果显示,使用两种方法分层计算时,包合物J的结合能的绝对值分别为4 825.95 kJ/mol和4 041.64 kJ/mol,包合物f在相应理论水平下的结合能的绝对值比包合物J分别高6.69 kJ/mol和41.37 kJ/mol.此外,ONIOM[WB97XD/6-31G(d):PM3]方法下计算得到的包合物f的结合能的绝对值也高于包合物J.显然,ONIOM计算结果与PM3的分析结果一致,即包合物f更加稳定.
| 表 2 NAR、βCD及其包合物的相关热力学参数 Table 2 Thermodynamic parameters of the NAR, βCD and their inclusion complex |
氢键弱相互作用是包合物形成过程中的重要驱动力之一,根据Gejji等[29]和Steiner等[30]对氢键的定义:C-H…O型氢键的长度要小于0.3 nm,O-H…O型氢键的长度在0.240~0.250 nm之间.ONIOM[WB97XD/6-31G(d):PM3]方法优化后,NAR与βCD之间形成的最优包合模式与氢键如图 9所示.NAR的A环从βCD的宽口端进入,形成的包合物J为路径1中最稳定的包合模式,从图 9中的J-1、J-2(J-1和J-2分别表示包合物J的俯视图和正视图)可看出,NAR几乎位于βCD的几何中心,且药物分子垂直于氧苷原子所在的平面,在包合物J中有三条氢键形成,即H158…O51、H159…O120和H100…O169长度分别为0.271 nm、0.287 nm和0.286 nm.包合物f是路径2中最稳定的包合物模式,是NAR的C环从βCD的宽口端进入而形成的,如图 9中的f-1、f-2(f-1和f-2分别表示包合物f的俯视图和正视图)所示,NAR的C环刚好进入βCD的空腔中,而A环和B环裸露在外面且整个NAR分子倾斜.虽然客体在包合物f中没有像在包合物J中一样完全进入主体的空腔,但是有六条氢键形成,平均长度为0.272 nm.值得注意的是,在包合物f和包合物J中,并没有发现有O-H…O型氢键的形成.因此,基于氢键形成的数量而言,包合物f比包合物J要更稳定,该结果与能隙、结合能的分析结果一致.
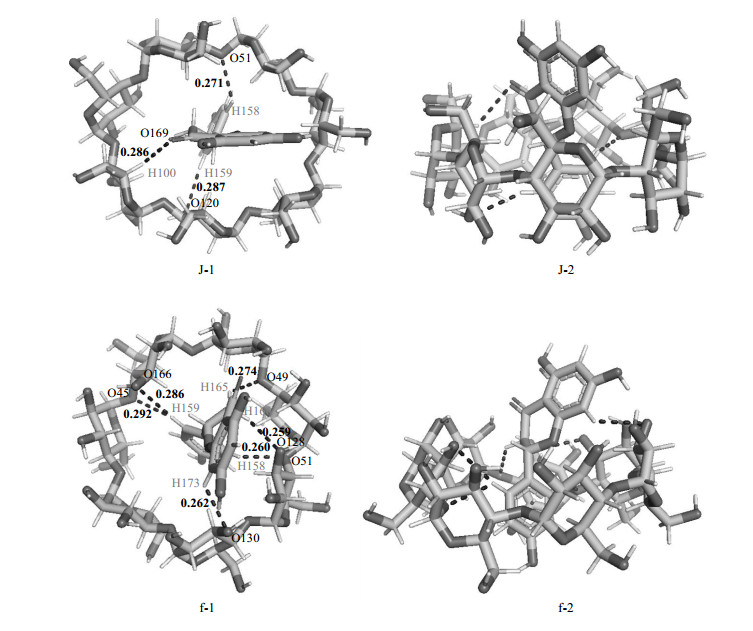
|
图 9 经ONIOM[WB97XD/6-31G(d): PM3]优化后包合物J(J-1, J-2)与包合物f(f-1, f-2)的结构及其形成的氢键(J-1、f-1:包合物的俯视图;J-2、f-2:包合物的正视图.氢键键长单位:nm) Fig. 9 The optimized structure and hydrogen bonds of inclusion complex J (J-1, J-2) and inclusion complex f (f-1, f-2) at ONIOM[WB97XD/6-31G(d): PM3] level of theory (J-1 and f-1: top view of the inclusion complex, J-2 and f-2: front view of the inclusion complex. hydrogen bond length unit: nm) |
经聚类分析后,观察所有形成的主客体对接模式,并没有NAR分子脱离βCD空腔的结果出现,说明主客体之间可以形成稳定的包合物.分子对接结果中最稳定的对接构象如图 10所示,NAR的C环从βCD的宽口端进入并斜靠于βCD的疏水空腔内壁.从主客体的分子表面积图来看,NAR的A、B环比C环的体积大,且极性比C环的弱,因此与C环竞争进入βCD空腔内时并不占优势,导致A、B环部分暴露于空腔外,所以形成这样的结构是合理的.此外,最优的包合模式中有两条氢键:一条为NAR分子C环上的羟基与βCD的氧苷原子之间形成的长为0.211 nm的氢键,另外一条为A环上5号位羟基与βCD羟基氧原子之间形成的氢键,长度为0.208 nm.总的来说,此构象为最优包合模式主要有两个原因:一是NAR分子斜靠于βCD内壁,包合物中主客体结合紧密使能量降低,另外一方面是氢键的形成降低了结合能能量.对接后的最优包合模式与量化计算中最稳定的包合物f的模式一致.
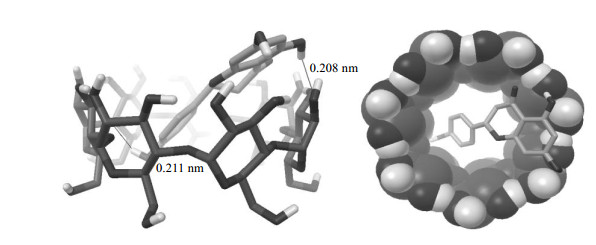
|
图 10 NAR/βCD包合物的分子对接包合模式 Fig. 10 Molecular docking conformation diagram of NAR/βCD inclusion complex |
本文采用超声法制备了NAR与βCD的配位包合物,采用XRD、IR法表征了主客体间的相互作用,表明了形成的包合物具有不同于主客体的结构性质.运用1H NMR、ROESY分析得到了NAR与βCD形成的最稳定的主客体包合模式:NAR的C环端从βCD的宽口端进入而形成超分子包合物.然后,采用半经验PM3方法计算了NAR与βCD形成超分子包合物的过程,以主客体间的结合能、能隙、氢键相互作用和热力学参数等为依据,分析所得出的最稳定包合模式与NMR研究结果一致,揭示了NAR与βCD形成包合物的驱动力源于焓驱动与氢键的弱相互作用,采用ONIOM方法得到的结果与PM3理论水平下的结果一致,结合分子对接计算模拟了NAR与βCD的对接模式,聚类分析后的最优包合模式与量子化学计算、NMR推断结果同样吻合.清晰的主客体结合模式与形成机理,将为NAR的进一步临床应用以及揭示NAR/βCD超分子药物的定量构效关系提供理论参考.
| [1] | FIELDEN S P, LEIGH D A, MCTERNAN C T, et al. Spontaneous assembly of rotaxanes from a primary amine, crown ether and electrophile[J]. J Am Chem Soc, 2018, 140(19): 6049-6052. DOI: 10.1021/jacs.8b03394. |
| [2] | FALAISE C, MOUSSAWI M A, FLOQUET S, et al. Probing dynamic library of metal-oxo building blocks with γ-cyclodextrin[J]. J Am Chem Soc, 2018, 140: 11189-11201. DOI: 10.1021/jacs.8b07349. |
| [3] | YILDIZ Z I, CELEBIOGLU A, KILIC M E, et al. Menthol/cyclodextrin inclusion complex nanofibers: Enhanced water-solubility and high-temperature stability of menthol[J]. J Food Eng, 2018, 224: 27-36. DOI: 10.1016/j.jfoodeng.2017.12.020. |
| [4] |
ZHAO F, YANG Y H, ZHAO X Q, et al. Study on inclusion behavior and properties of tetrahydropalmatine with β-cyclodextrin and its derivatives[J].
Chin Tradit Herbal Drugs, 2018, 49(15): 3609-3618.
赵芳, 杨云汉, 赵雪秋, 等. 延胡索乙素与β-环糊精及其衍生物的包合行为研究[J]. 中草药, 2018, 49(15): 3609-3618. DOI: 10.7501/j.issn.0253-2670.2018.15.020. |
| [5] | KARPUS A, YESYPENKO O, BOIKO V, et al. Synthesis of an enantiomerically pure inherently chiral calix[4]arene phosphonic acid and its evaluation as organocatalyst[J]. J Org Chem, 2018, 83(3): 1146-1153. |
| [6] | ZOHEB H, HAILEY F T, EMILY F B, et al. Molecular recognition of methionine-terminated peptides by cucurbit[8]uril[J]. J Am Chem Soc, 2018, 140: 12263-12269. DOI: 10.1021/jacs.8b07865. |
| [7] | JIE K C, ZHOU Y J, LI E R, et al. Linear positional isomer sorting in nonporous adaptive crystals of a pillar[5]arene[J]. J Am Chem Soc, 2018, 140: 3190-3193. DOI: 10.1021/jacs.7b13156. |
| [8] | YANG L J, WANG S H, ZHOU S Y, et al. Supramolecular system of podophyllotoxin and hydroxypropyl-β-cyclodextrin: Characterization, inclusion mode, docking calculation, solubilization, stability and cytotoxic activity[J]. Mater Sci Eng C, 2017, 76: 1136-1145. DOI: 10.1016/j.msec.2017.03.197. |
| [9] | YANG L J, CHANG Q, ZHOU S Y, et al. Host-guest interaction between brazilin and hydroxypropyl-β-cyclodextrin: Preparation, inclusion mode, molecular modelling and characterization[J]. Dyes Pigments, 2017, 150(2018): 193-201. |
| [10] |
JI P, ZHAO W M, YU T. Recent research progress of naringenin[J].
Chin J New Drugs, 2015, 12: 1382-1386.
季鹏, 赵文明, 于桐. 柚皮素的最新研究进展[J]. 中国新药杂志, 2015, 12: 1382-1386. |
| [11] |
SUN L J, HU X F, CHENG X, et al. NMR characterization of flavanone naringenin 7-O-glycoside diastereomer[J].
Chinese J Magn Reson, 2017, 34(4): 465-473.
孙丽娟, 胡小芳, 程寻, 等. 柚皮素7-O-葡萄糖苷非对映异构体的NMR波谱分析[J]. 波谱学杂志, 2017, 34(4): 465-473. |
| [12] | HATICE G A, TUBA A. Naringenin inhibits prostate cancer metastasis by blocking voltage-gated sodium channels[J]. Biomed Pharmacother, 2018, 106: 770-775. DOI: 10.1016/j.biopha.2018.07.008. |
| [13] | MD S, GAN S Y, YONG H H, et al. In vitro neuroprotective effects of naringenin nanoemulsion against β-amyloid toxicity through the regulation of amyloidogenesis and tau phosphorylation[J]. Int J Biol Macromol, 2018, 118: 1211-1219. DOI: 10.1016/j.ijbiomac.2018.06.190. |
| [14] | ZAIDUN N H, THENT Z C, LATIFF A A. Combating oxidative stress disorders with citrus flavonoid: Naringenin[J]. Life Sci, 2018, 208: 111-122. DOI: 10.1016/j.lfs.2018.07.017. |
| [15] | KARIM N, JIA Z, ZHENG X, et al. A recent review of citrus flavanone naringenin on metabolic diseases and its potential sources for high yield-production[J]. Trends Food Sci Tech, 2018, 79: 35-54. DOI: 10.1016/j.tifs.2018.06.012. |
| [16] |
ZHAO H, RONG X Y, LIU S, et al. Preparation and pharmaceutical characteristics of naringenin nanocrystals[J].
Chin Tradit Herbal Drugs, 2018, 49(13): 3026-3032.
赵涵, 戎欣玉, 刘爽, 等. 柚皮素纳米晶体的制备及药剂学性质研究[J]. 中草药, 2018, 49(13): 3026-3032. DOI: 10.7501/j.issn.0253-2670.2018.13.011. |
| [17] | YANG L J, MA S X, ZHOU S Y, et al. Preparation and characterization of inclusion complexes of naringenin with β-cyclodextrin or its derivative[J]. Carbohydrate Polymers, 2013, 98(1): 861-869. DOI: 10.1016/j.carbpol.2013.07.010. |
| [18] |
ZHU Q Y, HE P Z. Structural elucidation of D-camphor and β-cyclodextrin inclusion complex[J].
Chinese J Magn Reson, 2015, 32(1): 87-94.
朱庆英, 何佩芝. D-樟脑与β-环糊精包合物的结构表征[J]. 波谱学杂志, 2015, 32(1): 87-94. |
| [19] | LUNDBERG M, MOROKUMA A K. The ONIOM method and its applications to enzymatic reactions[J]. Chem Rev, 2015, 115(12): 5678-5796. DOI: 10.1021/cr5004419. |
| [20] | BANI-YASEEN A D. Computational molecular perspectives on the interaction of propranolol with β-cyclodextrin in solution: Towards the drug-receptor mechanism of interaction[J]. J Mol Liqui, 2017, 227: 280-290. DOI: 10.1016/j.molliq.2016.12.023. |
| [21] | FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 03, revision D. 01[OL]. Wallingford, CT: Gaussian, Inc., 2004-01-01. |
| [22] | ZHANG C L, LIU J C, YANG W B, et al. Experimental and molecular docking investigations on the inclusion mechanism of the complex of phloridzin and hydroxypropyl-β-cyclodextrin[J]. Food Chem, 2017, 215: 124-128. DOI: 10.1016/j.foodchem.2016.07.155. |
| [23] | MORRIS G M, HUEY R, LINDSTROM W, et al. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility[J]. J Comput Chem, 2009, 30(16): 2785-2791. DOI: 10.1002/jcc.21256. |
| [24] |
ZHOU Z G, YUAN Y Y, LIU H B, et al. An NMR study on prucalopride[J].
Chinese J Magn Reson, 2018, 35(1): 119-127.
周中高, 元洋洋, 刘红波, 等. 普卡必利的NMR研究[J]. 波谱学杂志, 2018, 35(1): 119-127. |
| [25] |
FANG H Y. Spectral analyses of a novel ibuprofen-phillygenin ester[J].
Chinese J Magn Reson, 2018, 35(1): 98-108.
樊宏宇. 新型连翘脂素-布洛芬酯合物的波谱学数据解析[J]. 波谱学杂志, 2018, 35(1): 98-108. |
| [26] | RAJENDIRAN N, SIVA S. Inclusion complex of sulfadimethoxine with cyclodextrins: Preparation and characterization[J]. Carbohydr Polym, 2014, 101: 828-836. DOI: 10.1016/j.carbpol.2013.10.016. |
| [27] | SIVA S, KOTHAI NAYAKI S, RAJENDIRAN N. Spectral and molecular modeling investigations of supramolecular complexes of mefenamic acid and aceclofenac with α-and β-cyclodextrin[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2017, 174: 349-362. DOI: 10.1016/j.saa.2014.12.002. |
| [28] | HAIAHEM S, NOUAR L, DJILANI I, et al. Host-guest inclusion complex between β-cyclodextrin and paeonol: A theoretical approach[J]. C R CHIM, 2013, 16(4): 372-379. DOI: 10.1016/j.crci.2012.11.008. |
| [29] | GEJJI S P, TAURIAN O E, LUNELL S. Theoretical study of the short asymmetric[O…H…O] hydrogen bond in solid potassium hydrogen diformate, including electron correlation[J]. J Phys Chem, 1990, 94(11): 4449-4452. DOI: 10.1021/j100374a018. |
| [30] | STEINER T, SAENGER W. Geometry of C-H⋯O hydrogen bonds in carbohydrate crystal structures. Analysis of neutron diffraction data[J]. J Am Chem Soc, 1992, 114(26): 10146-10154. DOI: 10.1021/ja00052a009. |
 2019, Vol. 36
2019, Vol. 36 
