氢能作为一种零碳排放的燃料,具有来源广、热值高、无毒等优点,可成为解决环境问题的清洁能源之一.但是,氢气的储存和运输一直是阻碍氢能大规模应用的瓶颈.在所知的储氢技术中,甲醇(CH3OH)因具有来源广泛、成本低、含氢量较高(12.6 %),且室温下为液态等优势,而成为一种理想的储氢能源载体[1].在甲醇重整制氢过程中会生成一系列的气态和液态中间产物.其中,气态产物,例如一氧化碳或二氧化碳,会大大限制甲醇重整产物的产率和选择性[2];而液态产物(C-H产物)则有利于氢气的储存和运输.因此甲醇重整产物的分析对于基于甲醇的储氢研究很重要.目前,研究者通常使用色谱、质谱等方法对甲醇重整产物进行分析,但是,值得注意的是甲醇重整中产生的一些中间产物在非工作状态或非原位状态下是不存在的[3-6].比如在水溶液中,甲醛(HCHO)是以水合物(HOCH2OH)的形式存在的;在非液体状态下,HOCH2OH则不存在.由此可见,通过产物分离的方法得到的分析结果可能并不真实.迄今为止,虽然研究者对于甲醇重整中间产物有了一定的研究,但是能在产物不分离且原位反应环境下对甲醇重整机理进行研究的技术还比较欠缺.因此,这些原位产物的复杂性和反应机理模糊不清,大大的限制了研究者对于甲醇重整机理的理解,进而阻碍了储氢技术的发展.
近期,研究者使用了一些原位或准原位的技术来观察催化反应的中间产物,包括:扫描隧道显微镜(STM)[7-9],时间分辨双光子光电子能谱(TR-2PP)[10],程序升温脱附法(TPD)[11-13],红外光谱(IR)[14-16],固体核磁共振(SSNMR)[17-23]以及密度泛函理论(DFT)计算[24, 25]等.这些方法可以模拟并探测催化剂与甲醇分子之间的相互作用,并提出一些可能存在的甲醇重整机理.然而,这些技术很难在反应过程中直接定量的检测物质的变化,并且大多数技术都是在理想的条件下(如固-气界面或者超真空环境)完成的,尽管能够得到精细的分辨率,但仍然很难将实际过程中复杂的反应环境影响考虑进去,比如表面特异性、溶剂效应,以及被吸附物之间的相互作用[26, 27],因此得出的结论并不能完全反映真实的异相反应体系.据我们所知,目前还没有研究者在真实固液反应环境中对甲醇重整过程中的转化机制进行报道.
据此,本文使用原位核磁共振(NMR)方法对光催化甲醇反应进行研究,在真实固液反应环境中对甲醇重整过程中液态中间产物进行了定量检测.同时,对甲醇重整过程中重要中间产物生成趋势进行跟踪和分析.
1 实验部分 1.1 试剂P25型、锐钛矿型和金红石型TiO2,含0.05 wt. %内标——3-(三甲基硅基)丙磺酸钠(DDS)的D2O(99.9 atom % D),甲醇(≥99.9%),13C标记甲醇(99 atom % 13C)均购于Sigma-Aldrich公司.
Pd (1 wt. %)/TiO2光催化剂粉末是用共沉淀法制备的.首先,将适量PdCl2水溶液(1 wt. %)加入到TiO2(100 mg,P25型TiO2)粉末中,在80 ℃条件下,搅拌反应1 h.产物经干燥后,在300 ℃下煅烧2 h.样品在检测前需要在20 % H2/Ar气氛中、300 ℃温度下,还原1 h.
1.2 仪器与参数透射电子显微镜(TEM)实验在JEM 2100 VP场发射电镜上进行,加速电压为200.0 kV.
X射线衍射(XRD)实验所用仪器型号为Rigaku Ultima Ⅳ,Cu-Ka靶,相关参数为:测试电压35 kV,电流25 mA,X射线波长0.154 18 nm,扫描范围5˚~85˚,扫描速度为10˚/min.
反应光源为300 W氙灯.在实验过程中,先在NMR谱仪腔体外照射样品,随后迅速放入腔体内进行NMR检测.光催化反应在光照下才能进行,离开光照后光催化反应停止.实验仪器谱为安捷伦700 MHz NMR谱仪.1H和13C NMR实验所用的探头为安捷伦HXY三通道静态探头,实验温度为298 K,工作频率分别为700.13和176.02 MHz,谱宽分别为14 044.94 Hz和44 642.85 Hz.1H NMR的脉冲宽度为4 μs(45˚),循环等待时间为5 s,采样次数分别为8、16或32.为了压制溶剂水的信号,自由感应衰减(FID)的前1 000个数据点在傅里叶变换前被删除.13C NMR脉冲宽度为7.3 μs(45˚),循环等待时间为2 s,采样次数为32.DEPT实验采用标准脉冲序列,耦合参数为145 Hz.二维谱包括2D梯度场HSQC、HMBC,均采用标准脉冲程序.HSQC的F2(1H)和F1(13C)维谱宽分别为14 044.94 Hz和35 195.77 Hz,采用数据点阵t2×t1=6 000×512;HMBC的F2(1H)和F1(13C)维谱宽分别为10 504.20 Hz和25 518.34 Hz,采用数据点阵t2×t1=16 806×1 024.原位NMR监测光催化反应的装置如图 1所示.通过该装置我们可以在产物不分离的情况下对真实固液反应环境中的光催化甲醇重整固液反应过程进行在线观测[5].

|
图 1 原位核磁共振(NMR)监测光催化甲醇反应过程示意图 Fig. 1 Schematic diagram of photochemical reaction detection with in operando NMR spectroscopy |
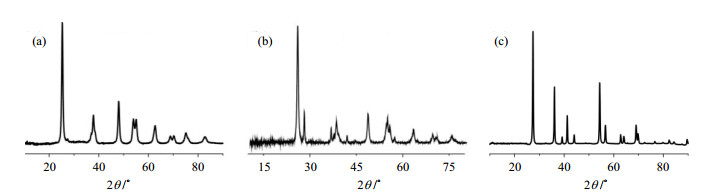
本实验所使用的TiO2催化剂主要有三种:锐钛矿型、P25型以及金红石型.这三种TiO2的形貌尺寸可以通过TEM实验表征.如图 2所示,这三种晶型TiO2的尺寸都在纳米尺度,锐钛矿型TiO2、P25型TiO2尺寸约在20~30 nm,而金红石型TiO2尺寸在60 nm左右.图 3为不同晶型TiO2的XRD谱图,从图中可以看出,这三种样品的晶型分别是锐钛矿型、P25型以及金红石型.

|
图 2 (a) 锐钛矿型TiO2、(b) P25型TiO2和(c)金红石型TiO2的透射电子显微镜(TEM)照片 Fig. 2 TEM images of anatase-TiO2 (a), P25-TiO2 (b), and rutile-TiO2 (c) |
|
图 3 (a) 锐钛矿型TiO2、(b) P25型TiO2和(c)金红石型TiO2的X射线衍射(XRD)谱图 Fig. 3 XRD patterns of anatase-TiO2 (a), P25-TiO2 (b), and rutile-TiO2 (c) |
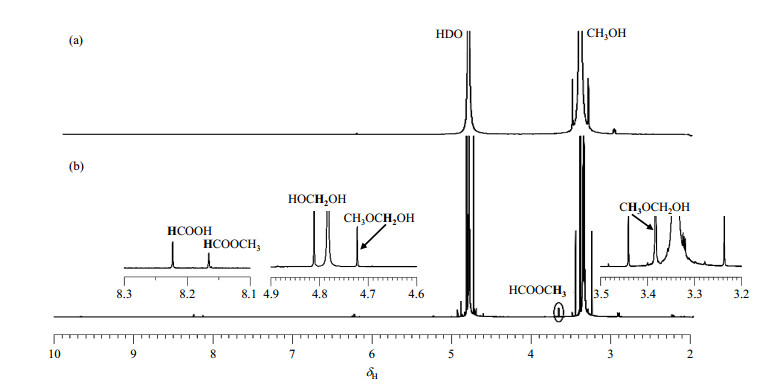
首先,我们对光催化甲醇重整体系中的主要产物进行了研究.将2 mg的Pd/TiO2粉末放入5 mm NMR样品管中,并向其中加入0.5 mL D2O和20 μL甲醇,超声5 min使之均匀分散,光照前和光照40 h后反应体系的1H NMR谱图如图 4所示.从图 4(a)中我们可以看出,光照前的反应体系的1H NMR谱中只出现CH3OH和HDO的信号.当对反应体系光照40 h后,甲醇发生了光解离现象,1H NMR谱中出现了6种质子信号,分别位于:δH 3.38、δH 3.65、δH 4.73、δH 4.83、δH 8.16和δH 8.22 [如图 4(b)所示].经过初步判断,δH 8.16和δH 8.22为与羰基相连的质子.
|
图 4 (a) 光照前和(b)光照40 h后反应体系的1H NMR谱图(以甲醇为牺牲剂) Fig. 4 1H NMR spectra of the reaction system before irradiation (a) and after 40 h irradiation (b) (using methanol as the sacrificial agent) |
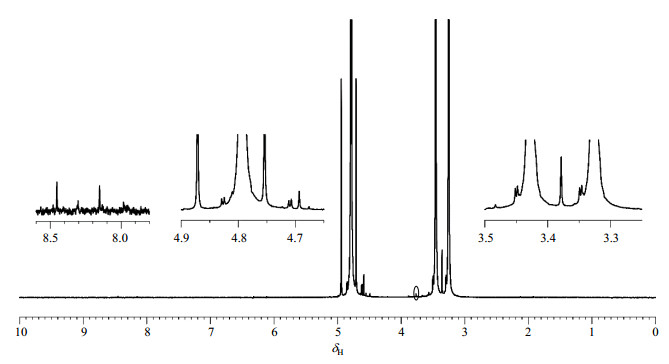
为了排除溶剂中杂质的影响,确认上述6个质子信号均为甲醇的分解产物,我们使用了13C标记的甲醇代替甲醇重复了该实验(图 5).从图 5可以看出,当使用13C标记的甲醇作为牺牲剂时,光照后的样品1H NMR谱中δH 3.38、δH 3.65、δH 4.73、δH 4.83、δH 8.16和δH 8.22处的信号(由于标记样品的不同,化学位移有些偏移)均产生了裂分,裂分来自于13C核对1H核的偶合.因此我们可以确定图 4中的6种质子信号均为甲醇的分解产物.
|
图 5 以13C标记的甲醇为牺牲剂时,光照40 h后反应体系的1H NMR谱图 Fig. 5 1H NMR spectra of the reaction system after 40 h irradiation using 13C labeled methanol as the sacrificial agent |
随后,我们利用一系列NMR方法对上述信号进行归属.我们采集了光照40 h后的反应体系(以13C标记的甲醇为牺牲剂)的13C NMR、DEPT-135、DEPT-90、1H-13C HSQC以及1H-13C HMBC谱图.该体系的13C NMR谱(图 6)中.δC 49.5为甲醇CH3信号,δC 49.2、δC 55.2、δC 82.3以及δC 90.1均为甲醇相关或分解产物信号(图中裂分为D核对13C核的裂分).DEPT-135和DEPT-90实验(图 6),结果显示δC 55.2为CH3信号,δC 90.1、δC 82.3和δC 49.2为CH2信号,而是δC 49.2的信号为结构片段CH2D[22],δC 130左右的信号推测为羰基碳的信号.

|
图 6 以13C标记甲醇为牺牲剂时,反应体系光照40 h后的(a) 13C NMR谱图、(b) DEPT-135碳谱,以及(c) DEPT-90碳谱 Fig. 6 13C NMR(a), DEPT-135 (b), and DEPT-90 (c) spectra of the reaction system after 40 h irradiation using 13C labeled methanol as the sacrificial agent |
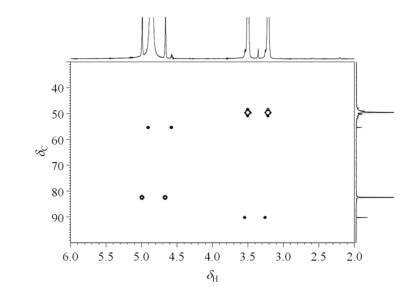
上述反应体系的1H-13C HSQC(图 7)显示:δH 3.33与δC 49.5相关(为甲醇);δH 3.38与δC 55.2相关;δH 4.73与δC 90.1相关;δH 4.83与δC 82.3相关.HMBC谱图(图 8)显示,δH 3.38与δC 90.1远程相关,δH 4.73与δC 55.2远程相关.由于光催化反应体系中只有水与甲醇两种可在1H和13C NMR谱上能产生信号的化合物,只含有C、H、O三种化学元素,故δH 4.83处信号对应于结构片段CH2,但由于未观察到碳氢远程相关,由此推测对应的甲醇产物可能为HOCH2OH.δH 3.38与δH 4.73对应甲醇分解产物片段为CH3OCH2O,我们推测其结构可能为CH3OCH2OH或者CH3OCH2OCH3,即半缩醛或者缩醛.而在1H NMR谱上δH 4.73与δH 3.38处的积分面积比约为2:3,则确定产物为半缩醛CH3OCH2OH.
|
图 7 以13C标记甲醇为牺牲剂时,反应体系光照40 h后的1H-13C HSQC谱图 Fig. 7 1H-13C HSQC spectrum of the reaction system after 40 h irradiation using 13C labeled methanol as the sacrificial agent |

|
图 8 以13C标记甲醇为牺牲剂时,反应体系光照40 h后的1H-13C HMBC谱图 Fig. 8 1H-13C HMBC spectrum of the reaction system after 40 h irradiation using 13C labeled methanol as the sacrificial agent |
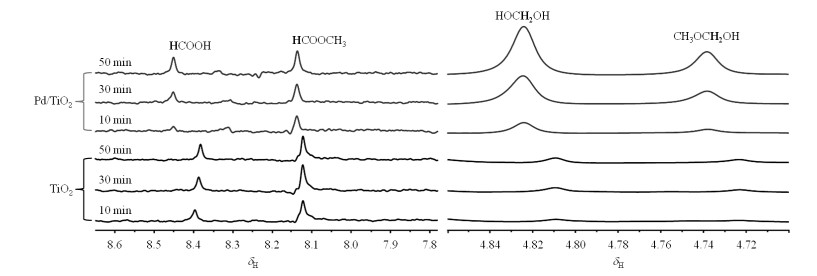
δH 8.16与δH 8.22是与羰基相连的质子信号,但我们在13C NMR谱中并未看到明显的羰基信号,这可能是因为信号太弱,也可能是因为产物结构不稳定、易分解.Pilkenton等[28]通过SSNMR研究,分析出乙醇在光催化制氢反应中的分解产物含有乙酸、甲酸等产物,由此我们猜测其结构可能为甲酸或者其衍生物,为了进一步验证我们的猜想,我们购买了甲酸(HCOOH)、甲酸甲酯(HCOOCH3)等物质加入到相同反应体系中做了相同实验.通过验证得出δH 8.16为HCOOCH3,而δH 8.22为HCOOH.
通过系统归属(表 1),我们可以得出,甲醇分解的四种主要产物中,δH 4.73和δH 4.83为光催化甲醇反应的一级产物:CH3OCH2OH和HOCH2OH;位于δH 8.16和δH 8.22为二级产物:HCOOCH3和HCOOH.由于HCOOH和HCOOCH3的产量很低,所以在二维谱中并没有观察到相关峰.
| 表 1 光催化甲醇反应体系的NMR谱图分析 Table 1 NMR spectral analysis of the decomposition product of methanol in the photocatalytic hydrogen generation reaction |
值得注意的是,在此体系中,我们并没有观察到甲醛气体的NMR信号,这一结果暗示大部分甲醛分子在离开催化剂表面后都转化成了它的水合形式(HOCH2OH)[如(1)式所示].
| $ {\rm{HCHO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{HOC}}{{\rm{H}}_{\rm{2}}}{\rm{OH}} $ | (1) |
由于HOCH2OH仅仅存在于液相环境中(气态理想条件下是不存在的),并且当把该物质从液体中分离出来后很难捕捉.因此,在原位条件下对反应过程的监测非常必要.需要说明的是本文实验中的溶剂环境为氘水(D2O),由于会存在活泼氢的交换,所以产物会存在更多种类,比如:DOCH2OD、CH3OCH2OD等.但是,为了使分析结果更加清楚明白,我们简化了产物种类(全部以无氘代产物进行分析).
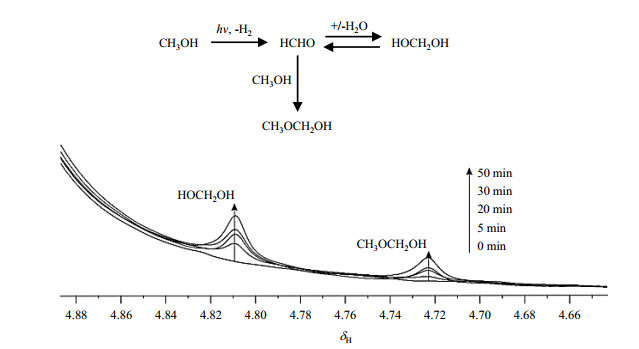
2.3 光照时间对光催化甲醇反应产物的影响为了更深入的研究光催化甲醇重整的机制,我们对使用纯P25型TiO2催化剂在不同光照时间(0 min、5 min、20 min、30 min、50 min)下的甲醇重整过程进行了研究(图 9和图 10).样品包括2 mg P25型催化剂、0.5 mL D2O和20 μL CH3OH.CH3OCH2OH(δH 4.73)和HOCH2OH(δH 4.83)的信号强度随着光照时间的延长而增加.HCOOH的信号强度随着光照时间延长而增加;同时,位置发生了轻微的偏移.HCOOCH3信号强度随光照时间的延长增加趋势是先缓慢后加快,此趋势与使用金红石型TiO2和锐钛矿型TiO2催化剂类似.HOCH2OH可能是由甲醛和水结合形成的,而CH3OCH2OH是由甲醛和甲醇结合而成的[如(2)式所示].
| $ {\rm{HCHO + C}}{{\rm{H}}_{\rm{3}}}{\rm{OH}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{OC}}{{\rm{H}}_{\rm{2}}}{\rm{OH}} $ | (2) |
|
图 9 一级产物的信号强度随光照时间的变化趋势(使用P25型TiO2催化剂) Fig. 9 Signal intensities of the primary products catalyzed by P25-TiO2 change with the irradiation time |

|
图 10 二级产物的信号强度随光照时间的变化(使用P25型TiO2催化剂) Fig. 10 Signal intensities of the secondary products catalyzed by P25-TiO2 change with irradiation time |
大量存在的CH3OCH2OH和HOCH2OH是生成甲醛的间接证据,但是溶液的组分会影响反应路径和产物.因此,使用原位NMR技术监测原位固液环境下的反应对于反应机理的研究非常重要.
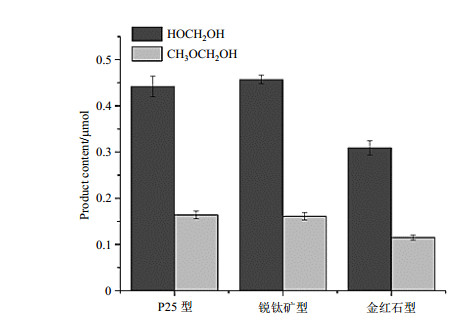
2.4 不同晶型TiO2对光催化甲醇重整产物的影响从上述数据中我们观察到CH3OCH2OH和HOCH2OH是甲醇重整中很重要的两个产物.为了观察他们在金红石型、锐钛矿型和P25型TiO2中氧化路径的差异,我们对其在紫外光照射下的产物进行了跟踪.样品包括2 mg不同晶型的催化剂、0.5 mL D2O和20 μL CH3OH.如图 11所示,基于DSS的积分对比,我们对产物进行了定量分析.例如:样品甲醇中加入n1 μmol内标DSS,光照反应后,测得内标物与产物(以HOCH2OH为例)的信号峰的积分面积分别为S1和S2,则产物的物质的量(n2,μmol)为:n2 = 9n1S2/2S1.从定量结果可以看出,使用三种晶型TiO2作为催化剂时,生成的HOCH2OH的产量都几乎是CH3OCH2OH的两倍多,活性顺序为P25型TiO2≈锐钛矿型TiO2 > 金红石型TiO2.
|
图 11 不同晶型TiO2催化下光照60 min后一级产物的含量对比 Fig. 11 Comparison of the contents of the primary products after 60 min irradiation catalyzed by different crystal type TiO2 |
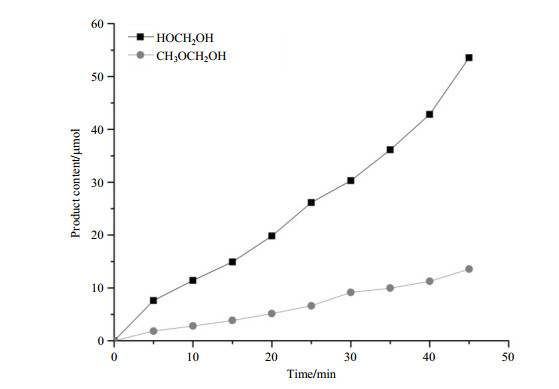
研究表明,在催化过程中当光照射在反应体系中会生成光生载流子(电子和空穴),其中电子和空穴的产生和复合会在整个过程中持续发生.当电子和空穴到达催化剂表面后,他们会与吸附在表面的有机分子发生氧化或还原反应.在本文的体系中,甲醇是作为电子供应分子.因此,甲醇会与产生并迁移到催化剂表面的空穴反应.为了验证这样的想法,我们设计了两组实验, 催化剂分别为P25型TiO2和Pd/P25型TiO2.样品包括2 mg催化剂、0.5 mL D2O和20 μL CH3OH.因为Pd共催化剂的费米能级比TiO2低,因此,迁移到TiO2表面的光生电子会被表面的Pd捕获.同时,迁移到TiO2表面的光生的空穴会与表面吸附的甲醇进行反应.负载Pd共催化剂会大量的增加光生电子空穴的分离,进而增加了迁移到表面的空穴.图 12为Pd/TiO2作为催化剂的甲醇重整产物图.结合图 11和12中可以看出,在光照时间未达到60 min时,使用Pd负载催化剂得到的CH3OCH2OH和HOCH2OH的产量是使用纯TiO2催化剂的2~3个数量级,与分析结果相匹配.
|
图 12 Pd/TiO2催化下,一级产物的含量随光照时间的变化 Fig. 12 The contents of the primary products catalyzed by Pd/TiO2 change with irradiation time |
有趣的是,如图 13所示,我们发现Pd的负载大大增加了一级产物CH3OCH2OH和HOCH2OH的产率,但是对于二级产物HCOOCH3和HCOOH的影响并不大[29, 30].据我们所知,一次产物为甲醇氧化直接产物,其产率与到达表面的空穴相关,而负载后更有利于电子空穴的分离,因此到达表面发生反应的空穴会增多,从而导致一级产物的产率增加.而二级产物可能不需要空穴的参与,因此负载对二级产物的影响不大,我们会在今后的工作中,进行更深入的研究,这对于催化机理的研究有重要意义.除了产量的变化外,我们还观察到Pd负载引起了部分产物信号的偏移,这可能是由于这些产物周围环境(例如氢键)变化所导致的.
|
图 13 使用Pd/TiO2和TiO2催化剂时,不同产物含量随光照时间的变化 Fig. 13 The contents of main products change with the irradiation time catalyzed by Pd/TiO2 and TiO2 |
本文就用原位NMR技术对光催化甲醇重整产物及其影响因素进行了研究.在未将产物分离的前提下,本文定量检测了4种主要液态中间产物的生成,并通过NMR技术推断它们分别是CH3OCH2OH、HOCH2OH、HCOOCH3和HCOOH.从定量结果可以看出,分别使用三种晶型TiO2作为催化剂时,生成的HOCH2OH的产量几乎都是CH3OCH2OH的两倍多,活性顺序为P25型TiO2≈锐钛矿型TiO2 > 金红石型TiO2.4种产物的信号强度随着光照时间的增加而增加.Pd负载对一级产物CH3OCH2OH和HOCH2OH的产率影响较大(其产率为不负载样品产率的2~3个数量级),对二级产物HCOOCH3和HCOOH影响较小.
| [1] | RODRIGUEZLUGO R E, TRINCADO M, VOGT M, et al. A homogeneous transition metal complex for clean hydrogen production from methanol-water mixtures[J]. Nat Chem, 2013, 5(4): 342-347. |
| [2] | NIELSEN M, ALBERICO E, BAUMANN W, et al. Low-temperature aqueous-phase methanol dehydrogenation to hydrogen and carbon dioxide[J]. Nature, 2013, 495(7439): 85-89. DOI: 10.1038/nature11891. |
| [3] | CLARKE H T, GILLESPIE H B, WEISSHAUS S Z. The action of formaldehyde on amines and amino acids[J]. J Am Chem Soc, 1933, 55(11): 4571-4587. DOI: 10.1021/ja01338a041. |
| [4] | HEYDUK A F, NOCERA D G. Hydrogen produced from hydrohalic acid solutions by a two-electron mixed-valence photocatalyst[J]. Science, 2001, 293(5535): 1639-1641. DOI: 10.1126/science.1062965. |
| [5] | WANG X L, LIU W, YU Y Y, et al. Operando NMR spectroscopic analysis of proton transfer in heterogeneous photocatalytic reactions[J]. Nat Communi, 2016, 7: 11918. DOI: 10.1038/ncomms11918. |
| [6] | CHEN X B, SHEN S H, GUO L J, et al. Semiconductor-based photocatalytic hydrogen generation[J]. Chem Rev, 2010, 110(11): 6503-6570. DOI: 10.1021/cr1001645. |
| [7] | ONISHI H, IWASAWA Y. Dynamic visualization of a metal-oxide-surface/gas-phase reaction:Time-resolved observation by scanning tunneling microscopy at 800 K[J]. Phys Rev Lett, 1996, 76(5): 791-794. DOI: 10.1103/PhysRevLett.76.791. |
| [8] | SCHEIBER P, RISS A, SCHMID M, et al. Observation and destruction of an elusive adsorbate with STM:O2/TiO2(110)[J]. Phys Rev Lett, 2010, 105(21): 5332-5337. |
| [9] | ZHANG Z, BONDARCHUK O, WHITE J M, et al. Imaging adsorbate O-H bond cleavage:methanol on TiO2(110)[J]. J Am Chem Soc, 2006, 128(13): 4198-4199. DOI: 10.1021/ja058466a. |
| [10] | LI B, ZHAO J, ONDA K, et al. Ultrafast interfacial proton-coupled electron transfer[J]. Science, 2010, 110(12): 7082-7099. |
| [11] | MCLAREN A D. The beckmann rearrangement of aliphatic ketoximes[J]. Science, 1946, 103(2678): 503. DOI: 10.1126/science.103.2678.503. |
| [12] | XU C B, YANG W S, GUO Q, et al. Molecular hydrogen formation from photocatalysis of methanol on anatase-TiO2(101)[J]. J Am Chem Soc, 2014, 136(2): 602-605. DOI: 10.1021/ja411020t. |
| [13] | XU C B, YANG W S, GUO Q, et al. Molecular hydrogen formation from photocatalysis of methanol on TiO2(110)[J]. J Am Chem Soc, 2013, 135(28): 10206-10209. DOI: 10.1021/ja4030963. |
| [14] | GUO Q, XU C B, REN Z F, et al. Stepwise photocatalytic dissociation of methanol and water on TiO2(110)[J]. J Am Chem Soc, 2012, 134(32): 13366. DOI: 10.1021/ja304049x. |
| [15] | ZHANG M, DE R M, FREI H. Time-resolved observations of water oxidation intermediates on a cobalt oxide nanoparticle catalyst[J]. Nat Chem, 2014, 6(4): 362-367. |
| [16] | HIGHFIELD J G, CHEN M. H, NGUYEN P T, et al. Mechanistic investigations of photo-driven processes over TiO2 by in-situ DRIFTS-MS:Part 1. Platinization and methanol reforming[J]. Energy Environ Sci, 2009, 2(9): 991-1002. DOI: 10.1039/b907781m. |
| [17] | CHEN T, FENG Z C, WU G P, et al. Mechanistic studies of photocatalytic reaction of methanol for hydrogen production on Pt/TiO2 by in situ fourier transform IR and time-resolved IR spectroscopy[J]. J Phys Chem C, 2007, 111(22): 8005-8014. DOI: 10.1021/jp071022b. |
| [18] | BLANC F, LESKES M, GREY C P. In situ solid-state NMR spectroscopy of electrochemical cells:batteries, supercapacitors, and fuel cells[J]. Acc Chem Res, 2013, 46(9): 1952-1963. DOI: 10.1021/ar400022u. |
| [19] | CATTANEO A S, VILLA D C, ANGIONI S, et al. Operando electrochemical NMR microscopy of polymer fuel cells[J]. Energy Environ Sci, 2015, 8(8): 2383-2388. DOI: 10.1039/C5EE01668A. |
| [20] | CHAN K W H. Probing adsorbates on Pt electrode surfaces by the Use of 13C spin-echo NMR[J]. J Electrochem Soc, 1990, 137(1): 367-368. DOI: 10.1149/1.2086433. |
| [21] | TONG Y Y, WIECKOWSKI A, OLDFIELD E. NMR of electrocatalysts[J]. J Phys Chem B, 2002, 106(10): 2434-2446. DOI: 10.1021/jp0129939. |
| [22] | XU S T, ZHANG W P, LIU X C, et al. Enhanced in situ continuous-flow MAS NMR for reaction kinetics in the nanocages[J]. J Am Chem Soc, 2009, 131(38): 13722-13727. DOI: 10.1021/ja904304h. |
| [23] | YAMAMOTO M, NAKAMURA R, KASAYA T, et al. Back cover:spontaneous and widespread electricity generation in natural deep-sea hydrothermal fields[J]. Angew Chem, 2017, 56(21): 5725. DOI: 10.1002/anie.201701768. |
| [24] | ZHANG W P, XU S T, HAN X W, et al. ChemInform abstract:in situ solid-state NMR for heterogeneous catalysis:A joint experimental and theoretical approach[J]. Chem Soc Rev, 2011, 43(1): 192-210. |
| [25] | SÁNCHEZ V M, COJULUN J A, SCHERLIS D A. Dissociation free energy profiles for water and methanol on TiO2 surfaces[J]. J Phys Chem C, 2010, 114(26): 11522-11526. DOI: 10.1021/jp102361z. |
| [26] | SETVÃN M, ASCHAUER U, SCHEIBER P, et al. Reaction of O2 with subsurface oxygen vacancies on TiO2 anatase (101)[J]. Science, 2013, 341(6149): 988-991. DOI: 10.1126/science.1239879. |
| [27] | SULEIMANOV N M, KHANTIMEROV S M, SCHEUERMANN R, et al. In situ muSR and NMR investigation of methanol dissociation on carbon-supported nanoscaled Pt-Ru catalyst[J]. J Solid State Electr, 2013, 17(8): 2115-2121. DOI: 10.1007/s10008-011-1349-0. |
| [28] | SCHRAUBEN J N, HAYOUN R, VALDEZ C N, et al. Titanium and zinc oxide nanoparticles are proton-coupled electron transfer agents[J]. Science, 2012, 336(6086): 1298-1301. DOI: 10.1126/science.1220234. |
| [29] | PILLENTON S, RAFTERY D. Solid-state NMR studies of the adsorption and photooxidation of ethanol on mixed TiO2-SnO2 photocatalysts[J]. Solid State Nuclear Magnetic Resonance, 2003, 24(4): 236-253. |
| [30] | BALDOVINO-MEDRANO V G, POLLEFEYT G, BLIZNUK V, et al. Synergetic behavior of TiO2-supported Pd(z)Pt(1-z) catalysts in the green synthesis of methyl formate[J]. Chemcatchem, 2016, 8(6): 1157-1166. DOI: 10.1002/cctc.201501211. |
 2019, Vol. 36
2019, Vol. 36 
