2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
高强度聚焦超声(high-intensity focused ultrasound,HIFU)是一种新型的微创治疗方法,HIFU消融通过将声能量聚焦到体内,形成60 ℃以上的瞬时高温,导致靶区组织的凝固性坏死.为了尽可能降低HIFU治疗对周围正常组织的影响,在治疗过程中需要对其进行引导和监控来保证其安全性和有效性[1].磁共振成像(magnetic resonance imaging,MRI)因其无辐射、空间分辨率高、能够进行温度成像等特点,是目前HIFU测温监控主要手段[2].
与其它温度敏感参数相比,质子共振频率位移(proton resonance frequency shift,PRFS)的优点在于它与温度呈稳定的线性关系,且与组织类型无关,是目前应用最为广泛的磁共振温度成像(magnetic resonance thermometry,MRT)测温方法[3].梯度回波(gradient-recalled-echo,GRE)序列是MRT最常用的序列,它具有相对较高的信噪比、时间分辨率和空间分辨率.为了使MRT的测温准确度达到最高,序列的回波时间(echo time,TE)要尽可能地接近组织的T2*值[4].在3 T下,一般组织的T2*在20~40 ms之间,这就会要求较长的重复时间(repetition time,TR,TR > TE),进而延长扫描时间.结合回波平面成像(echo planar imaging,EPI)的采集方式,MRT的采集速度能极大提高,然而它的图像信噪比(signal to noise ratio,SNR)较低,测温准确性受到影响[5],此外,EPI序列受到磁场不均匀性等因素的影响,图像往往有较大的畸变.另一种提高采集速度的方法是结合回波平移技术,将当前TR内激发的信号平移至下一个TR内采集,从而延长有效回波时间,在保证测温灵敏度的同时减少了扫描时间[6].
HIFU治疗在对靶区进行加热的同时,需要确保周围的正常组织不受影响,尤其是组织界面附近,因而在保证测温精确度和时间分辨率的同时,大覆盖范围对于HIFU治疗的测温监控也至关重要.为了兼顾范围覆盖度和时间分辨率,可以应用并行成像技术[7].然而由于线圈固有的g因子,传统并行成像技术的信噪比较低,造成测量精度降低.可控混叠的空间并行成像(controlled aliasing in volumetric parallel imaging,CAIPI)技术是一种通过增大相邻位置的线圈灵敏度的差异,从而减小g因子的方法,能改善因并行成像引起的图像信噪比降低的问题[8].
本文介绍了一种基于回波平移序列结合CAIPI的快速三维MRT方法,并通过实验验证了该方法的准确度与精确度.仿体降温实验中应用了光纤温度计测温的结果作为标准,对比使用本文提出的方法获得的MRT测温的结果,从而得到该方法测温的准确度(accuracy)和精确度(precision).在本实验中,准确度为MRT与光纤温度计测温差值的平均值,精确度为MRT与光纤温度计测温差值的标准差.室温条件下扫描离体猪肉组织,比较加速前后的温度变化差值的标准差(即MRT测温精确度).HIFU加热条件下扫描离体猪肉组织,在保证较大的覆盖范围的同时,对比加速前后温度变化差值的平均值(即MRT测温准确度).
1 理论基础 1.1 PRFS方法PRFS方法利用水中质子的共振频率与温度线性相关的原理进行温度测量,使用回波平移序列可以通过计算加热区域相位的变化得到质子共振频率的变化,继而推导出温度的改变
| $\mathit{\Delta} T(t) = \frac{{\mathit{\Delta} \mathit{\Phi} (t)}}{{\gamma a{B_0}TE}} = \frac{{\mathit{\Phi} (t) - \mathit{\Phi} (0)}}{{\gamma a{B_0}TE}}$ | (1) |
其中
图 1所示为本研究所用的回波平移序列.该序列在每个TR内,在层选方向和读出方向上分别添加了一对极性相反的破坏梯度,可以将回波延迟到下一个TR中产生.因而有效TE时间TEeff=TR+TE[10].相比较传统的GRE序列,回波平移序列在减少扫描时间的同时能增加温度敏感度.
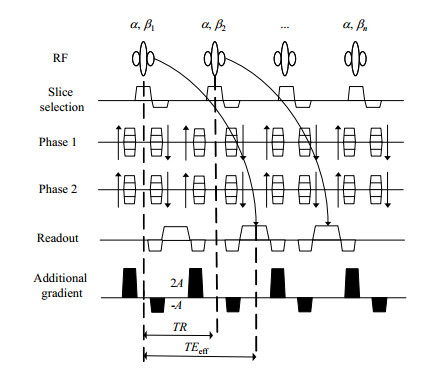
|
图 1 回波平移脉冲序列图.α表示射频脉冲,β指射频扰相,A表示破坏梯度的动量 Fig. 1 The diagram of echo shifted sequence. α: radio frequency; β: radio frequency spoiling; A: Momentum of the crushers |
为了使残余的横向磁化矢量完全失相,激发的射频脉冲中使用了射频扰相β,其相角
由于使用三维采集序列,因此可以在两个相位编码方向上均进行并行采集加速.图 2所示是CAIPI技术在两个相位编码ky、kz分别进行2倍加速所使用的采样模式,其中Δ为ky方向上的第偶数个采样点在kz方向上平移的量.根据傅里叶变换原理,降采样后得到的混叠图像如公式所示:
| $\rho _{alias}^j(y, z) = \sum\limits_{n = 0}^{{R_z} - 1} {\sum\limits_{m = 0}^{{R_y} - 1} {{C_j}} ({y_{m, n}}, {z_n}) \cdot \rho ({y_{m, n}}, {z_n})} $ | (2) |
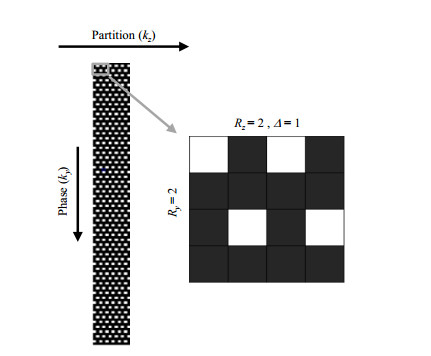
|
图 2 可控混叠的空间并行成像(CAIPI)的采样模式 Fig. 2 The sampling pattern of CAIPI |
其中
| $ SN{R_{解混叠后}} = \frac{{SN{R_{全采}}}}{{{g_\rho } \cdot \sqrt R }} $ | (3) |
其中R是加速因子;
所有的MRI扫描都是利用Siemens MAGNETOM Trio 3T人体MRI系统完成.
2.1 仿体实验仿体实验的目的是验证回波平移序列的测温准确度和精确度.参考仿体和热仿体都是由1.2%的琼脂(Sigma-Aldrich,St Louis,USA)、0.5%的氯化钠和纯水制作而成.在实验前数小时制作好参考仿体(外圈),冷却至室温,作为参考.实验开始前0.5 h制作好热仿体(内圈)并保温,确保实验开始时它的温度高于室温.理想情况下,在MRI扫描过程中参考仿体的温度保持不变,热仿体的温度逐渐下降至室温.在两个仿体中分别插入两支光纤温度计(FOTS-DINA-1000-S,Indigo Precision,China)用于记录仿体温度的真实值,光纤温度计的测温精确度为0.1 ℃(经深圳市计量质量检测研究院计量,两路光纤的计量报告编号:185510243,185509672),光纤温度计1和2插在仿体的第4层,光纤温度计3和4插在仿体的第8层[如图 3(a)所示].图像通过12通道头线圈获取,扫描所用的序列为三维回波平移序列[TR=9 ms,TE=5 ms,翻转角=10°,层厚=5 mm,FOV=192*192 mm2,成像矩阵=128*128,层数=12,单次扫描时间=13.8 s]扫描了100次用来测量热仿体降温过程中的温度变化.在图像中画出温度计附近的感兴趣区域(region of interest,ROI,半径为3个像素),对比测得的温度变化与光纤温度计记录的温度变化值之间的差异.由于磁场漂移,需要利用参考仿体进行零阶场漂校正[13].
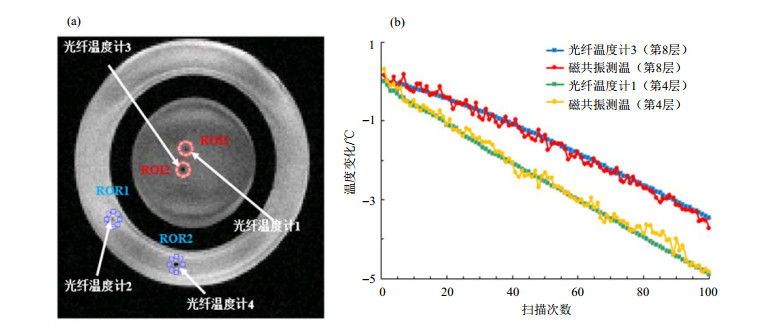
|
图 3 利用光纤温度计对基于回波平移序列的MRT的测温精度的标定. (a)通过回波位移序列得到的第4层的幅值图,其中红圈代表温度计附近的区域ROI,蓝圈代表用作场漂校正的区域ROR;(b)校正后的MRT与光纤温度计测温的温度变化曲线 Fig. 3 The accuracy of temperature measurement using echo-shifted sequence compared to optical fiber. (a) The magnitude image in the 4th slice acquired using echo-shifted sequence. The red circle is the ROI around the optical fiber thermometer and the blue circle is the ROR used for drift correction; (b) The temperature change curves acquired with the optical fiber thermometer and MRT after correction |
室温实验的目的在于对比加速前后回波平移序列测温的精确度.实验的对象是一块离体的猪肉组织,实验前3 h将其放入扫描间,保证其温度在实验过程中与室温保持一致.实验所用的线圈为32通道头线圈,成像参数为:TR=9 ms,TE=5 ms,层厚=5 mm,FOV=192*144 mm2,成像矩阵=128*96,层数=12,翻转角=10°.实验结束后对磁共振k-space原始数据按照图 2的模式进行降采样,两个相位编码方向的加速倍数均为2,总加速因子为4.该序列单次的扫描时间为10.4 s,因此加速后单次扫描时间为2.6 s,扫描50次.利用SENSE重建算法得到去混叠的图像后,温度变化可以通过(1)式计算得到.在扫描图像的中央画出ROI,通过计算得到的ROI内部温度变化的标准差(即MRT精确度).然后将加速前后的MRT精确度进行对比.
2.3 HIFU加热实验利用HIFU对离体猪肉组织进行加热,通过回波平移序列对进行整个过程进行温度监控,同时对比加速前后的温度变化曲线和温度变化图像.
将一个磁兼容的HIFU换能器(焦距为7.2 cm,650 kHz,Imasonic,France)置于水箱中.为确保HIFU焦点位于猪肌肉组织内部,将其放于一个底部由热塑性聚氨酯橡胶(thermoplastic urethane,TPU)包裹的亚克力容器中,将容器置于换能器的正上方,距离大约为5 cm.实验用的线圈为8通道颈线圈,成像参数为:TR=10 ms,TE=6 ms,层厚=5 mm,FOV=192*144 mm2,成像矩阵=128*96,层数=12,翻转角=10°,扫描次数=25.实验结束后对磁共振k-space原始数据按照图 2的模式进行降采样,两个相位编码方向的加速倍数均为2,总加速因子为4,加速前单次扫描时间为11.5 s,加速后单次扫描时间为2.88 s.加热从第4次扫描结束开始,第19次扫描结束停止,猪肌肉组织在20 W的声功率下加热了173 s.在计算温度变化的过程时,在图像未被加热的部分画出参考区域(region of reference,ROR)用作场漂校正[5].
欠采加速的过程和通过SENSE算法重建欠采加速数据的过程都是基于Matlab完成的.
3 实验结果与讨论 3.1 仿体实验结果图 3为利用光纤温度计对基于回波平移序列的MRT的测温精度的标定结果.在计算温度变化时,有效回波时间TEeff =TR+TE.图 3(a)为第4层的幅值图,其中ROI是温度计附近的区域,ROR是场漂校正的参考区域.图 3(b)所示为校正后的温度变化曲线,其中第4层基于回波平移序列的MRT测温为与光纤温度计测温的差值为(-0.08±0.14)℃,第8层基于回波平移序列的MRT测温与光纤温度计测温的差值为(0.04±0.11)℃.括号中前一数值代表MRT测温准确度,后一数值代表MRT测温精确度.
3.2 室温实验结果中间第6层和第7层的温度变化的标准差图像如图 4(a)、(b)所示.从结果可以观察到,以中间的6、7层为例,加速4倍后,温度变化差值的标准差大约增加到之前的2.2倍,加速前的温度变化差值的标准差的平均值(即精确度)约为0.5 ℃,加速后增至1.1 ℃.
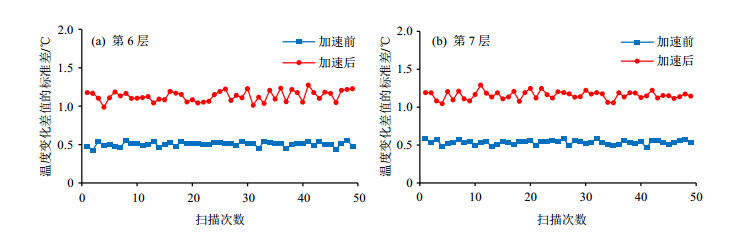
|
图 4 (a) 和(b)分别为室温条件下第6层和第7层加速前后得到的温度变化差值的标准差曲线,蓝线为加速前,红线为加速后 Fig. 4 (a) and (b) are the standard deviation curves of the temperature change without (blue line) and with (red line) acceleration in the 6th and the 7th slices at room temperature |
HIFU加热实验的结果如图 5所示.HIFU焦点区域的第5、6、7、12(其中12层未被加热的层面)层的加速前后的温度变化曲线的对比如图 5(a)~(d)所示,其中焦点中心位于第6层.加速前后的温度变化曲线基本一致.第5、6、7、12层加速前后温度变化差值的平均值(即测温准确度)分别为0.23 ℃、0.15 ℃、0.09 ℃、0.08 ℃.
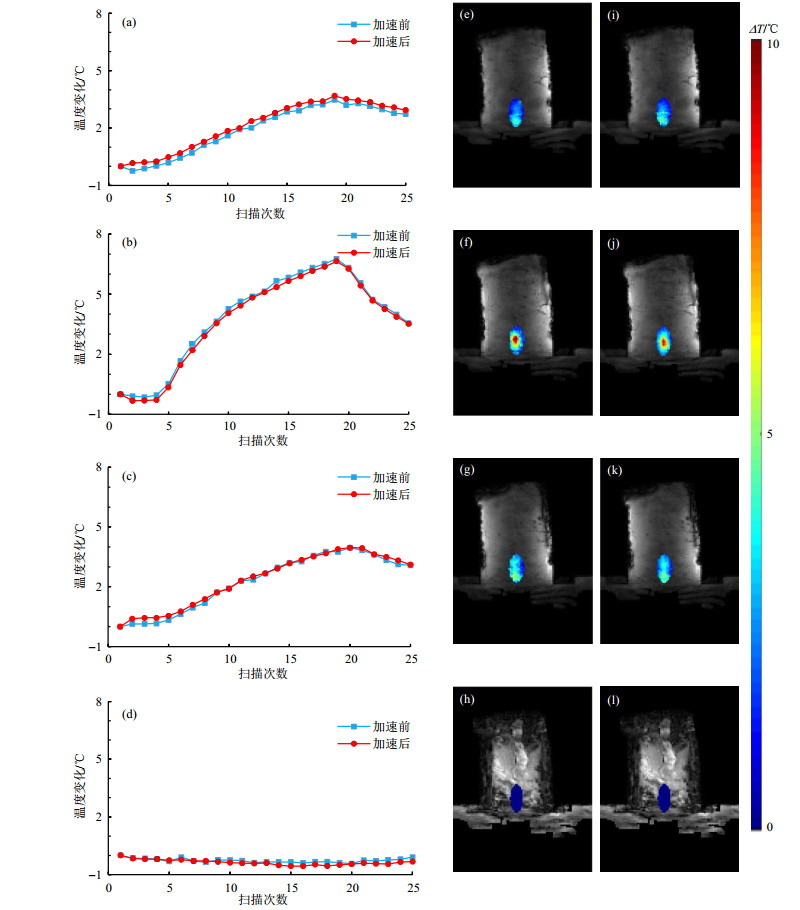
|
图 5 HIFU加热条件下的离体猪肉组织的MRT测温实验.(a)~(d)为5、6、7、12层加速前(蓝线)和加速后(红线)的温度变化曲线;(e)~(h)第15次扫描时,第5、6、7、12层加速前的温度变化图像;(i)~(l)第15次扫描时,第5、6、7、12层加速后的温度变化图像 Fig. 5 The MRT results of in vitro pork tissue with HIFU heating. (a)~(d) The temperature change curves before (blue variation MR line) and after (red line) acceleration of the 5th, 6th, 7th and 12th slices, respectively; (e)~(h) The temperature variation MR images before acceleration at the 15th measurement; (i)~(l) The temperature variation MR images after acceleration at the 15th measurement |
图 5(e)~(l)为第15次扫描时,第5层、第6层、第7层、第12层加速前后的温度变化图像.
3.4 讨论本文提出的基于回波平移序列并结合CAIPI技术的三维MRT方法十分适用于对HIFU治疗过程中进行测温监控,在保证测温精度的同时,具有较高的时间分辨率和较大的覆盖范围,在3 s内可以完成一次覆盖整个靶区的测温过程.
HIFU实验中焦点区域的长度大约为1.5 cm,实验中扫描的层数为12层,层厚为5 mm,因而12层足够包裹住整个焦点区域.当实际应用要求更大的监控范围时,可以牺牲空间分辨率,增加扫描层数.
本文结合CAIPI的方法实现采样加速,从实验中可以看出,利用CAIPI实现4倍加速后,MRT的测温不确定度提高了2.2倍,根据(3)式,理论上加速4倍后,不考虑线圈g因子,温度不确定度会提高2倍,因此在线圈设计上,仍然有一定的改善空间,以进一步减小由g因子导致的噪声放大问题.同时针对不同的应用设计相应的磁共振射频线圈,能够进一步改善图像信噪比,从而提高MRT的测量精度.
本研究的一个局限是加速过程是通过全采样的数据进行回顾式欠采完成的,在序列采集中完成加速和实时重建有待进一步实现.此外,本研究中线圈灵敏度预估是在加热前采集的预扫描数据中计算得到的,未来将灵敏度预扫描嵌入到MRI扫描中,可进一步提高线圈灵敏度预估的准确性.
4 结论本文提出了一种基于回波平移序列和CAIPI技术的三维超快速MRT方法.实验结果显示这种方法具有高时间分辨率、高精度和大覆盖范围的特点,十分适用于临床上对HIFU治疗进行测温监控.
| [1] | WU Z Q, KUMON R E, LAUGHNER J I, et al. Electrophysiological changes correlated with temperature increases induced by high-intensity focused ultrasound ablation[J]. Ultrasound Med Biol, 2015, 41(2): 432-448. |
| [2] |
NING R P, ZHU Y, LI G Y. A simple MR-compatible thermometer:design and applications[J].
Chinese J Magn Reson, 2010, 27(2): 157-162.
宁瑞鹏, 朱岩, 李鲠颖. 一种简单的MR兼容测温装置[J]. 波谱学杂志, 2010, 27(2): 157-162. DOI: 10.3969/j.issn.1000-4556.2010.02.003. |
| [3] | PALOMBO C, MALSHI E, MORIZZO C, et al. Arterial wave reflection during antihypertensive therapy with barnidipine:a 6-month, open-label study using an integrated cardiovascular ultrasound approach in patients with newly diagnosed hypertension[J]. Clin Ther, 2009, 31(12): 2873-2885. DOI: 10.1016/j.clinthera.2009.12.011. |
| [4] | MOONEN C T, LIU G, VAN G P, et al. A fast gradient-recalled MRI technique with increased sensitivity to dynamic susceptibility effects[J]. Magn Reson Med, 1992, 26(1): 184-189. DOI: 10.1002/mrm.1910260118. |
| [5] | CURTIS S L, ZAMBANINI A, MAYET J, et al. Reduced systolic wave generation and increased peripheral wave reflection in chronic heart failure[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1): H557-H562. DOI: 10.1152/ajpheart.01095.2006. |
| [6] | CHUNG Y C, DUERK J L. Signal formation in echo-shifted sequences[J]. Magn Reson Med, 1999, 42(5): 864-875. DOI: 10.1002/(SICI)1522-2594(199911)42:5<864::AID-MRM5>3.0.CO;2-8. |
| [7] | BANKSON J A, STAFFORD R J, HAZLE J D. Partially parallel imaging with phase-sensitive data:Increased temporal resolution for magnetic resonance temperature imaging[J]. Magn Reson Med, 2005, 53(3): 658-665. DOI: 10.1002/mrm.20378. |
| [8] | BREUER F A, BLAIMER M, MUELLER M F, et al. Controlled aliasing in volumetric parallel imaging (2D CAIPIRINHA)[J]. Magn Reson Med, 2006, 55(3): 549-556. DOI: 10.1002/mrm.20787. |
| [9] | DE P J, DE W C, DE D Y, et al. Noninvasive MRI thermometry with the proton resonance frequency (PRF) method:in vivo results in human muscle[J]. Magn Reson Med, 1995, 33(1): 74-81. DOI: 10.1002/mrm.1910330111. |
| [10] | CHUNG Y C, DUERK J L, SHANKARANARAYANAN A, et al. Temperature measurement using echo-shifted FLASH at low field for interventional MRI[J]. J Magn Reson Imaging, 1999, 9(1): 138-145. |
| [11] | DENOLIN V, AZIZIEH C, METENS T. New insights into the mechanisms of signal formation in RF-spoiled gradient echo sequences[J]. Magn Reson Med, 2005, 54(4): 937-954. DOI: 10.1002/mrm.20652. |
| [12] | BORMAN P T, BOS C, DE B T, et al. Towards real-time thermometry using simultaneous multislice MRI[J]. Phys Med Biol, 2016, 61(17): N461-N477. DOI: 10.1088/0031-9155/61/17/N461. |
| [13] | PENG Y H, ZOU C, QIAO Y Z. Fast MR thermometry using an echo-shifted sequence with simultaneous multi-slice imaging[J]. Magn Reson Mater Phy, 2018, 31(6): 771-779. DOI: 10.1007/s10334-018-0692-x. |
 2019, Vol. 36
2019, Vol. 36 
