2. 沈阳药科大学, 辽宁 沈阳 110016
2. Shenyang Pharmaceutical University, Shenyang 110016, China
核苷类药物广泛应用于肿瘤、病毒感染性疾病及其它疾病的临床治疗中.在使用化学法对天然核苷进行修饰时,往往需要对其碱基和核糖基团进行保护,因此发展新型有效的保护/脱保护方法对核苷的化学修饰来说至关重要.二齿硅烷类保护基团1, 1, 3, 3-四异丙基二硅氧烷基(TIPDS)可以有效地选择性保护核苷的3′-和5′-位羟基[1-3],而且对低浓度的酸溶液、碱溶液和一些氧化还原剂都不敏感.TIPDS保护基可以在含氟离子的试剂(如四丁基氟化铵)、0.2 mol/L HCl的二氧六环-水溶液(4:1)、NaOH的二氧六环-水溶液(> 0.2 mol/L)的作用下快速完全脱除.相比完全脱除,选择性脱除TIPDS保护的5′-位伯羟基在有机合成中具有更重要的价值.目前已有一些相关的研究报道,如0.2 mol/L HCl的二氧六环-水溶液(4:1)[2]、1 mol/L HCl的二氧六环溶液[4]、三氟乙酸-水-四氢呋喃体系(1:1:4,0 ℃)[5]以及SbCl3的乙腈-水溶液[6]都可以实现这种转化.但是上述方法选择性脱除TIPDS保护的伯羟基后,形成Si-OH键,硅原子上的羟基会导致TIPDS-OH基团更容易发生进一步水解脱落.本文采用氢氟酸吡啶鎓在5′-位选择性断裂TIPDS的Si-O键,得到游离的5′-OH,形成Si-F键.由于Si-F键的键能高于Si-O键,而且氟原子具有高电负性,因此形成的3-氟-1, 1, 3, 3-四异丙基二硅氧烷基保护基(TIPDS-F)稳定性得以保持.此方法操作简单、反应条件温和、反应时间短、产率高、重复性好,是一种有效地选择性脱除核糖5′-位羟基TIPDS保护基的方法.
本文采用了上述选择性脱保护的方法得到了核苷衍生物N-异丁酰基-3′-O-(1-氟-1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-3-基)-2′-苄氧羰基鸟苷(化合物1).该化合物未见文献报道,亦无相关信号归属报道.为了验证上述脱保护方法能够选择性断裂5′-位Si-O键,本文采集了化合物1的液相色谱串联质谱(LC-MS)、气相色谱-高分辨质谱(GC-HRMS)、液体1D和2D核磁共振(NMR)谱(包括1H NMR、13C NMR、19F NMR、DEPT135、DEPT90、1H-1H COSY、1H-13C HSQC和1H-13C HMBC)[7, 8],并对其1H、13C和19F NMR信号进行了归属,确定了其结构,验证了该脱保护方法的正确性.
1 实验部分 1.1 仪器与试剂LC-MS测试在Waters 3100单四极杆液质联用仪质谱系统上完成,GC-HRMS测试在VG ZAB-HS高分辨磁式气质联用仪上完成.1H NMR、13C NMR、19F NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱图均在Bruker Avance III-400型超导NMR谱仪上测定,使用PABBO-5 mm多核宽带探头.
氘代试剂(DMSO-d6、CD3OD、CDCl3和D2O,均为99.8%氘代,Cambridge Isotope Laboratories, Inc.)不含四甲基硅烷(TMS)内标;NMR样品管(ST-500,直径5 mm,NORELL).N-异丁酰基-3′, 5′-O-(1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-1, 3-二基)-2′-苄氧羰基鸟苷采用文献[9]方法制备,氢氟酸吡啶鎓(50%吡啶溶液,Sigma-Aldrich Co.),柱层析用硅胶(200~300目,青岛海洋化工有限公司),其他试剂均为市售分析纯,未经进一步纯化处理.
1.2 NMR实验NMR测试温度为298.6 K,样品分别溶于不含TMS内标的DMSO-d6、CD3OD和CDCl3.1H NMR、13C NMR和19F NMR的工作频率分别为400.13 MHz、100.62 MHz和376.46 MHz,谱宽分别为10 330.58 Hz、29 761.90 Hz和89 285.71 Hz.DEPT135、DEPT90采用标准脉冲序列,谱宽为18 498.9 Hz,采样累加次数为512.二维谱包括 1H-1H COSY、1H-13C HSQC及1H-13C HMBC谱,均采用标准脉冲程序.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为5 197.50 Hz,采样数据点阵t2 × t1 = 2 048×256,累加次数为16;1H-13C HSQC的F2(1H)和F1(13C)维谱宽分别为5 980.86 Hz和20 833.40 Hz,采样数据点阵t2 × t1= 1 024×256,累加次数为48;1H-13C HMBC的F2(1H)和F1(13C)维谱宽分别为5 197.50 Hz和22 123.32 Hz,采样数据点阵t2 ×t1 = 4 096×128,累加次数为16.
2 结果与讨论 2.1 化合物1的合成将21.47 g N-异丁酰基-3′, 5′-O-(1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-1, 3-二基)-2′-苄氧羰基鸟苷(29.41 mmol,1 eq.)溶解于300 mL二氯甲烷,室温条件下滴加12.82 g 50%氢氟酸吡啶鎓的吡啶溶液(64.71 mmol,2.2 eq.)后,继续室温下反应0.5 h.向反应液中加入150 mL水进行萃取获得有机层,有机层依次用水(100 mL×2)和饱和氯化铵水溶液(100 mL)清洗后,用无水硫酸镁干燥.减压蒸馏除去溶剂后得到23.25 g粗品.粗品经硅胶层析柱分离纯化,洗脱条件为[V(CH2Cl2):V(MeOH) = 100:0~30:1],得到白色胶状纯品20.04 g,产率为90.9%.化合物1的合成见图 1.

|
图 1 N-异丁酰基-3′-O-(1-氟-1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-3-基)-2′-苄氧羰基鸟苷(化合物1)的合成 Fig. 1 Synthesis of N-isobutyryl-3′-O-(1-fluoro-1, 1, 3, 3-tetraisopropyl-1, 3-disiloxane-3-yl)-2′-benzyloxycarbonyl-guanosine (compound 1) |
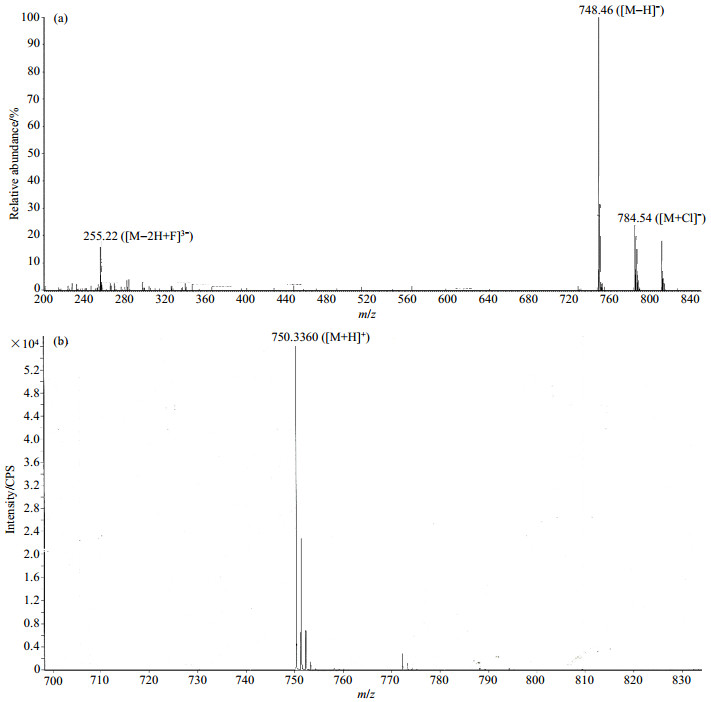
目标化合物1的LC-MS谱图如图 2(a)所示.在负离子检测模式下,经电喷雾离子源(ESI)电离后检测得到质荷比(m/z)为748.46的离子峰推测为准分子离子峰[M-H]-,m/z为784.54的离子峰推测为[M+Cl]-;同时得到m/z=255.22的主要碎片离子峰,根据化合物的结构特点,推测该离子峰为[M-2H+F]3-.目标化合物1的GC-HRMS谱图如图 2(b)所示,采用电子电离源(EI),正离子模式检测的m/z为750.336 0的[M+H]+,与目标化合物(分子式为C34H52FN5O9Si2、精确分子量为749.328 8)一致.
|
图 2 化合物1的质谱. (a) 液相色谱-串联质谱,负离子检测模式;(b) 气相色谱-高分辨质谱,正离子检测模式 Fig. 2 Mass spectra of compound 1. (a) LC-MS spectrum at negative ion detection mode; (b) GC-HRMS spectrum at positive ion detection mode |
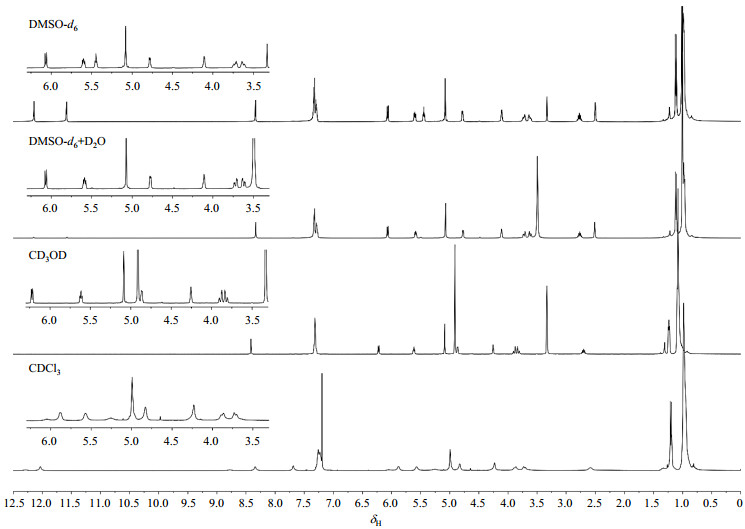
分别对化合物1的DMSO-d6、CD3OD和CDCl3溶液进行1H NMR 测试,并对其DMSO-d6溶液进行重水交换测试.测试结果表明,以DMSO-d6和CD3OD为溶剂时,化合物1的信号强度及裂分情况较为清晰,而CDCl3为溶剂时峰形不清晰,后述谱图的化学位移均为DMSO-d6为溶剂测试所得.
1H NMR谱图(图 3)展现了14组质子信号,可大致分为低场区(δH 7.00~12.50)、中间场区(δH 3.50~6.25)和高场区(δH 0.75~3.00)三个部分.通过对目标化合物结构的分析,可以大致判断出鸟苷部分两个活泼氢(H-1N,H-2N)、H-8,以及苯环上的质子(H-12~14)的信号位于低场区,核糖部分(H-1′~H-5′和H-OH)以及苄氧羰基的亚甲基质子(H-10)位于中间场区,而异丁酰基(H-2、H-3)和TIPDS-F上的质子(H-15~H-18)信号则位于高场区.
|
图 3 化合物1在DMSO-d6、DMSO-d6+D2O、CD3OD和CDCl3中的1H NMR谱 Fig. 3 The 1H NMR spectra of compound 1 in DMSO-d6, DMSO-d6+D2O, CD3OD and CDCl3 |
经重水交换后,δH 12.14、δH 11.58和δH 5.45处质子信号消失,表明这三个是活泼氢信号.通过分析信号峰的化学位移、峰型及其对应的积分面积,推测低场区δH 8.34(s, 1H)和δH 7.30(m, 5H)分别归属为H-8和苯环上H-12~14,中间场区δH 5.45(t, 1H)归属为H-OH,由于H-5'上的两个质子不等价,理论上该质子信号的峰形为dd峰,但由于J(H-5′a~H-OH) ≈ J(H-5′b~H-OH′),使得H-OH质子信号的裂分近似符合(n+1)规则,表现为t峰.δH 5.08(s, 2H)归属为苄氧羰基的亚甲基质子H-10.高场区δH 2.77(seven, 1H)和δH 1.12(d, 6H)分别归属为异丁酰基的H-2和H-3,δH 0.97~1.01(m,28H)则归属于TIPDS-F保护基.由于该保护基中部分氢原子受到氟原子的偶合而裂分,且各个质子化学位移比较接近,导致氢信号发生重叠,无法根据1D 1H-NMR谱图判断其具体归属.此外核糖上其他质子信号也无法通过1D 1H-NMR谱图进行归属,需要借助2D NMR谱图来确认.
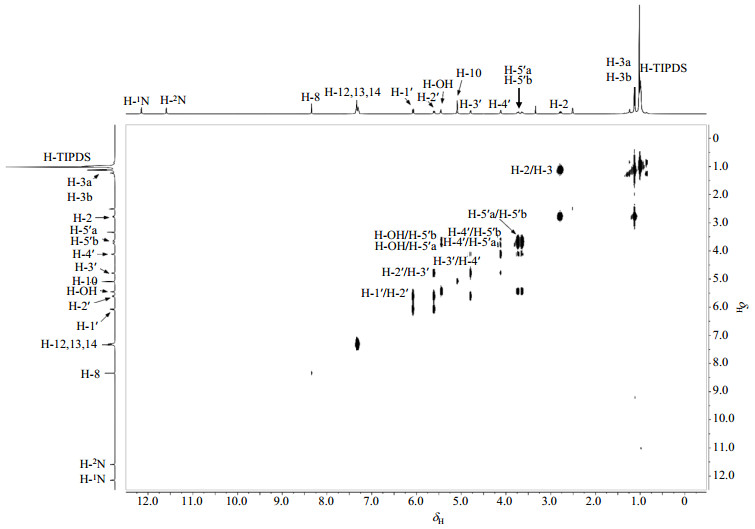
在1H-1H COSY谱图(图 4)中,δH 3.73(dt, 1H)和δH 3.63(dt, 1H)与H-OH相关,归属为H-5′a和H-5′b,这同时也证明了产物确实是底物5′-位Si-O键的选择性断裂产物.由于与C-5′相连的C-4′是手性碳原子,从而导致H-5′a和H-5′b磁不等价,在与H-OH和H-4′偶合的同时,还产生偕偶(Jgem=-12.0 Hz),理论上应该形成ddd峰,但是由于J(H-5′~H-OH) ≈ J(H-5′~H-4′) ≈ 4.0 Hz,使得H-5′a和H-5′b最终裂分为dt峰,并且可以在1H-1H COSY谱中观察到H-5′a和H-5′b的相关信号.δH 4.11(m, 1H)在COSY谱中与H-5′a和H-5′b相关,归属为H-4′,由于H-5′a和H-5′b磁不等价,导致H-4′信号裂分为多重峰.δH 4.78(dd, 1H)在COSY谱中与H-4′相关,归属为H-3′,同时还受到H-2′的偶合,其信号裂分为dd峰.δH 5.60(dd, 1H)与H-3′相关,归属为H-2′,同时还受到H-1′的偶合,其信号裂分为dd峰.δH 6.07(d, 1H)与H-2′相关,归属为H-1′,由于仅与H-2′的偶合,其信号裂分为d峰.核糖的C-1′与两个电负性较强的杂原子(氧原子和氮原子)直接相连,产生的诱导效应使H-1′邻近质子的电子云密度减小,削弱屏蔽效应,导致其化学位移向低场移动.
|
图 4 化合物1的1H-1H COSY谱图(DMSO-d6) Fig. 4 1H-1H COSY spectrum of compound 1 (DMSO-d6) |
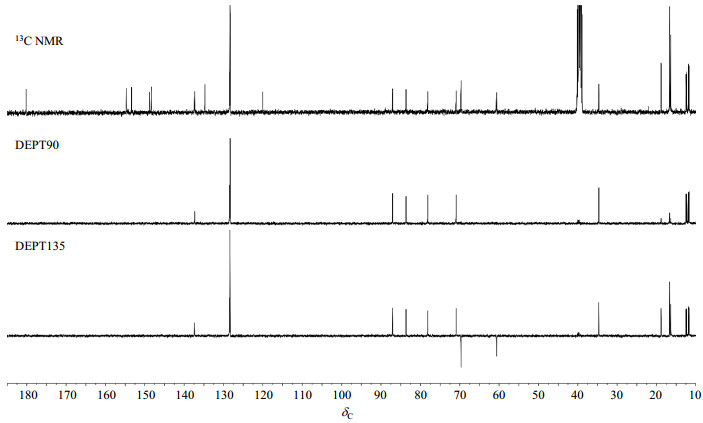
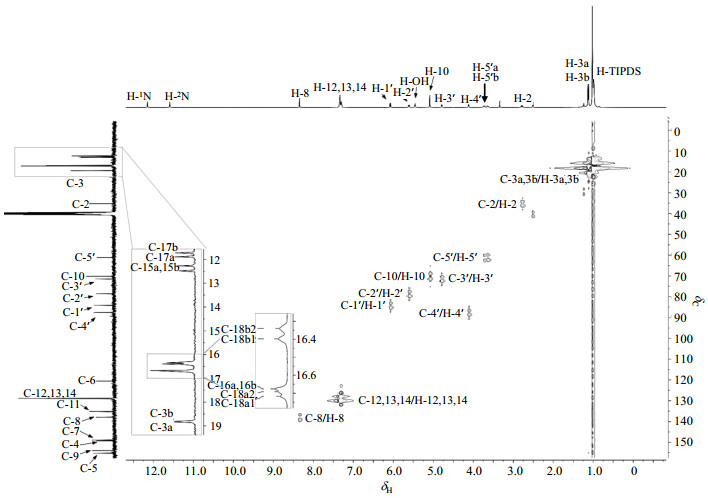
13C NMR谱图(图 5)显示29组13C核信号,与其1H NMR谱类似,也可大致分为低场区(δC 115.0~185.0)、中间场区(δC 60.0~90.0)和高场区(δC 10.0~40.0)三个部分.从DEPT谱(图 5)中可以判断它含有7个伯碳信号(δC 18.84、18.81、16.72、16.69、16.68、16.40、16.34)、2个仲碳信号(δC 69.67、60.66)、13个叔碳信号(δC 137.38、128.50、128.37、128.34、87.08、83.64、78.13、70.93、34.69、12.48、12.27、11.88、11.72)、7个季碳信号(δC 180.17、154.70、153.39、148.77、148.38、134.70、120.03),对其进行具体归属需要借助HSQC和HMBC谱来完成.
|
图 5 化合物1的13C NMR和DEPT谱(DMSO-d6) Fig. 5 13C NMR and DEPT spectra of compound 1 (DMSO-d6) |
在HSQC谱(图 6)中,叔碳δC 137.38与H-8相关,归属为C-8;叔碳δC 128.50、128.37和128.34这个三个叔碳信号与H-12~14相关,归属为C-12~14,但由于信号重叠,具体归属无法确定;δC 87.08与H-4′相关,归属为C-4′;δC 83.64与H-1′相关,归属为C-1′;δC 78.13与H-2′相关,归属为C-2′;δC 70.93与H-3′相关,归属为C-3′;仲碳δC 69.67与H-10相关,归属为C-10;仲碳δC 60.66与H-5′相关,归属为C-5′;δC 34.69与H-2相关,归属为C-2;δC 18.84和18.81与H-3相关,归属为C-3a和C-3b,产生两个碳信号的原因是异丁酰氨基具有部分双键性质,不能自由旋转,导致C-3a和C-3b所处化学环境不完全一致.剩余信号为TIPDS-F保护基上质子与对应碳原子的相关信号,由于该部分质子信号重叠在一起,因此也无法直接确定对应的碳原子.
|
图 6 化合物1的HSQC谱(DMSO-d6) Fig. 6 HSQC spectrum of compound 1 (DMSO-d6) |
由于硅原子的电负性小于碳原子,导致这些碳信号向高场移动.通过DEPT谱可以判断位于最高场的四个碳信号是叔碳,对应的是直接与硅原子相连的C-15a、C-15b、C-17a和C-17b,其中C-15a和C-15b受到电负性较大的氟原子的诱导效应,导致其化学位移较C-17a和C-17b移向低场.由于与C-17a和C-17b所连接的硅原子间隔两键的C-3′是手性碳原子,导致C-17a和C-17b相连的两个异丙基所处化学环境不一致,表现为6个碳信号,所以δC 16.72、16.69、16.40和16.34归属为这两个异丙基上的甲基碳信号C-18a1、C-18a2、C-18b1和C-18b2,δC 11.88和11.72归属为C-17a和C-17b;C-15a和C-15b基本不受此影响,但是这两个碳原子与氟原子间隔两键,受氟原子偶合裂分为双峰,所以δC 12.37(d, JC-F = 21.5 Hz)归属为C-15a和C-15b,δC 16.68归属为C-16a和C-16b.
在1H-13C HMBC谱(图 7)中,低场区δC 180.17与δH 11.58(s, 1H)、H-2和H-3存在远程相关,归属为C-1,δH 11.58归属为H- 2N,因此剩余的活泼氢信号δH 12.14归属为H-1N.δC 120.03和δC 148.38均与H-1N和H-8远程相关,由于C-7处于两个氮原子之间,化学位移较C-6移向高场,因此且δC 120.03归属为C-6,δC 148.38归属为C-7.δC 153.39与H-10和H-2′存在远程相关,归属为C-9.季碳δC 134.70与H-10和苯环氢信号存在远程相关,归属为C-11.此外还可观察到苯环上C-12、C-13和C-14与苯环上相应质子信号以及H-10之间存在的远程相关信息.
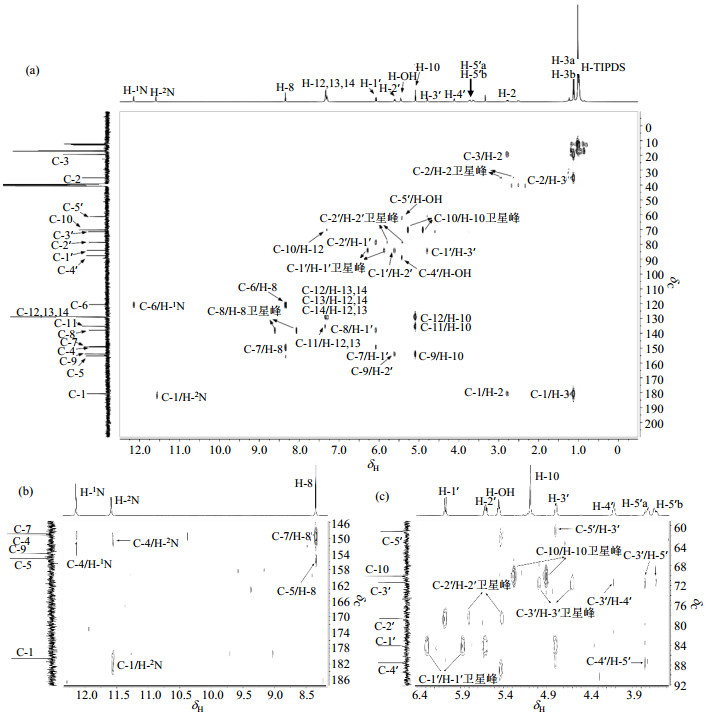
|
图 7 化合物1的HMBC谱. (a) 全谱;(b)和(c)为(a)的局部放大图(DMSO-d6) Fig. 7 HMBC spectra of compound 1. (a) Full spectrum; (b) and (c) are the partial enlarged spectra (DMSO-d6) |
该区域还有δC 154.70和δC 148.77两个季碳信号未归属,对应C-4和C-5.如果将该区域的峰信号放大,可以观察到它们的远程相关信号,尽管这些信号比较弱,但仍可与噪音信号相区别.如图 7(b)所示,δC 148.77与H-1N和H-2N都存在远程相关,归属为C-4;δC 154.70与H-8存在一个较弱的远程相关信号,归属为C-5,该信号是一个跨越四键的远程偶合.而且C-5作为羰基碳,化学位移理论上较C-4更偏向低场.如图 7(c)所示,在中间场区和高场区,通过观察已经得到归属的碳信号和氢信号,进一步验证了归属的正确性.值得注意的是,仅观察到了C-4′与H-OH的远程相关,但与H-5′的远程相关信号很弱,而且未观察到与H-3′的远程相关信号.类似地,也没有观察到C-2′与H-3′的远程相关信号,仅有C-1′与H-3′有明显的远程相关信号,而且C-3′与C-4′和H-5′的远程相关信号很弱.还观察到了C-5′与H-OH的远程相关,C-5′与H-3′的相关信号很弱,未观察到其与H-4′的相关信号.只有C-1′与H-2′和H-3′表现出明显的远程相关信息.此外,C-1′/H-1′、C-2′/H-2′、C-3′/H-3′、C-10/H-10和C-2/H-2的卫星峰也被观察到.
2.3.3 19F NMR谱图分析在质子去偶的19F NMR谱(图 8)中,可以观察到在δF -147.85处存在一个明显的单峰信号,归属为与硅原子直接连接的氟原子,与文献[10]报道相符;放大后可发现在该信号两侧存在一组卫星峰,推测该卫星峰是氟原子被硅原子偶合裂分产生的,且1JF-Si = 301.2 Hz.由于29Si原子的自旋量子数为1/2,自然界丰度为4.7%,因此在19F NMR谱中观察到1JF-Si是合理的.
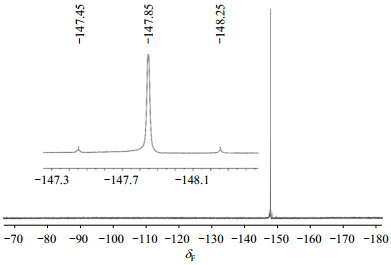
|
图 8 化合物1的19F NMR谱(DMSO-d6) Fig. 8 19F NMR spectra of compound 1 (DMSO-d6) |
通过对化合物1的1H NMR、13C NMR、19F NMR、DEPT135、DEPT90、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱的分析,确定了产物为原料核糖上5′-位Si-O键选择性断裂产物,并对其1H NMR和13C NMR信号进行了全部指认归属,结果见表 1.
| 表 1 N-异丁酰基-3′-O-(1-氟-1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-3-基)-2′-苄氧羰基鸟苷的1H和13C NMR归属(DMSO-d6) Table 1 1H and 13C NMR assignment of N-isobutyryl-3′-O-(1-fluoro-1, 1, 3, 3-tetraisopropyl-1, 3-disiloxane-3-yl) -2′-benzyloxycarbonyl-guanosine (DMSO-d6) |
本文首先使用氢氟酸吡啶鎓在核糖5′-位选择性断裂TIPDS保护基,得到了核苷衍生物N-异丁酰基-3′-O-(1-氟-1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-3-基)-2′-苄氧羰基鸟苷(化合物1),然后通过综合运用质谱与NMR技术分析了产物的氢-氢相关和碳-氢相关信息,准确地对产物的1H、13C和19F NMR进行了归属,确证了产物结构.本研究对核苷类化合物的化学修饰以及核苷类药物的开发具有一定的参考价值.
| [1] | MARKIEWICZ W, PADYUKOVA N, SAMEK Z, et al. The reaction of 1, 3-dichloro-1, 1, 3, 3-tetraisopropyldisiloxane with cytosine arabinoside and 1-(6-deoxy-α-L-talofuranosyl) uracil[J]. Collect Czech Chem Commun, 1980, 45(6): 1860-1865. DOI: 10.1135/cccc19801860. |
| [2] | KARPEISKY A, GONZALEZ C, BURGIN A, et al. Highly efficient synthesis of 2'-O-amino nucleosides and their incorporation in hammerhead ribozymes[J]. Tetrahedron Lett, 1998, 39(10): 1131-1134. DOI: 10.1016/S0040-4039(97)10784-5. |
| [3] | NISHIZONO N, SUMITA Y, UENO Y, et al. Effects of 2'-O-(trifluoromethyl) adenosine on oligodeoxynucleotide hybridization and nuclease stability[J]. Nucleic Acids Res, 1998, 26(22): 5067-5072. DOI: 10.1093/nar/26.22.5067. |
| [4] | HANESSIAN S, MACROTTE S, MAHARANI R, et al. Total synthesis of malayamycin A and analogues[J]. Tetrahedron, 2006, 62(22): 5201-5214. DOI: 10.1016/j.tet.2005.12.066. |
| [5] | ZHU X F, WILLIAMS H, SCOTT I. Aqueous trifluoroacetic acid—an efficient reagent for exclusively cleaving the 5'-end of 3', 5'-TIPDS protected ribonucleosides[J]. Tetrahedron Lett, 2000, 41(56): 9541-9545. |
| [6] | WU Q P, CHEN W, WANG Y, et al. Mild, efficient and highly selective hydrolysis of acetonides with antimony trichloride[J]. Lett Org Chem, 2006, 3(4): 271-274. DOI: 10.2174/157017806776114630. |
| [7] |
ZHOU Z G, YUAN Y Y, LIU H B, et al. An NMR study on prucalopride[J].
Chinese J Magn Reson, 2018, 35(1): 119-127.
周中高, 元洋洋, 刘红波, 等. 普卡必利的NMR研究[J]. 波谱学杂志, 2018, 35(1): 119-127. |
| [8] |
SUN W, SHE M Y, ZONG C L, et al. An NMR study on diacetonefructose[J].
Chinese J Magn Reson, 2017, 34(3): 329-337.
孙伟, 厍梦尧, 宗春蕾, 等. 果糖二丙酮的结构全归属[J]. 波谱学杂志, 2017, 34(3): 329-337. |
| [9] | TIMOSHCHUK V, HOGREFE R, VAGHEFI M. Improved and reliable synthesis of 3'-azido-2', 3'-dideoxyguanosine derivatives[J]. Nucleosides, Nucleotides and Nucleic Acids, 2004, 23(1-2): 171-181. DOI: 10.1081/NCN-120027826. |
| [10] | 张正行. 有机光谱分析[M]. 北京: 人民卫生出版社, 2009. |
 2019, Vol. 36
2019, Vol. 36 
