2. 中国科学院大学, 北京 100049;
3. 华烁科技股份有限公司, 湖北省化学研究院, 湖北 武汉 430074
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Haiso Technology Co. Ltd., Hubei Research Institute of Chemistry, Wuhan 430074, China
乙二醇是一种无色、无味,可与水以任意比例互溶的液体,也是一种与人们日常生活密切相关的重要的基础化工原料,广泛用于生产涤纶纤维、涂料、包装用聚酯树脂、防冻剂、润滑剂、炸药以及医药中间体等[1-3].
我国作为全球最大的乙二醇消费国,年消耗量高达1 300万吨,但年自主产量不到500万吨,即年进口量高达800万吨,而且这一数字随着未来几年国内市场的旺盛需求而持续增加[4-6].目前,在传统的工业大生产中,乙二醇的制备主要采用乙烯(一种重要的石油产品)为原料,而随着石油资源的逐渐枯竭,加之国内的乙烯严重依赖进口,一方面导致了国内乙二醇自主产量的严重不足,另外一方面导致了国内乙二醇的生产成本远高于国外同等产品,产品的市场竞争力严重不足[6].显然,改变传统的乙二醇工业制备路线迫在眉睫.目前,我国率先开发了以煤为原料生产乙二醇的技术,年产量已达百万吨.煤基乙二醇法的出现,不但丰富了乙二醇的制备路线,而且可以充分利用我国丰富的煤资源,改善乙二醇严重依赖进口的局面[3].
乙二醇主要作为纺织纤维的原料,其所含的微量杂质,特别是含有次甲基的1, 2-丁二醇,在长期存储过程中易被氧化;在与二元酸聚合后的聚酯纤维中,由于乙基支链的存在,导致其结晶度、熔点及规整度的降低,从而造成聚酯切片色度不合格、纺丝困难、染整不均匀等问题[3, 7].聚合级乙二醇的有机杂质含量极低,且沸点和挥发度非常接近,导致这类有机杂质的分析非常困难.相对于成熟的石油制备路线已有完整的杂质数据库,煤基乙二醇的杂质研究尚不够深入,尤其欠缺关键特征杂质的快速分析技术.在煤基乙二醇的诸多杂质中,从反应机理看[7],在含次甲基的所有杂质中,1, 2-丁二醇(化学式为CH3CH2CHOHCH2OH)的含量最高,而丙二醇等其它含三级氢的多元醇的含量极少[8],因此快速鉴定杂质中是否含有1, 2-丁二醇对煤基乙二醇的工艺路线的优化具有非常重要的指导意义.
众所周知,核磁共振(nuclear magnetic resonance,NMR)波谱是强有力的定性分析工具[9-11],但受限于NMR过低的灵敏度,目前,混合体系中痕量/微量组分的结构分析依然充满诸多挑战.虽然可先通过物理分离、富集,然后再测定的的方法来解决,但该方法除会导致分析成本增加外,同时也会带来一定的操作误差。聚合级乙二醇的含量高达99.8%以上,且乙二醇在NMR谱上仅出现一个共振信号(溶剂为重水时);另外,考虑到在超低温探头条件下,NMR实验的信噪比有3~4倍的增强,因此本文利用多信号抑制技术,通过抑制乙二醇以及溶剂信号的方法,在配备了超低温探头的谱仪上对不同工艺条件下的煤制聚合级乙二醇中的杂质进行了研究.
1 实验部分 1.1 仪器与试剂实验所用的重水(氘代率为99.9%)和3-(三甲基硅基)丙酸钠(sodium trimethylsilylpropionate,TSP,结构为Me3Si-CD2CD2-CO2Na,氘代率为98%)购自美国剑桥同位素实验室.
所有的NMR实验均在配备了三共振(TXI)超低温探头的Bruker AVANCE Ⅲ 700型NMR谱仪上完成,其质子的共振频率为700.2 MHz.
所有的乙二醇样品均由湖北省化学研究院的孔渝华课题组提供.根据不同工艺条件制得的煤制聚合级乙二醇,分别配制了三个样品(依次编号为1、2、3),另外,配制了一个石油法制备的乙二醇样品和一个对照样品,对照样品是在样品3中加入浓度为450 mg/kg的1, 2-丁二醇.
1.2 实验方法取450 μL样品于EP管中,加入50 μL含适量TSP的重水用于定标和锁场,充分混匀后转移至直径为5 mm的NMR样品管,密封保存.
1.3 NMR实验由于溶剂信号(δH 5.20)和主产物乙二醇的信号(δH 3.62)完全掩盖了杂质1, 2-丁二醇的NMR信号,故在两个射频通道分别对这两个信号进行饱和,第一通道用W5脉冲[12]压制溶剂信号,第二个通道用低功率连续波脉冲[13]饱和乙二醇信号,脉冲序列见文后补充材料:溶剂峰压制脉冲序列.1H NMR谱宽为14 005.6 Hz,采样点数为32 k,空扫8次,累加128次,弛豫等待时间为2 s.
由于样品粘度较大,分子运动受限,常温下难以获得高分辨率的NMR谱,本文所有的NMR实验均在308 K下进行,以便获得较为理想的NMR谱.
2 结果与讨论 2.1 多信号抑制图谱图 1(a)为样品1的单脉冲1H NMR谱,显然,除了溶剂信号和乙二醇信号外,得不到任何有关杂质的信息.而对溶剂信号和乙二醇信号饱和后,无论是处于高场区的,还是低场区的杂质质子信号均清晰可见,而且谱图基线平整,如图 1(b)所示.实验过程中,可根据实验需要,选择性对溶剂信号和乙二醇信号同时进行压制,亦可仅对溶剂信号进行饱和.

|
图 1 信号压制(a)前和(b)后样品1的1H NMR谱图对比 Fig. 1 1H NMR spectra of sample 1 before (a) and after (b) signal suppression |
煤基乙二醇的反应机理[7]决定了经过常规分离、精馏后含量达99.8%以上的煤制聚合级乙二醇样品中,1, 2-丁二醇为含三级氢的主要杂质(CH3CH2OH、CH3CH2CH2OH等一元醇由于化学性质差别较大而易被分离).因此在NMR谱图上,只要出现CH3CH2的特征峰,便可证明1, 2-丁二醇的存在.对于1, 2-丁二醇的CH3CH2基团,甲基质子受亚甲基两个质子(CH2)的耦合影响,在高场区会裂分成三重峰(尽管亚甲基上两个质子不等价,但它们与甲基质子的耦合常数差别较小,在谱图上表现为三重峰),而亚甲基的两个不等价质子受甲基质子(CH3)和次甲基质子(CH)的耦合影响,将在高场区出现两个多重峰,且化学位移比甲基质子略大.据此,可对3个煤制聚合级乙二醇样品中是否存在1, 2-丁二醇杂质做出快速判断.
三个煤制法样品的1H NMR谱的高场区(δH 0.65~2.20)如图 2所示.从图中我们可以看出,样品1[图 2(a)]在δH 0.94处存在一个三重峰,而在δH 1.51和δH 1.40处出现了两个多重峰,刚好与1, 2-丁二醇的甲基和亚甲基质子的两个特征峰吻合(箭头所指的位置),且两者的积分面积比约为3:2(积分方法可参考下文定量分析),据此可判断样品1中存在1, 2-丁二醇杂质,且含量较高;样品2[图 2(b)]尽管在δH 0.94处存在一个对应信号(可能来源其它杂质),但在δH 1.51处未发现亚甲基质子信号;而样品3[图 2(c)]在δH 0.94、1.40、1.51三处位置均未出现与1, 2-丁二醇相对应的特征信号,因此可认为样品2和3中不存在1, 2-丁二醇,或者其含量已低于NMR技术的检测限.另外,从图 2还可以看出,样品3的杂质种类相对其它两个样品较少,且含量更低.与此同时,我们对石油法制备的乙二醇样品的杂质同样进行了分析,其1H NMR谱如图 2(d)所示,显然,石油法制备的乙二醇存在1, 2-丁二醇,其特征信号如图 2箭头所示.
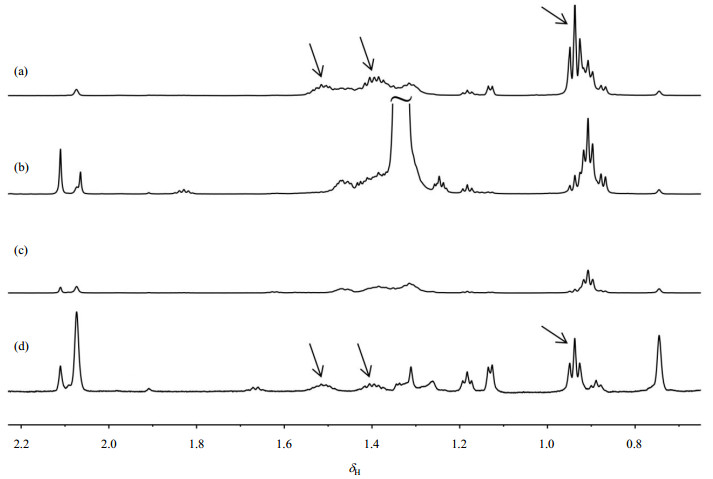
|
图 2 (a) 样品1、(b)样品2、(c)样品3和(d)石油法制得的样品的1H NMR谱(高场区),其中图(d)纵向放大15倍 Fig. 2 High field region of 1H NMR spectra of sample 1 (a), 2 (b), 3 (c) and the sample from petroleum route (d), Fig. (d) was longitudinally amplified for 15 times |
为了进一步证实基于特征信号的峰型分析的结论是可靠的,我们制备了一个对照样品,对照样品是在样品3中加入了1, 2-丁二醇,这样保证了对照样品中1, 2-丁二醇分子所处的液态环境和样品3中1, 2-丁二醇杂质分子的液态环境类似,避免了由于溶液条件的改变导致化学位移的微弱变化.通过对比对照样品和样品3的谱图(如图 3所示),可以发现样品3并不出现1, 2-丁二醇的特征信号,这进一步证实了样品3中要么不存在该杂质,要么该杂质的含量低于NMR检测限.

|
图 3 (a) 对照样品和(b)样品3的1H NMR谱,以及(c)二者的差谱(δH 0.6~1.9) Fig. 3 1H NMR spectra of control sample (a), sample 3 (b), and their differential spectrum (c) (δH 0.6~1.9) |
从图 2可以看出,由于谱峰重叠,通过直接比较积分面积的方法难以准确地分析样品1中的1, 2-丁二醇的含量.对于对照样品,由于是在样品3中加入了已知含量的1, 2-丁二醇,因此从对照样品与样品3的差谱中可得到1, 2-丁二醇的干净谱图,如图 3所示.因此,图 3差谱的积分面积可准确衡量已知含量1, 2-丁二醇(450 mg/kg)的积分面积.同样地,对于样品1,杂质1, 2-丁二醇的特征峰与其他杂质峰有部分重叠(见图 2),积分时,无论是直接截取甲基信号还是亚甲基信号,均不能准确测量1, 2-丁二醇的积分面积.不过,从图 2可以看出,样品1的δH 0.94处的甲基峰与其它谱峰的重叠仅发生在谱峰的右侧,左侧完全不受重叠的影响,而甲基质子信号在NMR谱图上通常是左右完美对称的,因此甲基信号的积分面积可以通过左侧积分面积乘以系数2的方式获得,截取示意图如图 4所示:从峰中心轴向低场方向截取适当距离(δr),积分后乘以系数2作为最终的积分面积.

|
图 4 峰面积截取示意图 Fig. 4 The sketch map of peak area to be selected |
根据定量NMR的原理[14],本文所有实验样品中的1, 2-丁二醇的含量可计算如下:
| $ {C_{{\rm{exp}}}} = \frac{{{A_{\rm{s}}}}}{{{A_{\rm{d}}}}} \times 450 $ | (1) |
其中,Cexp为待测样品中1, 2-丁二醇含量,As为待测样品中1, 2-丁二醇特征峰的积分面积,Ad为差谱[图 3(c)]中1, 2-丁二醇特征峰的积分面积.由于所有样品实验中均加入了一定体积的重水,Cexp并不能反应1, 2-丁二醇的真实浓度,样品稀释前1, 2-丁二醇的浓度Creal需校正如下:
| $ {C_{{\rm{real}}}} = \frac{{{V_{\rm{a}}}}}{{{V_{\rm{b}}}}} \times {C_{\exp }} $ | (2) |
其中,Vb、Va为原始样品稀释前后的体积,在本实验中,分别对应450 μL和500 μL.根据(1)式和(2)式计算得到在不同截取距离(δr)条件下,样品1中的1, 2-丁二醇的含量见表 1.
| 表 1 不同截取距离(δr)计算出的样品1中1, 2-丁二醇杂质的含量 Table 1 The content of 1, 2-butanediol impurities in sample 1 calculated at different δr |
从表 1中可以看出,对于不同的截取距离,各计算结果差距极小,这表明本文提出的半谱峰积分方法可以克服信号重叠的影响,确保积分结果准确可靠.同样地,据此方法,对石油法制备的样品中1, 2-丁二醇含量进行了计算(选取δr = 0.05),结果如表 2所示.
| 表 2 不同样品中1, 2-丁二醇的含量 Table 2 The content of 1, 2-butanediol in different samples |
综上分析,不管从1, 2-丁二醇杂质的含量还是其它副产物的含量上比较,煤制聚合级乙二醇的三个样品中,样品3对应的工艺条件最优.进一步分析煤制聚合级乙二醇样品3和石油法制备的乙二醇的1H NMR谱(所有条件一致),可以发现石油法制备的乙二醇杂质总含量较低,但NMR谱上依然可辨识到1, 2-丁二醇的微弱特征信号[图 5(a)中“*”标记];而煤制聚合级乙二醇的工艺虽然可以控制1, 2-丁二醇处在极低的水平(NMR谱上几乎看不见),但其它有机杂质含量较高,如图 5(b)所示(低场区信号极少,故不显示全谱).

|
图 5 (a) 石油法制备的乙二醇样品和(b)样品3的1H NMR谱图对比. *标记的信号为1, 2-丁二醇的特征峰 Fig. 5 Comparison of 1H NMR spectra of the sample from petroleum route (a) and sample 3 (b). * Specific signals of 1, 2-butanediol |
本文发展了一种有效的NMR分析方法用于鉴定并定量分析煤制聚合级乙二醇中关键杂质——1, 2-丁二醇.实验结果表明,优化后的煤制法工艺路线,1, 2-丁二醇的含量极少,甚至不产生该杂质,但其它有机杂质的总含量和种类均超过了石油法路线.本文的研究结果不但为煤制聚合级乙二醇工艺路线的优化提供了指导依据,而且有望为混合体系的快速定性和定量研究提供一种新思路.
补充材料溶剂峰压制脉冲序列:
#include <Avance.incl>
#include <Grad.incl>
"d12=20u"
"d13=4u"
"acqt0=-p1*2/3.1416"
1 ze
d12 pl21:f2
2 30m
d12 pl1:f1
d1 cw:f2 ph29
d13 do:f1 do:f2
10u
p1 ph1
50u UNBLKGRAD
p16:gp1
d16 pl18:f1
p27*0.087 ph3
d19*2
p27*0.206 ph3
d19*2
p27*0.413 ph3
d19*2
p27*0.778 ph3
d19*2
p27*1.491 ph3
d19*2
p27*1.491 ph4
d19*2
p27*0.778 ph4
d19*2
p27*0.413 ph4
d19*2
p27*0.206 ph4
d19*2
p27*0.087 ph4
50u
p16:gp1
d16
4u
p16:gp2
d16
p27*0.087 ph5
d19*2
p27*0.206 ph5
d19*2
p27*0.413 ph5
d19*2
p27*0.778 ph5
d19*2
p27*1.491 ph5
d19*2
p27*1.491 ph6
d19*2
p27*0.778 ph6
d19*2
p27*0.413 ph6
d19*2
p27*0.206 ph6
d19*2
p27*0.087 ph6
p16:gp2
d16
4u BLKGRAD
go=2 ph31
30m mc #0 to 2 F0(zd)
exit
ph29=0
ph1=0 2
ph3=0 0 1 1 2 2 3 3
ph4=2 2 3 3 0 0 1 1
ph5=0 0 0 0 0 0 0 0 1 1 1 1 1 1 1 1
2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 3
ph6=2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 3
0 0 0 0 0 0 0 0 1 1 1 1 1 1 1 1
ph31=0 2 2 0 0 2 2 0 2 0 0 2 2 0 0 2
; pl1 : f1 channel - power level for pulse (default)
; pl18: f1 channel - power level for 3-9-19-pulse (watergate)
; p1 : f1 channel - 90 degree high power pulse
; p16: homospoil/gradient pulse
; p27: f1 channel - 90 degree pulse at pl18
; d1 : relaxation delay; 1-5 * T1
; d16: delay for homospoil/gradient recovery
; d19: delay for binomial water suppression
; d19 = (1/(2*d)), d = distance of next null (in Hz)
; ns: 8 * n, total number of scans: NS * TD0
; ds: 4
; use gradient ratio: gp 1 : gp 2
; 34 : 22
; for z-only gradients:
; gpz1: 34%
; gpz2: 22%
; use gradient files:
; gpnam1: SMSQ10.100
; gpnam2: SMSQ10.100
| [1] | YUE H R, ZHAO Y G, MA X B, et al. Ethylene glycol:properties, synthesis, and applications[J]. Chem Soc Rev, 2012, 41(11): 4218-4224. DOI: 10.1039/c2cs15359a. |
| [2] |
SHAO S Y, ZHU G S, WANG Z H. The present situation and development prospect of coal to ethylene glycol[J].
Shandong Chem Ind, 2017, 46(2): 30-31.
邵守言, 朱桂生, 王忠华. 煤制乙二醇的现状及发展前景[J]. 山东化工, 2017, 46(2): 30-31. DOI: 10.3969/j.issn.1008-021X.2017.02.013. |
| [3] |
LI Q, JIANG M F. Technical progress and technical economy analysis of coal-based ethylene glycol production process[J].
Shanghai Chem Ind, 2016, 41(3): 23-31.
李清, 蒋美芬. 煤制乙二醇生产工艺技术进展及技术经济分析[J]. 上海化工, 2016, 41(3): 23-31. DOI: 10.3969/j.issn.1004-017X.2016.03.007. |
| [4] |
LI D H, WANG H B. Market and technology progress of syngas to ethylene glycol[J].
Mod Chem Ind, 2017, 37(1): 5-10.
李代红, 王洪波. 合成气制乙二醇市场及技术进展[J]. 现代化工, 2017, 37(1): 5-10. |
| [5] |
DING G R. Analysis and forecast of the market of ethylene glycol at home and abroad[J].
Acetaldehyde Acetic Acide Chem Ind, 2017, 5: 14-17.
丁国荣. 国内外乙二醇市场分析及预测[J]. 乙醛醋酸化工, 2017, 5: 14-17. |
| [6] |
LIU L Y. Study of China's coal-to-ethanediol industry development[J].
Contemp Chem Ind, 2016, 12: 74-75.
刘凌云. 我国煤制乙二醇产业发展研究[J]. 当代化工研究, 2016, 12: 74-75. |
| [7] |
ZHENG Y J, ZHENG Y, HAN L G, et al. Analysis and effect of impurities on UV transmittance of coal-based ethylene glycol[J].
Guangzhou Chem Ind, 2016, 44(12): 111-113.
郑永军, 郑勇, 韩联国, 等. 影响煤基乙二醇紫外透光率杂质分析[J]. 广州化工, 2016, 44(12): 111-113. DOI: 10.3969/j.issn.1001-9677.2016.12.040. |
| [8] |
KONG H N, ZHENG W. Impurity analysis and lifting method of UV value of coal based ethylene glycol[J].
Jiangsu Sci Technol Info, 2015, 28: 63-64.
孔会娜, 郑卫. 煤基乙二醇UV值的杂质分析及提升方法[J]. 江苏科技信息, 2015, 28: 63-64. |
| [9] | FULMER G R, MILLER A J M, SHERDEN N H, et al. NMR chemical shifts of trace impurities:common laboratory solvents, organics, and gases in deuterated solvents relevant to the organometallic chemist[J]. Organometallics, 2010, 29(9): 2176-2179. DOI: 10.1021/om100106e. |
| [10] |
JIANG Y M, ZOU Y Y, HUANG T, et al. NMR Fingerprints of Eucommia ulmoides Oliver[J].
Chinese J Magn Reson, 2017, 34(4): 453-464.
姜阳明, 邹云云, 黄滔, 等. 杜仲的核磁共振指纹图谱研究[J]. 波谱学杂志, 2017, 34(4): 453-464. |
| [11] |
SUN L J, HU X F, CHENG X, et al. NMR Characterization of Flavanone Naringenin 7-O-Glycoside Diastereomer[J].
Chinese J Magn Reson, 2017, 34(4): 465-473.
孙丽娟, 胡小芳, 程寻, 等. 柚皮素467-O-葡萄糖苷非对映异构体的NMR波谱分析[J]. 波谱学杂志, 2017, 34(4): 465-473. |
| [12] | LIU M L, MAO X A, YE C H, et al. Improved WATERGATE pulse sequences for solvent suppression in NMR spectroscopy[J]. J Magn Reson, 1998, 132(1): 125-129. DOI: 10.1006/jmre.1998.1405. |
| [13] | REDFIELD A G, GUPTA R K. Pulsed fourier-transform NMR spectrometer for use with H2O solutions[J]. J Chem Phys, 1971, 54(3): 1418-1419. DOI: 10.1063/1.1674990. |
| [14] | BHARTI S K, ROY R. Quantitative 1H NMR spectroscopy[J]. Trac-Trend anal Chem, 2012, 35: 5-26. DOI: 10.1016/j.trac.2012.02.007. |
 2019, Vol. 36
2019, Vol. 36 
