2. 中国科学院大学, 北京 100049;
3. 遗传工程国家重点实验室, 复旦大学 生命科学学院, 附属中山医院, 人类表型组研究院, 上海 200438
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. State Key Laboratory of Genetic Engineering, Zhongshan Hospital and School of Life Sciences, Human Phenome Institute, Metabonomics and Systems Biology Laboratory at Shanghai International Centre for Molecular Phenomics, Fudan University, Shanghai 200438, China
代谢组分析是研究基因和环境因素引起的代谢表型变化的有效手段[1, 2],是认识生命过程分子基础的重要突破口,已经被广泛应用于病理学、营养学和毒理学等领域[3-6].目前代谢组分析的对象包括体液、动植物组织、粪样、细胞和微生物等.这些样品通常需要前处理才能用于代谢组检测分析,因此,样品前处理已成为代谢组分析的重要环节之一.例如:动植物组织、粪样、细胞和微生物等生物样品常常需要经过萃取才能进行代谢组分析[7-9],这个过程通常包括“破碎萃取-溶剂去除-样品复溶”的过程.体液等生物样品也常常需要去除水分以确保对水敏感的衍生化反应顺利进行,如气相色谱-质谱(gas chromatography-mass spectrum,GC-MS)分析前的硅烷化反应[10]和液相色谱-质谱(liquid chromatography-mass spectrum,LC-MS)分析前的部分同位素衍生化反应[11]等.因此,溶剂去除已经成为样品前处理的重要步骤.
冷冻干燥可以将生物样品中的溶剂在真空和低温环境中通过由固态变成气态的升华过程快速去除,同时还可以抑制酶活,因此已经成为代谢组分析中样品前处理的重要技术之一.已有研究表明冷冻干燥不仅会降低易挥发性代谢物的含量[12],也会破坏细胞膜的结构[13],促进蛋白质的降解[14],还可能会引起生物样品中羧酸类代谢物、氨基酸和胆碱等代谢物含量的改变[15-17].但是,目前冷冻干燥对生物样品代谢组分析影响的研究相对较少,而且已有的研究[12, 15]主要集中在植物营养成分.对于难以控制水分含量的尿液及水肿组织等生物样本,冷冻干燥除去水分后所得到的总固体重量也可以用于代谢组数据归一化,但此除水过程会影响哪些物质的含量仍不清楚.
尿液和血液等体液中含有氨基酸、有机羧酸、胆碱、脂类和肠道菌群共代谢产物等多种代谢物.这些代谢物也是动植物组织、粪样、细胞和微生物等样品的主要成分,其组成和含量变化与机体的生理病理状态密切相关.此外,体液样品的收集相对简单,已经被广泛应用到代谢组学研究中.核磁共振(nuclear magnetic resonance,NMR)技术可以实现体液样品在接近生理条件下的无偏向高通量无损检测,是代谢组分析重要的检测技术之一.本文以人类尿液和血清样品为研究对象,采用NMR技术分析冷冻干燥对尿液和血清代谢组分析结果的影响,为代谢组学研究样品前处理和数据归一化方式的选择提供重要的基础数据.
1 实验部分 1.1 化学试剂重水(D2O,99%氘代)购于西格玛奥德里奇(上海)贸易有限公司;2, 2, 3, 3-氘代三甲基硅烷丙酸钠(2, 2, 3, 3-trimethylsilyl propionic acid-D4,TSP,98%氘代)购于剑桥同位素实验室;分析纯三水磷酸氢二钾(K2HPO4·3H2O)、二水磷酸二氢钠(NaH2PO4·2H2O)和氯化钠(NaCl)购自上海国药集团化学试剂有限公司.
1.2 样品收集本研究使用的尿液和血清样品均来源于人群队列研究,志愿者均属健康成人,该研究通过了相关机构的伦理审批且获得了志愿者的知情同意.样品收集后立即液氮速冻,-80 ℃冰箱保存.
1.3 样品制备尿液样品(n=8)在室温下解冻,取0.6 mL样品进行冷冻干燥处理24 h(真空度0.02 bar,冷阱温度为-55 ℃).所得粉末用0.6 mL双蒸水复溶,记为冷冻干燥组,对应的等量未经冷冻干燥处理的尿液样品为对照组.在上述两组样品中分别加入60 μL用于尿液配制用的磷酸盐缓冲液(1.5 mol/L K2HPO4/NaH2PO4,pH 7.43,100% D2O,6.22 mmol/L TSP),涡旋震荡30 s混匀并离心(4 ℃,16 099 g,10 min)后,各取上清液0.55 mL转移至直径5 mm NMR样品管待检.
血清样品(n=12)在室温下解冻,取0.2 mL样品进行上述冷冻干燥处理24 h.所得粉末用0.2 mL双蒸水复溶,记为冷冻干燥组,对应等量未处理的血清样品为对照组.在上述两组样品中各加入0.4 mL用于血清配制的磷酸盐缓冲液(45 mmol/L K2HPO4/NaH2PO4,pH 7.43,50% D2O),涡旋震荡30 s混匀且离心(4 ℃,16 099 g,10 min)后,各取上清液0.55 mL转移至5 mm NMR样品管待检.
1.4 样品检测1H NMR实验在配备超低温探头的Bruker AVIII 600 MHz NMR谱仪上完成(Bruker Biospin,Germany),质子共振频率为600.13 MHz,实验温度为298 K.尿液样品的检测采用noesygppr1d(RD-90˚-t1-90˚-tm-90˚-ACQ)脉冲序列,参数如下:谱宽(SW)设为20 ppm,等待时间(RD)设为2 s,混合时间(tm)设为100 ms,t1设为4 μs,90˚脉宽(p1)约为10 μs,采样点数(TD)为32 k,采样时间(AQ)为1.36 s,累加扫描64次.血清样品的检测采用CPMGPR [RD-90˚-(τ-180˚-τ)n-ACQ]脉冲序列,参数如下:SW设为20 ppm,RD设为2 s,tm设为100 ms,t1设为4 μs,p1约为10 μs,TD设为32 k,AQ为1.36 s,累加扫描64次,回波演化时间τ(d20)设为350 μs,回波循环n(L4)设为100,总回波时间(2nτ)为70 ms.
二维谱的实验参数参考文献[3].
1.5 数据分析所有1H NMR谱图经傅里叶变换、手动校正相位和基线后,尿液样品NMR谱图用TSP进行化学位移定标(δH 0.00),血清样品NMR谱图用α-葡萄糖的H-1信号进行化学位移定标(δH 5.23).使用Amix软件(V3.9.15,Bruker Biospin)对谱图进行分段积分,积分间隔为1.2 Hz.尿液谱图的积分区间为δH 0.50~10.00,并去除δH 4.61~5.17区间的水峰残余信号和δH 5.60~6.24区间的尿素信号;血清谱图的积分区间为δH 0.50~9.00,且去除δH 4.47~5.17区间的水峰残余信号和δH 5.50~6.50区间的尿素信号.对尿液积分数据进行概率熵归一化[18],对血清积分数据进行血清体积归一化[3].代谢物的NMR信号通过二维谱COSY、TOCSY、JRES、HSQC和HMBC,以及实验室的数据库进行归属.在尿液中共归属到36种代谢物,在血清中共归属到26种代谢物(图S1和表S1,扫描文章首页OSID码,或者在论文网络版查看附件).同时,选择与其他信号不重叠的代谢物特征信号进行整个峰面积的积分(使用归一化后的数据进行积分,积分区间见附件中表S2和S3),该信号的峰面积代表该代谢物的相对含量.将代谢物的相对含量数据导入Simca-P+软件(V14.1,Umetrics,Umeå,Sweden)进行多变量统计分析.使用主成分分析(principal component analysis,PCA)初步判断样品的聚集离散程度,结果采用得分图进行展示.使用正交偏最小二乘法判别分析(orthogonal projection to latent structure discriminant analysis,OPLS-DA)[19]得到组间有显著性差异的代谢物,结果采用得分图和相关系数负载图进行展示.在负载图中,用颜色表征代谢物对组间区分的贡献大小(即相关系数):颜色越暖,则代谢物变量与分组变量的相关系数越大,代表该代谢物对组间的区分贡献越大[9, 20].为了确保上述多变量分析的可靠性,还分别对组间有显著差异的代谢物进行单变量统计分析.
2 结果与讨论 2.1 冷冻干燥对人类尿液代谢组的影响尿液的PCA得分图结果显示冷冻干燥后样品的分布比对照组更加聚集,但两组之间没有明显的分离趋势[图 1(a)].OPLS-DA分析结果表明乳酸(lactate)和乙酸(acetate)的含量在对照组(Control)和处理组(FD)间存在显著性差异[图 2(a)],进一步通过单变量统计分析可以看出[图 3(a)],冷冻干燥使尿液代谢组中乳酸和乙酸含量的显著降低(乳酸:p=0.0017;乙酸:p=0.014).经查证,乳酸和乙酸与水在常压下沸点比较接近,常压下乳酸、乙酸和水的沸点分别为122 ℃、117.9 ℃和100 ℃.但真空度较高(0.02 bar)时,乳酸和乙酸的沸点会远低于122 ℃,冷冻干燥的过程中很可能与水一起挥发,因此这里观察到的冷冻干燥所致尿液乳酸和乙酸含量的降低应该是一个因为沸点较低而导致的挥发现象.已有文献[12, 21]报道冷冻干燥会降低易挥发代谢物的含量,但对尿液中乳酸和乙酸含量的影响未见报道.乳酸是丙酮酸在乳酸脱氢酶作用下的代谢产物.当机体剧烈运动或者出现病变时,尿液中乳酸的含量会发生改变,乳酸的含量与生物体的生理病理密切相关.乙酸是一种重要的短链脂肪酸,其含量的变化可以反映生物体内肠道菌群的改变.因此,在使用GC-MS和LC-MS对尿液代谢组分析时,如样品需要冷冻干燥的前处理,就必须考虑冷冻干燥对挥发性代谢物的影响.

|
图 1 冷冻干燥对尿液(a)和血清(b)代谢组影响的主成分分析得分图.红色圆点代表对照组,蓝色圆点代表冷冻干燥组 Fig. 1 PCA scores plots derived from 1H NMR data for human (a) urine and (b) serum samples from the control group (red dot) and lyophilization (FD) group (blue dot) |

|
图 2 冷冻干燥对尿液(a)和血清(b)代谢组影响的OPLS-DA得分图(左)和相关系数负载图(右).红色圆点代表对照组,蓝色圆点代表冷冻干燥组.Gln:谷氨酰胺;Lys:赖氨酸 Fig. 2 OPLS-DA scores plots (left) and corresponding loadings plots (right) derived from the 1H NMR data for human (a) urine and (b) serum samples from the control group (red dot) and lyophilization (FD) group (blue dot). Gln: glutamine; Lys: lysine |
|
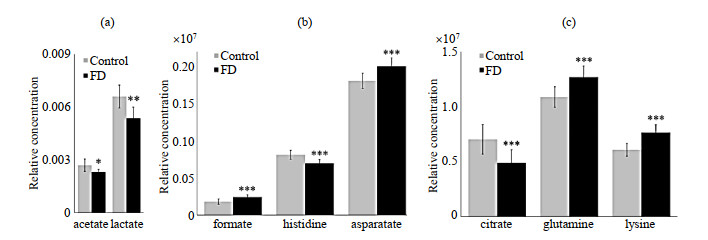
图 3 尿液(a)和血清(b, c)样品中代谢物的相对浓度 Fig. 3 Relative concentration of metabolites derived from the 1H NMR data for human (a) urine and (b, c) serum samples from the control group (gray) and lyophilization (FD) group (black). *p < 0.05, **p < 0.01, ***p < 0.001 |
血清样品的PCA得分图显示冷冻干燥对样品分布的聚集程度并未产生明显影响,对照组和冷冻干燥处理组之间也没有明显的分离趋势[图 1(b)].OPLS-DA分析结果表明甲酸(formate)、天冬氨酸(asparatate)、谷氨酰胺(glutamine,Gln)、赖氨酸(lysine,Lys)、组氨酸(histidine)和柠檬酸(citrate)的含量在对照组和处理组间存在显著性差异[图 2(b)].进一步通过单变量统计分析结果[图 3(b), (c)]表明冷冻干燥引起了血清样品中甲酸、天冬氨酸、谷氨酰胺和赖氨酸含量的显著增加,而组氨酸和柠檬酸的含量显著降低(p < 0.001).
与尿液结果类似,我们发现冷冻干燥引起血清中易挥发代谢物(柠檬酸)的含量明显降低.柠檬酸是三羧酸循环的中间产物,从化学结构上看,它是一种三羧酸类代谢物,极易溶于水,在冷冻干燥的过程中容易随水一起挥发,因此冷冻干燥后血清中的柠檬酸含量显著降低.
与尿液结果不同的是,冷冻干燥引起血清中氨基酸含量的改变.这可能与两种体液样品的基质及其所含酶不同有关.血清样品中含有多种脂蛋白,在冷冻干燥的过程中,这些脂蛋白颗粒会被破坏而释放出甘油酯、脂肪酸、磷脂与固醇等疏水性物质及载脂蛋白,这些代谢物在用水复溶时可能无法完全溶解;冷冻干燥时血清中的酶会得到最大限度的释放,可能催化导致蛋白质分解,产生游离氨基酸[14]. 因此,冷冻干燥后天冬氨酸、谷氨酰胺和赖氨酸的含量明显增加应当与后者有关.这与冷冻干燥会引起牛奶中游离氨基酸含量的增加相一致[16].事实上,牛奶这种乳液中也含有多种酶和其他蛋白质,冷冻干燥引起蛋白质的降解,从而增加了氨基酸的含量.冷冻干燥引起样品中游离氨基酸的增加也在蜂蜜的研究中报道[17].冷冻干燥后蜂蜜中总氨基酸没有改变,而总游离氨基酸的含量显著增加,提示冷冻干燥会导致蛋白质分解产生游离氨基酸,从而引起样品中游离氨基酸含量的上升.所以,冷冻干燥也可能导致非酶催化的蛋白质分解.甲酸本身属于易挥发物质,冷冻干燥理论上应该导致其浓度降低,这里观察到的甲酸浓度升高,进一步说明酶促反应在冷冻干燥过程中的重要性;冷冻干燥引起血清中组氨酸的含量降低也与文献报道的一致且涉及酶促反应[22].尽管冷冻干燥过程中样品温度应该在水的冰点附近,酶催化反应较慢,但冷冻干燥所用时间较长,足以使酶催化反应发生.
3 结论本文使用NMR技术,研究了冷冻干燥对人类尿液和血清代谢物组成的影响,发现冷冻干燥会引起尿液和血清样本中有机羧酸和氨基酸含量的改变.冷冻干燥对尿液和血清代谢组的影响不同,前者主要表现在易挥发性物质的丢失,而后者除了易挥发性物质的丢失外还有一系列酶促反应所导致的代谢物浓度变化.这些酶促反应的影响可以在冷冻干燥前通过沉淀去除蛋白而下降,但易挥发性物质的丢失是冷冻干燥无法克服的弱点.在代谢组学分析研究中,如果这些物质属于重要的关注对象,就必须考虑冷冻干燥的适用性问题.
| [1] | NICHOLSON J K, CONNELLY J, LINDON J C, et al. Metabonomics:a platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov, 2002, 1(2): 153-161. |
| [2] | NICHOLSON J K, LINDON J C. Systems biology-metabonomics[J]. Nature, 2008, 455(7216): 1054-1056. DOI: 10.1038/4551054a. |
| [3] | AN Y P, XU W X, LI H H, et al. High-fat diet induces dynamic metabolic alterations in multiple biological matrices of rats[J]. J Proteome Res, 2013, 12(8): 3755-3768. DOI: 10.1021/pr400398b. |
| [4] | HOLMES E, WILSON I D, NICHOLSON J K. Metabolic phenotyping in health and disease[J]. Cell, 2008, 134(5): 714-717. DOI: 10.1016/j.cell.2008.08.026. |
| [5] | HE Q H, TANG H R, REN P P, et al. Dietary supplementation with L-arginine partially counteracts serum metabonome induced by weaning stress in piglets[J]. J Proteome Res, 2011, 10(11): 5214-5221. DOI: 10.1021/pr200688u. |
| [6] | HUANG C Y, LEI H H, ZHAO X J, et al. Metabolic influence of acute cyadox exposure on kunming mice[J]. J Proteome Res, 2013, 12(1): 537-538. DOI: 10.1021/pr301033a. |
| [7] |
WU X Y, LI N, TANG H R. Quantitative analysis of metabolites in mungbean (Vigna Radiata) extracts using NMR techniques[J].
Chinese J Magn Reson, 2014, 31(4): 548-563.
吴香玉, 李宁, 唐惠儒. 绿豆(Vigna Radiata)代谢物组成的核磁共振定量分析[J]. 波谱学杂志, 2014, 31(4): 548-563. |
| [8] |
HU Y L, HAO F H, WANG Y L. NMR-based metabonomic analyses on spleen tissues of 4T1 tumor-bearing mice subjected to chemotherapies with different drug delivery strategies[J].
Chinese J Magn Reson, 2018, 35(1): 8-21.
胡依黎, 豪富华, 王玉兰. 基于NMR的4T1荷瘤小鼠脾脏受不同给药方式影响的代谢组学[J]. 波谱学杂志, 2018, 35(1): 8-21. |
| [9] |
ZHANG C C, WU J F, WANG Y L. Gender difference in intestinal bile acid profiles in C57BL/6 mice[J].
Chinese J Magn Reson, 2018, 35(3): 328-337.
张聪聪, 吴俊芳, 王玉兰. 不同性别C57BL/6小鼠肠道胆汁酸组成的差异性研究[J]. 波谱学杂志, 2018, 35(3): 328-337. |
| [10] | CHAN E C Y, PASIKANTI K K, NICHOLSON J K. Global urinary metabolic profiling procedures using gas chromatography-mass spectrometry[J]. Nat Protoc, 2011, 6(10): 1483-1499. DOI: 10.1038/nprot.2011.375. |
| [11] | ZHOU R K, GUO K V, LI L. 5-diethylamino-naphthalene-1-sulfonyl chloride (DensCl):a novel triplex isotope labeling reagent for quantitative metabolome analysis by liquid chromatography mass spectrometry[J]. Anal Chem, 2013, 85(23): 11532-11539. DOI: 10.1021/ac403000n. |
| [12] | ABASCAL K, GANORA L, YARNELL E. The effect of freeze-drying and its implications for botanical medicine:A review[J]. Phytother Res, 2005, 19(8): 655-660. DOI: 10.1002/ptr.1651. |
| [13] | RINDLER V, LUNEBERGER S, SCHWINDKE P, et al. Freeze-drying of red blood cells at ultra-low temperatures[J]. Cryobiology, 1999, 38(1): 2-15. DOI: 10.1006/cryo.1998.2143. |
| [14] | TANG X L, PIKAL M J. Design of freeze-drying processes for pharmaceuticals:Practical advice[J]. Pharm Res, 2004, 21(2): 191-200. DOI: 10.1023/B:PHAM.0000016234.73023.75. |
| [15] | OIKAWA A, OTSUKA T, JIKUMARU Y, et al. Effects of freeze-drying of samples on metabolite levels in metabolome analyses[J]. J Sep Sci, 2011, 34(24): 3561-3567. DOI: 10.1002/jssc.201100466. |
| [16] | IBRAHIM A H, KHALIFA S A. Effect of freeze-drying on camel's milk nutritional properties[J]. Int Food Res J, 2015, 22(4): 1438-1445. |
| [17] | RANIERI A, BENELLI G, CASTAGNA A, et al. Freeze-drying duration influences the amino acid and rutin content in honeybee-collected chestnut pollen[J]. Saudi J Biol Sci, 2019, 26(2): 252-255. DOI: 10.1016/j.sjbs.2017.08.011. |
| [18] | DIETERLE F, ROSS A, SCHLOTTERBECK G, et al. Probabilistic quotient normalization as robust method to account for dilution of complex biological mixtures. Application in H-1 NMR metabonomics[J]. Anal Chem, 2006, 78(13): 4281-4290. DOI: 10.1021/ac051632c. |
| [19] | ERIKSSON L, TRYGG J, WOLD S. CV-ANOVA for significance testing of PLS and OPLS (R) models[J]. J Chemometr, 2008, 22(11, 12): 594-600. |
| [20] | CLOAREC O, DUMAS M E, TRYGG J, et al. Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in H-1 NMR spectroscopic metabonomic studies[J]. Anal Chem, 2005, 77(2): 517-526. DOI: 10.1021/ac048803i. |
| [21] | JIMENEZ C, VENTURA R, WILLIAMS J, et al. Reference materials for analytical toxicology including doping control:freeze-dried urine samples[J]. Analyst, 2004, 129(5): 449-455. DOI: 10.1039/B310111H. |
| [22] | RAISTRICK H. On a new type of chemical change produced by bacteria. The conversion of histidine into urocanic acid by bacteria of the Coli-Typhosus group[J]. Biochem J, 1917, 11(1): 71-77. |
 2020, Vol. 37
2020, Vol. 37 
