2. 淮阴师范学院 化学化工学院, 江苏 淮安 223300;
3. 广东省石油与精细化工研究院, 广东 广州 510665
2. School of Chemistry and Chemical Engineering, Huaiyin Normal University, Huai'an 223300, China;
3. Guangdong Research Institute of Petrochemical and Fine Chemical Engineering, Guangzhou 510665, China
继《美国药典》后,核磁共振(NMR)波谱也被写入《中国药典》通则,成为定性、定量检测药品质量的工具.作为一种结构解析工具,NMR波谱中的化学位移可以提供原子核所处的化学环境信息,谱峰多重性可提供相邻基团和立体化学信息,偶合常数可用于辅助确定基团的取代情况,谱峰相对强度可用于确定基团中质子的个数[1].对于结构复杂或结构未知的样品,通常需要结合1H NMR、13C NMR、19F NMR、31P NMR和2D NMR波谱,以及其他分析手段确定其结构[2-5].
在寻找抗惊厥活性更强、毒性更低的抗癫痫药物过程中,6-(4-氯苯氧基)四唑并[5, 1-a]酞嗪(化合物1,图 1)被发现具有较强的抗癫痫活性[6-10],是一类抗癫痫创新候选药物.然而其芳香环的取代碳信号,仅用1D NMR技术或者经验规则难以进行准确归属;而且,目前文献[11, 12]仅报道了化合物1在300 MHz NMR谱仪上采集得到的1H和13C NMR谱图,且未见其1H和13C NMR的完全归属,另外,化合物1的15N NMR归属也未见文献报道.化合物1的结构还存在四唑环开合问题,并且具有多晶型性.这些结构的不确定性对化合物1在临床中的安全用药造成了隐患,需要一套完善的多方位质量认证数据支持.基于此原因,本文在500 MHz NMR谱仪上采集了化合物1的1H NMR、13C NMR、DEPT-135、1H-1H COSY、1H-13C HSQC、1H-13C HMBC、HSQC-TOCSY、15N NMR、1H-15N HMBC谱图,并结合量子化学中的密度泛函理论计算,对化合物1的1H NMR、13C NMR和15N NMR进行了完全归属[7-9],确定了该化合物的精细结构,为其在临床中的安全用药奠定了基础.
|
图 1 6-(4-氯苯氧基)四唑并[5, 1-a]酞嗪(化合物1)的化学结构和编号 Fig. 1 Chemical structure and atom numbering of 6-(4-chlorophenoxy)-tetrazolo[5, 1-a]phthalazine (compound 1) |
延边大学药学院药物化学教研部原创性[11]制备并提供化合物1.化合物1溶于DMSO-d6(Cambridge Isotope Laboratories,Inc.,D > 99.9%),以四甲基硅烷(δH 0.00,δC 0.0)和硝基甲烷(δN 0.0)为内标.所有的NMR实验均在Bruker AVANCE Ⅲ HD 500 MHz全数字化超导NMR谱仪上完成,使用PABBO 500S1探头,室温(25℃)条件下测试.1H、13C和15N核的工作频率分别为500.13、125.04和50.89 MHz.1H NMR、13C NMR、DEPT-135和15N NMR的脉冲序列采用topspin 3.5标准参数组,谱宽分别为10 330.58、29 761.90、20 161.29、22 058.82 Hz. 2D NMR(1H-1H COSY、1H-13C HSQC、1H-13C HMBC、HSQC-TOCSY、1H-15N HMBC)均采用标准脉冲程序.1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为4 032.26 Hz,采样数据点阵t2×t1=2 048×128,累加次数为30;1H-13C HSQC的F2维(1H)和F1维(13C)谱宽分别为4 032.26 Hz和20 751.59 Hz,采样数据点阵t2×t1=1 024×256,累加次数为16;1H-13C HMBC的F2维(1H)和F1维(13C)谱宽分别为4 032.26 Hz和20 669.48 Hz,采样数据点阵t2×t1=4 096×128,累加次数为16;HSQC-TOCSY的F2维(1H)和F1维(13C)谱宽分别为4 032.26 Hz和20 751.59 Hz,采样数据点阵t2×t1=2 048×256,累加次数为30.1H-15N HMBC的F2维(1H)和F1维(15N)谱宽分别为4 032.26 Hz和8 856.26 Hz,采样数据点阵t2×t1=2 048×256,累加次数为300.
采用B3LYP杂化泛函方法,在6-31G(d)基组水平上,对化合物1的几何结构进行优化.并用相同的理论方法进行频率计算,频率计算无虚频出现,证实了优化结构为稳定结构.为进一步对实验结果进行指认,在以上优化几何结构基础上,采用GIAO方法[13]计算化学位移.计算对比了基组影响,即在相同密度泛函B3LYP方法下采用6-31G(d)、6-311+G(2d, p) Pople基组和Jensen的片段收缩pcSseg-1基组[14],并与波函MP2[15]/pcSseg-1以及标度法[16, 17]进行对比.标度法中,1H、13C化学位移的计算用B3LYP/6-31G(d)方法,而15N化学位移的计算在PBE0/6-311+G(2d, p)水平上完成.考虑溶剂对化学位移的影响,采用了隐式溶剂SMD模型来模拟溶剂效应,除标度法中采用CHCl3为溶剂外,其他方法均以DMSO为溶剂.
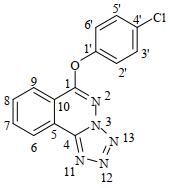
2 结果与讨论 2.1 化合物1的1H、13C和15N NMR归属化合物1的1H NMR谱(图 2)显示6组峰:δH 8.64 (d,J=7.5 Hz)、δH 8.54 (d,J=7.5 Hz)、δH 8.25 (ddd,J=7.5/1.0/0.5 Hz)、δH 8.15 (ddd,J=7.5/1.0/0.5 Hz)、δH 7.64 (ddd,J=9.0/4.5/3.0 Hz)、δH 7.55 (ddd,J=9.0/4.5/3.0 Hz),而且积分面积之比为1:1:1:1:2:2.化合物1的δH 8.25、8.15、7.64、7.55处(500 MHz)由于高场的原因,芳环上的氢之间邻、间、对位的偶合变得精细,出现了ddd、ddd、ddd、ddd裂分峰,而文献[12]报道其在300 MHz NMR波谱上对应为t、t、d、d裂分峰.因而场强越高的谱仪得到的谱图分辨率越高,越有利于分析样品结构.
|
图 2 化合物1的1H NMR谱 Fig. 2 1H NMR spectrum of compound 1 |
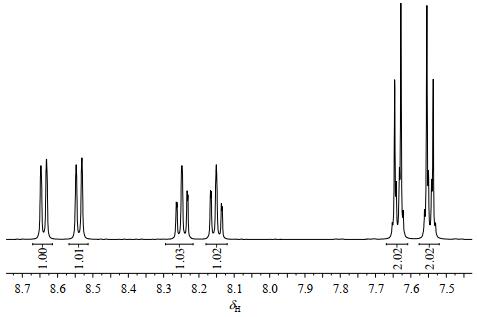
化合物1的1H-1H COSY谱(图 3)显示4组相关信号:δH 8.64与δH 8.25;δH 8.54与δH 8.15;δH 8.25与δH 8.15;δH 7.64与δH 7.55.结合谱图积分面积之比和化合物1的结构,判断δH 8.64、8.54、8.25、8.15隶属于同一个苯环;δH 7.64、7.55隶属于同一个苯环.
|
图 3 化合物1的1H-1H COSY谱 Fig. 3 1H-1H COSY spectrum of compound 1 |
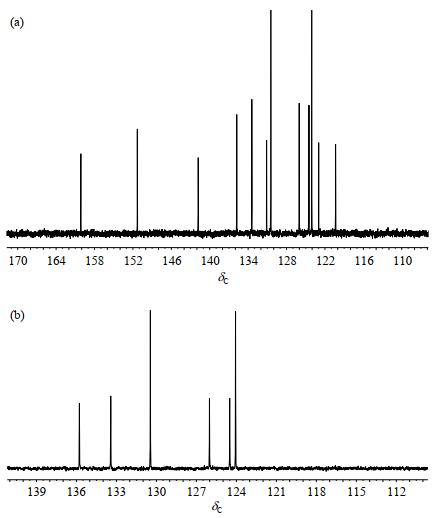
化合物1的13C NMR谱[图 4(a)]显示共有12组碳信号,DEPT-135谱[图 4(b)]表明有6个连接质子的碳原子,这与化合物1的结构相符.结合化合物1的结构,判断δC 135.8、133.4、130.5、126.0、124.5、124.1为芳香环未取代碳,δC 160.1、151.3、141.8、131.1、123.0、120.3为芳香环取代碳.
|
图 4 化合物1的(a) 13C NMR谱和(b) DEPT-135谱 Fig. 4 (a) 13C NMR and (b) DEPT-135 spectra of compound 1 |
1H-13C HSQC谱中(图 5),δH 8.64与δC 124.5、δH 8.54与δC 126.0、δH 8.25与δC 135. 8、δH 8.15与δC 133.4、δH 7.64与δC 130.5、δH 7.55与δC 124.1分别相关;而δC 160.1、151.3、141.8、131.1、123.0、120.3在1H-13C HSQC谱中没有相关峰.这与DEPT-135结果一致.
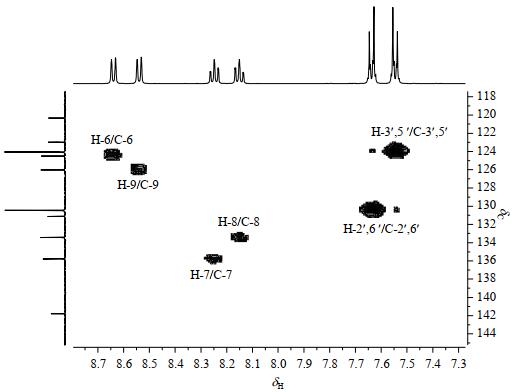
|
图 5 化合物1的1H-13C HSQC谱 Fig. 5 1H-13C HSQC spectrum of compound 1 |
1H-13C HMBC谱中(图 6):δH 7.64、δH 7.55都与δC 131.1相关,结合1H-1H COSY谱推断δH 7.64和δH 7.55隶属于同一个苯环,说明δC 131.1对应于C-1'或C-4'.由于四唑并[1, 5-b]哒嗪体系的离域的影响使得C-1'去屏蔽效应强于C-4',因而δC 131.1归属为C-4';相应的在氯苯氧基中,另一个季碳C-1'的化学位移是δC 151.3.δH 7.64在1H-13C HMBC谱中与C-1'相关,归属为H-2'/H-6';因而,δH 7.55归属为H-3'/H-5';由1H-13C HSQC谱可得,δC 130.5归属为C-2'/C-6',δC 124.1归属为C-3'/C-5'.比较四唑并[1, 5-b]哒嗪体系中4种季碳C-1、C-4、C-5、C-10取代情况,C-1和C-4化学位移差异是源于连接氧原子和氮原子的不同,由于氧原子的负诱导效应[18]强于氮原子,因此δC 160.1归属为C-1;C-4和C-5、C-10化学位移差异是源于连接氮原子和碳原子的电负性不同,δC 141.8暂时归属为C-4,这需要后续的量子化学计算验证.1H-13C HMBC谱中,δH 8.54不但与C-1强相关,而且与C-4弱相关,因此δH 8.54归属为H-9;由1H-13C HSQC谱可知,δC 126.0归属为C-9.δH 8.15和H-9在1H-1H COSY谱中相关,归属为H-8;δC 133.4在1H-13C HSQC谱与H-8相关,归属为C-8.由1H-1H COSY谱知,δH 8.25和H-8相邻,归属为H-7;δC 135.8归属为C-7.剩余的δH 8.64归属为H-6,δC 124.5归属为C-6.1H-13C HMBC谱中,H-6与C-4隔C-5三键关联,意味着H-6与C-5两键关联,即δC 120.3归属为C-5.1H-13C HMBC谱中,H-9与C-1隔C-10三键关联,意味着H-6与C-10两键关联,即δC 123.0归属为C-10.
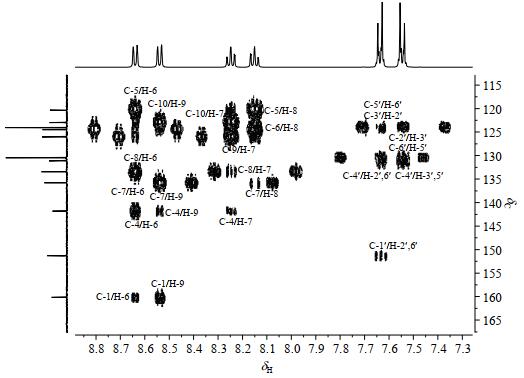
|
图 6 化合物1的1H-13C HMBC谱图 Fig. 6 1H-13C HMBC spectrum of compound 1 |
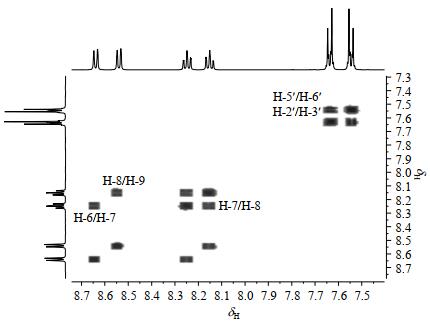
HSQC-TOCSY[19]谱(图 7)中H-6与C-9、C-7、C-8相关,说明H-6与C-9、C-7、C-8同属1个自旋体系.H-7与C-6、C-8相关,说明H-7与C-6、C-8同属1个自旋体系.H-8与C-6、C-7相关,说明H-8与C-6、C-7同属1个自旋体系.综上4种相关,验证了H-6,7,8,9同属于一个苯环体系.H-2'/6'与C-3'/C-5'相关,说明H-2'/6'与C-3'/5'同属1个自旋体系.H-3'/H-5'与C-2'/6'是相关的,表明H-3'/5'与C-2'/6'同属1个自旋体系.综上4种相关,验证了H-2',3',5',6'也同属于另外一个苯环体系.
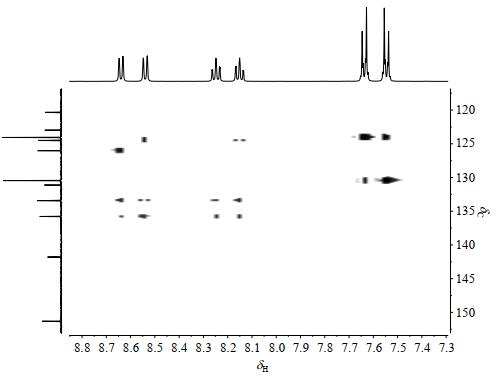
|
图 7 化合物1的HSQC-TOCSY谱 Fig. 7 HSQC-TOCSY spectrum of compound 1 |
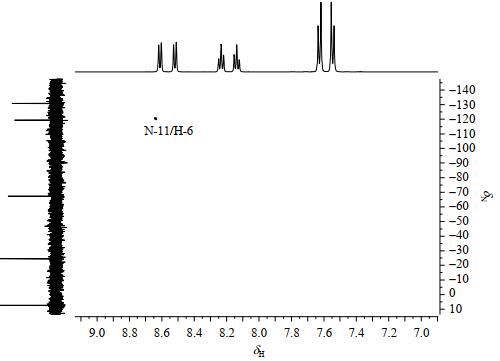
化合物1中氮原子数目较多,其中3个氮原子是开链、还是闭合成唑环,一直饱受质疑,仅用质谱数据是难以确认的,而且氮原子之间的偶合信息也较缺乏.化合物1的15N NMR谱(图 8)以硝基甲烷做内标,显示有5处信号:δN 6.5、-25.4、-68.4、-120.1和-132.0,与文献[20, 21]中四唑并[1, 5-b]哒嗪氮原子化学位移规律一致.1H-15N HMBC谱(图 9)中可见N-11与H-6相关,说明N-11与H-6在空间上可能存在氢键,使得N-11、C-4、C-5、C-6电子云离域,这也是C-4化学位移低于C-1的可能因素,也使得N-12去屏蔽效应增强,化学位移变大,这是化合物1中存在四唑环骨架的直接证据.化合物1的氮原子的归属结合密度泛函理论的计算确证了四唑环骨架的合理性,即化合物1中3个氮原子是闭环的.至此,化合物1的1H、13C、15N NMR信号得到归属(表 1).
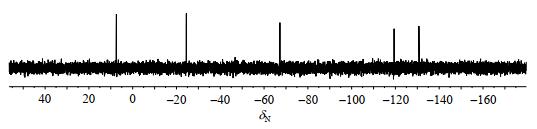
|
图 8 化合物1的15N NMR谱 Fig. 8 15N NMR spectrum of compound 1 |
|
图 9 化合物1的1H-15N HMBC谱 Fig. 9 1H-15N HMBC spectrum of compound 1 |
| 表 1 化合物1的13C、15N和1H NMR归属 Table 1 13C, 15N and 1H NMR assignments of compound 1 |
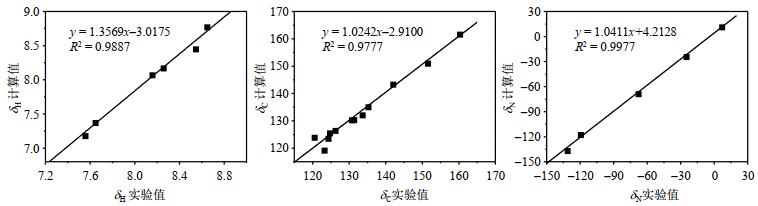
对化合物1的1H、13C和15N NMR化学位移进行量子化学计算,进一步佐证由实验得到的归属结果.5种方法计算的化学位移参见该篇文章网络版附件,或者扫描文章首页OSID码查看附件.标度法计算的1H、13C和15N NMR化学位移与实验值进行了线性回归分析,相关系数(R2) 1H NMR谱为0.988 7,13C NMR谱为0.977 7,15N NMR谱为0.997 7(图 10),高的相关系数意味着由实验值与标度法计算值得到的归属高度吻合[22].
|
图 10 化合物1的NMR化学位移实验值和理论值的关系 Fig. 10 Relationship between experimental NMR chemical shifts and the theoretical values of compound 1 |
根据化合物1的1D NMR和2D NMR波谱数据,对该化合物的1H、13C和15N NMR进行了完全归属,并利用密度泛函理论计算进行了佐证,从而为该药物进入市场提供了结构数据支持.
| [1] | 国家药典委员会.核磁共振波谱法[S]//中华人民共和国药典四部. 2020年版.北京: 中国医药科技出版社, 2020: 0441. |
| [2] |
WANG Y L, WANG X J, WANG Z W. Spectral analyses and structural elucidation of azilsartan[J].
Chinese J Magn Reson, 2019, 36(3): 350-358.
王亚兰, 王晓静, 王志伟. 阿齐沙坦的波谱学数据及结构确证[J]. 波谱学杂志, 2019, 36(3): 350-358. |
| [3] |
WEI H Q, YU J, BI C F, et al. An NMR study of N-isobutyryl-3'-O-(1-fluoro-1, 1, 3, 3-tetraisopropyl-1, 3-disiloxane-3-yl)-2'-benzyloxycarbonyl-guanosine[J].
Chinese J Magn Reson, 2019, 36(1): 93-102.
魏会强, 于江, 毕常芬, 等. N-异丁酰基-3'-O-(1-氟-1, 1, 3, 3-四异丙基-1, 3-二硅氧烷-3-基)-2'-苄氧羰基鸟苷的NMR研究[J]. 波谱学杂志, 2019, 36(1): 93-102. |
| [4] | WANG S H, KAN Y H. Experimental and theoretical studies of the absolute configuration of (2S, 1'R) and (2R, 1'R)-2-acetoxymethyl-3-phenyl-N-(1'-phenylethyl)-propionamide[J]. Journal of Molecular Structure, 2010, 981(1): 159-162. |
| [5] |
WANG S H, YIN X M, KAN Y H, et al. Assignment of carbon and proton chemical shifts of 3-nitrobenzanthron[J].
Journal of Yanbian Uviversity (Natural Science), 2012, 38(2): 138-141.
王思宏, 尹秀梅, 阚玉和, 等. 3-硝基苯并蒽酮的碳和氢的化学位移归属[J]. 延边大学学报(自然科学版), 2012, 38(2): 138-141. |
| [6] | LI X, ZHANG H J, WANG Q, et al. Current study of the mechanism of action of the potential anti-epileptic agent Q808[J]. Molecules, 2017, 22(7): 1134. |
| [7] | SUN X Y, WEI C X, DENG X Q, et al. Evaluation of the anticonvulsant activity of 6-(4-chlorophenyoxy)-tetrazolo[5, 1-a]phthalazine in various experimental seizure models in mice[J]. Pharmacol Rep, 2010, 62(2): 273-277. |
| [8] | YU H L, ZHANG F, LAN T, et al. Effects of 6-(4-chlorophenoxy)-tetrazolo[5, 1-a]phthalazine on anticoagulation in mice and the inhibition of experimental thrombosis in rats[J]. J Cardiovasc Pharmacol, 2014, 64(6): 560-566. |
| [9] | YU H L, ZHANG F, LI Y J, et al. Anti-inflammatory and antinociceptive effects of 6-(4-chlorophenoxy)-tetrazolo[5, 1-a]phthalazine in mice[J]. Pharmacol Rep, 2012, 64(5): 1155-1165. |
| [10] | ZHANG F, JIANG H C, CHEN X R, et al. Antidepressant-like effect of 6-(4-chlorophenoxy)-tetrazolo[5, 1-a]phthalazine in mice[J]. Chin J Pharm Toxicol, 2013, 27(5): 783-788. |
| [11] | SUN X Y, WEI C X, DENG X Q, et al. Synthesis and primary anticonvulsant activity evaluation of 6-alkyoxyl-tetrazolo[5, 1-a]phthalazine derivatives[J]. Arzneim Forsch, 2010, 60(6): 289-292. |
| [12] |
LI L, LIU C, QUAN Z S, et al. Structure identification and determination of therelated substances in the first type of new anti-epileptic drug Q808[J].
Journal of Yanbian Uviversity (Natural Science), 2016, 39(2): 103-107.
李龙, 刘冲, 全哲山, 等. 抗癫痫一类新药Q808有关物质的结构确定及含量测定[J]. 延边大学医学学报, 2016, 39(2): 103-107. |
| [13] | WOLINSKI K, HINTON J F, PULAY P. Efficient implementation of the gauge-independent atomic orbital method for NMR chemical shift calculations[J]. J Am Chem Soc, 1990, 112(23): 8251-8260. |
| [14] | JENSEN F. Segmented contracted basis sets optimized for nuclear magnetic shielding[J]. J Chem Theory Comput, 2015, 11(1): 132-138. |
| [15] | GAUSS J. Calculation of NMR chemical shifts at second-order many-body perturbation theory using gauge-including atomic orbitals[J]. Chem Phys Lett, 1992, 191(6): 614-620. |
| [16] | LODEWYK M W, SIEBERT M R, TANTILLO D J. Computational prediction of 1H and 13C chemical shifts:a useful tool for natural product, mechanistic, and synthetic organic chemistry[J]. Chem Rev, 2012, 112(3): 1839-1862. |
| [17] | GAO P, WANG X, YU H. Towards an accurate prediction of nitrogen chemical shifts by density functional theory and gauge-including atomic orbital[J]. Adv Theor Simul, 2019, 2(2): 1800148. |
| [18] | 于德泉, 杨峻山. 分析化学手册:核磁共振波谱分析[M]. 北京: 化学工业出版社, 1999. |
| [19] | 孔令义. 复杂天然产物波谱解析[M]. 北京: 中国医药科技出版社, 2012. |
| [20] | CMOCH P, STEFANIAK L, MELZER E, et al. 1H, 13C and 15N NMR study of some triazolo-and tetrazolopyridazines and thioxotriazolopyridines[J]. Magn Reson Chem, 1999, 37(7): 493-497. |
| [21] | STEFANIAK L, ROBERTS J D, WITANOWSKI M, et al. A nitrogen-15 NMR investigation of some azolopyridines[J]. Org Magn Reson, 1984, 22(4): 209-214. |
| [22] |
XU X, ZHU C L, KAN Y H. Sensing mechanism and molecular design of FRET based dual-emission fluorescent probe[J].
Journal of Huaiyin Teachers College (Natural Science Edition), 2019, 18(1): 41-47.
徐鑫, 朱长磊, 阚玉和. 基于FRET的双发射荧光探针的传感机理及分子设计[J]. 淮阴师范学院学报(自然科学版), 2019, 18(1): 41-47. |
 2020, Vol. 37
2020, Vol. 37 
