阿尔茨海默症(Alzheimer's Disease,AD)是一种神经系统的、不可逆的、渐进性脑部疾病,其特征是认知和智力缺陷严重到足以干扰日常生活,致使个人,特别是老年人群,丧失执行简单任务的能力[1];身体机能逐渐丧失,最终导致死亡[2].其致病因素包括家族史、头部外伤、低教育水平、甲状腺病、母育龄过高或过低、病毒感染等[3].目前的药物只能减缓AD症状,但有效治疗仍然难以实现[4].因此,AD早期临床诊断具有重要意义[5].
常用的AD临床诊疗手段为磁共振成像(Magnetic Resonance Imaging,MRI).与其他医学成像技术相比,MRI具有无创、无辐射、多对比度等特点[6],已被纳入AD诊断标准[7].寻找有效的MRI特征是近年AD临床研究的热点之一.近年来,国内外学者通过利用机器学习算法对磁共振图像进行自动分析,辅助临床医生进行AD早期诊断,准确率不断提高.Tong等[8]通过提取具有高度辨别力的特征,利用多实例学习策略和支持向量机(Support Vector Machine,SVM)对AD和正常受试者(Normal Control,NC)进行分类;Shankar等[9]研究了AD相关的磁共振图像特征,建立了基于决策树分类器的检测系统,并使用灰狼群优化算法提高了分类性能;Baskar等[10]使用自动解剖标签方法从磁共振图像中提取海马区和后扣带回皮层相关的感兴趣区域,通过多标准特征选择方法,选择与AD高度相关的特征,最后通过C均值聚类(其基本思想为:通过迭代寻找C个聚类进行划分,使得用C个聚类的均值来代表相应各类样本时所得到的总体误差最小)和人工神经网络算法基于脑图像对AD进行检测;Madusanka等[11]根据纹理和形态特征,利用SVM对AD、NC和轻度认知障碍(Mild Cognitive Impairment,MCI)患者进行分类.虽然机器学习方法已经在辅助AD早期诊断方面显示出较大优势,但上述方法以手工提取特征为主,主观随意性较大.深度学习的分类方法能从原始数据中自动提取特征,通过非线性模型将原始特征转变为浅层特征,并从浅层到深层逐步抽象为具有分类代表性的深层特征,从而建立更加有效的分类模型.目前研究表明,深度学习方法的分类效果优于机器学习的统计方法.Cui等[12]提出了一个基于卷积神经网络和递归神经网络相结合的分类框架,用于基于T1加权共振图像对AD进行诊断;Li等[13]提出了一种基于多聚类密集卷积网络(DenseNet)的分类方法,用于学习AD患者磁共振图像的各种局部特征,并结合这些特征进行自动分类;Liu等[14]构建了自编码深度神经网络模型,并使用零掩蔽策略融合多个模态数据来检测AD.
本文受目前广泛应用的深度学习模型的启发,提出了一种基于磁共振图像和改进三维UNet++进行AD和NC分类的方法.该方法结合了UNet++浅层特征与深层特征,利用了特征图像实用率较高的优势,并引入深度监督和特征融合结构,对全脑图像、白质(White Matter,WM)、灰质(Gray Matter,GM)和脑脊液(Cerebrospinal Fluid,CSF)分别进行分类实验,实现了AD和NC的自动分类,而且效果较好、效率较高.
1 卷积神经网络模型 1.1 卷积神经网络常用层在分类网络中,常用层包括卷积层、池化层、全连接层和批归一化(Batch Normalization,BN)层[15].卷积层主要作用是实现对输入图像的特征提取,通常使用卷积核与输入特征图进行卷积操作以提取特征.池化层的作用是降低特征图分辨率、减少参数量,从而加快收敛并增强网络的鲁棒性、并有效防止过拟合.全连接层与前一层中的所有单元完全连接,将前一层的结构特征更改为预定义的一维特征向量.全连接层可以有效地挖掘传入的特征以提取有关输入图像内容的信息.BN层将前一层的输出进行标准化,从而增加网络的非线性[16]、有效解决梯度消失问题.
1.2 UNet++网络UNet++是由Zhou等[17]提出的网络模型,它有效的结合了传统UNet[18]和DenseNet[19]的优势.利用UNet中跨层连接的方式结合了底层信息和高层信息,同时利用DenseNet中的密集连接加强了特征传播的能力,并加入了更多的编码器和解码器,通过一系列嵌套的密集跨层路径进行连接,增加了网络特征的利用率.传统UNet浅层抓取简单特征,通过下采样过程中感受野的增大,抓取到更深层、抽象的特征;上采样的作用是还原位置信息,还原特征图像的分辨率;跨层连接则整合了神经网络层抓取的不同分辨率、不同强度语义的特征及位置信息.UNet++通过重新设计的密集跨层路径使编码器特征映射的语义级别更接近于解码器中特征映射的语义级别,减小了编码器和解码器的特征映射之间的语义差距.密集跨层连接的公式如(1)式所示:
| ${x^{i, j}} = \left\{ \begin{gathered} \mathit{\boldsymbol{H}}({x^{i - 1, j}}), &j = 0 \\ \mathit{\boldsymbol{H}}\left\{ {\left[ {[{x^{i, k}}]_{k = 0}^{j - 1}, {\rm{ }}\mathit{\boldsymbol{U}}({x^{i + 1, j - 1}})} \right]} \right\}, {\rm{ }}\, &j > 0 \\ \end{gathered} \right.$ | (1) |
其中,
由于比传统UNet增加了更多的编码器和解码器,所以UNet++独特的网络结构不仅由收缩网络和扩张网络构成,还包含了4个子网络,并结合深度监督算法使L1、L2、L3和L4子网络输出4个不同语义级别的特征图像.同时,UNet++中重新设计的跨层连接优化了UNet中出现的语义鸿沟问题,使得编码器特征映射的语义级别更接近于解码器中特征映射的语义级别,有助于提高实验的准确性.
加深网络可以加深网络的学习能力,但如果忽略特征图像的使用率,效果提升并不显著,所以在特定的数据集下,UNet网络结构中的4次下采样并非效果最好.UNet++在传统UNet的基础上增加了更多的上采样,将不同层次的特征通过特征叠加的方式整合.并在不同层次的语义输出结果上均加入深度监督,提高了网络对不同级别特征图的利用率.
1.3 本文提出的改进UNet++网络本文受传统UNet++神经网络的启发,提出了一种改进的三维UNet++网络结构(图 1).针对阿尔茨海默神经影像学计划(Alzheimer's Disease Neuroimaging Initiative,ADNI)数据库中数据集的特点,对基于传统的UNet++网络和深度学习进行AD和NC区分的实验进行了改进:(1)优化深度监督算法,舍弃对L1的网络输出监督,仅整合L2、L3和L4的输出结果;(2)加入特征融合层,用于分类实验;(3)对图像进行了预处理.
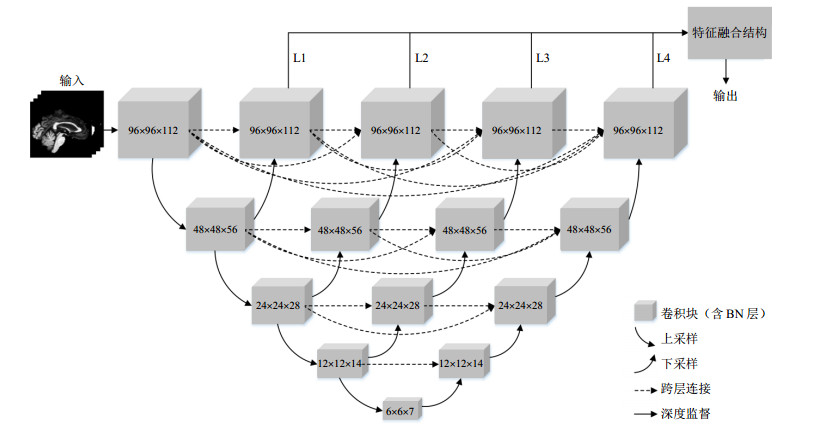
|
图 1 本文使用的网络框架示意图 Fig. 1 Schematic diagram of the proposed network framework |
深度监督算法可以有效减轻梯度消失的影响[20],并提高隐藏层学习过程的直接性和透明度[21].经多次实验结果对比,本文所用深度监督算法对传统UNet++的深度监督作出改进,网络最后的输出结果不再由所有子网络的输出决定,而仅由L2、L3和L4三部分输出结果决定.输入的图像经过4个下采样、10个上采样及图中对应的一系列嵌套的密集跨层连接操作,得到特征图.在训练过程中,附加1×1×1的卷积层对L1、L2、L3和L4进行监督,然后根据验证集上的结果选择分类效果最好的组合,从而构成改进后的深度监督算法.加入深度监督算法后的输出如(2)式所示:
| $Outpu{t_{fusion}} = outpu{t_{{\rm{L2}}}} + outpu{t_{{\rm{L}}3}} + outpu{t_{{\rm{L}}4}}$ | (2) |
对整个网络模型使用深度监督,而不是对4个不同深度的子网络分别训练,因为L2、L3和L4的输出结果在训练过程中,更深层的子网络会帮助其他部分做权重更新,使后一个子网络的输出结果综合前几个子网络更多的有效特征,多个子网络的互相影响提高了加入深度监督的模型的分类能力.
在改进算法中舍弃L1的输出结果,是因为经过对比实验发现L1对真实病灶的分类检测能力不够,舍弃L1对实验结果没有影响.因此,仅选择L2、L3和L4的输出结果引入特征融合层.
1.3.2 特征融合层的构建由于UNet++网络属于全卷积神经网络,并不能直接输出实验所要得到的分类结果.所以,本文在传统UNet++网络结构的基础上加入特征融合层.如图 2所示.
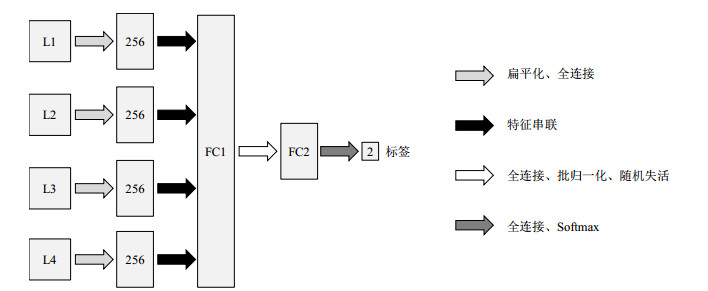
|
图 2 特征融合层结构 Fig. 2 Structure of the feature fusion layer |
特征融合层首先将上采样得到的不同语义级别的特征图像的张量数量经过Flatten扁平化和Dense全连接转换为256,然后通过Concatenate特征串联拼接组成第一个全连接层,再次通过Dense构建第二个全连接层,同时加入随机失活(Dropout)层[22]和BN层减少过拟合的发生,最后经过Dense和Softmax回归函数对数据进行分类.Softmax回归函数可以解决多种分类问题,如(3)式所示.
| ${S_i}{\rm{ = }}\frac{{{{\rm{e}}^{{V_i}}}}}{{\sum\nolimits_i^C {{{\rm{e}}^{{V_i}}}} }}$ | (3) |
其中,
在本文模型中,将前期得到的L2、L3和L4特征图像聚合后进行池化,然后接入全连接层,同时为了防止过拟合,在两个全连接层中间增加随机失活层.特征融合层的增加有三个方面的作用:(1)在一定程度上让网络参数在后续训练过程中不断得到调整,逐渐弱化图像的差异对整个网络结构带来的影响;(2)增加模型的非线性表达能力;(3)减少过拟合的发生.
1.3.3 预处理数据集中通常包含个别异常数据,导致实验结果产生误差.因此,在网络模型分析数据之前,通过预处理提高数据质量十分必要.从ADNI数据库获得数据集后,使用FMRIB软件库(FMRIB Software Library,FSL)工具箱对数据进行预处理,包括配准、颅骨剔除、图像增强、组织分割和尺度变换.预处理各阶段图像如图 3所示.其中配准使用的是MNI152_T1_1mm_brain模板;图像增强部分包括中值滤波和直方图均衡化处理;尺度变换包括去除大脑组织外部过多的背景图像体积,并将图像修剪为网络输入预先选择的大小112×96×96.

|
图 3 预处理各阶段图像
Fig. 3 The magnetic resonance bpxzz-37-3-321s at each preprocessing stage
|
本文实验所用的T1加权图像来自于ADNI数据库,其中AD患者198例、NC对照139例.我们将数据集分为三个子集,其中训练集数据占总数据量的70%,验证集和测试集分别占15%.在3个子集中AD样本所占比例均为46%,NC样本所占比例均为54%.
采用Keras深度学习模型框架,选择Tensorflow为后端,创建了UNet++架构.实验环境为统一计算设备架构(Compute Unified Device Architecture,CUDA)9.0并行计算架构,CuDNN 7.0.4GPU加速库,图形处理器(Graph Processing Unit,GPU)为NVIDIA Quadro P6000,操作系统为Windows 10.循环次数(Epoch)为150次,L2系数为0.000 05,优化器为Adam.
本文实验包含图像预处理、网络的训练阶段、验证阶段和测试阶段,具体实验流程如图 4所示.在预处理阶段,本文采用FSL[23]将图像组织分割,分成白质、灰质和脑脊液三个部分.在训练阶段,将训练集图像送入UNet++网络,经过前向传播,不断地更新模型的参数;用验证集为模型提供监督指导,以保存最佳模型;在测试阶段,将预处理后的测试集图像输入到保存的最佳模型中,经过前向传播,得到最终的分类结果.
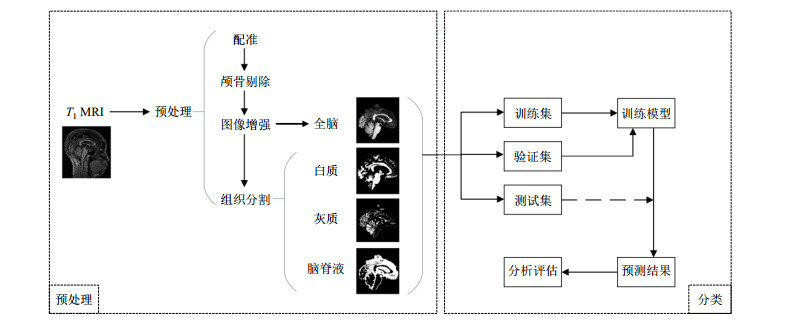
|
图 4 本文的实验流程
Fig. 4 The experimental process in this research
|
为了计算本文所提出分类框架的性能,采用准确率(Accuracy)、灵敏度(Sensitivity)、特异度(Specificity)来评价结果的质量.公式如下:
| $Accuracy = \frac{{TP + TN}}{{TP + TN + FP + FN}}$ | (4) |
| $Sensitivity = \frac{{TP}}{{TP + FN}}$ | (5) |
| $Specificity = \frac{{TN}}{{TN + FP}}$ | (6) |
其中TP为真阳性,表示被判定为AD、实际也是AD的个数;TN为真阴性,表示被判定为NC、实际也是NC的个数;FP为假阳性,表示被判定为AD、实际是NC的个数;FN为假阴性,表示被判定为NC、实际是AD的个数.
3 实验结果与讨论图 5显示了在经过预处理后的全脑图像数据中利用改进的UNet++网络,基于训练集和验证集分别得到的AD与NC分类结果的准确率和损失曲线.由图 5可以看出,训练过程在进行100次迭代后准确率和损失都得到收敛,取得了较高的训练和验证准确率.测试过程中获得的混淆矩阵如表 1所示.

|
图 5 (a) 训练集和验证集的准确率曲线;(b)训练集和验证集的损失曲线 Fig. 5 (a) Accuracy curves of training set and validation set; (b) Loss curves of training set and validation set |
| 表 1 测试集数据运行所得混淆矩阵 Table 1 Confusion matrix during running the test set |
为测试本文所提方案的稳定性,进行了3次独立运行实验,其中各部分数据集在每次运行前均被重新分区,三次独立实验的准确率分别为98.33%、98.74%和98.33%,平均准确率为98.47%,表明利用本文提出的改进UNet++网络结构可以有效区分AD患者和NC对照.
3.1 超参数对分类结果的影响在深度神经网络中,超参数可能会显著影响网络的学习效果,为了进一步分析所提方案的性能和鲁棒性,我们设置不同的超参数进行了大量测试.在通常的深度学习实验中,学习率(Learning Rate)和随机失活率会显著影响深度神经网络的性能.表 2为批尺寸(Batch Size)参数为10时,不同随机失活率和学习率下准确率的比较,可以看出网络模型分类性能受学习率和随机失活率影响显著.在学习率为0.001、随机失活率为0.5时,我们获得了最优准确率为98.74%.
| 表 2 不同随机失活率和学习率下的分类准确率 Table 2 Comparison of classification accuracy rates under different dropout rates and learning rates |
批尺寸也是深度学习中的重要参数.当数据量较少时,可以将批尺寸设置为训练集样本总数;但数据量较多时,往往采用小批量数据处理原则.但批尺寸参数的值不宜选的太小,太小容易导致不收敛,或者需要经过很大的Epoch才能收敛;也不能选得太大,太大则会出现内存溢出、训练时间增加、收敛缓慢、局部最优,泛化性差等一系列问题.所以,选择一个合适的批尺寸值尤为重要.图 6显示了在学习率为0.001、随机失活率为0.5时,训练过程中使用不同批尺寸参数获得的验证集的准确率.在批尺寸参数为10时,模型获得了最高准确率,为98.74%.
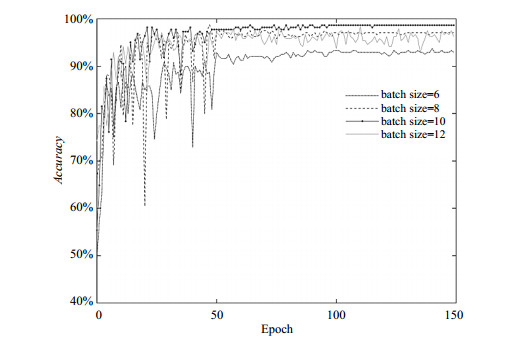
|
图 6 使用不同批尺寸参数时,验证集的准确率 Fig. 6 Accuracy rate of the validation set under different batch sizes |
本文还设计多组实验来验证深度监督算法的有效性,并通过实验来寻求最优的简化深度监督算法.首先,在学习率为0.001、随机失活率为0.5、批尺寸值为10的统一超参数的基础上,对本文的改进模型进行自身对比实验,实验结果如表 3所示.由表 3可以看出,只取L1、L2或L3以及L1+L2、L1+L3的深度监督算法的得到的分类结果的准确率、灵敏度和特异度低于无深度监督算法,但其它采用深度监督算法的实验结果均优于无深度监督算法.其中使用L2+L3+L4的深度监督算法得到的分类结果最优,说明L1+L2+L3+L4组合过多的复杂特征会导致网络模型产生过拟合,验证了本文改进后的深度监督算法的有效性.
| 表 3 深度监督算法在测试集中分类结果的对比 Table 3 Comparison of classification performance of deep supervision algorithms in the test set |
数据预处理对分类结果影响较大.没有经过数据预处理得到的分类准确率为76.31%、灵敏度为78.26%、特异度为74.63%.相比在相同的网络结构和超参数下,没有经过数据预处理得到的分类准确率比经过数据预处理后低了22.38%.
本文还将使用不同组织的磁共振图像得到的分类结果进行了对比(表 4).在不同组织图像组合分类实验中,WM+GM的组合取得到最好的测试分类结果,所有评价标准均高于WM+GM+CSF三种组织图像组合所得分类结果.由此可知,三种组织图像组合实验产生了过拟合,同时也表明了WM与GM的组织信息组合对阿尔茨海默症的检测最为有效,增加CSF的组织信息并不能提高网络模型的整体性能.
| 表 4 不同组织图像对测试集分类结果的影响 Table 4 Comparison of classification performance using different tissue bpxzz-37-3-321s in the test set |
使用ADNI数据集,利用本文提出的方法与文献报道的其他7种方法(使用的数据集与本文相同)得到的AD和NC分类结果.如表 5所示.文献[8]采用多实例学习策略和SVM算法得到了89.20%的准确率;文献[9]采用决策树算法取得了96.23%的准确率;文献[10]使用C均值聚类和人工神经网络相结合的方法,取得了98.63%的准确率,虽然准确率与本文算法几乎相当,但灵敏度和特异度远低于本文算法;文献[11]对纹理和形态特征采用了SVM算法得到了86.61%的准确率;文献[12-14]分别采用了循环神经网络(Recurrent Neural Networks,RNN)、DenseNet以及自编码神经网络的深度学习算法,得到的准确率、敏感度和特异度均低于本文方法.
| 表 5 利用本文提出的实验方法与其他7种方法得到的分类结果对比 Table 5 Comparison of classification performance using the proposed method and the referenced 7 methods |
本文基于从ADNI数据库获得的磁共振图像,提出了改进的UNet++模型,可有效区分AD患者和NC人群,该方法在测试数据集上获得的准确率、灵敏度和特异度分别为98.74%、100%和97.67%,高于文献中其他7种方法.超参数的选择、预处理过程和组织图像的选择都会影响深度学习分类器的最终性能.在未来的工作中,我们将使用更多数据集加强AD与NC人群、AD与MCI的分类诊断,并开发更具普适性的分类模型.
| [1] | QUERFURTH H W, LAFERLA F M. Alzheimer's mechanisms of disease[J]. New Engl J Med, 2010, 362(4): 329-344. DOI: 10.1056/NEJMra0909142. |
| [2] | ALZHEIMER'S ASSOCIATION. 2011 Alzheimer's disease facts and figures[R]. Alzheimer's & Dementia, 2011, 7(2): 208. |
| [3] | KIVIPELTO M, HELKALA E L, LAAKSO M P, et al. Midlife vascular risk factors and Alzheimer's disease in later life:longitudinal, population based study[J]. Brit Med J, 2001, 322(7300): 1447-1451. DOI: 10.1136/bmj.322.7300.1447. |
| [4] | JACK JR C R, BERNSTEIN M A, FOX N C, et al. The Alzheimer's disease neuroimaging initiative (ADNI):MRI methods[J]. J Magn Reson Imaging, 2008, 27(4): 685-691. DOI: 10.1002/jmri.21049. |
| [5] | BRON E E, SMITS M, VAN DER FLIER W M, et al. Standardized evaluation of algorithms for computer-aided diagnosis of dementia based on structural MRI:the CADDementia challenge[J]. NeuroImage, 2015, 111: 562-579. DOI: 10.1016/j.neuroimage.2015.01.048. |
| [6] |
CHENG H T, WANG S S, KE Z W, et al. Deep recursive cascaded convolutional network for parallel MRI[J].
Chinese J Magn Reson, 2019, 36(4): 437-445.
程慧涛, 王珊珊, 柯子文, 等. 基于深度递归级联卷积网络的并行磁共振成像方法[J]. 波谱学杂志, 2019, 36(4): 437-445. |
| [7] | LIU S D, CAI W D, WEN L F, et al. Neuroimaging biomarker based prediction of Alzheimer's disease severity with optimized graph construction[C]. San Francisco: 2013 IEEE 10th International Symposium on Biomedical Imaging. 2013: 1336-1339. |
| [8] | TONG T, WOLZ R, GAO Q Q, et al. Multiple instance learning for classification of dementia in brain MRI[J]. Med Image Comput Comput Assist Interv, 2013, 16(Pt 2): 599-606. |
| [9] | SHANKAR K, LAKSHMANAPRABU S K, KHANNA A, et al. Alzheimer detection using group grey wolf optimization based features with convolutional classifier[J]. Comput Electr Eng, 2019, 77: 230-243. DOI: 10.1016/j.compeleceng.2019.06.001. |
| [10] | BASKAR D, JAYANTHI V S, JAYANTHI A N. An efficient classification approach for detection of Alzheimer's disease from biomedical imaging modalities[J]. Multimed Tools Appl, 2019, 78(10): 12883-12915. DOI: 10.1007/s11042-018-6287-8. |
| [11] | MADUSANKA N, CHOI H K, SO J H, et al. Alzheimer's disease classification based on multi-feature fusion[J]. Curr Med Imaging Rev, 2019, 15(2): 161-169. DOI: 10.2174/1573405614666181012102626. |
| [12] | CUI R X, LIU M H, THE ALZHEIMER'S DISEASE NEUROIMAGING INITIATIVE. RNN-based longitudinal analysis for diagnosis of Alzheimer's disease[J]. Comput Med Imag Grap, 2019, 73: 1-10. DOI: 10.1016/j.compmedimag.2019.01.005. |
| [13] | LI F, LIU M H, ALZHEIMER'S DISEASE NEUROIMAGING INITIATIVE. Alzheimer's disease diagnosis based on multiple cluster dense convolutional networks[J]. Comput Med Imag Grap, 2018, 70: 101-110. DOI: 10.1016/j.compmedimag.2018.09.009. |
| [14] | LIU S Q, LIU S D, CAI W D, et al. Multimodal neuroimaging feature learning for multiclass diagnosis of Alzheimer's disease[J]. IEEE T Bio-Med Eng, 2015, 62(4): 1132-1140. DOI: 10.1109/TBME.2014.2372011. |
| [15] | IOFFE S, SZEGEDY C. Batch normalization: Accelerating deep network training by reducing internal covariate shift[J]. 2015. arXiv: 1502.03167. |
| [16] |
LIU K W, LIU Z L, WANG X Y, et al. Prostate cancer diagnosis based on cascaded convolutional neural networks[J].
Chinese J Magn Reson, 2020, 37(2): 152-161.
刘可文, 刘紫龙, 汪香玉, 等. 基于级联卷积神经网络的前列腺磁共振图像分类[J]. 波谱学杂志, 2020, 37(2): 152-161. |
| [17] | ZHOU Z W, SIDDIQUEE M M R, TAJBAKHSH N, et al. Unet++: A nested u-net architecture for medical image segmentation[C]. 4th Deep Learning in Medical Image Analysis (DLMIA) workshop, Computer Vision and Pattern Recognition, 2018. arXiv: 1807.10165 |
| [18] | RONNEBERGER O, FISCHER P, BROX T. U-net: Convolutional networks for biomedical image segmentation[C]. MICCAI 2015, Computer Vision and Pattern Recognition, Cham, 2015. arXiv: 1505.04597. |
| [19] | HUANG G, LIU Z, VAN DER MAATEN L, et al. Densely connected convolutional networks[C]. 2017 IEEE Conference on Computer Vision and Pattern Recognition (CVPR), Honolulu, HI, 2017: 2261-2269. |
| [20] | DOU Q, CHEN H, JIN Y M, et al. 3D deeply supervised network for automatic liver segmentation from CT volumes[C]. MICCAI 2016, Computer Vision and Pattern Recognition, 2016, arXiv: 1607.00582. |
| [21] | LEE C Y, XIE S N, GALLAGHER P, et al. Deeply-supervised nets[C]//Artificial Intelligence and Statistics. 2015. arXiv: 1409.5185. |
| [22] | Srivastava N, Hinton G, Krizhevsky A, et al. Dropout:a simple way to prevent neural networks from overfitting[J]. J Mach Learn Res, 2014, 15(1): 1929-1958. |
| [23] | JENKINSON M, BECKMANN C F, BEHRENS T E J, et al. FSL[J]. Neuroimage, 2012, 62(2): 782-790. DOI: 10.1016/j.neuroimage.2011.09.015. |
 2020, Vol. 37
2020, Vol. 37 
