全球兰科(Orchidaceae)石斛属植物(Dendrobium Sw.)超过1 500种,广泛分布于亚洲热带和亚热带地区至大洋洲.我国有74种和2变种,产于秦岭以南诸省区,以云南南部为多.石斛属植物的茎作为中药材石斛(Dendrobii Caulis)在我国药用已有千年,是我国常用贵重药材,具有滋阴清热、生津益胃、润肺止咳等功效,用于治疗热病伤津、口干烦渴、病后虚热等多种病症.现代药理研究显示石斛具有增强免疫、缓解糖尿病、抗氧化、抗衰老、抗肿瘤、抗炎和保护神经系统等多种药理作用[1].
石斛属植物中化学成分主要有生物碱、倍半萜、芳香类、多糖及挥发油等[2, 3].石斛碱类生物碱(dendrobines)是石斛属植物最早分离得到的成分,也是其代表性成分.石斛碱类成分结构上属于倍半萜类生物碱(sesquiterpenoid alkaloids)[4],其独特的结构和显著的生理活性备受国内外学者注目[5, 6].数十年来国内外学者围绕石斛碱类成分已开展多方面研究,发现石斛碱类成分具有广泛的生理活性,在改善胰岛素抵抗、改善大脑记忆和认知功能障碍、保护急性脑缺血损伤、抗肿瘤、抗白内障等方面效果显著[7, 8].鉴于目前尚无石斛碱类成分波谱学特征的总结,本文归纳了该类化合物的结构特点和波谱学特征,包括紫外光谱(UV)、红外光谱(IR)、质谱(MS)和核磁共振(NMR)波谱,为今后深入进行结构鉴定、构效关系、结构修饰等研究及开发提供科学依据.
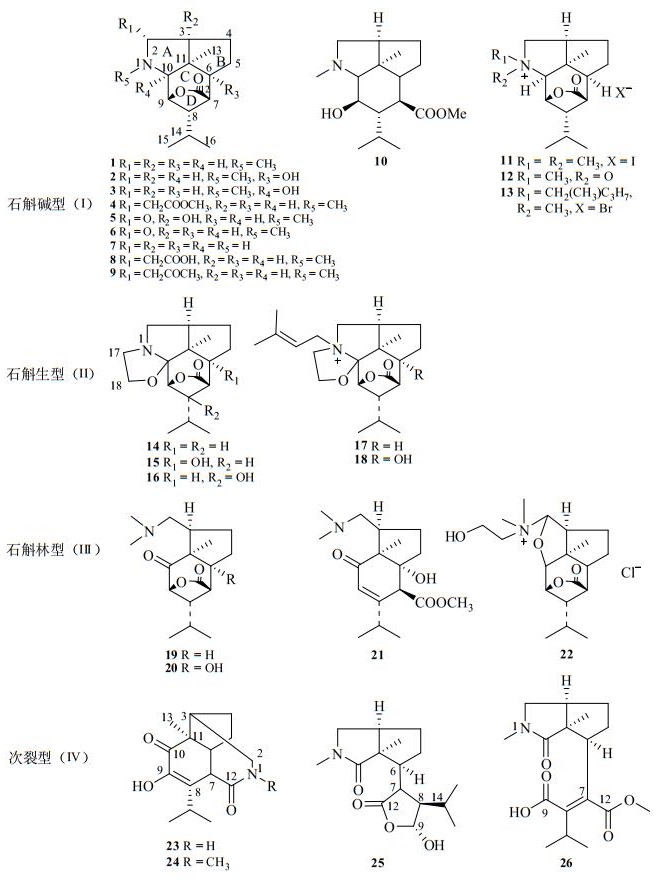
1 石斛碱类成分的结构分类与特点石斛碱类倍半萜生物碱是石斛属植物中最早发现的成分.1935年日本学者铃木秀干等首次从金钗石斛(D. nobile)分得石斛碱(1),至今从石斛属共发现该类成分26个(表 1和图 1),分布于金钗石斛、棒节石斛(D. findlayanum)、D. hildebrandii、细茎石斛(D. moniliforme)、D. friedricksianum、大苞鞘石斛(D. wardianum)六种植物中.石斛碱类成分属于伪生物碱(pseudoalkaloids),生源上来自于甲戊二羟酸(MVA)途径,其前体2-反-6-反-金合欢醇(2-epi-6-epi-trans-farnesol)经双键修饰、环合、裂解等步骤合成picrotoxane型倍半萜,再经氨基化引入氮原子而合成[9, 10].石斛碱母核是15个碳原子组成的picrotoxane型四环倍半萜,氮原子与倍半萜的C-2、C-11形成五元杂环,氮原子通常连有甲基等官能团.石斛碱多为5/5/7/5环系,其A/B、A/C、B/C、C/D环均为顺式稠合,即H-3、CH3-13、H-6、H-10、H-7、H-9均为α构型.多数石斛碱具有五元内酯环,少数内酯断裂形成OH-7和OCOCH3-9等取代.结构中有3个甲基,其中CH3-13是α构型角甲基,C-14连有两个甲基.石斛碱类成分根据结构特点可分为4个类型,即石斛碱型(Ⅰ)、石斛生型(Ⅱ)、石斛林型(Ⅲ)和次裂型(Ⅳ)[9].
| 表 1 石斛属植物中石斛碱类成分 Table 1 Dendrobines from the Dendrobium plants |
|
图 1 石斛属植物中石斛碱类成分的结构
Fig. 1 Structures of dendrobines from the Dendrobium plants
|
石斛碱型(Ⅰ)是本类化合物基本类型,数量最多,目前报道约13个(表 1中1~13),其结构特点是含氮吡咯环(A环)与倍半萜部分形成紧密四环体系,结构多样性在于氮原子存在形式和C-2、C-3、C-6、C-10的取代情况(图 1第1行).氮原子多为甲基取代,还有季铵碱、N-氧化物等存在形式,如N-isopentenyldendrobinium bromide(13)取代有异戊烯基形成季铵碱[11].C-3、C-6、C-10常见α构型羟基取代.C-2易氧化为酮,或为羧乙基(-CH2COOH)取代[12].此外mubironine C(9)内酯断裂形成OH-9和CH3OCO-7取代,环系转变为5/5/6[13].
石斛生型(Ⅱ)的结构特点是具有噁唑啉环(图 1第2行).代表性化合物为石斛生(dendroxine,14)及其C-6、C-8羟基取代化合物[14],同类化合物17和18则在氮原子上取代有异戊烯基形成季铵碱[15].
石斛林型(Ⅲ)结构中A环氧化开环,C-10氧化为酮羰基,且具有偕氮甲基取代(图 1第3行).nobiline(19)、6-hydroxynobiline(20)和moniline(21)都属该类化合物[16, 17].此外dendrowardine(22)的C-2与C-10成醚[18].
次裂型(Ⅳ)是2018年杨丹等[8]从棒节石斛中发现的一系列新颖的石斛碱,结构经X-单晶衍射实验验证.findlayines A(23)和B(24)可能源于石斛林型的N原子与裂开酯键形成酰胺,从而构成新的七元环.findlayine C(25)应为石斛碱型C环C(9)-C(10)键氧化断裂产物,而findlayine D(26)则在此基础上进一步断裂内酯键而形成.
2 石斛碱类倍半萜生物碱的波谱学特征 2.1 UV光谱UV光谱在结构解析中多用于判断化合物的共轭情况.石斛碱类成分的基本母核为饱和烃类,本身无发色基团,无特征UV吸收.石斛碱类成分的内酯环在200~210 nm处有末端吸收,但无特征性,因大多数化合物在此波长区域有吸收.少数如化合物21、23、24、26等存在α, β-不饱和酮而具有特征紫外吸收(λmax≈240 nm).
2.2 IR光谱IR光谱主要用于判断化合物中特殊官能团的存在,在石斛碱类成分中可用于判断羰基的存在形式.石斛碱类成分中五元内酯环(D环)的羰基吸收峰一般出现于1 770 cm−1处,若内酯键断裂则其吸收峰出现在1 730 cm−1处,如化合物9(υmax 1 730 cm−1)[13]、21(υmax 1 733 cm−1)[26]和26(υmax 1 729 cm−1)[8].部分化合物可通过IR谱中1 680 cm−1附近强吸收判断内酰胺结构的存在,如化合物5、6、23~25等;或通过1 630 cm−1附近的强吸收峰判断α,β-不饱和酮的存在,如化合物21、23、24、26均在1 630 cm−1左右出现强吸收峰.此外,含羟基取代的石斛碱类成分一般在3 300~3 400 cm−1处出现强吸收峰.
2.3 MS谱图MS谱图在石斛碱类成分的识别与鉴定中作用较大,除以分子离子峰信息给出精确分子量以推测分子式外,还可通过碎片峰裂解规律推断化合物结构.常见用于石斛碱类测定的电离方式主要有电子轰击电离(EI)和电喷雾电离(ESI).
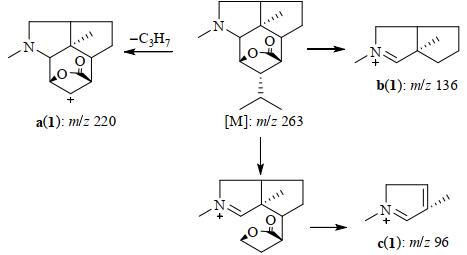
在EI裂解方式下,石斛碱类化合物主要有3个碎片离子,即去除异丙基(C3H7)的离子a(M43)、含A、B环的含氮离子b、和含B环的含氮离子c,如石斛碱(1)([M]:m/z 263)的碎片离子分别为a(1):m/z 220、b(1):m/z 136和c(1):m/z 96(图 2)[19, 27].其它化合物的离子a、b和c随取代基在相应位置的增加而发生质量位移,根据取代基类型、位置对相应离子质量影响的不同可初步完成相应取代基的种类和位置的确定,如N-CH3、C-2、C-10取代影响所有离子(a、b和c)的质量,C-6取代影响离子a和b的质量,C-8取代影响a的质量[16].在此基础上,石斛碱类的异丙基、羟基、噁唑啉环、N-CH3等基团都可鉴定出来[27].EI裂解方式下石斛碱类化合物的内酯结构的特征性并不明显.
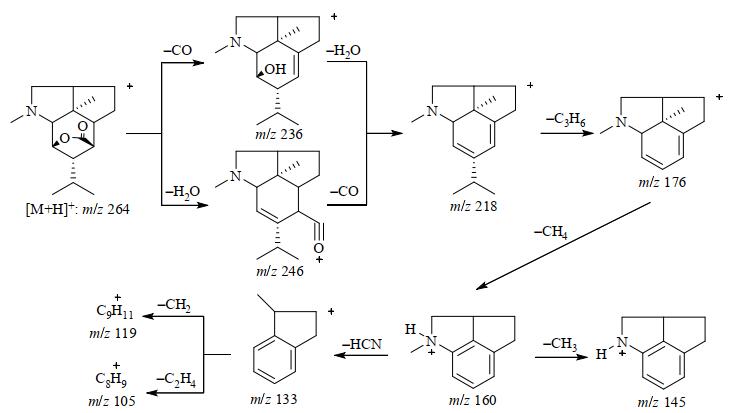
石斛碱类化合物ESI电离时通常以正离子模式进行,在一级电离时易得到[M+H]+、[M+Na]+和[M+K]+等准分子离子峰信号,方便确定化合物的相对分子量以推断分子式.ESI的二级或多级电离可发生进一步裂解,因石斛碱类化合物结构中存在内酯键、羟基、N-CH3取代等基团,故在ESI电离时多表现为丢失H2O、异丙基(C3H7)和CO或CO2等基团的离子[28, 29].如图 3所示,石斛碱的ESI裂解中可见依次脱去-CO、-OH、-H2O等基团的碎片峰,其他化合物的裂解规律也与石斛碱类似,据此可推断相应化合物的结构[30, 31].值得注意的是,应用ESI裂解规律进行石斛碱的识别与结构鉴定的尚需进一步总结经验.
2.4 NMR波谱 2.4.1 石斛碱类化合物的NMR特征石斛碱类化合物的1H NMR谱具有典型的萜类化合物特征:饱和烃质子多、峰型复杂、高场区易重叠,辨识与归属困难,故在1H NMR谱图解析时应重点关注特征信号[32].石斛碱类1H NMR谱的高场区可见三个特征的甲基信号,可作为本类化合物的诊断信号:(1)角甲基H-13位于δH 1.2~1.4,相对积分面积为3,且为单峰;(2)异丙基的一组偕二甲基H-15和H-16位于δH 0.8~1.2,相对积分面积为3,因H-14裂分为双峰(d),耦合常数(J)为6~7 Hz.本类化合物的含氧基团多取代于C-3、C-6、C-7、C-19等位置而形成季碳,故较少见含氧取代质子.多数化合物可见位于δH 4.5~5.1间的特征含氧取代质子H-9的信号.根据H-9的峰型可判断C-10的取代情况:C-10未被取代时,H-9呈双二重峰(dd);C-10被取代或羰基化时,H-9为二重峰(d).石斛碱类1H NMR谱中还可见氮原子取代特征信号,此类信号既可作为本类化合物的诊断信号,还可用于区分四种类型的化合物.
石斛碱类化合物的13C NMR谱除取代基外,母核总碳数为15,多数信号位于δC 20~40的高场区.高场区同样可见3个特征甲基诊断信号:C-13 [δC 19~32, (q)]、C-15和C-16 [δC 17~21, (q)].少数内酯断裂形成OCOCH3-7等取代,则还可见位于间的酯基氧甲基信号[δC 50~52, (q)].此外,氮甲基的信号也较为特征.石斛碱类成分至少含有2个特征季碳可作为本类化合物的诊断信号:不含氧取代C-11 [δC 51~54, (s)]和内酯羰基季碳C-12 [δC 174~180, (s)].次裂型的内酯键羰基的化学位移易受共轭影响而高场位移至约δC 170处[8].因含氧取代羟基、酯基等的引入,还可见含氧取代季碳C-6、C-7等,一般位于δC 84~86间.
2.4.2 根据氮原子取代情况区分4类化合物石斛碱类化合物的氮原子取代信号既可作为本类化合物的诊断信号,用于区分石斛碱类生物碱和picrotoxane型倍半萜,还可用于区分4种子类型化合物.石斛碱型(Ⅰ)和次裂型(Ⅳ)化合物中通常仅含一个N-CH3(δH 2.5~2.9, s, 3H; δC 35~45 q).此外,石斛碱型(Ⅰ)的H-2(t)和H-10(d)在无含氧取代时因氮原子α效应相比其它位置质子明显低场位移,位于δH 2.6~3.2间.而与石斛碱型(Ⅰ)相比,次裂型(Ⅳ)的C-10因酮基化质子信号消失,13C NMR谱中多出酰胺羰基信号约δC 170~178 (s),据此可区分二者.石斛林型(Ⅲ)都具有双N-CH3取代,积分面积为6;且石斛林型C-10羰基取代[δC 200~207 (s)].石斛生型(Ⅱ)可根据噁唑啉环的特征信号进行识别,与其他类型相比多出两个低场亚甲基CH2-17 [δH 2.9~3.1 (m), δC 55~57 (t)]和CH2-18 [δH 3.7~3.9 (m), δC 75~77 (t)],且C-10低场位移至约δC 100(表 2).
| 表 2 石斛碱类代表化合物的NMR数据 Table 2 NMR spectral data of typical compounds of dendrobines |
石斛碱类成分的结构解析一般可先通过高分辨质谱(HR-MS)确定化合物的相对分子量和分子式,然后对1H和13C NMR进行分析,通过与文献比对可鉴定已知化合物的结构(表 2).新化合物则在初步结构鉴定的基础上,进一步进行2D NMR测试予以确认.通过1H-1H COSY分析邻位氢之间关联,通过HSQC谱图完成质子与直接相连的碳原子的归属,依据HMBC谱图氢碳远程相关确定各片段的连接方式,以完成新化合物的平面结构鉴定.其中,HMBC谱在取代基的定位方面作用极大.MS碎片峰的分析也可以用于辅助进行结构鉴定.IR光谱、UV光谱和其他理化性质可用于辅助验证相应官能团的存在.此外,新化合物还需采用NOESY谱和X-单晶衍射、圆二色谱等技术对其立体结构进行分析.
3 总结随着对石斛属植物的更加深入系统的研究,尤其是对其化学成分和神经系统活性的研究,石斛碱类倍半萜生物碱成分越来越多地受学者们的关注.波谱学方法,特别是MS和NMR技术,是鉴定该类成分最为方便、有效的技术.充分利用石斛碱类成分的波谱学特征可以实现其结构的快速、准确鉴定.本文对石斛碱类成分的波谱学特征进行了总结与归纳,为该类化合物的鉴定与分析提供了参考依据.
| [1] |
ZHANG X Q, ZHAO T M, LIU J, et al. Advances in chemical compounds and pharmacological effects of Dendrobii Caulis[J].
Chinese Tradit Herbal Drugs, 2018, 49(13): 3174-3182.
张雪琴, 赵庭梅, 刘静, 等. 石斛化学成分及药理作用研究进展[J]. 中草药, 2018, 49(13): 3174-3182. DOI: 10.7501/j.issn.0253-2670.2018.13.033. |
| [2] |
XIAO S J, LIU Z, ZHANG M S, et al. A new bibenzyl compound from Dendrobium nobile[J].
Acta Pharm Sin, 2016, 51(7): 1117-1120.
肖世基, 刘珍, 张茂生, 等. 金钗石斛中一个新的联苄类化合物[J]. 药学学报, 2016, 51(7): 1117-1120. |
| [3] | XU J, HAN Q B, LI S L, et al. Chemistry, bioactivity and quality control of Dendrobium, a commonly used tonic herb in traditional Chinese medicine[J]. Phytochem Rev, 2013, 12(2): 341-367. |
| [4] |
LIU J K, HAN X W, WU D G, et al. 2D NMR studies on sesquiterpene alkaloids from Celastrus angulatus[J].
Chinese J Magn Reson, 1992, 9(3): 289-295.
刘吉开, 韩秀文, 吴大刚, 等. 南蛇藤中倍半萜生物碱的二维NMR研究[J]. 波谱学杂志, 1992, 9(3): 289-295. |
| [5] | NG T B, LIU J, WONG J H, et al. Review of research on Dendrobium, a prized folk medicine[J]. Appl Microbiol Biotechnol, 2012, 93(5): 1795-1803. DOI: 10.1007/s00253-011-3829-7. |
| [6] | GUO L, FREY W, PLIETKER B. Catalytic enantioselective total synthesis of the picrotoxane alkaloids (-)-dendrobine, (-)-mubironine B, and (-)-dendroxine[J]. Org Lett, 2018, 20(14): 4328-4331. DOI: 10.1021/acs.orglett.8b01782. |
| [7] | LI L S, LU Y L, NIE J, et al. Dendrobium nobile Lindl alkaloid, a novel autophagy inducer, protects against axonal degeneration induced by Aβ25-35 in hippocampus neurons in vitro[J]. CNS Neurosci Ther, 2017, 23(4): 329-340. DOI: 10.1111/cns.12678. |
| [8] | YANG D, CHENG Z Q, YANG L, et al. Seco-dendrobine-type alkaloids and bioactive phenolics from Dendrobium findlayanum[J]. J Nat Prod, 2018, 81(2): 227-235. |
| [9] | 王锋鹏. 生物碱化学[M]. 北京: 化学工业出版社, 2008: 394-396. |
| [10] | GÖSSINGER E. Picrotoxanes[M]. Springer, Vienna: 2010: 71-210. |
| [11] | HEDMAN K, LEANDER K. Studies on orchidaceae alkaloids. XXVII. Quaternary salts of the dendrobine type from Dendrobium nobile Lindl[J]. Acta Chem Scand, 1972, 26: 3177-3180. DOI: 10.3891/acta.chem.scand.26-3177. |
| [12] | INUBUSHI Y, NAKANO J. Structure of dendrine[J]. Tetrahedron Lett, 1965, 31: 2723-2728. |
| [13] | MORITA H, FUJIWARA M, YOSHIDA N, et al. New picrotoxinin-type and dendrobine-type sesquiterpenoids from Dendrobium snowflake 'Red Star'[J]. Tetrahedron, 2000, 56(32): 5801-5805. DOI: 10.1016/S0040-4020(00)00530-5. |
| [14] | WANG D F, YU G X, ZHAO N Y, et al. Study on chemical constituents in stems of Dendrobium nobile[J]. Chin Tradit Herbal Drugs, 2012, 43(8): 1492-1495. |
| [15] | HEDMAN K, LEANDER K, LUNING B. Studies on orchidaceae alkaloids. XXV. N-isopentenyl derivatives of dendroxine and 6-hydroxydendroxine from Dendrobium friedricksianum Lindl. and Dendrobium hildebrandii Rolfe[J]. Acta Chem Scand, 1971, 25(3): 1142-1144. |
| [16] | OKAMOTO T, NATSUME M, ONAKA T, et al. The structure of dendramine (6-oxydendrobine) and 6-oxydendroxine the fourth and fifth alkaloid from Dendrobium nobile[J]. Chem Pharm Bull, 1966, 14(6): 676-680. |
| [17] | LIU W H, HUA Y F, ZHAN Z J. Moniline, a new alkaloid from Dendrobium moniliforme[J]. J Chem Res, 2007, 2007(6): 317-318. DOI: 10.3184/030823407X218048. |
| [18] | BLOMQVIST L, BRANDANGE S, GAWEL L, et al. Studies on Orchidaceae alkaloids. XXXVII. dendrowardine, a quaternary alkaloid from Dendrobium wardianum Wr.[J]. Acta Chem Scand, 1973, 27(4): 1439-1441. |
| [19] | WANG H, ZHAO T, CHE C T. Dendrobine and 3-hydroxy-2-oxodendrobine from Dendrobium nobile[J]. J Nat Prod, 1985, 48(5): 796-801. DOI: 10.1021/np50041a014. |
| [20] | CHEN K K, CHEN A L. The alkaloid of Chin-shih-hu[J]. J Biol Chem, 1935, 111(3): 653-658. |
| [21] | GRANELLII, LEANDER K, LUNING B. Studies on Orchidaceae alkaloids. XVI. A new alkaloid, 2-hydroxydendrobine, from Dendrobium findlayanum par. et Rchb. f.[J]. Acta Chem Scan, 1970, 24(4): 1209-1212. |
| [22] | MENG C W, HE Y L, PENG C, et al. Picrotoxane sesquiterpenoids from the stems of Dendrobium nobile and their absolute configurations and angiogenesis effec[J]. Fitoterapia, 2017, 121: 206-211. DOI: 10.1016/j.fitote.2017.07.017. |
| [23] | LIU Q F, ZHAO W M. A new dendrobine-type alkaloid from Dendrobium nobile[J]. Chinese Chem Lett, 2003, 14(3): 278-279. |
| [24] | OKAMOTO T, NATSUME M, ONAKA T, et al. Further studies on the alkaloidal constituents of Dendrobium nobile (Orchidaceae)-structure determination of 4-hydroxy-dendroxine and nobilomethylene[J]. Chem Pharm Bull, 1972, 20(2): 418-421. DOI: 10.1248/cpb.20.418. |
| [25] | YAMAMURA S, HIRATA Y. Structures of nobiline and dendrobine[J]. Tetrahedron Lett, 1964, 5(2): 79-87. DOI: 10.1016/S0040-4039(00)90333-2. |
| [26] | ELANDER M, LEANDER K. Studies on orchidaceae alkaloids. XXI. 6-hydroxynobiline, a new alkaloid from Dendrobium hildebrandii Rolfe[J]. Acta Chem Scand, 1971, 25(2): 717-720. |
| [27] | 丛浦玉, 李笋玉. 天然有机质谱学[M]. 北京: 中国医药科技出版社, 2003: 443-444. |
| [28] | CHEN X M, ZHANG S S, MA J S, et al. A simple, rapid and reliable UFLC-MS/MS method for the determination of dendrobine in rat plasma and its application to a pharmacokinetic study[J]. Anal Methods, 2014, 6(4): 1197-1202. |
| [29] |
XIA J, YANG Z, ZENG Q F, et al. Analysis of chemical constituents in Dendrobium nobile by UPLC-Q-TOF[J].
Chinese Med Mat, 2018, 41(3): 600-607.
夏杰, 杨洲, 曾庆芳, 等. UPLC-Q-TOF法分析金钗石斛化学成分[J]. 中药材, 2018, 41(3): 600-607. |
| [30] |
HE Y Q, LU Y L, LI L S, et al. Analysis of alkaloids from Dendrobium nobile stem by UPLC-ESI-Orbitrap-MS[J].
Chinese J Exp Tradit Med Form, 2017, 23(20): 30-35.
何芋岐, 鲁艳柳, 李利生, 等. 基于UPLC-ESI-Orbitrap-MS技术对金钗石斛生物碱的分析[J]. 中国实验方剂学杂志, 2017, 23(20): 30-35. |
| [31] | WANG Y H, AVULA B, ABE N, et al. Tandem mass spectrometry for structural identification of sesquiterpene alkaloids from the stems of Dendrobium nobile using LC-QToF[J]. Planta Med, 2016, 82(7): 662-670. DOI: 10.1055/s-0042-103031. |
| [32] |
YIN T P, LUO Z H, CAI L, et al. Research progress and NMR spectral features of natural C19-diterpenoid alkaloids[J].
Chinese J Magn Reson, 2018, 36(1): 113-126.
尹田鹏, 罗智慧, 蔡乐, 等. 天然C19-二萜生物碱的研究进展及其核磁共振波谱特征[J]. 波谱学杂志, 2018, 36(1): 113-126. |
 2020, Vol. 37
2020, Vol. 37