2. 中国科学技术大学, 安徽 合肥 230026
2. University of Science and Technology of China, Hefei 230026, China
Wilson疾病(Wilson’s disease,WD)是一种铜代谢异常的常染色体隐性遗传疾病,染色体上的ATP7B基因突变导致肝细胞转运铜发生障碍,引起铜在肝脏、大脑等器官沉积[1].过量的铜沉积会诱导双侧壳核、苍白球(lateral globus pallidus,LGP)、丘脑及小脑等脑区域病变[2],使WD患者出现震颤、运动障碍及认知障碍等症状[3].目前对WD的研究主要集中在分子水平的基因分析、整体水平的疾病动物模型及临床病理研究[4].由于医学伦理学及相关临床实验法规的限制,合适的实验动物模型对WD研究非常重要.啮齿类动物作为复制人类疾病和基因功能研究的首选动物模型,被广泛应用于功能基因组学、发育生物学和疾病机制的研究领域[5].常用的WD动物模型包括LEC(long-evens cinnamon)大鼠、ATP7B基因敲除小鼠和TX(toxic milk)小鼠等[6].相比于其他几种动物模型,TX小鼠具有与WD患者类似的表型特征[7],包括生长迟缓、震颤、运动能力及空间记忆力下降等,是目前较为理想的WD动物模型.
扩散张量成像(diffusion tensor imaging,DTI)是一种基于水扩散特性研究组织微观结构的磁共振成像(magnetic resonance imaging,MRI)方法,因无创且操作相对简单,被广泛应用于活体脑组织研究[8].各向异性比值(fractional anisotropy,FA)和平均扩散率(mean diffusivity,MD)作为DTI常用量化指标,能够反映组织内水分子的扩散特性,有助于探究微观结构的异常[9].FA是指扩散张量各向异性分量与总扩散张量的比值,其变化与脑组织微观结构异常有关;MD是水分子扩散在各个方向上的平均值,若MD明显上升,表明组织内自由水分子增多、脑组织缺失某些组成成分或结构出现异常[10].FA值可进一步分为轴向扩散系数λ//(axial diffusivity,AD)和径向扩散系数λ⊥(radial diffusivity,RD)两个失量参数,AD值等于最大扩散系数(λ1),RD值为中级扩散系数(λ2)和最低扩散系数(λ3)的平均值.高分辨DTI能够通过神经纤维束成像的方法,描绘出脑区域之间的结构连接.纤维束追踪法是一种通过局部张量信息和计算机重建技术,显示纤维结构整体连续性和空间分布的检测方法[11].目前,纤维束追踪算法主要包括确定性算法和概率算法.与确定性纤维束追踪法不同的是,概率算法在纤维束追踪时同时考虑了水分子在空间扩散中的各向同性和各向异性,从而在精细分支纤维和交叉纤维的辨认上有一定的优势.众多研究[12-14]表明,WD患者在铜累积区域,如双侧尾状核(caudate putamen,CPu)、豆状核、腹侧丘脑等区域,FA显著下降,MD显著上升.与常规MRI相比,DTI对脑损伤具有更高的敏感性和特异性[15],但利用DTI技术对WD动物模型TX小鼠的研究至今未见报道.
本文利用9.4 T高场DTI技术探究TX小鼠的脑结构异常.研究过程中采用了感兴趣区域(regions of interest,ROIs)分析法和纤维束追踪法,通过分析TX小鼠在海马(hippocampus,Hcp)、尾状核、苍白球及额叶联合皮层(frontal association cortex,FrA)区域内FA和MD等指标的变化,探讨DTI对铜累积区域脑组织结构异常的灵敏性,为WD动物模型的脑组织研究提供一种新思路.
1 实验方法 1.1 实验材料实验选取自美国Jackson动物实验中心引进的6只TX种鼠(模型组)和6只DL乳鼠(对照组),均为5月龄,饲养于安徽省重点实验室9.4 T磁共振动物一体化成像平台小动物屏障环境[动物实验使用许可证:SYXK(皖)2018-005]内进行传代繁殖,环境温度控制在22~26 ℃,相对湿度为50%~70%,光照强度为15~20勒克斯,昼夜循环12 h.所有实验及相关操作均在光照期间内进行.小鼠自由饮水,利用常规鼠类饲料喂养.本实验所涉及的实验动物研究内容,经中国科学院合肥物质科学研究院实验动物伦理委员会审查,符合国家科学技术委员会发布的《实验动物管理条例》和卫生部发布的《医学实验动物管理实施细则》以及中国科学院合肥物质科学研究院动物使用和管理委员会有关章程.
1.2 数据采集采用3.5%剂量的异氟烷混合氧气对小鼠进行诱导麻醉后,将小鼠仰卧放置在动物床内,并用水浴垫对小鼠进行保温.扫描期间,使用0.8%~1%剂量的异氟烷使小鼠保持麻醉状态,并利用呼吸监控仪观测小鼠生命体征,使小鼠的呼吸频率维持在(30±5)次/分钟.
图像扫描利用Agilent Technologies 9.4T/400PS动物扫描仪,口径为40 cm.梯度线圈口径为26 cm,射频线圈为自制高灵敏度小型正交高通型线圈.结构像采用伴弛豫增强快速釆集(rapid acquisition with relaxation enhancement,RARE)序列获得,相关参数为:重复时间(repetition time,TR)= 8 000 ms,回波时间(echo time,TE)=18 ms,视野范围(field of vision,FOV)=16 mm×16 mm,矩阵=192×192,层厚=0.5 mm,带宽=50 kHz.自旋回波序列用于采集轴向扩散张量图像,采集参数为:TR=3 500 ms,TE=32 ms,FOV=16 mm×16 mm,矩阵=90×90,层厚=0.5 mm,b=600 s/mm2,梯度方向数=12.
1.3 数据处理采用Matlab R2018b(https://ww2.mathworks.cn/)、DSI-Studio(http://dsi-studio.labsolver.org/)和FMRIB's Diffusion Toolbox(FDT,www.fmrib.ax.ac.uk/fsl)软件包进行数据处理.首先将原始的DICOM数据转成NIFTI格式,以便后续处理;然后利用ImageJ(https://imagej.nih.gov/)软件手动剥除结构像中颅骨以外的非脑组织,得到小鼠脑模板;在Matlab平台上,利用小鼠脑模板生成去除颅骨后的DL对照组和TX模型组的结构像和扩散张量图像.
使用DSI-Studio软件处理DTI数据,得到DL对照组与TX模型组的FA图、MD图、AD图及RD图;对照Paxinos等[16]人制作的标准小鼠脑图谱选取结构像上单层面内的双侧海马、尾状核、苍白球及额叶联合皮层作为ROIs(图 1),计算区域内各量化指标均值用以统计分析.ROI在同一脑区左右两侧大小相同,形状均为椭圆形.为减小手绘误差,将ROI保存为模板以做标记,并选取双侧数据均值作为各ROI的测量值.
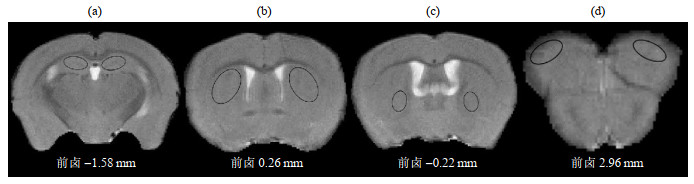
|
图 1 用于分析的感兴趣区域.(a)海马;(b)尾状核;(c)苍白球;(d)额叶联合皮层 Fig. 1 Regions of interest for analysis. (a) Hippocampus; (b) Caudate putamen; (c) Lateral globus pallidus; (d) Frontal association cortex |
纤维束追踪是利用FDT工具包处理得到的.去除由涡流引起的变形和头动后,在贝叶斯估计扩散参数(BEDPOSTX)方法下[17],利用马尔可夫链蒙特卡罗(Markov Chain Monte Carlo)抽样技术计算每个体素的扩散参数,得到纤维束追踪需要的所有参数及每个体素交叉纤维的数量.以上述脑区左右两侧ROIs为种子区,使用白质纤维概率追踪工具包(ProbtrackX)进行全脑的概率走向估计,产生经过各个ROI的纤维连接图,其中曲率变化阈值(curvature change threshold)设置为0.1.通过FSLeyes的统计直方图得到概率图的连接强度,在Matlab平台上计算DL正常组和TX模型组的平均连接强度用于统计分析.
1.4 统计分析采用SPSS 20.0(https://www.ibm.com/analytics/spss-statistics-software)软件进行统计学分析,数据用均数±标准差(x±s)表示.DL正常组与TX模型组之间采用组间独立样本t检验,分析是否存在显著性差异,p < 0.05表示差异具有统计学意义.
2 结果与讨论 2.1 基于ROI的量化指标结果分析本实验利用9.4 T高场磁共振DTI技术对DL对照组和TX模型组小鼠的铜累积区域成像.对比分析图 2所示的FA图、MD图、AD图及RD图,DL对照组与TX模型组之间未表现出明显差异.
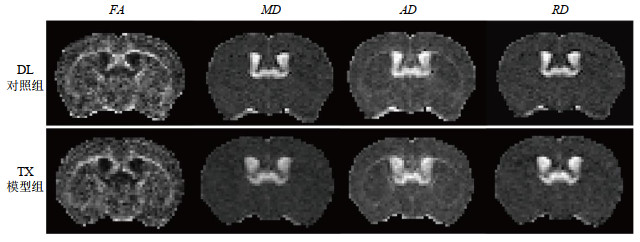
|
图 2 DL对照组与TX模型组的扩散张量图像.FA(各向异性比值),MD(平均扩散率),AD(轴向扩散系数),RD(径向扩散系数) Fig. 2 Diffusion tensor images of DL control group and TX model group. FA (fractional anisotropy), MD (mean diffusivity), AD (axial diffusivity), RD (radial diffusivity) |
TX模型组的脑病理学研究发现,海马、纹状体、大脑皮层和小脑区域铜浓度均呈升高趋势,其中以纹状体浓度最高.由铜转运障碍引起的铜累积会诱导神经元凋亡,破坏脑组织微观结构,影响铜沉积脑区的正常功能[18].因此,本文选取海马、尾状核、苍白球及额叶联合皮层作为ROIs.通过计算FA、MD、AD及RD(表 1),对ROIs结构变化进行定量分析.
| 表 1 DL对照组及TX模型组感兴趣区域的各向异性比值(FA)、平均扩散率(MD)、轴向扩散系数(AD)、径向扩散系数(RD)的比较 Table 1 Comparison of FA, MD, AD and RD values in ROIs between DL control group and TX model group |
各向异性指标FA的下降可间接反映脑组织异常,本文通过ROI分析发现TX模型组的FA在海马区域显著下降(p < 0.05)(图 3),表明该区域脑组织微观结构被破坏.海马作为脑学习记忆中枢,其结构异常会影响TX小鼠空间记忆能力.Terwel等[7]利用Morris水迷宫实验观察发现,12月龄TX模型组到达隐蔽平台的时间明显长于DL对照组小鼠,表明TX模型组空间记忆能力下降.TX模型组的FA在额叶联合皮层呈下降趋势,但无统计学意义(p > 0.05)(图 3).基底神经节具有重要的运动调节作用,尾状核和苍白球作为基底神经节的主要组成部分,其结构改变会引起小鼠运动功能异常.在苍白球和尾状核区域,TX模型组的FA较DL对照组下降显著(p < 0.05),由上述差异可知苍白球、尾状核区域内组织的微观结构受损,从而影响TX小鼠的运动功能.Przybylkowski等[19]发现在2月龄和12月龄TX小鼠的纹状体区域均出现不同程度的铜沉积,其中12月龄小鼠沉积显著.转棒实验和脚印实验测试结果表明,相比于同月龄DL小鼠,2月龄TX小鼠运动能力呈现下降趋势,12月龄的TX小鼠出现明显的运动障碍.
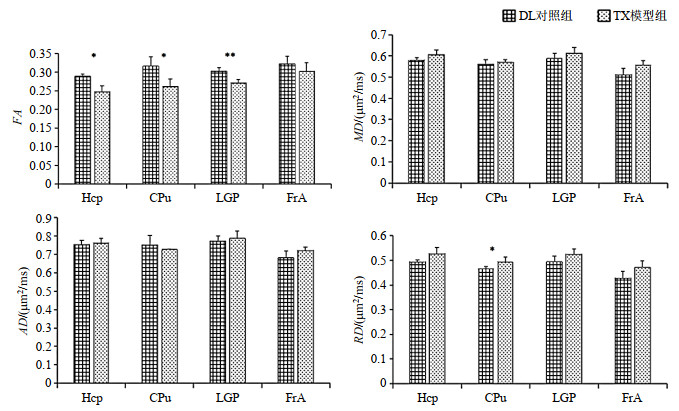
|
图 3 感兴趣区域(Hcp:海马;CPu:尾状核;LGP:苍白球;FrA:额叶联合皮层)的各向异性比值(FA)、平均扩散率(MD)、轴向扩散系数(AD)及径向扩散系数(RD)在DL对照组与TX模型组之间的变化趋势.条形图由平均值±标准差表示,其中**表示p < 0.01,* p < 0.05 Fig. 3 Comparison of FA, MD, AD and RD values in ROIs between DL control group and TX model group. Data were represented by mean±standard deviation, ** p < 0.01, * p < 0.05 |
在所选ROIs,MD在TX模型组中均呈上升趋势,但无统计学意义(p > 0.05)(图 3).AD反映水分子在纤维束平行方向的扩散能力;RD表示在垂直于纤维束的两个方向上水分子扩散的平均值,分子在径向扩散越明显,表明神经纤维束在径向越稀疏,水分子更容易通过[20].因此AD和RD可间接反映结构完整性及病变对结构造成的影响.实验结果显示在FA显著下降的尾状核区域,AD下降、RD显著上升,表明尾状核区域内FA的下降主要与RD上升有关.RD值越大,水分子在径向扩散越明显,表明组织含水量越多.但其他区域的MD、AD及RD均未出现明显变化,因此相比于FA值,其他三种指标对TX小鼠脑结构损伤灵敏性较低.WD患者的病变脑域普遍表现为FA下降,MD上升[12-14].Lawrence等[21]对WD病人进行脱铜治疗后,患者的DTI量化指标出现明显改善,主要体现在FA上升,MD、AD及RD下降.本文发现DTI指标变化在TX模型组与ATP7B功能障碍引起人脑结构异常存在着一定的相似性,但并不完全相同,比如TX模型组的DTI指标仅在部分脑区与DL对照组相比存在显著性差异.
2.2 纤维束追踪结果分析以海马、尾状核、苍白球和额叶联合皮层为种子区得到的纤维束追踪概率图如图 4所示,其中靠近种子点的区域连接概率较高,随着追踪距离的增加,连接概率下降(由黄色逐渐变为红色).纤维束概率追踪得到的是两点之间连接的可能性,追踪图的信号强度反映了每个体素和种子点之间的连接强度[17].统计分析发现,与DL对照组相比,TX模型组在海马(p=0.778)、尾状核(p=0.386)、苍白球(p=0.268)和额叶联合皮层(p=0.913)种子区的连接强度均无显著性差异(p > 0.05),说明经过种子区的纤维束没有出现明显异常.结果表明TX模型组仅在ROIs内存在组织结构损伤,脑区域之间的结构连接未受到严重破坏.胡璟等[22]研究了5月龄TX模型组和DL对照组小鼠脑中铜浓度分布及铜累积对神经元的影响,发现在铜累积较多的基底神经节区,存在比大脑皮层等脑区更多的细胞凋亡,神经元的凋亡、坏死导致神经系统损伤,这解释了尾状核和苍白球区域观察到FA显著改变的原因,同时证明了铜累积对神经元的损伤具有区域性[23].
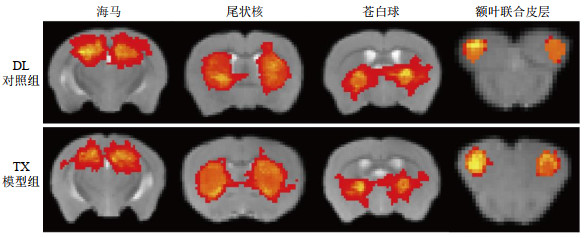
|
图 4 DL对照组与TX模型组的纤维束追踪概率图 Fig. 4 Fiber tractographys of DL control group and TX model group |
本文利用9.4 T DTI技术分析了TX小鼠脑组织病变区域的成像特点.基于ROI分析法发现DTI量化指标FA对TX小鼠脑损伤灵敏性较高,纤维束追踪法显示TX小鼠的脑结构连接未受到严重破坏.以上结果表明,DTI技术可作为辅助分析TX小鼠脑组织微观结构改变的手段.
| [1] | BULL P C, THOMAS G R, ROMMENS J M, et al. The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene[J]. Nat Genet, 1993, 5(4): 327-337. DOI: 10.1038/ng1293-327. |
| [2] | DAVIES K M, HARE D J, COTTAM V, et al. Localization of copper and copper transporters in the human brain[J]. Metallomics, 2013, 5(1): 43-51. DOI: 10.1039/C2MT20151H. |
| [3] | PATIL M, SHETH K A, KRISHNAMURTHY A C, et al. A review and current perspective on Wilson disease[J]. J Clin Exp Hepatol, 2013, 3(4): 321-336. DOI: 10.1016/j.jceh.2013.06.002. |
| [4] |
ZHAO W, CHENG N, HAN Y Z. Advances in animal models of Wilson's disease[J].
Anhui Medical Journal, 2014, 35(11): 1611-1613.
赵雯, 程楠, 韩咏竹. Wilson病的动物模型研究进展[J]. 安徽医学, 2014, 35(11): 1611-1613. DOI: 10.3969/j.issn.1000-0399.2014.11.046. |
| [5] | FUENTEALBA I C, ABURTO E M. Animal models of copper-associated liver disease[J]. Comp Hepatol, 2003, 2(1): 5. DOI: 10.1186/1476-5926-2-5. |
| [6] | MEDICI V, HUSTER D. Animal models of Wilson disease[J]. Handb Clin Neurol, 2017, 142: 57-70. DOI: 10.1016/B978-0-444-63625-6.00006-9. |
| [7] | TERWEL D, LÖSCHMANN Y N, SCHMIDT H H, et al. Neuroinflammatory and behavioural changes in the Atp7B mutant mouse model of Wilson's disease[J]. J Neurochem, 2011, 118(1): 105-112. DOI: 10.1111/j.1471-4159.2011.07278.x. |
| [8] |
JIANG F, WANG Y J. Construction of human brain templates with diffusion tensor imaging data:a review[J].
Chinese J Magn Reson, 2018, 35(4): 123-133.
蒋帆, 王远军. 扩散张量成像的人脑模板构建[J]. 波谱学杂志, 2018, 35(4): 123-133. |
| [9] | BUDDE M D, SKINNER N P. Diffusion MRI in acute nervous system injury[J]. J Magn Reson, 2018, 292: 137-148. DOI: 10.1016/j.jmr.2018.04.016. |
| [10] |
NIE T T, SHEN Z W, GENG K, et al. T2-weighted image and diffusion tensor imaging of cuprizone-induced demyelination in C57BL/6 mouse model[J].
Chinese J Magn Reson Imaging, 2014, 5(6): 467-472.
聂婷婷, 沈智威, 耿宽, 等. Cuprizone诱导的C57BL/6小鼠脱髓鞘模型的T2WI及DTI研究[J]. 磁共振成像, 2014, 5(6): 467-472. DOI: 10.3969/j.issn.1674-8034.2014.06.18. |
| [11] | MASUTANI Y, AOKI S, ABE O, et al. MR diffusion tensor imaging:recent advance and new techniques for diffusion tensor visualization[J]. Eur J Radiol, 2003, 46(1): 53-66. DOI: 10.1016/S0720-048X(02)00328-5. |
| [12] | JADAV R, SAINI J, SANJIB S, et al. Diffusion tensor imaging (DTI) and its clinical correlates in drug native Wilson's disease[J]. Metab Brain Dis, 2013, 28(3): 455-462. DOI: 10.1007/s11011-013-9407-1. |
| [13] | LI W, LIU J, SKIDMORE F, et al. White matter microstructure changes in the thalamus in Parkinson disease with depression:a diffusion tensor MR imaging study[J]. AJNR Am J Neuroradiol, 2010, 31(10): 1861-1866. DOI: 10.3174/ajnr.A2195. |
| [14] | WANG A Q, WU H L, XU C S, et al. Study on lesion assessment of Cerebello-Thalamo-Cortical network in Wilson's disease with diffusion tensor imaging[J]. Neural Plast, 2017: 7323121. |
| [15] | MEENAKSHI-SUNDARAM S, MAHADEVAN A, TALY A B, et al. Wilson's disease:A clinico-neuropathological autopsy study[J]. J Clin Neurosci, 2008, 15(4): 409-417. DOI: 10.1016/j.jocn.2006.07.017. |
| [16] | KONSMAN J P. The mouse brain in stereotaxic coordinates[M]//PAXINOS G, FRANKLIN K B J. Psychoneuroendocrinology. 2nd Ed. New York: Academic Press, 2003, 28(6): 827-828. |
| [17] | BEHRENS T E, BERG H J, JBABDI S, et al. Probabilistic diffusion tractography with multiple fibre orientations:What can we gain?[J]. Neuroimage, 2007, 34(1): 144-155. DOI: 10.1016/j.neuroimage.2006.09.018. |
| [18] | MEDICI V, HUSTER D. Animal models of Wilson disease[J]. Handb Clin Neurol, 2017, 142: 57-70. DOI: 10.1016/B978-0-444-63625-6.00006-9. |
| [19] | PRZYBYLKOWSKI A, GROMADZKA G, WAWER A, et al. Neurochemical and behavioral characteristics of toxic milk mice:an animal model of Wilson's disease[J]. Neurochem Res, 2013, 38(10): 2037-2045. DOI: 10.1007/s11064-013-1111-3. |
| [20] |
GAO W J, LI Q, CHEN P Y, et al. The correlation between the structural properties of the arcuate bundle and the performance of language comprehension is analyzed by limiting spherical convolution[J].
Chinese J Magn Reson, 2016, 33(2): 269-280.
高雯菁, 李锵, 陈品元, 等. 应用限制球形卷积解析弓状束的结构特性与语言理解表现的相关性[J]. 波谱学杂志, 2016, 33(2): 269-280. |
| [21] | LAWRENCE A, SAINI J, SINHA S, et al. Improvement of diffusion tensor imaging (DTI) parameters with decoppering treatment in Wilson's disease[J]. JIMD Rep, 2015, 25: 31-37. |
| [22] |
HU J, JIAO X T, LIU X Q, et al. Cell apoptosis and expression of ATP7A in brain of Atp7btx-j mice[J].
Journal of Shanghai Jiaotong University (Medical Science), 2013, 33(7): 916-919.
胡璟, 焦先婷, 刘晓青, 等. Atp7btx-j小鼠脑组织细胞凋亡及ATP7A表达研究[J]. 上海交通大学学报(医学版), 2013, 33(7): 916-919. DOI: 10.3969/j.issn.1674-8115.2013.07.004. |
| [23] | BONILLA E, SALAZAR E, VILLASMIL J J, et al. Copper distribution in the normal human brain[J]. Neurochem Res, 1984, 9(11): 1543-1548. DOI: 10.1007/BF00964589. |
 2019, Vol. 36
2019, Vol. 36 
