2. 中国科学院 武汉物理与数学研究所, 湖北 武汉 430071
2. Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences, Wuhan 430071, China
相比HY分子筛,超稳Y分子筛具有更加良好的催化性能,目前已被作为催化剂的活性组分广泛用于各种催化反应.由于水热稳定性好、氢转移性能较缓等特点,超稳Y分子筛被广泛用作催化裂化(FCC)催化剂的活性组分来生产高质量的汽油,其生产的汽油具有裂化产物烯烃多、汽油辛烷值较高、结焦少、烧焦所需温度低等优点[1-3].在工业使用过程中,FCC催化剂需经历条件苛刻的水热环境,超稳Y分子筛的骨架结构会逐渐受到破坏,从而改变其孔道结构和表面酸性等物化性质,导致活性中心数目逐渐减少,最终发生水热失活现象.因此,工业FCC催化剂不仅需具有良好的活性和选择性,还必须具备良好的水热稳定性,才能在高温水热条件下具有较好的催化活性保留度.
现有研究表明,超稳Y分子筛酸中心的数目、酸强度都会直接影响FCC催化剂的催化性能,而分子筛酸性的来源与其自身铝物种密切相关[2-5].在Y分子筛水热脱铝过程中,骨架硅/铝原子比随着脱铝深度的增加而增大,晶胞常数会逐渐变小,而且还会有大量晶格空位和非骨架铝物种出现.水热脱铝引起的上述性质的变化均可能对其活性、选择性、稳定性、扩散和吸附性能产生影响[4-7].因此,超稳Y分子筛在水热老化过程中结构和酸性特征的变化,对FCC催化剂性能的影响至关重要.Lohse等[8, 9]研究认为:在高温水热条件下,非骨架铝可以形成流动性的复合物,当进行进一步老化或水热处理时,它们可迁移至晶粒外表面,并有机会形成多核铝簇,从而可能形成中性铝物种,同时表面大量富铝.在已往的文献报道中,由于缺乏有效的表征手段,超稳Y分子筛水热老化条件下物性变化的研究工作主要集中在常规物化表征及宏观反应评价,而对于其铝物种和酸性质的变化规律及其对应关系等一些重要的问题尚缺乏深入的研究.作者前期的研究[10]中,对此基础问题曾进行过初步的探讨.
为了深入地研究超稳Y分子筛在水热老化过程中的酸中心结构和酸性特征的变化规律,本文通过固体核磁共振(NMR)结合探针分子技术,在前期研究[10-12]的基础上,又考察了不同骨架硅/铝原子比的超稳Y分子筛在水热老化过程中酸性质的变化规律及其与铝物种的关联,并对铝物种、酸量和酸强度进行定量或定性分析,较为全面获取了超稳Y分子筛的结构组成和酸性特征的变化规律,以期为超稳Y分子筛改性和应用提供有益信息.
1 实验部分 1.1 试剂和分子筛制备实验所用的原料NaY分子筛的整体硅/铝原子比为2.7、氧化钠含量为12%、结晶度为84%,购于中国石化催化剂有限公司长岭分公司;探针分子三甲基膦(TMP)和2-13C-丙酮均购于百灵威科技有限公司.
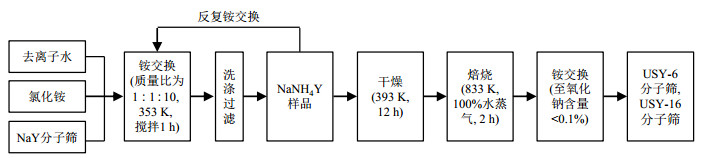
超稳Y分子筛的制备流程[11]如图 1所示,本文分别选取了第一次铵交换6次和16次的分子筛进行研究分析,处理得到的两种超稳Y分子筛样品,分别命名为USY-6(骨架硅/铝原子比为5.9)和USY-16(骨架硅/铝原子比为6.8)分子筛,其结构组成见表 1.超稳Y分子筛的老化处理方法见参考文献[11],本文选取的超稳Y分子筛的老化时间分别为1 h、3 h、5 h、9 h和17 h.
|
图 1 超稳Y分子筛(USY-6和USY-16)的制备流程图 Fig. 1 Preparation flow chart of the two ultra-stable Y zeolites (USY-6 and USY-16) |
| 表 1 本文制备的2个超稳Y分子筛样品的化学组成和结构参数 Table 1 The elemental composition and structure parameters of the two prepared ultra-stable Y zeolites |
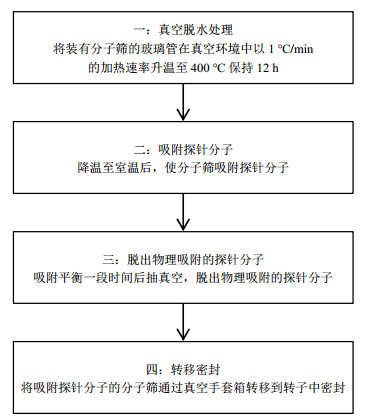
NMR探针分子技术是通过观测吸附在分子筛上的探针分子来研究分子筛的酸性,因此须将探针分子吸附在分子筛上再进行固体NMR实验.本文使用的探针分子(包括2-13C-丙酮和TMP)吸附处理流程具体如图 2所示.
|
图 2 探针分子的吸附处理流程示意图 Fig. 2 Adsorption process schematic of probe molecule |
31P核和27Al核的单脉冲NMR实验均在Bruker Avance Ⅲ 500 WB谱仪上完成.27Al核和31P核的共振频率分别为130.2 MHz和202.3 MHz.27Al魔角旋转(MAS)NMR实验采用小扳倒角的单脉冲序列,MAS速率为12 kHz,激发π/18脉宽设为0.6 μs,脉冲延迟为1 s.31P DP/MAS NMR(DP为高功率去耦的单脉冲)实验的90˚脉宽为2.85 μs,循环延迟为200 s,MAS转速为10 kHz.
13C NMR实验均在配备7 mm双共振探头的Varian-300谱仪上完成,在13C交叉极化/魔角旋转(CP/MAS)NMR实验中,1H→13C CP采用六甲基苯优化Hartmann-Hahn匹配条件,MAS速率为4 kHz,脉冲延迟为5 s,累加扫描1 600次.
31P、27Al和13C NMR的化学位移分别以(NH4)2HPO4、1 mol/L Al (NO3)3溶液和六甲基苯定标.
2 结果与讨论 2.1 水热老化过程中超稳Y分子筛酸中心结构的变化规律分子筛酸中心结构的变化取决于铝的配位状态的变化,而我们前期的研究结果[11]已表明, 骨架硅/铝原子比不同的超稳Y分子筛(整体硅/铝比相同)在水热老化过程中铝物种的变化规律基本相同,这表明水热老化过程中超稳Y分子筛酸中心结构的变化规律相似.本文为了更清晰地呈现出铝物种与酸性之间的对应关系,图 3再次给出了USY-6和USY-16分子筛的27Al MAS NMR谱图,0 h的谱图对应未老化的新鲜剂.根据图 3可知,水热老化1 h后,骨架铝含量急剧减少,非骨架铝含量剧增.尽管USY-6新鲜剂中的骨架铝含量高于USY-16新鲜剂,但经过1 h的水热老化后,USY-6和USY-16分子筛中骨架铝的含量几乎相同[11],这表明新鲜剂的骨架硅/铝原子比越高(整体硅/铝比相同的条件下,晶胞越小),老化前期其骨架铝脱除的越少.通过27Al NMR实验结果,我们推测出在水热老化过程中,除了部分骨架四配位铝脱除形成非骨架五配位铝外,还有部分非骨架六配位铝也转变为非骨架五配位铝物种.针对不同铝物种的变化规律,我们的前期研究[11]已给出了相应的解释,认为可能是非骨架六配位铝可以进一步与骨架四配位铝之间脱除一个水分子形成非骨架五配位铝[13],使得在老化过程中不仅骨架铝的含量在降低,同时非骨架六配位铝的含量也在降低.

|
图 3 不同水热老化时间后的(a) USY-6和(b) USY-16分子筛的27Al MAS NMR谱[11].Ⅳ—骨架四配位铝;Ⅴ—非骨架五配位铝;Ⅵ—非骨架六配位铝 Fig. 3 27Al MAS NMR spectra of USY-6 (a) and USY-16 (b) zeolites prepared at different aging time. Ⅳ— Four-coordinate framework aluminum; Ⅴ— Five-coordinate extra-framework aluminum; Ⅵ — Six-coordinate extra-framework aluminum |
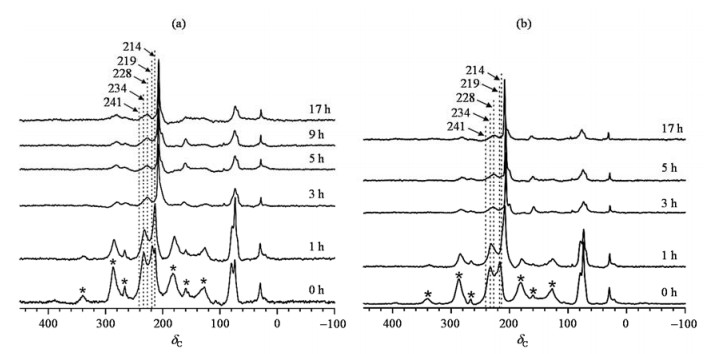
本文首先利用2-13C-丙酮作为NMR探针分子研究了不同老化时间下的超稳Y分子筛的酸强度.图 4(a)和图 4(b)分别给出了不同老化时间的USY-6和USY-16分子筛吸附2-13C-丙酮的13C CP/MAS NMR图谱.由图 4(a)可知,水热老化前后的USY-6分子筛中都存在着3种不同酸强度的Br ønsted酸(B酸)位,吸附在3种不同B酸位上的丙酮分别位于δC 219、228和234,对应分别记为B1、B2和B3酸位.位于δC 219的信号归属为吸附在常规B酸位上的丙酮,位于δC 228和234的信号归属为吸附在B酸与L酸协同效应引起酸性增强(当L酸与B酸位周围的氧原子配位时,将会导致B酸位酸性的增强,尽管二者之间不存在直接的相互作用)的B酸位上的丙酮.位于δC 241的信号则归属于吸附在L酸位上的丙酮[14].对比老化前后的NMR谱图可见,老化前后不同酸强度的B酸位的相对含量(不同B酸位占总B酸位的百分比)变化很大.老化前,B酸中B1酸位的相对含量最高,B3酸位的相对含量次之,而B2的相对含量最低;老化1 h后,B3酸位的相对含量最高,而B1酸位的相对含量变为最低;当老化3 h后,相对含量最高的是B2酸位,相对含量最低的是B1酸位;老化时间大于3 h后,三种B酸位的相对含量几乎不再变化.通过对比图 4(a)和图 4(b)可知,老化前后的USY-16分子筛也同样存在着3种不同酸强度的B酸位和L酸位;且在水热老化过程中,USY-16分子筛中3种不同酸强度的B酸位相对含量的变化规律与USY-6分子筛相同.
|
图 4 吸附在不同老化时间的(a) USY-6和(b) USY-16分子筛上的2-13C-丙酮的13C CP/MAS NMR谱 Fig. 4 13C CP/MAS NMR spectra of 2-13C-acetone adsorbed on USY-6 (a) and USY-16 (b) zeolites prepared at different aging time |
上述结果表明,在水热老化过程中,USY-6和USY-16分子筛B酸位的变化规律相似,老化后B酸的酸量大幅减少.在老化的前3 h,尽管B酸的总酸量随着水热老化时间的增加而减少,但是酸性增强的B酸位(δC 228和234)的相对含量在增加;老化超过3 h后,在保留下来的B酸中,酸性增强的B酸位(δC 228)的相对含量最高.因此,我们可以推测:在水热老化过程中,最易失去的B酸是位于δC 219的常规B酸位,最稳定的B酸是酸性增强的B酸位(δC 228).
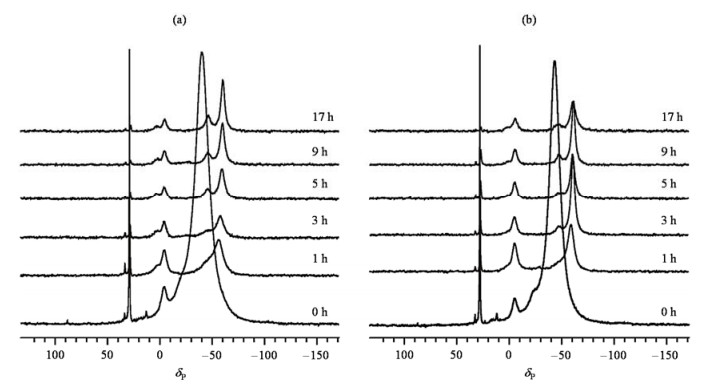
2.2.2 TMP探测的超稳Y分子筛中B酸和L酸的酸量变化规律探针分子TMP可以用于定量的分析不同酸种类的酸量.图 5(a)和图 5(b)分别给出了不同老化时间的USY-6和USY-16分子筛吸附的TMP的31P DP/MAS NMR谱图.其中位于δP -4.5和δP 3的信号分别归属为吸附在常规B酸位和酸性增强的B酸位上的TMP,位于δP -32 ~ -58处的信号和δP -60左右处的谱峰则分别归属为吸附在L酸和物理吸附的TMP[15-18].另外,在δP 29处的信号可归属为三甲基膦氧(TMPO)的信号,这是由TMP被氧化后所产生的.从图 5可以清楚地看到,老化前后,USY-6和USY-16分子筛的L酸酸量减少很明显.由于谱峰重叠,我们不能直观的判断出老化前后B酸酸量的变化趋势,但可观测出老化过程中强B酸位(δP 3)的量的保留度高于常规B酸位(δP -4.5),这与前面丙酮探针分子给出的结论一致.
|
图 5 吸附在不同老化时间(a) USY-6和(b) USY-16分子筛上的TMP的31P DP/MAS NMR谱 Fig. 5 31P DP/MAS NMR spectra of TMP adsorbed on USY-6 (a) and USY-16 (b) zeolites prepared at different aging time |
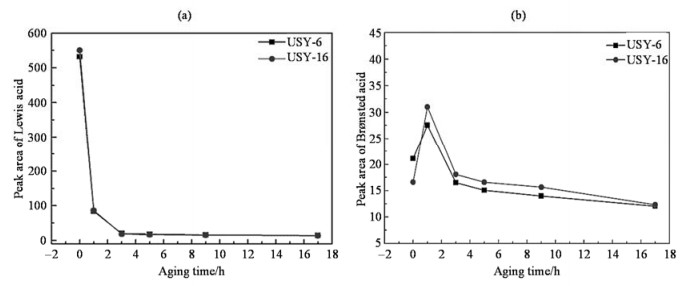
为了对B酸和L酸酸量进行定量分析,我们对TMP的31P DP/MAS NMR谱(图 5)进行了分峰拟合,并进行了质量归一化处理,结果如表 2所示.从表 2可见,在水热老化过程中,USY-6和USY-16样品的L酸和B酸酸量都随着老化时间的增加而减少.为了更清晰的呈现出L酸和B酸酸量的变化规律,由表 2分别作出了两个超稳Y分子筛的L酸和B酸的峰面积随老化时间的变化曲线(图 6).从图 6(a)可见,在老化过程的第1 h,两个样品L酸酸量的下降速率最大,USY-6和USY-16分子筛L酸酸量的保留量非常接近;老化1 h之后,L酸酸量逐渐减少;当老化超过3 h后,随着老化时间的增加,USY-6和USY-16的L酸酸量幅度降低非常小.
| 表 2 TMP 31P DP/MAS NMR谱测得的两种分子筛在不同老化时间下的B酸和L酸酸量 Table 2 Integrated peak areas of Lewis acid and Brønsted acid of the two USY zeolites prepared at different aging time determined by TMP 31P DP/MAS NMR |
|
图 6 TMP 31P DP/MAS NMR谱测得的两种USY型分子筛的(a) L酸和(b) B酸酸量随老化时间的变化曲线 Fig. 6 Integrated peak area change of Lewis acid (a) and Br ønsted acid (b) of the two USY zeolites determined by TMP 31P DP/MAS NMR with aging time |
根据上述L酸酸量的变化规律可知,水热老化初期,两个样品的L酸酸量变化趋势与非骨架铝物种的总含量的变化趋势相反,这表明有部分非骨架铝物种不再提供L酸位.从2.1节已知,当老化小于3 h时,只有非骨架五配位铝物种在急剧增加,而非骨架六配位铝则在减少.因此我们推测:经过水热老化处理后,有一种非骨架铝物种不再提供酸位,这种铝物种可能是非骨架五配位铝.水热老化后期,USY-6和USY-16的L酸酸量与不同铝物种含量变化趋势的一致性可进一步证明上述推测.
图 6(b)给出了B酸峰面积随老化时间的变化曲线.从图 6(b)可见,在老化过程的第1 h,通过TMP探测到的USY-6和USY-16两个样品的B酸酸量不降反增,其中骨架硅/铝原子比较高的USY-16增加幅度较大;老化1 h之后,B酸酸量都逐渐减小;老化时间大于3 h后,两个样品的B酸酸量的降低幅度都很小.需要强调的是,在整个老化过程中,尽管两个样品的B酸酸量变化趋势相同,但是老化前后的B酸酸量均有一定的差别.对于新鲜剂,USY-6的B酸酸量略高于USY-16;而经老化处理后,USY-6样品的B酸保留量略小于USY-16.这表明新鲜剂整体硅/铝原子比相同的条件下,水热老化前后B酸酸量的变化幅度与分子筛新鲜剂的晶胞大小呈正比,这与前面27Al NMR实验结果给出的结论一致.
上述B酸酸量的变化规律表明,两个样品经过1 h老化处理后的B酸酸量都高于各自新鲜剂.根据两种分子筛水热老化前后骨架铝含量的变化可知,理论上两种新鲜剂的B酸位酸量均应高于老化1 h后,且USY-6分子筛新鲜剂的B酸酸量高于USY-16分子筛.这说明通过TMP探测新鲜剂的B酸时所探测到的B酸偏少.我们认为其原因是:(1)TMP尺寸较大,不能进入方钠石笼中,因此不能探测到方钠石笼中的B酸位;(2)非骨架铝很多,而非骨架铝及硅碎片会造成部分孔道堵塞,从而导致TMP能探测到的B酸位进一步减少.而老化1 h后,已脱出的非骨架五配位铝迁移到表面聚合成多聚铝,原来孔道内未被探测到的B酸可以被TMP接近到,所以出现了老化1 h后的B酸酸量高于其新鲜剂的现象.随着老化时间的增加,骨架铝不断脱出,使得B酸酸量开始出现减小;当老化超过3 h后,两个样品的结构趋于稳定,从骨架上脱出的铝很少,因此老化3 h后的B酸酸量降低幅度很小.我们认为理论上,整个老化过程中铝迁移生成多聚铝和骨架脱铝两种过程应同时存在,不同老化阶段出现的现象,取决于哪种过程占主导地位.
根据对TMP探测到的NMR谱图峰面积的拟合结果的分析可知,不同骨架硅/铝原子比的USY-6和USY-16分子筛在水热老化过程中B酸和L酸酸量的变化规律相似.其变化规律为:在老化初期,B酸和L酸都随着老化时间的增加而减小;当老化时间大于3 h后,B酸和L酸酸量随老化时间的变化幅度很小,且保留下来的B酸与L酸酸量非常接近.结合两个分子筛骨架铝物种的变化规律,我们认为新鲜剂整体硅/铝原子比相同的条件下,水热老化前后B酸酸量的变化幅度与分子筛新鲜剂的骨架硅铝比呈反比,与晶胞大小呈正比.
结合分子筛的27Al NMR、探针分子丙酮和探针分子TMP的NMR实验结果,可以给出USY-6和USY-16分子筛铝物种与酸性特征变化之间的关联.在老化初期,随着老化时间的增加,超稳Y分子筛的骨架铝不断从骨架上脱出形成非骨架五配位铝,导致B酸(共有三种不同酸强度的B酸位)随老化时间的增加而减少.而非骨架五配位铝会向表面迁移生成多聚铝,不再提供L酸位,使得L酸酸量也随着老化时间的增加而大幅度减少.其中位于常规B酸位(δC 219)减少幅度最大,而协同效应产生的酸性增强的B酸位(δC 228)减少幅度最小;老化后期,随着老化时间进一步延长,不同铝物种的含量变化非常小,因此B酸和L酸酸量变化幅度很小,且保留下来的B酸酸量与L酸酸量非常接近.
3 结论利用固体NMR实验结合探针分子技术研究了超稳Y分子筛水热老化过程中酸性特征的变化规律及其与铝物种的对应关系.
丙酮探针分子的NMR实验结果表明,超稳Y分子筛中有3种不同酸强度的B酸位,包括常规的B酸位和两种酸性增强的B酸位.在水热老化的过程中,常规B酸位酸量的降低幅度最大,而酸性增强的B酸位(δC 228)酸量降低幅度最小.这表明,在超稳Y分子筛中,B酸和L酸的协同效应一直存在,而且水热稳定性最好的B酸位是协同效应产生的酸性增强的B酸位(δC 228).
27Al结合TMP探针分子的NMR实验结果表明,由于探针分子尺寸及空间位阻的影响,TMP所探测到的新鲜剂的B酸酸量偏少.在老化最初阶段,骨架铝不断地脱出形成非骨架的五配位铝,五配位铝向分子筛表面迁移并形成多聚铝,不仅使得B酸位随老化时间的增加而减少,同时L酸位也在减少.在水热老化过程的前3 h内,不同配位的铝物种及不同酸强度的酸量的变化幅度较大.在整体硅/铝原子比相等的条件下,B酸酸量的变化幅度与分子筛新鲜剂的晶胞大小呈正比;随着水热老化时间的继续增加,不同配位的铝物种含量趋于稳定,因此使得B酸和L酸酸量也基本趋于稳定.
| [1] | ARRIBAS J, CORMA A, FORNES V, et al. Influence of framework aluminum gradients on the catalytic activity of Y zeolites:Cracking of gas-oil on Y zeolites dealuminated by different procedures[J]. J Catal, 1987, 108(1): 135-142. DOI: 10.1016/0021-9517(87)90160-6. |
| [2] | CORMA A, FORNES V, MARTINEZ A, et al. Influence of the method of dealumination of Y zeolites on its behaviour for cracking N-heptane and vacuum gas oil[J]. Stud Surf Sci Catal, 1988, 37(6): 495-503. |
| [3] | WILLIAMS B A, BABITZ S M, MILLER J T, et al. The roles of acid strength and pore diffusion in the enhanced cracking activity of steamed Y zeolites[J]. Appl Catal A:Gen, 1999, 177(2): 161-175. DOI: 10.1016/S0926-860X(98)00264-6. |
| [4] | CORMA A, FORNES V, MARTINEZ A, et al. Parameters in addition to the unit cell that determine the cracking activity and selectivity of dealuminated HY zeolites[J]. ACS Sym Ser, 1988, 368(368): 542-554. |
| [5] | XU B, BORDIGA S, PRINS R, et al. Effect of framework Si/Al ratio and extra-framework aluminum on the catalytic activity of Y zeolite[J]. Appl Catal A:Gen, 2007, 333(2): 245-253. DOI: 10.1016/j.apcata.2007.09.018. |
| [6] | CORMA A, GRANDE M, FORNéS V, et al. Interaction of zeolite alumina with matrix silica in catalytic cracking catalysts[J]. Appl Catal, 1990, 66(1): 45-57. |
| [7] | WANG Q L, GIANNETTOG, GUISNET M. Dealumination of zeolites Ⅲ. Effect of extra-framework aluminum species on the activity, selectivity, and stability of Y zeolites in n-heptane cracking[J]. J Catal, 1991, 130(2): 471-482. DOI: 10.1016/0021-9517(91)90129-R. |
| [8] | LOEFFLER E, LOHSE U, PEUKER C H, et al. Study of different states of nonframework aluminum in hydrothermally dealuminated HZSM-5 zeolites using diffuse reflectance IR spectroscopy[J]. Zeolites, 1990, 10(4): 266-271. DOI: 10.1016/0144-2449(94)90138-4. |
| [9] | MEYERSBL, FLEISCH TH, RAY G J, et al. Multitechnique characterization of dealuminatedmordenites[J]. J Catal, 1988, 110(1): 82-95. DOI: 10.1016/0021-9517(88)90299-0. |
| [10] |
GAO X Z, WANG X M, XU G T, et al. Insight into structureand acidity evolution mechanism of Y zeolites during hydrothermal aging[C]. Chinese zeolite conference, 2013.
高秀枝, 王秀梅, 徐广通, 等. Y型分子筛水热老化过程中结构和酸性变化规律的研究[C].全国分子筛学术大会会议. 2013. |
| [11] |
GAO X Z, ZHANG Y, XU G T, et al. Insight into structure evolution mechanism of ultra-stable Y zeolites during hydrothermal aging[J].
Acta Petrolei Sinica, 2016, 32(2): 357-363.
高秀枝, 张翊, 徐广通, 等. 超稳Y分子筛水热老化过程中的结构变化规律[J]. 石油学报, 2016, 32(2): 357-363. |
| [12] |
GAO X Z, ZHANG Y, WANG X M, et al. State of acidic center and acidity of dealuminated HY zeolites investigated by solid-state NMR spectroscopy[J].
Acta Petrolei Sinica, 2012, 28(2): 180-187.
高秀枝, 张翊, 王秀梅, 等. 脱铝HY分子筛酸中心结构与酸性的固体NMR研究[J]. 石油学报, 2012, 28(2): 180-187. |
| [13] | YU Z W, AMOUREUX J P, DENG F, et al. Insights into the dealumination of zeolite HY revealed by sensitivity-enhanced 27Al DQ-MAS NMR spectroscopy at high field[J]. Angew Chem Int Ed, 2010, 49(46): 8657-8661. DOI: 10.1002/anie.201004007. |
| [14] | LI S H, YE C H, DENG F, et al. Brønsted/Lewis acid synergy in dealuminated HY zeolite:A combined solid-state NMR and theoretical calculation study[J]. J Am Chem Soc, 2007, 129(36): 11161-11171. DOI: 10.1021/ja072767y. |
| [15] | HAW J F, NICHOLAS J B, XU T, et al. Physical organic chemistry of solid acids:Lessons from in situ NMR and theoretical chemistry[J]. Accounts Chem Res, 1996, 29(6): 259-267. DOI: 10.1021/ar950105k. |
| [16] | LUNSFORD J H, ROTHWEL W P. Acid sites in zeolite Y:A solid-state NMR and infrared study using trimethylphosphine as a probe molecule[J]. J Am Chem Soc, 1985, 107: 1540. DOI: 10.1021/ja00292a015. |
| [17] | ZHANG Y, OLDFIELD E. 31P NMR chemical shifts in hypervalent oxyphosphoranes and polymeric orthophosphates[J]. J Phys Chem B, 2006, 110: 579. DOI: 10.1021/jp054022p. |
| [18] | ZHENG A, LIU S B, DENG F. 31P NMR chemical shifts of phosphorus probes as reliable and practical acidity scales for solid and liquid catalysts[J]. Chem Rev, 2017, 117(19): 12475-12531. DOI: 10.1021/acs.chemrev.7b00289. |
 2020, Vol. 37
2020, Vol. 37 
