2. 中国科学院大学 材料与光电研究中心, 北京 100049
2. Center of Materials Science and Optoelectronics Engineering, University of Chinese Academy of Sciences, Beijing 100049, China
聚酰胺-胺树状大分子(PAMAM)聚合物含有大量的表面活性官能团和非极性的内部疏水结构,几何对称性很高,而且分子质量及纳米尺寸相对可控[1-4].作为一类新型的主体分子,PAMAM与多种客体小分子之间的相互作用已被广泛研究,例如PAMAM可作为缓释药物的载体、高效催化剂、信息存储材料、纳米材料[5-9].而且,树状大分子也是生物医学领域研究最广泛的合成类高分子之一,特别是用作抗癌药物的载体[10-12].5-氟尿嘧啶(5-FU)是一种嘧啶类似物,具有较低的水溶性和疏水性,其在中性介质中最稳定的互变异构体是二酮式结构[13, 14].5-FU是最具有抗代谢物和免疫抑制性活性的抗癌药物之一,可抑制DNA在恶性细胞中的快速合成,现已广泛应用于治疗消化道、胸部及头颈部等部位的恶性肿瘤[15-17].然而,5-FU因具有半衰期短、对全身正常细胞毒性较大且分布很广泛等特点,常被限制使用[15, 18].如果利用常被用作临床药物载体[19]的树状大分子所具备的低毒性和纳米尺寸的特点,使其与5-FU相互作用,从而延长5-FU的药效时间、减少5-FU对人体造成的危害,是十分有意义的.
目前,G3代、G4代和G5代的PAMAM对5-FU的包合量已通过紫外分光光度法、平衡透析法、量热滴定等方法进行了测定研究,并分析了不同树状大分子末端基团的性质以及空间位阻结构、活性位点等对5-FU的结合量的影响[7, 20-23].然而,关于PAMAM与5-FU分子二者之间的相互作用机制、相互作用位点等信息尚不清楚.
核磁共振(NMR)技术作为一种多维、多核、对样品无破坏的分析方法[5, 24],在识别主客体相互作用的研究方面可以提供大量有效的信息,如分子的聚集态、离子对和化学环境变化等[25, 26].本文利用一维1H NMR、13C NMR、19F NMR化学位移滴定及二维1H-13C HSQC谱图系统地揭示了PAMAM和5-FU之间的相互作用机制及作用位点.并通过测定5-FU分子的1H核和19F核的弛豫时间及二者相互作用后混合溶液的1H-1H NOESY谱图进一步证明了5-FU与PAMAM之间的相互作用机制.
1 实验部分 1.1 仪器与试剂实验所用仪器为配备5 mm PABBO BB/19F-1H/D变温探头的带有梯度场的Bruker AV-Ⅲ 400 MHz液体NMR谱仪.
5-FU(C4H3FN2O2,质量分数 > 99%)购于上海阿拉丁生化科技股份有限公司,G3代PAMAM树状大分子(C302H608N122O60)购于山东威海晨源分子新材料有限公司.重水(D2O,99.8 atom% D)购于百灵威科技有限公司.
1.2 样品准备将浓度为7.24×10﹣4 mol/L的G3代PAMAM树状大分子重水溶液作为储备溶液使用.分别向400 μL的上述储备溶液中加入不同重量的5-FU粉末,配制成一系列不同摩尔比(n5-FU:nPAMAM=0:1, 8:1, 16:1, 24:1, 32:1, 48:1, 64:1, 1:0)的待测样品,25 ℃条件下磁力搅拌反应48 h.
1.3 NMR实验 1.3.1 一维1H、19F和13C NMR化学位移滴定实验1H、19F和13C核的工作频率分别为400.13、376.50和100.62 MHz,谱宽分别为8 012.82、89 285.71和24 038.46 Hz.实验温度为25 ℃.均采用标准脉冲程序.
1.3.2 二维1H-13C HSQC和1H-1H NOESY实验二维梯度场1H-13C HSQC及1H-1H NOESY实验温度为25 ℃.HSQC的F2(1H)和F1(13C)维谱宽分别为4 795.40和16 668.48 Hz,采样数据点阵t2×t1=2 048×256,累加次数为8.NOESY的F2(1H)和F1(1H)维谱宽分别为2 673.80 Hz和3 654.97 Hz,采样数据点阵t2×t1=2 048×256,累加次数为8,混合时间为300 ms.均采用标准脉冲程序.
1.3.3 1H核和19F核弛豫时间的测定自旋-晶格弛豫时间(T1)的测定脉冲序列为t1ir.实验温度为25 ℃,5-FU的19F核的T1测定实验的谱宽为11 312.22 Hz,弛豫延迟值在n5-FU:nPAMAM=1:0和1:6两个摩尔比例下分别为30 s和20 s,中心频率为﹣64 017.52 Hz,采样数据点阵t2×t1=16 384×16.1H核的T1测定实验的谱宽为4 000.00 Hz,弛豫延迟值为35 s,中心频率为2 470.97 Hz,采样数据点阵t2×t1= 32 768×16.T1值的拟合用Topspin 3.1软件.
2 结果与讨论 2.1 1H NMR化学位移滴定本文利用1H NMR技术研究主客体体系PAMAM与5-FU分子之间的相互作用.PAMAM和5-FU的结构及原子标记如图 1所示.

|
图 1 分子的化学结构和原子标记. (a) 5-FU分子;(b) G3 PAMAM分子的内部重复单元;(c) G3 PAMAM分子最外层结构;(d) G3 PAMAM分子 Fig. 1 The chemical structure and atom labeling of (a) 5-FU molecule, (b) G3 PAMAM interior repetitive unit, (c) G3 PAMAM outermost layer, and (d) G3 PAMAM molecule |
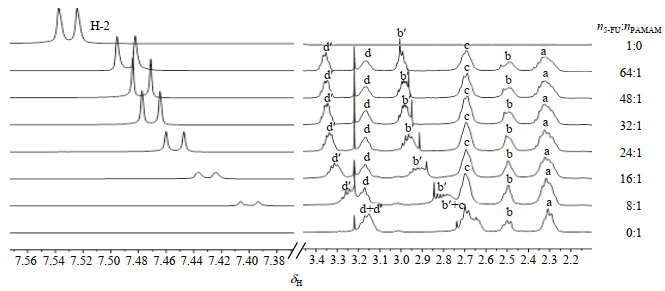
图 1显示,PAMAM一共应包含六种1H NMR信号,分别对应于其内部结构的四种CH2质子(a、b、c、d)和最外层的两种CH2质子(b′、d′).根据之前的研究报道[27],对PAMAM的内部质子归属如下:H-a,δH 2.30;H-b,δH 2.50;H-c,δH 2.69;H-d,δH 3.16.由于PAMAM最外层的H-b′、H-d′分别与H-c、H-d的信号在1H NMR谱图中重叠,因此当溶液中只存在PAMAM时,其1H NMR谱图中只观察到四个较宽的信号.但当加入5-FU分子后,通过COSY谱图(论文网络版图S1)对PAMAM信号进一步进行归属发现:H-b′与H-c、H-d′与H-d的信号可明显分开,其归属结果在滴定谱图中标出.
从一系列5-FU与PAMAM摩尔比例不同的重水混合溶液的1H NMR谱图(图 2)可以看出,随着5-FU比例的不断增加,PAMAM化学位移变化较大的是最外层的亚甲基质子H-b′和H-d′,并且紧邻着末端胺基的质子H-b′的化学位移变化最大(∆δH=0.31),靠近酰胺的质子H-d′的化学位移变化也相对较大(∆δH=0.19).以上信号变化趋势说明5-FU分子在PAMAM表面与其发生相互作用,由于去屏蔽效应,使位于最外层的质子向低场位移.同时,从图中也可以观察到加入PAMAM后,5-FU的质子信号与其在重水溶液中的信号(δH 7.53)相比,不断向高场移动,也说明PAMAM与5-FU之间发生相互作用.根据以前的研究报道[7, 21, 22],5-FU分子不仅在PAMAM表面与其发生相互作用,也可以通过疏水作用或氢键作用进入PAMAM分子非极性的内部空腔.然而,由于与5-FU相互作用后,PAMAM的1H NMR谱峰变宽,难以确定G3 PAMAM内部质子的位移是否发生移动.因此,为判断PAMAM是否对5-FU分子进行包合作用,5-FU分子是否进入到PAMAM的分子内部空腔,需要做进一步的研究与分析判断.
|
图 2 摩尔比例(n5-FU:nPAMAM)不同的5-FU/PAMAM重水溶液的1H NMR谱图 Fig. 2 The 1H NMR spectra of 5-FU/PAMAM D2O solutions with different molar ratios (n5-FU:nPAMAM) |
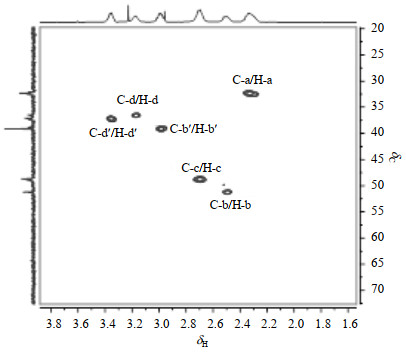
由于PAMAM的13C NMR谱图的信噪低,难以直接对其信号进行指认.因此采集了n5-FU:nPAMAM=32:1时的重水溶液的1H-13C HSQC谱图(图 3),通过对已归属的质子相关信号的指认,对混合物的13C NMR谱进行了归属.
|
图 3 n5-FU:nPAMAM=32:1时的5-FU/PAMAM重水溶液的1H-13C HSQC谱图 Fig. 3 The 1H-13C HSQC spectrum of the 5-FU/PAMAM D2O solution with n5-FU:nPAMAM=32:1 |
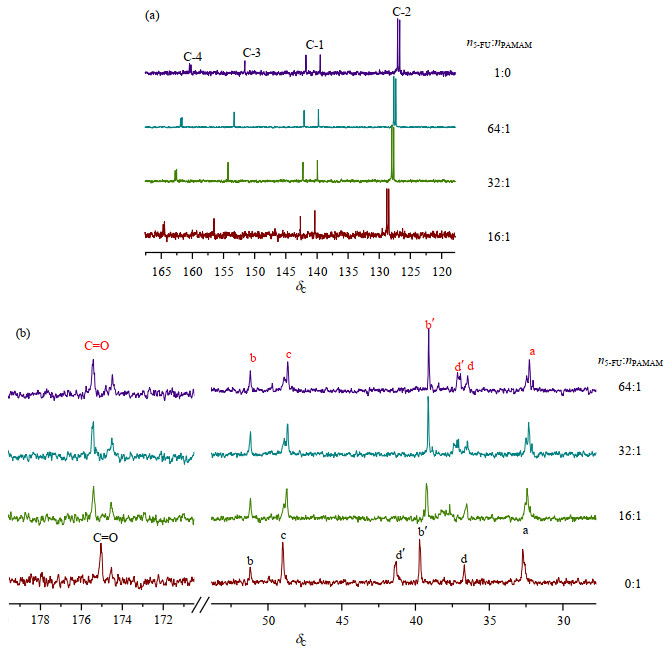
根据1H NMR谱,选取几种典型比例(n5-FU:nPAMAM=0:1、16:1、32:1、64:1、1:0)的5-FU/PAMAM重水溶液进行13C NMR化学位移滴定实验.与纯5-FU重水溶液的13C NMR谱图[图 4(a)]相比,当n5-FU:nPAMAM=16:1时,5-FU中位移变化最大的是C-3(∆δC=4.9)和C-4(∆δC=4.3),C-1(∆δC=0.8)和C-2(∆δC=1.8)位移相对变化较小,可以推测可能为5-FU分子酰胺键的碳氧双键与树状大分子相互作用.另外,当PAMAM与5-FU相互作用时,观察树状大分子的13C NMR谱[图 4(b)],随着5-FU比例增大至n5-FU:nPAMAM=64:1时,PAMAM位移变化最大的是C-d′(∆δC=4.3)和C-b′(∆δC=0.6),这与1H NMR化学位移滴定实验的结果一致,说明5-FU在PAMAM的表面与其发生相互作用.但值得注意的是,靠近酰胺键的C-d′比最外层的C-b′化学位向高场偏移更大,说明靠近PAMAM最外层酰胺键的氮氢键可能与5-FU酰胺键的碳氧双键形成氢键.另外PAMAM分子的C-a也向高场移动(∆δC=0.5);且加入5-FU分子后,PAMAM上羰基的位移也发生变化,这些也可以推测出作用位点为PAMAM上酰胺键的碳氧双键与5-FU分子作用.这些结果都说明5-FU分子可能通过氢键作用或疏水作用进入PAMAM的空腔内部,与其内部结构的酰胺键发生相互作用.
|
图 4 摩尔比例(n5-FU:nPAMAM)不同的5-FU/PAMAM重水溶液中,(a) 5-FU和(b) PAMAM分子的13C NMR谱图 Fig. 4 The 13C NMR spectra of (a) 5-FU and (b) PAMAM molecules in the 5-FU/PAMAM D2O solutions with different molar ratios (n5-FU:nPAMAM) |
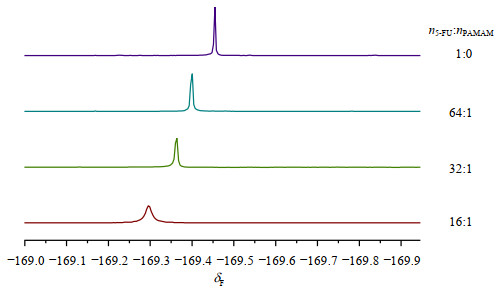
与纯5-FU重水溶液中的19F NMR信号(δF ﹣169.45)对比,当加入PAMAM(n5-FU:nPAMAM=16:1)后,5-FU分子的19F NMR信号(δF ﹣169.30)向低场移动(∆δF=0.15)(图 5),与13C NMR谱图变化趋势一致.另外,从图中可以看出,加入PAMAM后,5-FU分子的19F NMR信号谱峰变宽.通常情况下,若小分子与大分子发生相互作用,则小分子的运动受限,导致谱峰变宽及其T1值明显降低[5].与纯5-FU重水溶液相比,加入PAMAM的5-FU的19F核的T1值下降25 %,1H核下降26 %(表 1),这也充分说明了二者之间发生了相互作用.
|
图 5 摩尔比例(n5-FU:nPAMAM)不同的5-FU/PAMAM重水溶液的19F NMR谱图 Fig. 5 The 19F NMR spectra of 5-FU/PAMAM D2O solutions with different molar ratios (n5-FU:nPAMAM) |
| 表 1 纯5-FU重水溶液及n5-FU:nPAMAM=16:1时的重水溶液中5-FU分子的19F核和1H核的T1(单位为s) Table 1 The spin-lattice relaxation time (T1/s) values of 19F and 1H nuclei in 5-FU molecule from pure 5-FU and 5-FU/PAMAM (n5-FU:nPAMAM=16:1) D2O solutions |
2D NOESY技术已经被证明是研究主客体间相互作用有效的分析工具[28-30].为证明5-FU分子进入到PAMAM的空腔内部,可以通过NOESY谱图观察二者的质子信号是否有相关性.为提高检测的灵敏度,选择n5-FU:nPAMAM=48:1的混合溶液用来进行测试,结果如图 6所示.通过纯PAMAM溶液的NOESY谱图(论文网络版图S2)以及二者相互作用后混合溶液的COSY谱图(论文网络版图S3)对比,从谱图中信号可以观察到:除PAMAM分子自相关外,还可以很清晰地看到5-FU分子的H-2(δH 7.56)与PAMAM的H-a(δH 2.43)存在交叉信号(H-2/H-a).进一步验证了5-FU分子进入到PAMAM空腔内部,与其内部结构的酰胺基团发生相互作用.

|
图 6 n5-FU:nPAMAM=48:1的5-FU/PAMAM重水溶液的1H-1H NOESY谱图 Fig. 6 The 1H-1H NOESY spectrum of the 5-FU/PAMAM D2O solution with n5-FU:nPAMAM=48:1 |
本文利用一维1H NMR、13C NMR、19F NMR化学位移滴定实验,二维1H-13C HSQC,T1测定及1H-1H NOESY等方法揭示了PAMAM和5-FU之间的相互作用机制.结果表明5-FU分子不仅在PAMAM分子表面与其发生相互作用,还进入PAMAM的疏水空腔内部,并与其内部结构的酰胺键发生相互作用.该研究为利用NMR技术研究树状大分子和药物小分子的相互作用提供了系统的分析方法.
| [1] | MEKURIA S L, DEBELE T A, TSAI H C. PAMAM dendrimer based targeted nano-carrier for bio-imaging and therapeutic agents[J]. RSC Advances, 2016, 6(68): 63761-63772. DOI: 10.1039/C6RA12895E. |
| [2] | WU Q L, CHENG Y Y, HU J J, et al. Insights into the Interactions between dendrimers and bioactive surfactants: 3. size-dependent and hydrophobic property-dependent encapsulation of bile salts[J]. J Phys Chem B, 2009, 113(39): 12934-12943. DOI: 10.1021/jp906661z. |
| [3] | HSU H J, BUGNO J, LEE S R, et al. Dendrimer-based nanocarriers:a versatile platform for drug delivery[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2017, 9(1): 1-21. |
| [4] | KOLEY S, PANDA M R, BHARADWAJ K, et al. Spectroscopic and calorimetric studies of molecular recognitions in a dendrimer-surfactant complex[J]. Langmuir, 2018, 34(3): 817-825. DOI: 10.1021/acs.langmuir.7b01081. |
| [5] | HU J J, XU T W, CHENG Y Y. NMR Insights into dendrimer-based host guest systems[J]. Chem Rev, 2012, 112(7): 3856-3891. DOI: 10.1021/cr200333h. |
| [6] | CHENG Y Y, ZHAO L B, LI T F. Dendrimer-surfactant interactions[J]. Soft Matter, 2014, 10(16): 2714-2727. DOI: 10.1039/c3sm53180e. |
| [7] | BUCZKOWSKI A, SEKOWSKI S, GRALA A, et al. Interaction between PAMAM-NH(2) G4 dendrimer and 5-fluorouracil in aqueous solution[J]. Int J Pharm, 2011, 408(1/2): 266-270. |
| [8] | CHEN C H, WANG Y, HILTY C. Intermolecular interactions determined by NOE build-up in macromolecules from hyperpolarized small molecules[J]. Methods, 2018, 138: 69-75. |
| [9] | ZHAO L B, LI C, ZHANG J H, et al. Interactions between dendrimers and ionic liquids revealed by pulsed field gradient and nuclear overhauser effect NMR studies[J]. J Phys Chem B, 2012, 116(24): 7203-7212. DOI: 10.1021/jp303391c. |
| [10] | MEDINA S H, EL-SAYED M E H. Dendrimers as carriers for delivery of chemotherapeutic agents[J]. Chem Rev, 2009, 109(7): 3141-3157. DOI: 10.1021/cr900174j. |
| [11] | TEKADE R K, KUMAR P V, JAIN N K. Dendrimers in oncology:an expanding horizon[J]. Chem Rev, 2009, 109(1): 49-87. |
| [12] | KESHARWANI P, LYER A K. Recent advances in dendrimer-based nanovectors for tumor-targeted drug and gene delivery[J]. Drug Discov Today, 2015, 20(5): 536-547. DOI: 10.1016/j.drudis.2014.12.012. |
| [13] | SZTERNER P. Solubilities in water of uracil and its halogenated derivatives[J]. J Chem Eng Data, 2008, 53(8): 1738-1744. DOI: 10.1021/je800029c. |
| [14] | MARKOVA N, ENCHEV V, IVANOVA G. Tautomeric equilibria of 5-fluorouracil anionic species in water[J]. J Phys Chem A, 2010, 114(50): 13154-13162. DOI: 10.1021/jp1063879. |
| [15] | LAQUINTANA V, DENORA N, LOPALCO A, et al. Translocator protein ligand-PLGA conjugated nanoparticles for 5-fluorouracil delivery to glioma cancer cells[J]. Mol Pharm, 2014, 11(3): 859-871. |
| [16] | SHOBANA S, SUBRAMANIAM P, DHARMARAJA J, et al. Morphological and pharmacological investigation on some biopotent materials derived from substituted pyrimidine and imidazole enzyme constituents[J]. Spectrochim Acta A, 2014, 126: 242-253. DOI: 10.1016/j.saa.2014.01.089. |
| [17] | JANGIR D K, CHARAK S, MEHROTRA R, et al. FTIR and circular dichroism spectroscopic study of interaction of 5-fluorouracil with DNA[J]. J Photoch Photobio B, 2011, 105(2): 143-148. DOI: 10.1016/j.jphotobiol.2011.08.003. |
| [18] | PARIKH R H, PARIKH J R, DUBEY R R, et al. Poly(D, L-lactide-co-glycolide) microspheres containing 5-fluorouracil:optimization of process parameters[J]. AAPS PharmSciTech, 2003, 4(2): E13. |
| [19] | GUO L J, WANG C H, YANG C P, et al. Morpholino-terminated dendrimer shows enhanced tumor pH-triggered cellular uptake, prolonged circulation time, and low cytotoxicity[J]. Polymer, 2016, 84: 189-197. DOI: 10.1016/j.polymer.2015.12.056. |
| [20] | BUCZKOWSKI A, WALISZEWSKI D, URBANIAK P, et al. Study of the interactions of PAMAM G3-NH2 and G3-OH dendrimers with 5-fluorouracil in aqueous solutions[J]. Int J Pharm, 2016, 505(1/2): 1-13. |
| [21] | BUCZKOWSKI A, OLESINSKI T, ZBICINSKA E, et al. Spectroscopic and calorimetric studies of formation of the supramolecular complexes of PAMAM G5-NH(2) and G5-OH dendrimers with 5-fluorouracil in aqueous solution[J]. Int J Pharm, 2015, 490(1/2): 102-111. |
| [22] | BUCZKOWSKI A, URBANIAK P, PALECZ B. Thermochemical and spectroscopic studies on the supramolecular complex of PAMAM-NH(2) G4 dendrimer and 5-fluorouracil in aqueous solution[J]. Int J Pharm, 2012, 428(1/2): 178-182. |
| [23] | TOKARCZYK K, JACHIMSKA B. Characterization of G4 PAMAM dendrimer complexes with 5-fluorouracil and their interactions with bovine serum albumin[J]. Colloid Surface A, 2019, 561: 357-363. DOI: 10.1016/j.colsurfa.2018.10.080. |
| [24] |
GAO D L, SUN P, WANG Q W, et al. Interactions between albumin and fatty acids studied by NMR spectroscopy[J].
Chinese J Magn Reson, 2018, 35(3): 338-344.
高东莉, 孙鹏, 王倩文, 等. 运用NMR研究白蛋白与脂肪酸的相互作用[J]. 波谱学杂志, 2018, 35(3): 338-344. |
| [25] | HU J J, CHENG Y Y, MA Y R, et al. Host-guest chemistry and physicochemical properties of the dendrimer-mycophenolic acid complex[J]. J Phys Chem B, 2009, 113(1): 64-74. DOI: 10.1021/jp8078919. |
| [26] |
CHEN X Y, YU G J, MAO S Z, et al. An NMR study on how steric effects affect synergistic effects in surfactant mixtures[J].
Chinese J Magn Reson, 2018, 35(1): 75-80.
陈晓瑛, 俞刚金, 毛诗珍, 等. 1H NMR探究空间效应对表面活性剂复配体系中协同作用的影响[J]. 波谱学杂志, 2018, 35(1): 75-80. |
| [27] | CHENG Y Y, LI Y W, WU Q L, et al. New insights into the interactions between dendrimers and surfactants by two dimensional NOE NMR spectroscopy[J]. J Phys Chem B, 2008, 112(40): 12674-12680. DOI: 10.1021/jp804954j. |
| [28] | OOYA T, LEE H. Amino acid-dependent host-guest interaction:polyglycerol dendrimer of generation 3 encapsulates amino acids bearing two amino groups[J]. Chemnanomat, 2015, 1(4): 264-269. DOI: 10.1002/cnma.201500018. |
| [29] | MARKOWICZ M, SZYMANSKI P, CISZEWSKI M, et al. Evaluation of poly(amidoamine) dendrimers as potential carriers of iminodiacetic derivatives using solubility studies and 2D-NOESY NMR spectroscopy[J]. J Biol Phys, 2012, 38(4): 637-656. DOI: 10.1007/s10867-012-9277-5. |
| [30] |
ZHAO B, LI Y L, LI M, et al. An NMR Study of Capsaicin/β-cyclodextrin Complex[J].
Chinese J Magn Reson, 2013, 30(4): 576-584.
赵兵, 李艺蕾, 李明, 等. 辣椒碱与β-环糊精包合物的核磁共振研究[J]. 波谱学杂志, 2013, 30(4): 576-584. DOI: 10.3969/j.issn.1000-4556.2013.04.011. |
 2019, Vol. 36
2019, Vol. 36 
