2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
核磁共振(NMR)技术因具有无损伤、无辐射、空间分辨率高等诸多优点在疾病诊断上有着广泛的应用[1].但是传统的质子磁共振信号存在灵敏度低、背景干扰强等缺点[2].近些年来兴起的自旋交换光泵技术可将129Xe的极化度相对于热极化状态提高10 000倍,极大地提高了磁共振信号的灵敏度[3-7].随着这项技术的发展,新型超极化129Xe分子探针也应运而生,实现了低浓度、高精度的无损伤磁共振探测.据文献报道,超极化129Xe分子探针已经实现了对蛋白[8-10]、酶[11, 12]、核酸[13]、受体[14-18]、硫醇[19]等多种生命物质,pH值[20, 21]和金属离子[22-25]的探测,具有非常广阔的发展前景.但是单原子Xe本身不具备特异性,由于这一缺点的限制,使得超极化129Xe分子探针的构建必须依托特定的“分子笼”.当前对主体“分子笼”的研究以穴番为主[26],然而经过数十年的不断探索,基于穴番的超极化129Xe分子探针技术已经趋于成熟,很难再有大的突破.因此新型“分子笼”的构建是超极化129Xe磁共振领域面临的巨大挑战.
葫芦[6]脲(CB[6])是葫芦[n]脲(CB[n])家族中的一员.葫芦[n]脲一般都是多个甘脲通过亚甲基桥联形成的大环笼状酰胺化合物,它们的结构一般为中空南瓜状(图 1),有一个疏水性的空腔和两个羰基氧原子构成的半亲水的端口.2015年,Leif研究组研究表明CB[6]具有疏水、刚性开放,且与Xe尺寸(范德华直径约为0.43 nm)相似的空腔的特点,可促进其空腔内外129Xe有较快的交换速率,也可用作超极化129Xe分子探针的主体分子[27].但是,相较于穴番“分子笼”,基于CB[6]的超极化129Xe分子探针往往有信号过宽、较弱、易被噪声掩盖等缺点,同时,CB[6]自身水溶性和修饰难度也制约着此类分子探针的发展.近年来,科学家们找到了可以直接官能化CB[n]的方法,经由简单的几步反应就能合成各种特定的CB[n]衍生物[28],并探索它们的应用[29],包括合成基于CB[6]的囊泡[30]和聚合物纳米胶囊[31].这种新型的基于CB[6]的纳米颗粒有良好的水溶性和独特的疏水空腔,可以用来装载特定的小分子化合物.
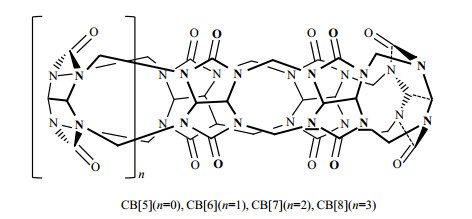
|
图 1 葫芦[n]脲的结构式 Fig. 1 Structural formula of cucurbit[n]urils |
为了改善以CB[6]为主体的超极化129Xe分子探针的信号,发展更具优势的CB[6]类“分子笼”,我们在前人研究的基础上,制备了一系列以CB[6]为基础的纳米颗粒(一个纳米颗粒包含多个CB[6]“分子笼”,能够实现信号增强),并进行超极化129Xe化学交换饱和转移(Hyper-CEST)测试,以期筛选出水溶性良好、有较强CB[6] CEST信号的纳米颗粒.
1 实验部分 1.1 仪器与试剂仪器:Hyper-CEST测试均在Bruker AVANCE 400中进行.纳米颗粒样品的水合粒径测试均使用仪器Malvern Zetasizer 90.纳米颗粒样品的透射电镜(TEM)图均由HITACHI H-7000 FA拍摄.
试剂:氢化钠(纯度60%,分散在在矿物油中)、乙酸、甲酸、过氧化氢溶液、丙酮、乙醚、浓盐酸、甲醇、2-氨基乙硫醇盐酸盐、尿素、浓盐酸、氢氧化钠、氯化钾、多聚甲醛、1, 2-乙二硫醇、碘甲烷、乙烯基乙醚均从国药集团化学试剂有限公司购买;烯丙基溴(分析纯)购自萨恩化学技术(上海)有限公司;甲氧基聚乙二醇巯基(HS-PEG,化学纯,分子量分别为2 000和5 000)购自上海芃圣生物科技有限公司.如无其他说明,所有试剂均直接使用,未经过进一步的纯化.
1.2 纳米颗粒的制备 1.2.1 骨架型CB[6]纳米颗粒的合成及表征骨架型CB[6]纳米颗粒的合成采用以下步骤(图 2)进行:1)参照文献[29],合成化合物12-烯丙氧基CB[6](a).2)参照文献[32],纳米颗粒1-1由化合物a和1, 2-乙二硫醇以1:48的比例在甲醇溶液中经紫外照射20 h后直接聚合而成.后续处理中加入乙烯基乙醚,洗去纳米颗粒表面多余裸露的巯基链,然后透析,滤去多余的硫醇.3)参照文献[33],由纳米颗粒1-1经过量碘甲烷甲基化后制得纳米颗粒1-2,纳米颗粒1-1中硫元素被甲基化后形成=S+-CH3而带正电,使得纳米颗粒1-2也带大量正电荷,增加了水溶性.4)由纳米颗粒1-1与少量己二胺盐混合搅拌制得纳米颗粒1-3,因为CB[6]与多胺小分子间存在很强的亲和力(K>106 mol-1),所以利用己二胺盐占据部分CB[6]空腔以提高整个纳米颗粒的水溶性.
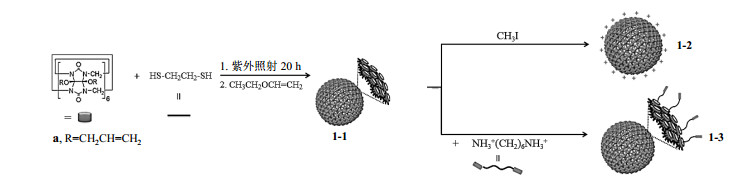
|
图 2 骨架型CB[6]纳米颗粒1-1、1-2和1-3的合成 Fig. 2 Synthesis of skeletal CB[6] nanoparticles 1-1, 1-2 and 1-3 |
通过动态光散射(DLS)测试发现骨架型CB[6]纳米颗粒的粒径主要分布于220 nm左右[图 3(a)].由纳米颗粒1-1的TEM图[图 3(b)]可以看出,此类纳米颗粒具备明显的壳层结构,粒径大小与DLS测试结果相符.
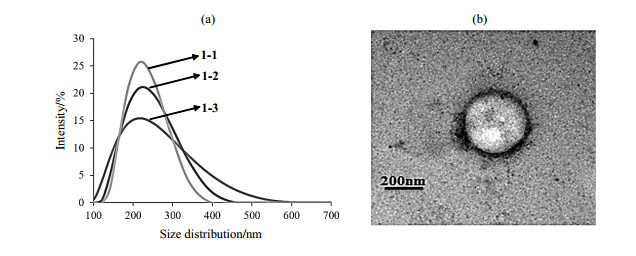
|
图 3 (a) DLS测试骨架型CB[6]纳米颗粒的水合粒径分布;(b)纳米颗粒1-1的TEM图 Fig. 3 (a) Size distribution of skeletal CB[6] nanoparticles measured by DLS; (b) TEM image of nanoparticle 1-1 |
自组装型CB[6]纳米颗粒的合成采用以下步骤(图 4)进行:1)参照文献[34],12-烯丙氧基CB[6](a)和2-氨基乙硫醇盐酸盐(b1)以1:6的比例在甲醇溶液中经紫外照射3天,形成两亲性单体(CB[6]自身空腔疏水,修饰的巯基化合物亲水),将单体加入蒸馏水中超声30 min,即可得到纳米颗粒2-1.纳米颗粒2-2制备方法同上,用2-羟基乙硫醇(b2)代替b1.纳米颗粒2-3制备方法同上,用甲氧基聚乙二醇巯基(b3)(分子量为2 000)代替b1.2)参照文献[35],制备单羟基CB[6],修饰上双键后和甲氧基聚乙二醇巯基(b4)(分子量为5 000),以1:1.5的比例在甲醇溶液中经紫外照射3天,形成两亲性单体,将单体加入蒸馏水中超声30 min,即可得到纳米颗粒2-4.
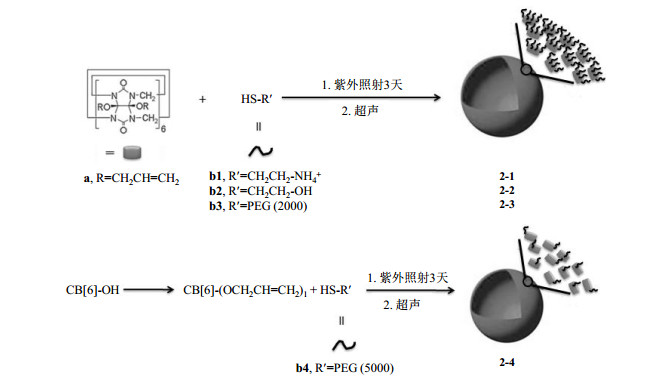
|
图 4 自组装型CB[6]纳米颗粒2-1、2-2、2-3和2-4的合成 Fig. 4 Synthesis of self-assembling CB[6] nanoparticles 2-1, 2-2, 2-3 and 2-4 |
DLS测试结果[图 5(a)]显示自组装型CB[6]纳米颗粒2-1的粒径主要分布在300 nm,2-2、2-3的粒径主要分布在350 nm,2-4主要集中在450 nm(受PEG链长影响).由纳米颗粒2-4的TEM图[图 5(b)]可以看出,自组装型纳米颗粒非刚性结构,形状并不十分规则,但所得粒径大小也与DLS测试结果相符.

|
图 5 (a) DLS测试自组装型CB[6]纳米颗粒的水合粒径分布;(b)纳米颗粒2-4的TEM图 Fig. 5 (a) Size distribution of self-assembling CB[6] nanoparticles measured by DLS; (b) TEM image of nanoparticle 2-4 |
在配制溶液时,我们发现不同类型的纳米颗粒溶解度差异比较大,在遵循制得溶液无固体析出和得到最优的测试结果两个前提下,不同种类的纳米颗粒在实际测量中使用不同的浓度,具体详见表 1.对于溶液浓度的确定,骨架型纳米颗粒的浓度以其本身质量计算,自组装型纳米颗粒的浓度以其单体质量估算.
| 表 1 纳米颗粒Hyper-CEST 129Xe测试时所用的溶液浓度 Table 1 Solution concentrations used in Hyper-CEST 129Xe testing for nanoparticles |
取配好的纳米颗粒水溶液2 mL,向其中加入少许消泡剂,混匀后转移至10 mm NMR样品管.测试时,通入超极化的Xe气体(气体成分:2%天然丰度的Xe,10% N2,88% He)20 s后,停止通气,然后进行选择性信号的饱和,再利用90˚脉冲激发信号进行采样,测试温度恒定在298 K.实验时所选择谱宽为220 ppm,饱和照射范围为30~250 ppm,饱和照射脉冲强度为13 μT,在每个设置的饱和点位置(根据经验和文献的报道饱和位点并不完全均匀分布),分别饱和照射10 s,然后采集获得一系列129Xe谱,对溶解态Xe信号进行积分,其积分值为Mz;关闭饱和照射脉冲后采集129Xe谱,对溶解态Xe信号进行积分,其积分值为M0;然后以饱和照射点的频率为横坐标,以Mz/M0(需做归一化处理)为纵坐标作图,即可得到CEST谱图.
2 结果与讨论 2.1 骨架型CB[6]纳米颗粒的Hyper-CEST 129Xe测试据文献[27]报道,CB[6]内的Hyper-CEST 129Xe的化学转移通常出现在100 ppm左右,经简单修饰所形成纳米颗粒中的CB[6]的信号也应分布在100 ppm附近.三种骨架型CB[6]纳米颗粒的结果如图 6所示.

|
图 6 骨架型CB[6]纳米颗粒的Hyper-CEST 129Xe磁共振谱图 Fig. 6 Hyper-CEST 129Xe magnetic resonance spectra of skeletal CB[6] nanoparticles |
图 6显示,100 ppm处无任何CEST信号出现,溶解态信号(即194 ppm处信号)很窄,这意味着超极化129Xe在此类纳米颗粒溶液中基本没有CEST交换,或者交换较少,信号强度未能达到检测限.分析原因可能是因为这类纳米颗粒巨大的刚性结构,使其在水中的溶解度不高,溶液中没有足够多的可以用来进行CEST交换的“笼子”,导致只有溶解态Xe信号出现.
2.2 自组装型CB[6]纳米颗粒的Hyper-CEST 129Xe测试 2.2.1 全取代的自组装型CB[6]纳米颗粒为了进一步改善溶解性的问题,我们尝试在CB[6]的腰部修饰亲水性基团.由于CB[6]自身带有疏水性空腔,这样形成的两亲性化合物在超声的作用下,依靠分子间作用力很容易自组装成纳米颗粒.相较于骨架型纳米颗粒的刚性结构,柔性可变结构使自组装型纳米颗粒在溶解性方面更具优势.全取代的自组装型纳米颗粒2-1、2-2、2-3的Hyper-CEST 129Xe磁共振谱测试结果如图 7所示.

|
图 7 全取代自组装型纳米颗粒2-1、2-2、2-3的Hyper-CEST 129Xe磁共振谱图 Fig. 7 Hyper-CEST 129Xe magnetic resonance spectra of total-replaced self-assembling nanoparticles 2-1, 2-2, 2-3 |
图 7显示,纳米颗粒2-1、2-2在100 ppm左右没有信号出现,可能单体亲水端所修饰的易溶小分子对最终形成的纳米颗粒的水溶性提升不够明显,依旧未能达到Hyper-CEST检测水平;只有修饰长链(PEG),极大改善纳米颗粒水溶性后才会有CB[6] 100 ppm处的信号出现.
另外,在纳米颗粒2-3的CEST谱图中我们观察到另一个信号的存在,即出现在溶解态信号附近210 ppm处的信号.经过调研文献[33],我们得知合适的纳米尺寸“分子笼”也能有效的装载超极化129Xe分子,而且其CEST信号一般出现在溶解态信号左右.这一信号的出现给了我们极大的启发,在实际测试中,以单一信号作为评判标准很难去除偶然误差所带来的影响,假阳性或者假阴性信号的出现会对最终测试结果造成偏差,容易引发误判.如果在一次测试中,同时有两个信号的改变,可以有效的避免这种情况的发生.这也为我们所构建的纳米颗粒找到了一个新的发展方向.当用此类“分子笼”运载特定化合物(如疏水性药物)时,在化合物载入或者释放前后,纳米颗粒上CB[6]的信号和纳米颗粒自身空腔的信号会同时发生变化,根据双信号的同时改变,我们可以对特定化合物的传递作出准确地判断,在一定程度上,有效避免了假阳性或者假阴性信号的可能.
2.2.2 单取代的自组装型CB[6]纳米颗粒纳米颗粒2-3在Hyper-CEST 129Xe磁共振谱测试中出现的双信号,给予我们很大的启发,但是同时我们也发现这两处信号都比较宽,如果环境的扰动比较小,可能就很难观察到双信号的变化.如果我们后续想要将其运用到特定化合物的传递上,必须对此纳米颗粒进行优化.
经过分析,我们认为这是由全取代过程中的反应不完全导致的,不完全反应会产生质量不一的两亲性单体,这使得自组装形成的纳米颗粒也不够均一,众多信号的叠加造成信号变宽,于是在纳米颗粒基础上我们做了如下改进:1)参考文献,合成单羟基CB[6],再进一步合成单取代两亲性单体,确保单体性质的均一;2)用单取代代替全取代,意味着纳米颗粒中PEG的含量会大大下降,为了维持纳米颗粒良好的水溶性,我们决定适当增加PEG的链长(分子量由2 000增大至5 000).经过多次尝试最终合成纳米颗粒2-4用于Hyper-CEST 129Xe磁共振谱测试,其结果如图 8所示.

|
图 8 单取代自组装型纳米颗粒2-4的Hyper-CEST 129Xe磁共振谱图 Fig. 8 Hyper-CEST 129Xe magnetic resonance spectrum of single-replaced self-assembling nanoparticle 2-4 |
首先,双信号再次同时出现,这是后续能够进行特定化合物传递研究的保障;其次,纳米颗粒2-4相较于2-3双信号峰的变窄,意味其对化学环境的变化更加敏感;最后,100 ppm处CB[6]的信号强度的增加,使得纳米颗粒2-4能在复杂环境(细胞或者活体)中同样发挥作用.
3 结论本文构建了一系列以CB[6]为基础的纳米颗粒,从中成功筛选出了水溶性良好、有较强CB[6]“笼”内Xe CEST信号的纳米颗粒,并发现了这种纳米颗粒中存在CB[6]/纳米颗粒内部的两个“笼”内129Xe信号.这一发现表明,这种以CB[6]为基础的水溶性纳米颗粒可以作为一种性质优秀的超极化129Xe磁共振“分子笼”,具有进一步成为超极化129Xe磁共振分子探针的潜力.凭借超极化129Xe磁共振技术带来的高灵敏度,借助纳米颗粒双129Xe CEST信号的同时改变,该纳米颗粒可以实现在复杂环境下对疏水性药物(如紫杉醇)传递效率的准确判断,有效降低检测结果中假阳性与假阴性的发生率,具有非常广阔的研究前景.
| [1] | TERRENO E, CASTELLI D D, VIATE A, et al. Challenges for molecular magnetic resonance imaging[J]. Chem Rev, 2010, 110(5): 3019-3042. DOI: 10.1021/cr100025t. |
| [2] |
GAO D L, SUN P, ZHANG X, et al. Interactions between albumin and fatty acids studied by NMR spectroscopy[J].
Chinese J Magn Reson, 2018, 35(3): 338-344.
高东莉, 孙鹏, 张许, 等. 运用NMR研究白蛋白与脂肪酸的相互作用[J]. 波谱学杂志, 2018, 35(3): 338-344. |
| [3] | PALANIAPPAN K K, FRANCIS M B, PINES A, et al. Molecular sensing using hyperpolarized xenon NMR spectroscopy[J]. Israel J Chem, 2014, 54(1/2): 104-112. |
| [4] | WALKER T, HAPPER W. Spin-exchange optical pumping of noble-gas nuclei[J]. Rev Mod Phys, 1997, 69(2): 629-642. DOI: 10.1103/RevModPhys.69.629. |
| [5] | ZHOU X, SUN X P, LUO J, et al. Production of hyperpolarized Xe-129 gas without nitrogen by optical pumping at Cs-133 D-2 line in flow system[J]. Chin Phys Lett, 2004, 21(8): 1501-1503. DOI: 10.1088/0256-307X/21/8/024. |
| [6] | ZHOU X, GRAZIANI D, PINES A. Hyperpolarized xenon NMR and MRI signal amplification by gas extraction[J]. Proc Natl Acad Sci U S A, 2009, 106(40): 16903-16906. DOI: 10.1073/pnas.0909147106. |
| [7] |
ZHAO X C, SUN X P, ZHOU X, et al. Measuring polarization of hyperpolarized xenon-129 gas with low-field NMR[J].
Chinese J Magn Reson, 2016, 33(3): 458-467.
赵修超, 孙献平, 周欣, 等. 超极化气体氙-129的低场NMR测量[J]. 波谱学杂志, 2016, 33(3): 458-467. |
| [8] | SCHLUNDT A, KILIAN W, BEYERMANN M, et al. A xenon-129 biosensor for monitoring MHC-peptide interactions[J]. Angew Chem Int Ed, 2009, 48(23): 4142-4145. DOI: 10.1002/anie.200806149. |
| [9] | BOUTIN C, STOPIN A, LENDA F, et al. Cell uptake of a biosensor detected by hyperpolarized Xe-129 NMR: The transferrin case[J]. Bioorg Med Chem, 2011, 19(13): 4135-4143. DOI: 10.1016/j.bmc.2011.05.002. |
| [10] | KOTERA N, DUBOST E, MILANOLE G, et al. A doubly responsive probe for the detection of Cys4-tagged proteins[J]. Chem Commun, 2015, 51(57): 11482-11484. DOI: 10.1039/C5CC04721H. |
| [11] | WEI Q, SEWARD G K, HILL P A, et al. Designing Xe-129 NMR biosensors for matrix metalloproteinase detection[J]. J Am Chem Soc, 2006, 128(40): 13274-13283. DOI: 10.1021/ja0640501. |
| [12] | CHAMBERS J M, HILL P A, AARON J A, et al. Cryptophane xenon-129 nuclear magnetic resonance biosensors targeting human carbonic anhydrase[J]. J Am Chem Soc, 2009, 131(2): 563-569. DOI: 10.1021/ja806092w. |
| [13] | ROY V, BROTIN T, DUTASTA J P, et al. A cryptophane biosensor for the detection of specific nucleotide targets through xenon NMR spectroscopy[J]. Chemphyschem, 2007, 8(14): 2082-2085. DOI: 10.1002/cphc.200700384. |
| [14] | KHAN N S, RIGGLE B A, SEWARD G K, et al. Cryptophane-folate biosensor for Xe-129 NMR[J]. Bioconjugate Chem, 2015, 26(1): 101-109. DOI: 10.1021/bc5005526. |
| [15] | PALANIAPPAN K K, RAMIREZ R M, BAJAJ V S, et al. Molecular imaging of cancer cells using a bacteriophage-based 129Xe NMR biosensor[J]. Angew Chem Int Ed, 2013, 52(18): 4849-4853. DOI: 10.1002/anie.201300170. |
| [16] | ROSSELLA F, ROSE H M, WITTE C, et al. Design and characterization of two bifunctional cryptophane A-based host molecules for xenon magnetic resonance imaging applications[J]. Chempluschem, 2014, 79(10): 1463-1471. DOI: 10.1002/cplu.201402179. |
| [17] | WITTE C, MARTOS V, ROSE H M, et al. Live-cell MRI with xenon Hyper-CEST biosensors targeted to metabolically labeled cell-surface glycans[J]. Angew Chem Int Ed, 2015, 54(9): 2806-2810. DOI: 10.1002/anie.201410573. |
| [18] | ROSE H M, WITTE C, ROSSELLAA F, et al. Development of an antibody-based, modular biosensor for Xe-129 NMR molecular imaging of cells at nanomolar concentrations[J]. Proc Natl Acad Sci U S A, 2014, 111(32): 11697-11702. DOI: 10.1073/pnas.1406797111. |
| [19] | YANG S J, JIANG W P, REN L L, et al. Biothiol xenon MRI sensor based on thiol-addition reaction[J]. Anal Chem, 2016, 88(11): 5835-5840. DOI: 10.1021/acs.analchem.6b00403. |
| [20] | BERTHAULT P, DESVAUX H, WENDLINGER T, et al. Effect of pH and counterions on the encapsulation properties of xenon in water-soluble cryptophanes[J]. Chem Eur J, 2010, 16(43): 12941-12946. DOI: 10.1002/chem.201001170. |
| [21] | RIGGLE B A, WANG Y, DMOCHOWSKI I J. A "smart" Xe-129 NMR biosensor for pH-dependent cell labeling[J]. J Am Chem Soc, 2015, 137(16): 5542-5548. DOI: 10.1021/jacs.5b01938. |
| [22] | KOTERA N, TASSALI N, LEONCE E, et al. A sensitive zinc-activated 129Xe MRI probe[J]. Angew Chem Int Ed, 2012, 51(17): 4100-4103. DOI: 10.1002/anie.201109194. |
| [23] | TASSALI N, KOTERA N, BOUTIN C, et al. Smart detection of toxic metal ions, Pb2+ and Cd2+, using a Xe-129 NMR-based sensor[J]. Anal Chem, 2014, 86(3): 1783-1788. DOI: 10.1021/ac403669p. |
| [24] | ZHANG J, JIANG W P, LUO Q, et al. Rational design of hyperpolarized xenon NMR molecular sensor for the selective and sensitive determination of zinc ions[J]. Talanta, 2014, 122: 101-105. DOI: 10.1016/j.talanta.2014.01.023. |
| [25] | GUO Q N, ZENG Q B, JIANG W P, et al. A molecular imaging approach to mercury sensing based on hyperpolarized Xe-129 molecular clamp probe[J]. Chem Eur J, 2016, 22(12): 3967-3970. DOI: 10.1002/chem.201600193. |
| [26] | WANG Y F, DMOCHOWSKI I J. An expanded palette of xenon-129 NMR biosensors[J]. Acc Chem Res, 2016, 49(10): 2179-2187. DOI: 10.1021/acs.accounts.6b00309. |
| [27] | KUNTH M, WITTE C, HENNIG A, et al. Identification, classification, and signal amplification capabilities of high-turnover gas binding hosts in ultra-sensitive NMR[J]. Chem Sci, 2015, 6(11): 6069-6075. DOI: 10.1039/C5SC01400J. |
| [28] | JON S Y, SELVAPALAM N, OH D H, et al. Facile synthesis of cucurbit[J]. J Am Chem Soc, 2003, 125(34): 10186-10187. DOI: 10.1021/ja036536c. |
| [29] | KIM K, SELVAPALAM N, KO Y H, et al. Functionalized cucurbiturils and their applications[J]. Chem Soc Rev, 2007, 36(2): 267-279. |
| [30] | LEE H K, PARK K M, JEON Y J, et al. Vesicle formed by amphiphilc cucurbit[J]. J Am Chem Soc, 2005, 127(14): 5006-5007. DOI: 10.1021/ja042172s. |
| [31] | KIM D, KIM E, KIM J, et al. Direct synthesis of polymer nanocapsules with a noncovalently tailorable surface[J]. Angew Chem Int Ed, 2007, 46(19): 3471-3474. DOI: 10.1002/anie.200604526. |
| [32] | KIM D, KIM E, LEE J, et al. Direct synthesis of polymer nanocapsules: self-assembly of polymer hollow spheres through irreversible covalent bond formation[J]. J Am Chem Soc, 2010, 132(28): 9908-9919. DOI: 10.1021/ja1039242. |
| [33] | YUN G, HASSAN Z, LEE J, et al. Highly stable, water-dispersible metal-nanoparticle-decorated polymer nanocapsules and their catalytic applications[J]. Angew Chem Int Ed, 2014, 53(25): 6414-6418. DOI: 10.1002/anie.201403438. |
| [34] | PARK K M, SUH K, JUNG H, et al. Cucurbituril-based nanoparticles: a new efficient vehicle for targeted intracellular delivery of hydrophobic drugs[J]. Chem Commun, 2009(1): 71-73. DOI: 10.1039/B815009E. |
| [35] | AYHAN M M, KAROUI H, HARDY M, et al. Comprehensive synthesis of monohydroxy-cucurbit[J]. J Am Chem Soc, 2015, 137(32): 10238-10245. DOI: 10.1021/jacs.5b04553. |
| [36] | STEVENS T K, RAMIREZ R M, PINES A. Nanoemulsion contrast agents with sub-picomolar sensitivity for xenon NMR[J]. J Am Chem Soc, 2013, 135(26): 9576-9579. DOI: 10.1021/ja402885q. |
 2019, Vol. 36
2019, Vol. 36 
