2. 上海市磁共振重点实验室, 华东师范大学 物理与材料科学学院, 上海 200062
2. Shanghai Key Laboratory of Magnetic Resonance, College of Physics and Materials Science, East China Normal University, Shanghai 200062, China
普遍存在固体核磁共振(nuclear magnetic resonance,NMR)实验中的背景信号会造成NMR谱图相位和基线的畸变,甚至会产生假峰[1-4].背景信号一般来源于两个方面:一是射频脉冲产生的假信号(acoustic ringing),可通过相位循环消除[5, 6];二是来自于定子或探头材料产生的真实信号,这类背景信号会随着样品信号的累积而累积,严重干扰样品的观测[7-10].探头中经常使用的材料有聚酰亚胺(Torlon)、聚三氟氯乙烯(Kel-F)和陶瓷等,这些材料含有13C、1H、15N、27A1等元素,可能会产生背景信号.对于天然丰度较低的核(如13C核),背景信号对其NMR谱图的干扰更为严重.
为了不影响样品信号的观测和分析,必须对背景信号进行有效抑制.目前报道的消除背景信号的方法有以下几种.Cory等[11-13]提出的DEPTH脉冲序列可以很好地抑制单脉冲实验中稀核的背景信号,这是由于线圈外有效场的不均匀性和射频场强度的急剧降低,导致线圈外的核自旋几乎不被激发.Fu等[14]提出连续发射两个绝热反转脉冲,再将两次采样的信号相减,以去除背景信号.Jaeger等[15, 16]报道的EASY方法在第一次采样后重复之前的90°脉冲,由于样品信号还未恢复,此时采集到的是背景信号,然后将两次采样信号相减即可去除背景信号,这种方法在稀核定量实验及二维谱中得到了很好的应用.White等[17]提出的组合脉冲
本文使用的是Bruker公司生产的静态探头,测试过程中发现探头产生严重的13C NMR背景信号,信号强度大,覆盖范围广,而且可以被交叉极化(cross polarization,CP)[19-21].以往的报道认为探头材料中由于1H核含量较低,而且线圈外有效场急剧降低,很难产生CP信号.而我们使用的静态探头13C NMR背景信号在CP实验中被增强,并与真实样品信号重叠,导致相位及基线矫正极其困难.以上几种去除背景信号的方法中,除了组合脉冲和EMMA方法外,均不适用于CP条件下静态探头产生的背景信号的去除.而组合脉冲和EMMA方法需要优化的参数较多,实验操作复杂.因此需要一种更加简洁有效的新方法去除静态探头经CP增强的13C NMR背景信号.
本研究的目的是找出背景信号的来源,并对其进行有效抑制.我们提出将相位步进脉冲(phase incremented pulses)引入CP实验中(以下称为PIPCP),可以完全抑制静态探头经CP增强的13C NMR背景信号,而样品信号不受影响.
1 实验部分 1.1 样品制备本文使用甘氨酸单晶样品制备方法如下:将1.8 g天然丰度的甘氨酸样品和0.2 g 13C全标记的甘氨酸样品(购买于美国CIL公司)混合均匀,溶解于5 mL蒸馏水中,待溶剂在室温下缓慢挥发完全,即得到10% 13C全标记的甘氨酸单晶,期间避免一切震动等干扰.
1.2 仪器设备及实验参数NMR实验使用配备双通道7 mm静态探头的Bruke Avance 300型固体NMR谱仪,1H核共振频率为300.15 MHz,13C核共振频率为75.54 MHz.13C NMR谱图以甘氨酸定标(δC 176.03).本文共使用了三种脉冲序列:单脉冲,常规CP脉冲序列和PIPCP序列.
单脉冲实验参数优化如下:13C通道施加宽度为4 μs(90°)的脉冲,脉冲强度为62.5 kHz,采样时间为50 ms,重复等待时间d1为10 s,采样次数为5 000,激发中心O1设置在背景信号中心δC 151.3处.去耦脉冲为TPPM15脉冲序列,去耦脉冲强度为40.5 kHz.
CP实验参数优化如下:1H通道施加宽度为4 μs(90°)脉冲,脉冲强度为62.5 kHz,自旋锁定脉冲强度为40.5 kHz,自旋锁定时间P15为960 μs,去耦脉冲为TPPM15脉冲序列,去耦脉冲强度为40.5 kHz.13C通道自旋锁定脉冲强度为94.6 kHz,采样时间为50 ms,重复等待时间d1为5 s,采样次数为2 048,激发中心O1设置在背景信号中心δC 151.3处.
PIPCP脉冲优化过程及参数设置见1.3节.
1.3 PIPCP脉冲序列本实验提出的PIPCP脉冲序列如图 1所示.I通道为丰核通道,S通道为稀核通道.丰核通道施加90°脉冲将1H核的磁化矢量转移到XY平面,然后再施加自旋锁定脉冲(spin locking);此时,稀核通道施加相位步进脉冲;采样在稀核通道进行,丰核通道施加高功率去耦脉冲.
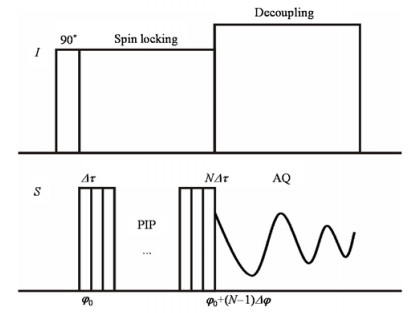
|
图 1 PIPCP脉冲序列示意图 Fig. 1 Pulse sequence of PIPCP |
相位步进脉冲由一系列相同脉宽(Δτ)的矩形脉冲相互连接组成,第一个脉冲的初始相位为φ0,每个矩形脉冲的相位都比前一个脉冲增加Δφ,其中-180°≤Δφ≤180°,N为步进个数,总的相位移动应满足:
| $ \varphi = \sum\limits_i {\Delta {\varphi _i} = 2n{\rm{ \mathsf{ π} }}} $ | (1) |
其中n必须为整数[22],即表示总的相位移动大小应等于360°的整数倍,从而保证最终相位回到初始相位的方向.这里使用的相位步进脉冲中每一个步进脉冲的强度都相同,其大小根据CP匹配条件(Hartmann-Hahn match)调节,总的脉宽等于I通道锁定场的脉宽.相位步进脉冲的作用是使激发中心的频率发生移动,移动的大小满足:
| $ \Delta f = \Delta \varphi /(2{\rm{ \mathsf{ π} }}\Delta \tau ) $ | (2) |
PIPCP的原理如图 2所示.1H通道施加90°射频脉冲(f1)将1H核的磁化矢量从Z轴翻转到XY平面,然后1H通道加自旋锁定脉冲(spin locking),此时13C核通道施加相位步进脉冲,初始相位φ0=0°.1H核的磁化矢量通过极化转移传递给13C核,13C核的磁化矢量在XY平面增长.根据相位步进脉冲的原理,初始相位φ0通过相位步进在自旋锁定的过程中翻转360°的整数倍最终回到初始相位的方向.而处于线圈外的背景信号的相位变化具有不可预测性,且线圈外锁定场强度降低,因此无法被CP.
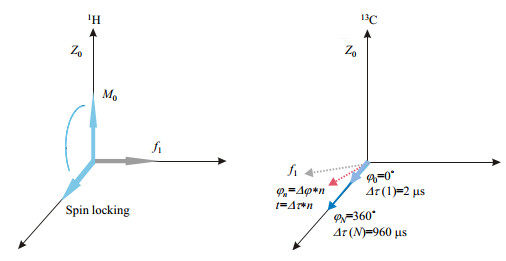
|
图 2 PIPCP的原理,以及旋转坐标系下1H核和13C核磁化矢量的变化过程.Z0表示主磁场;M0表示初始磁化矢量;f1表示射频场;Δτ表示步进时间;φ0表示13C核的初始相位(浅蓝色);φn表示13C核在PIPCP某一时刻的相位,虚线表示相位变化(红色);φN表示13C核的最终相位(深蓝色) Fig. 2 Principle of PIPCP in the rotating coordinate system. Z0 represents the main magnetic field; M0 represents the initial magnetization vector; f1 represents the radio frequency field; Δτ represents the pulse width; φ0 represents the initial phase of 13C nucleus (light blue); φn represents the phase of 13C nucleus at a certain time in PIPCP (red); φN represents the final phase of 13C nucleus (dark blue) |
PIPCP实验参数优化如下:1H通道施加宽度为4 μs(90°)脉冲,脉冲强度为62.5 kHz,自旋锁定脉冲强度为40.5 kHz,自旋锁定时间P15为960 μs,去耦脉冲为TPPM15脉冲序列,去耦脉冲强度为40.5 kHz.13C核通道施加相位步进脉冲强度为94.6 kHz,初始相位φ0等于0°,相位步进Δφ等于12°,脉宽Δτ为2 μs,步进个数等于480,激发中心O1设置在背景信号中心δC 151.3处.采样时间为50 ms,重复等待时间d1为5 s,采样次数为2 048.
2 结果与讨论 2.1 背景信号的来源图 3(a)是探头空采得到的单脉冲13C NMR谱图,出现明显的背景信号,此背景信号包含两个成分,位于δC 108.5处较窄的信号和位于δC 151.3处较宽的信号.此背景信号强度较大,化学位移分布广(δC 20~250),几乎覆盖了整个13C核的出峰范围,对后续谱图分析造成困难.图 3(b)是探头空采得到的常规13C CP谱图,背景信号依然存在,但峰形与单脉冲采样结果[图 3(a)]不同.位于δC 108.5处较窄的信号消失,位于δC 151.3处的信号增强.将CP 1H通道锁定场的相位移动180°,背景信号也随之翻转180° [图 3(c)],说明此13C NMR背景信号可能来自于探头所使用的有机材料.
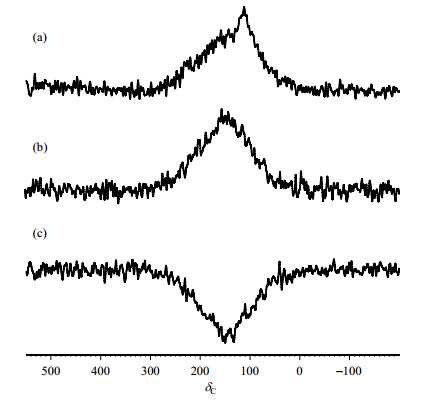
|
图 3 探头空采得到的13C NMR谱图:(a)单脉冲采样得到的信号;(b)常规CP脉冲采样得到的信号,1H通道锁定场脉冲相位设定为-X;(c)常规CP脉冲采样得到的信号,1H通道锁定场脉冲相位设定为X Fig. 3 13C NMR spectra of the empty probe head acquired with different pulse methods: (a) Single pulse; (b) Conventional CP with I spin locking pulse on –X; (c) Conventional CP with I spin locking pulse on X |
为了进一步验证背景信号的来源,通过改变CP锁定场脉冲的时间研究背景信号积分面积强度随时间的变化,从而得到CP动力学曲线(图 4).从图 4可以看出,背景13C NMR信号的积分面积随着CP时间的增加出现明显的动力学变化.当CP时间小于700 μs,背景13C NMR信号的积分面积急剧增加,这是由于当达到Hartmann-Hahn匹配时,1H核的磁化矢量通过1H核和13C核之间的极化转移传递给13C核,导致13C NMR信号强度不断增加.当CP时间在700~1 000 μs之间,1H核到13C核的极化转移达到平衡,因此背景13C NMR信号的积分面积强度几乎不变.当CP时间继续增加大于1 000 μs,背景13C NMR信号的积分面积强度反而下降,这是由1H核信号在锁定场下的弛豫造成的.因1H核初始磁化矢量较大,相比初始磁化矢量,锁定场强度较弱,1H核在锁定场下弛豫导致信号强度损失.
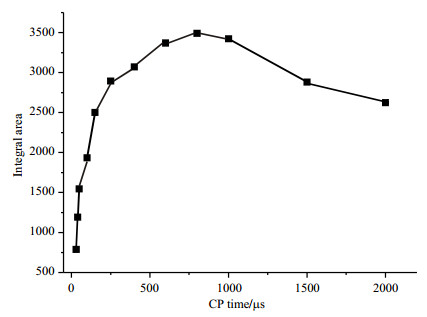
|
图 4 背景信号的积分面积随着CP时间的变化 Fig. 4 Variations of background signal integral area with CP time |
以上讨论说明背景信号受1H锁定场脉冲相位影响,并且其积分面积随着CP时间的增加出现先增长后降低的变化,这充分说明此13C NMR背景信号来源于探头所使用的有机材料.此13C NMR背景信号不仅强度大,会随着样品信号的累积而累积,而且它的化学位移范围非常宽(δC 20~250),很容易和样品信号重叠,因此必须要对背景信号进行有效抑制.
2.2 背景信号的消除我们发现激发中心O1的设置对背景信号的强度有严重影响.图 5显示了采用常规CP脉冲序列对探头进行空采,激发中心改变对13C NMR背景信号的影响.当激发中心设置在背景信号中心时(δC 151.3,即13 kHz),背景信号强度最大[图 5(a)].将激发中心向右移动到9 kHz时(4 kHz offset),相同的采样条件下,背景信号的强度有所降低[图 5(b)].继续将激发中心向右移动,可以看到背景信号的强度随着offset的增加而降低[图 5(c)和5(d)].当激发中心移动到-3 kHz(16 kHz offset)时,背景信号消失不见[图 5(e)].可见背景信号对offset敏感,可通过移动激发中心来消除背景信号.虽然改变激发中心使offset大于16 kHz可有效去除背景信号,但是这种做法无法对激发中心移动进行补偿,导致后续实验存在offset的影响[23].而相位步进脉冲既可以实现激发频率的移动又能保持相位相干,可通过施加相反的相位步进脉冲将激发中心再次移动到谱图中心,不影响后续实验.基于此种分析,我们提出将相位步进脉冲引入CP实验消除背景信号.
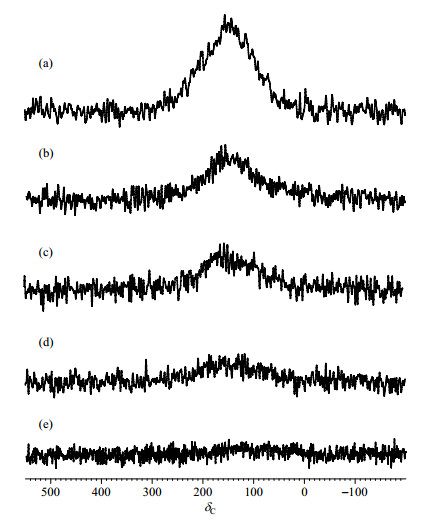
|
图 5 改变激发中心(O1),采用常规CP脉冲序列对探头空采得到的13C NMR谱图.(a) O1 = 13 kHz; (b) O1 = 9 kHz; (c) O1 = 5 kHz; (d) O1 = 1 kHz; (e) O1 = -3 kHz Fig. 5 13C NMR spectra of the empty probe head acquired with conventional CP pulse sequence with different O1 values. (a) O1 = 13 kHz; (b) O1 = 9 kHz; (c) O1 = 5 kHz; (d) O1 = 1 kHz; (e) O1 = -3 kHz |
图 6(a)是10% 13C全标记甘氨酸单晶样品的常规13C CP谱图.位于δC 0和δC 50.5处的信号来自于甘氨酸分子中与氨基连接的13C原子(Cα),位于δC 214.8和δC 265.5处的信号来自于羰基13C原子(Co).实验所使用的是10% 13C全标记的甘氨酸,Cα和Co之间强烈的偶极耦合(约为3 800 Hz),导致Cα和Co分别裂分为2个峰.位于δC 27.2和δC 239.4处的两个小峰来自于天然丰度的Cα和Co.除了甘氨酸样品的13C NMR信号,图 6(a)中还出现了一个明显的背景信号,位于δC 151.3,化学位移分布非常宽(δC 20 ~ 250),并且与甘氨酸的信号重叠,导致谱图难以进行基线矫正,影响样品信号的观测和分析.
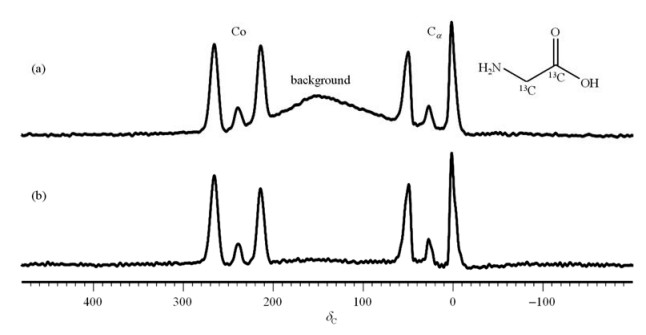
|
图 6 10% 13C标记甘氨酸单晶的13C NMR谱图.(a)使用常规CP脉冲序列;(b)使用PIPCP脉冲序列 Fig. 6 13C NMR spectra of a single crystal of 10% 13C double-labelled glycine acquired with (a) conventional CP pulse sequence, and (b) the PIPCP pulse sequence |
图 6(b)是使用PIPCP脉冲采集的13C NMR谱图,可以看到背景信号完全消失,而样品信号保持不变.PIPCP脉冲的优化过程如下:为了达到最佳Hartmann-Hahn匹配条件,13C通道相位步进脉冲功率等于常规CP脉冲13C通道锁定场的强度,为了使Co和Cα CP效率最佳,CP时间P15应在700~1 000 μs之间.经过多次尝试选取Δφ=12°,总的相位步进应等于360°的整数倍,因此总的步进个数N为480,总的步进时间为960 μs.
PIPCP脉冲序列在保持样品信号不损失的条件下完美地去除了背景信号.这是由于经过相位步进脉冲线圈外相位严重畸变,而且线圈外锁定场强度的急剧降低,使得来自探头材料的13C NMR信号无法有效进行CP.而对于被测样品来说,相对于1H核和13C核之间强烈的偶极耦合作用,16 kHz的激发频率移动对锁定场(94.6 kHz)的影响仅为1.4%:
| $ \sqrt {{{94.6}^2} + {{16}^2}} = 95.9 $ | (3) |
| $ \frac{{95.9 - 94.6}}{{94.6}} = 1.4\% $ | (4) |
因此Co和Cα基团的信号保持不变,而来自线圈外的13C NMR背景信号则消失不见.PIPCP方法去除背景信号简洁有效,不仅可以用于静态探头,也可以用于魔角旋转(magic-angle spinning,MAS)探头.
3 结论背景信号在固体13C NMR实验中普遍存在,严重干扰样品的测试分析.本文探讨了Bruker公司静态探头产生的13C NMR背景信号来源,此背景信号可通过CP累积.我们通过将相位步进脉冲引入CP脉冲,有效去除了经CP增强的13C NMR背景信号.施加相位步进脉冲后,线圈内相位的变化遵循相位步进脉冲的原理,而线圈外的相位变化则不可预测,另外线圈外射频场强度的急剧降低,来自线圈外的13C NMR背景信号无法进行CP.根据这个原理有效地去除了来自线圈外材料的背景信号,而样品信号不受影响.利用相位步进脉冲去除背景信号简洁有效,可被更多地用于其它脉冲序列去除背景信号,也可用于MAS探头.
| [1] | SMERNIK R J, OADES J M. Background signal in solid state 13C NMR spectra of Soil Organic Matter (SOM)-Quantification and minimization[J]. Solid State Nucl Magn Reson, 2001, 20(1/2): 74-84. |
| [2] | CHEN Q, HOU S S, SCHMIDT-ROHR K. A simple scheme for probehead background suppression in one-pulse 1H NMR[J]. Solid State Nucl Magn Reson, 2004, 26(1): 11-15. DOI: 10.1016/j.ssnmr.2003.08.002. |
| [3] | MEIER S, BENIE A J, DUUS J, et al. Adiabatic low-pass J filters for artifact suppression in heteronuclear NMR[J]. Chem Phys Chem, 2009, 10(6): 893-895. DOI: 10.1002/cphc.200900072. |
| [4] | KONUMA T, NAGADO A, KURITA J I, et al. Analysis of artifacts caused by pulse imperfections in CPMG pulse trains in NMR relaxation dispersion experiments[J]. Magnetochemistry, 2018, 4(3): 33-50. DOI: 10.3390/magnetochemistry4030033. |
| [5] | LBUESS M, LPETERSEN G. Acoustic ringing effects in pulsed nuclear magnetic resonance probes[J]. Rev Sci Instrum, 1978, 49(8): 1151-1157. DOI: 10.1063/1.1135538. |
| [6] | ZHANG S M, WU X L, MEHRING M. Elimination of ringing effects in multiple-pulse sequences[J]. Chen Phys Lett, 1990, 173(5/6): 481-484. |
| [7] | BAIN A D, HUGHES D W, ANAND C K, et al. Problems, artifacts and solutions in the INADEQUATE NMR experiment[J]. Magn Reson Chem, 2010, 48(8): 630-641. |
| [8] | GEROTHANASSIS I P. Simple reference baseline subtraction-90˚ pulse sequence for acoustic ringing elimination in pulsed Fourier transform NMR spectroscopy[J]. Magn Reson Chem, 1986, 24(5): 428-433. DOI: 10.1002/mrc.1260240508. |
| [9] | MALLONI W M, SANCTI S D, TOME A M, et al. Automated solvent artifact removal and base plane correction of multidimensional NMR protein spectra by AUREMOL-SSA[J]. J Biomol NMR, 2010, 47(2): 101-111. DOI: 10.1007/s10858-010-9414-z. |
| [10] | SPEIGHT P A, JEFFREY K R, COURTENEY J A. A probe modification for pulsed nuclear magnetic resonance to eliminate spurious ringing[J]. J Phys E Sci Instrum, 1974, 7: 801-802. DOI: 10.1088/0022-3735/7/10/008. |
| [11] | CORY D G, RITCHEY W M. Suppressionof signals from the probe in bloch decay spectra[J]. J Magn Reson, 1988, 80(1): 128-132. |
| [12] | BODENHAUSEN G, FREEMAN R, TURNER D L. Suppressionof artifacts in two-dimensional J spectroscopy[J]. J Magn Reson, 1977, 27: 511-515. |
| [13] | BENDALL M R, GOEDON R E. Depth and refocusing pulses designedfor multipulse NMR with surfacecoils[J]. J Magn Reson, 1983, 53(3): 365-385. |
| [14] | FU R Q, Arturo J H M. Boosting sensitivity and suppressing artifacts via multi-acquisition in direct polarization NMR experiments with small flip-angle pulses[J]. J Magn Reson, 2018, 293: 34-40. DOI: 10.1016/j.jmr.2018.05.015. |
| [15] | CHRISTIAN J, HEMMANN F. EASY:A simple tool for simultaneously removing background, deadtime and acoustic ringing in quantitative NMR spectroscopy-Part I:Basic principle and applications[J]. Solid State Nucl Magn Reson, 2014, 57-58: 22-28. DOI: 10.1016/j.ssnmr.2013.11.002. |
| [16] | CHRISTIAN J, HEMMANN F. EASY:A simple tool for simultaneously removing background, deadtime and acoustic ringing in quantitative NMR spectroscopy-Part II:Improved ringing suppression, application to quadrupolar nuclei, cross polarisation and 2D NMR[J]. Solid State Nucl Magn Reson, 2014, 63-64: 13-19. DOI: 10.1016/j.ssnmr.2014.08.001. |
| [17] | WHITE J L, BECK L B, FERGUSON D B, et al. Background suppression in MAS NMR[J]. J Magn Reson, 1992, 100(2): 336-341. |
| [18] | MOLLIC G, ZIARELLI F, TINTARU A, et al. Suppressing background signals in solid state NMR via the Electronic Mixing-Mediated Annihilation (EMMA) method[J]. J Magn Reson, 2012, 218: 1-4. DOI: 10.1016/j.jmr.2012.03.015. |
| [19] |
LIU Z J, SHU J, ZHANG L L, et al. A study on the cross-polarization kinetics of polyethylene crystals[J].
Chinese J Magn Reson, 2008, 25(2): 159-164.
刘志健, 舒婕, 张莉莉, 等. 聚乙烯结晶区的交叉极化动力学研究[J]. 波谱学杂志, 2008, 25(2): 159-164. DOI: 10.3969/j.issn.1000-4556.2008.02.002. |
| [20] |
SUN Y, CHEN Y K, LI J P, et al. Efficiency of double cross polarization in magic-angle spinning solid-state NMR studies on membrane proteins[J].
Chinese J Magn Reson, 2017, 34(3): 257-265.
孙毅, 陈艳可, 李建平, 等. 固体核磁共振中膜蛋白双交叉极化效率与动力学参数相关的定量分析[J]. 波谱学杂志, 2017, 34(3): 257-265. |
| [21] |
ZHANG L, YANG G, CHEN Q. Influence of CP time on intermolecular cross polarization in the composite of poly(ethylene oxide) and fullerene[J].
Chinese J Magn Reson, 2005, 22(3): 245-251.
张磊, 杨光, 陈群. 交叉极化时间对分子间交叉极化的影响的研究[J]. 波谱学杂志, 2005, 22(3): 245-251. DOI: 10.3969/j.issn.1000-4556.2005.03.002. |
| [22] | ZHANG S M. Phase incremented pulses in NMR with applications[J]. Annu Rep NMR Spectro, 2004, 53: 1-66. DOI: 10.1016/S0066-4103(04)53001-6. |
| [23] | GUENDOUZ L, ROBERT A, RRTOURNARD A, et al. Off-resonance effects and selectivity profiles in pulsed nitrogen-14 nuclear quadrupole resonance[J]. Solid State Nucl Magn Reson, 2012, 47-48: 39-46. DOI: 10.1016/j.ssnmr.2012.08.004. |
 2020, Vol. 37
2020, Vol. 37 
