糖尿病(diabetes mellitus,DM)是一种以慢性血糖升高为特征的全身性代谢性疾病.最新报告表明,2017年全球约有4.51亿成人患有DM,预计至2045年,DM患者将达到6.93亿之多[1].自从于1965年提出的DM脑病的概念用于描述DM诱发的中枢系统病理变化以来,有关DM脑病的研究就日益得到重视[2].其中,认知功能障碍(cognitive impairment,CI)是常见的并发症之一,且最近研究表明,约有50 %以上的DM患者会出现CI[3, 4],主要表现为学习和记忆能力降低、情感障碍等.病程开始为轻度认知障碍(mild cognitive impairment,MCI),可通过药物等措施进行干预并扭转;随着病程的延长可能发展为痴呆症(dementia,DA),一旦发生DA,病情将很难逆转,目前尚无有效的药物,因而早期预防尤其重要[5].根据DM早期阴虚热盛为主、中晚期气阴两虚或阴阳两虚为主的病理特点,在前期实验的基础上,本实验室发现了对DM具有明显改善作用的西洋参-石菖蒲(Panax quinquefolius L.-Acorus Tatarinowii,X-S)药液.其中西洋参具有滋阴补气、生津止渴等作用,石菖蒲具有开窍豁痰、醒神益智等作用.西洋参属寒性药物、石菖蒲属温性药物,西洋参配伍石菖蒲可改善西洋参的寒凉性质,且石菖蒲具有行散作用,可提高血脑屏障通透性,促进西洋参有效成分进入中枢神经系统[6].
据报道[7],DM大鼠12周已经出现脑萎缩,本实验室前期研究[8-10]也证实在90天时,30%~40%的DM大鼠出现学习记忆损害,并且发现X-S药液能改善DM大鼠的学习记忆能力,但其对DM大鼠学习记忆能力相关脑区的影响尚未见报道.因此,本文基于磁共振成像(magnetic resonance imaging,MRI)技术,通过感兴趣区域(region of interest,ROI)分析法与基于体素形态学(voxel-based morphometry,VBM)法分析了X-S药液对DM大鼠全脑灰质(gray matter,GM)和白质(white matter,WM)的体积和密度的影响,并通过对特定脑区形态学进行观察,为糖尿病认知功能障碍(diabetes-associated cognitive decline,DACD)相关药物研究提供一定的实验基础.
1 实验部分 1.1 仪器与材料MRI扫描仪(Philips公司,3.0 T);小动物线圈(上海辰光医疗科技股份有限公司);Morris水迷宫视频跟踪分析系统(成都泰盟软件有限公司);超低温冰箱(SANYO公司);MS 105分析天平(Mettler Toledo公司).
链脲佐菌素(streptozotocin,STZ,Sigma公司,S0130);葡萄糖氧化酶试剂盒(上海荣盛生物技术有限公司).
西洋参、石菖蒲购于北京同仁堂哈尔滨药店,经哈尔滨商业大学药学院曲中原教授鉴定分别为五加科植物西洋参(Panax quinquefolius L.)的干燥根、天南星科植物石菖蒲(Acorus Tatarinowii)的干燥根茎.
无特定病原体(specific pathogen free,SPF)级健康Wistar 8~10周龄大鼠38只,均为雄性,体重为(220±20)g,购自长春市亿斯实验动物技术有限责任公司,实验动物生产许可证号码:SCXK(吉)-2016-0003,实验动物质量合格证序号:201700018989.
1.2 溶液配制 1.2.1 STZ溶液配制配制0.1 mol·L-1的柠檬酸溶液及柠檬酸钠溶液,将二者按1:1.32体积比进行混合,测定并调节至pH 4.2~4.5,0.22 μm微孔滤膜过滤除菌,4 ℃下避光保存.以0.1 mol·L-1的柠檬酸-柠檬酸钠缓冲液溶解配制STZ溶液(10 mg·mL-1),现用现配.
1.2.2 X-S药液配制西洋参有效部位提取:精密称取西洋参粉末(过40目筛),加入8倍体积70%乙醇,回流提取3 h,提取2次,过滤,收集滤液,60 ℃回收溶剂至无醇味,浓缩至1 g·mL-1水溶液后,冷冻干燥成冻干粉.
石菖蒲有效部位提取:精密称取西洋参粉末(过40目筛),加入12倍体积双蒸水,浸泡2 h后回流提取9 h,期间收集提取的挥发油.
X-S药液配制:西洋参与石菖蒲提取物按生药比3:2进行混匀,配制成浓度为0.108 g·mL-1的X-S药液,于4 ℃冰箱备用[6].
1.3 DM大鼠模型复制、分组及给药38只雄性Wistar大鼠分为空白组大鼠6只和模型组大鼠32只.适应性喂养7天,禁食不禁水16 h,模型组按65 mgkg-1的剂量腹腔注射STZ溶液,空白组注射同等剂量的柠檬酸-柠檬酸钠缓冲溶液.3天后测定空腹血糖,空腹血糖≥16.7 mmol·L-1作为模型复制标准[11, 12],获得模型组25只,成模率为78.13%.达到成模标准的大鼠按空腹血糖及体重随机分为DM组、X-S组,其中DM组大鼠18只,X-S组大鼠7只.STZ注射7天后开始灌胃给药,空白组及DM组大鼠灌胃给予等剂量蒸馏水,X-S组大鼠按1.08 g·kg-1灌胃给予X-S药液,每日1次,连续灌胃113天.同时,分别于STZ注射20、40、60、80、120天后测定各组大鼠空腹血糖,及时剔除不符合标准的大鼠.实验期间,18只DM组大鼠,死亡6只,死亡率为33.33%;7只X-S组大鼠,死亡2只,死亡率为28.57%;6只空白组大鼠,死亡1只,死亡率为16.67%.
1.4 Morris水迷宫实验STZ注射80天后,对空白组织5只、DM组12只以及X-S组5只大鼠进行Morris水迷宫实验,该实验包括适应性训练、定位航行实验、可视化平台实验3个阶段.
适应性训练:定位航行实验前1天,不放置平台将大鼠放入水迷宫环境中进行适应性训练,自由游泳120 s后将大鼠取出擦干,以减少抓取、水环境等应激因素影响.
定位航行实验:Morris水迷宫为直径150 cm,高50 cm的圆形水池,水池内壁被漆为黑色,水池被4个等距点分为4个象限,分别在4个象限池壁的中心贴上不同标记物,为三角形,正方形,圆形和五角星彩色塑料卡片.大鼠面朝池壁随机象限入水,登上平台3 s终止记录,记录大鼠找到平台时间,即逃避潜伏期,以此作为学习记忆评价指标;若大鼠90 s内未找到平台,逃避潜伏期为90 s,并将大鼠引导至平台上停留30 s.上下午各一次,连续5天.
可视化平台实验:放出水迷宫内部分水,使平台露出水面1 cm,并在平台上固定一个小旗.将大鼠面对池壁放入水迷宫,记录大鼠登上平台的时间.
DACD大鼠与糖尿病非认知障碍(non-diabetes-associated cognitive decline,DNCD)大鼠筛选标准:在定位航行第6次到第10次期间,若动物出现连续2次逃避潜伏期大于等于90 s,且没有出现连续2次逃避潜伏期低于空白组动物逃避潜伏期出现显著性降低次数时的平均逃避潜伏期,则认为大鼠为DACD;若动物出现连续2次逃避潜伏期低于空白组动物逃避潜伏期出现显著性降低次数时的平均逃避潜伏期,且未出现连续2次逃避潜伏期90 s以上,则认为大鼠为DNCD.在测定DM组大鼠逃避潜伏期后,本文对DM组大鼠进行了学习记忆成绩的个体化评价,12只DM组大鼠中有4只确定为DACD,有4只确定为DNCD,符合标准纳入实验,进行MRI脑部结构检测和苏木精-伊红(hematoxylin-eosin,HE)染色实验.其余4只为介于DACD和DNCD间的中间状态,未进行MRI及HE染色实验.
1.5 大鼠脑部MRI扫描及分析方法STZ注射120天后,按45 mg·kg-1剂量腹腔注射3%戊巴比妥钠进行麻醉后,置于固定板上,保持头部水平,左右校正,使鼻尖位于木板前缘中心,动物脊柱伸直,并用胶布固定头部,前爪摆平置于头部两侧.使用配备了标准的八通道小动物线圈的MRI扫描(Philips公司,3.0 T)仪对大鼠脑部进行扫描.将大鼠固定装置置于动物线圈内,鼻部不超过线圈上端.所有图像均由两位有经验的放射科医师评估.
使用T2W-TSE-12序列,扫描参数为:重复时间(repetition time,TR)为4 503 ms,回波时间(echo time,TE)为100 ms,反转角(flip angle,FA)为90˚,层厚为1.3 mm,矩阵为200×160,体素大小为0.30×0.30×1.30 mm3,采集层数为23,磁激励次数为10,成像视野为60×48 mm2,扫描时间为724 s.
ROI分析:首先,将大鼠大脑图集中定义的所有ROI都保存为单独的掩模图像,将每只大鼠的图像作为目标图像.然后,将spmratIHEP中的MRI T2WI模板图像在空间上进行转换,以记录每个目标图像以及所有ROI掩模图像.从单个图像中提取出这些ROI的体积(像素个数)和平均强度(平均密度).将脑区的像素个数除以全脑像素个数,即体积比;将脑区的平均密度除以全脑平均密度,即密度比.
VBM分析:采用基于SPM8的spmratIHEP工具箱(Welcome Department of Cognitive Neurology,London,UK)用于大鼠脑图像VBM分析,以及数据分析和再处理.图像由一套MRI T2WI大鼠脑模板和相应的组织先验概率图(tissue probability maps,TPMs)组成.根据参与者的图像,建立具有小群体代表性的平均模板;使用脑内像素自动提取算法将平均图像中的脑内组织提取出来,以被试个体脑图像作为参考标准,将自定义的平均模板及掩膜图像进行空间变换,自动去除被试个体的脑外像素,并保证不改变被试个体的原始空间.为提高结构成像数据分析的精度,将被试个体脑图像分割为GM、WM、脑脊液,分别进行密度分析;所有分割的图像被重新分割为0.98×1.95×10 mm3体素.该程序生成了“未调制”的GM和WM图像,用于组间比较GM和WM密度.此外,将GM和WM分割图像中的体素值相乘,该程序生成“调制”图像,用于GM和WM体积的组间比较.使用雅可比行列式对分割结果进行调制,并进行体积分析.使用半高宽为2×4×2 mm3对未调制及调制后的图像进行高斯平滑.基于一般线性模型的框架,对所有预处理图像进行分析.为了区分空白组、DNCD组、DACD组及X-S组的GM和WM的差异,首先进行了双样本t检验.根据体素水平高度阈值p < 0.005(未校正)和集群范围阈值20个体素,对大鼠脑区出现的GM和WM变化进行统计.
1.6 脑组织取材与HE染色MRI扫描结束后,将大鼠仰卧固定于工作台上,从剑突剪开并暴露心脏,寻找左心尖及右心耳位置,将灌流针从左心尖插入至升主动脉,同时剪开右心耳,灌注200 mL生理盐水冲出血液至液体清亮及肝组织呈灰白色,后10%甲醛灌注150 mL,待大鼠身体僵硬后,于冰浴下迅速断头取脑,置于10%甲醛固定24 h,以备用于HE染色.
HE染色步骤:1)酒精梯度脱水,二甲苯透明,石蜡包埋,进行冠状切片;2)组织贴片烤片;3)二甲苯脱蜡,乙醇脱去二甲苯并梯度使蜡片复水;4)蒸馏水洗数分钟,放入苏木精溶液中染色数分钟,分别加入酸水与氨水分色数秒钟;5)自来水冲洗l h后置于蒸馏水片刻,分别于浓度为70%和90%酒精中各脱水一次,每次10 min;6)放入伊红染色液中染色2~3 min;7)染色后的组织切片经无水乙醇脱水后,经二甲苯对组织切片进行透明处理;8)滴加中性树胶,加盖玻片封固标本;9)光学显微镜下观察.
1.7 数据分析空白组、DM组、X-S组大鼠的空腹血糖、定位航行游泳速度和逃避潜伏期数据的统计差异采用SPSS 21.0中单因素方差分析(ANOVA)方法来分析,p < 0.05表明有显著性差异,p < 0.01表明有非常显著性差异.
2 结果 2.1 大鼠空腹血糖的测定实验发现,与空白组相比,DM组与X-S组大鼠的空腹血糖均显著性增高(p < 0.01);与DM组相比,X-S组大鼠空腹血糖有降低趋势,但无显著性变化(p > 0.05)(图 1).

|
图 1 各组大鼠空腹血糖对比,**DM组与空白组相比,p < 0.01,▲▲X-S组与空白组相比,p < 0.01 Fig. 1 Fasting blood-glucose values of rats in each group. **DM group vs. control group, p < 0.01. ▲▲X-S group vs. control group, p < 0.01 |
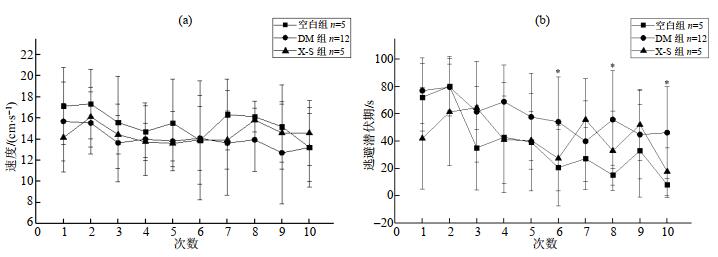
实验发现,各组大鼠的定位航行游泳速度无显著性差异(p > 0.05),因而排除游泳速度对各组大鼠逃避潜伏期测定结果的影响.同时,由可视化平台实验可知,空白组、DM组以及X-S组大鼠均为视力正常大鼠.与空白组相比,DM组大鼠训练第6、8、10次逃避潜伏期显著性延长(p < 0.05);与DM组相比,X-S组大鼠除第3、7、9次逃避潜伏期外,其他各次训练逃避潜伏期均缩短,但无显著性差异(p > 0.05)(图 2).
|
图 2 各组大鼠定位航行游泳速度(a)及逃避潜伏期(b),*DM组与空白组相比,p < 0.05 Fig. 2 Swimming speeds (a) and escape latencies (b) of rats in each group. *DM group vs. control group, p < 0.05 |
ROI法分析结果发现,与空白组比较,DNCD和与DACD大鼠出现广泛的脑区体积比或密度比的改变(见表 1).与DNCD组相比,DACD组与X-S组大鼠左侧颞叶联合皮质体积比显著性降低(p < 0.05或p < 0.01);与DACD组相比,X-S组大鼠左侧颞叶联合皮质体积比显著性降低(p < 0.05).
| 表 1 X-S药液对DM大鼠不同脑区体积比(%)的影响 Table 1 Effects of X-S on volume ratios (%) of brain regions of DM rats |
实验进一步发现,与空白组比较,DNCD与DACD组大鼠中脑导水管周围灰质(左右)均发生密度比的增加(p < 0.05或p < 0.01);而与DNCD组相比,X-S组则出现显著性降低(p < 0.05)(见表 2).
| 表 2 X-S药液对DM大鼠不同脑区密度比(%)的影响 Table 2 Effects of X-S on concentration ratios (%) of brain regions of DM rats |
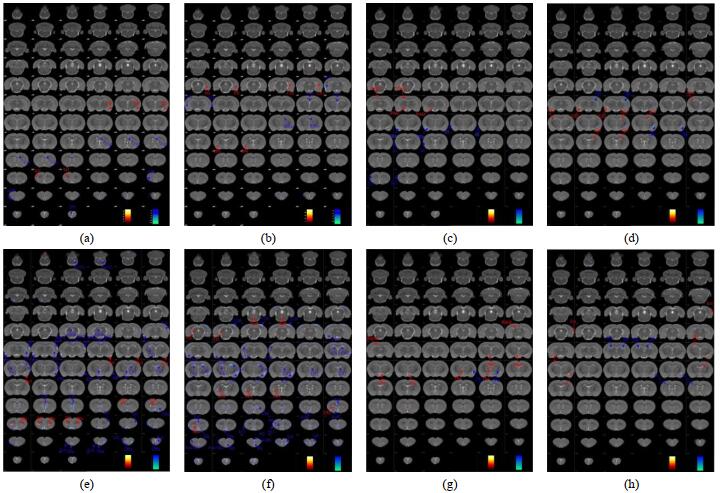
VBM法分析显示,与DNCD组比较,X-S组大鼠嗅周皮质(-6, 7, -3)、导叶皮质(-7, 7, -2)、感觉皮质(-7, 5, -2)灰质体积降低;中脑导水管(0, 7, -5)、压后皮质(-1, 3, 6)灰质体积升高.与DACD组比较,X-S组大鼠纹状体(5, 7, -3)、海马齿状回(3, 3, -4)灰质体积降低;海马CA3区(-5, 6, -4)、CA1区(1, 3, -1)(-4, 2, -4)(2, 2, -2)灰质体积升高.与DNCD组比较,X-S组大鼠纹状体(5, 7, -2)灰质密度降低;海马CA1区(2, 2, -3)、丘脑(1, 8, -3)(-1, 5, -2)、脑室周围(0, 7, -4)、压后皮质(-1, 3, -6)灰质密度升高.与DACD组比较,X-S组大鼠纹状体(5, 7, -2)、海马齿状回(3, 3, -4)、(-3, 3, -5)灰质密度降低;内嗅皮层(7, 5, -8)、海马伞(1, 3, -2)、海马CA1区(-3, 2, -4)灰质密度升高(见图 3;表 3,4).
|
图 3 各组大鼠灰质体积(a)~(d)及密度(e)~(h)差异(p < 0.005,未校正,团簇尺寸为20).(a)和(e):DNCD组vs.空白组;(b)和(f):DACD组vs.空白组;(c)和(g):X-S组vs. DNCD组;(d)和(h):X-S组vs. DACD组 Fig. 3 Differences in gray matter volume (a)~(d) and concentration (e)~(h) of rats in each group (p < 0.005, uncorrected, cluster size=20). (a) and (e): DNCD group vs. control group; (b) and (f): DACD group vs. control group; (c) and (g): X-S group vs. DNCD group; (d) and (h): X-S group vs. DACD group |
| 表 3 X-S药液对DM大鼠脑区灰质体积的影响 Table 3 Effects of X-S on gray matter volume of brain regions of DM rats |
| 表 4 X-S药液对DM大鼠脑区灰质密度的影响 Table 4 Effects of X-S on gray matter concentration of brain regions of DM rats |
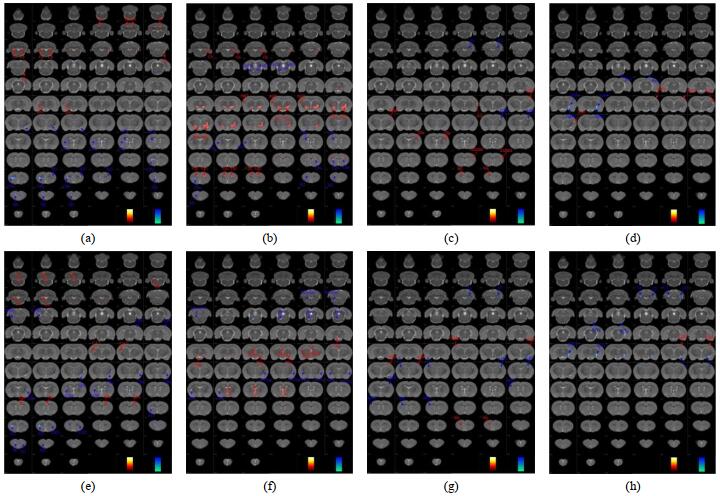
VBM法分析显示,与DNCD组比较,X-S组大鼠小脑(3, 6, -10)、感觉皮质(5, 3, -3)白质体积降低;纹状体(3, 5, -1)、感觉皮质(5, 2, -3)、(4, 4, 2)、听觉皮质(6, 4, -5)、运动皮质(-2, 3, 4)白质体积升高.与DACD组比较,X-S组大鼠脑桥网状核(1, 10, -10)、中脑深核(2, 8, -6)、内侧膝状体核(3, 6, -5)白质体积降低;听觉皮质(6, 4, -3)、顶叶皮质(5, 2, -4)白质体积升高.与DNCD组比较,X-S组大鼠小脑(3, 6, -10)、海马伞(-5, 3, -3)、纹状体(-4, 3, 0)、感觉皮质(-5, 3, 0)、(4, 3, -3)白质密度降低;前边缘皮层(-1, 3, 3)、感觉皮质(5, 2, -4)、视皮质(-4, 1, -4)白质密度升高.与DACD组比较,X-S组大鼠脑桥网状被盖核(1, 10, -9)、内囊(3, 7, -4)、内侧膝状体核(3, 6, -5)、小脑(3, 6, -10)、(-3, 4, -10)白质密度降低;感觉皮质(5, 2, -3)白质密度升高(见图 4;表 5,6).
|
图 4 各组大鼠白质体积(a)~(d)及密度(e)~(h)差异(p < 0.005,未校正,团簇尺寸为20).(a)和(e):DNCD组vs.空白组;(b)和(f):DACD组vs.空白组;(c)和(g):X-S组vs. DNCD组;(d)和(h):X-S组vs. DACD组 Fig. 4 Differences in white matter volume (a)~(d) and concentration (e)~(h) of rats in each group (p < 0.005, uncorrected, cluster size=20). (a) and (e): DNCD group vs. control group; (b) and (f): DACD group vs. control group; (c) and (g): X-S group vs. DNCD group; (d) and (h): X-S group vs. DACD group |
| 表 5 X-S药液对DM大鼠脑区白质体积的影响 Table 5 Effects of X-S on white matter volume of brain regions of DM rats |
| 表 6 X-S药液对DM大鼠脑区白质密度的影响 Table 6 Effects of X-S on white matter concentration of brain regions of DM rats |
HE染色结果(图 5)显示:空白组大鼠海马CA1、CA3区锥体细胞的细胞圆而大,细胞排列紧密有序,胞核清晰.与空白组相比,DNCD组大鼠海马CA1、CA3区椎体细胞排列稍有疏松但比较规则,出现个别细胞核固缩现象.与空白组相比,DACD组大鼠海马CA1区神经元椎体细胞排列散乱且不规则,细胞核深染,出现明显细胞核固缩及神经毡疏松的现象.DACD组大鼠海马CA3区锥体细胞变化类似于海马CA1区,细胞排列散乱且细胞核固缩明显.与DACD组相比,X-S组大鼠海马CA1、CA3区椎体细胞排列规则,细胞核固缩情况明显缓解.

|
图 5 各组大鼠海马组织的HE染色结果 Fig. 5 HE staining of hippocampus of rats in each group |
临床研究和流行病学调查显示DM是引起CI和DA的危险因素,DACD的主要表现为学习能力下降、记忆功能减退、语言、理解、判断等能力受影响,其中学习记忆障碍是DM中枢神经系统并发症的主要表现[13].通过本次实验发现,80天左右DM大鼠已经发生CI.而CI一旦发病无法逆转,尚未发现可靠的药物.本实验室前期发现了X-S药液能改善DM大鼠的糖代谢相关指标,并在其发生认知损害过程中起到干预作用,提高学习记忆能力、降低社交障碍的发生[14].本文通过MRI技术检测了该药液对DACD大鼠学习记忆相关脑区结构的影响.
目前,大多数动物的CI判定是组间比较,即模型组与对照组比较,默认模型组动物的CI发生率为100%,但是DACD是继发性的,临床发现其发病率约为40%[15].而且,DACD是不规则的,经常出现阶段性变化.因此,本次研究明确区分了DACD和DNCD动物模型,从而更准确地反映药物的干预作用.基于动物水迷宫实验的逃避潜伏期作为其学习记忆成绩,我们建立了个性化动物学习记忆成绩评价方法(专利编号CN106070014B),用于DACD和DNCD大鼠的筛选[16].本实验将DM组动物按照“1.4节DACD与DNCD筛选标准”进行了12只DM大鼠学习记忆成绩的个体化评价,其中4只确定为DACD、4只确定为DNCD,余下动物为“中间状态”,将符合标准动物纳入实验,运用MRI技术检测脑部结构.
脑结构MRI扫描每次检测都会产生数十万像素的信息量,如此庞大的数据分析处理方法可分为ROI和VBM.本文首先通过自动化ROI法在全脑水平对伴有和不伴有认知障碍的DM大鼠,以及X-S组大鼠脑部结构左右两侧72个区域进行了分析,测定指标包括灰质体积、密度,体积比和密度比.实验发现,DACD组大鼠较DNCD组大鼠颞叶联合皮质体积降低,X-S大鼠较DACD组大鼠颞叶联合皮质体积降低(表 1).颞叶联合皮质可参与处理物体的识别与分辨、记忆及社交等功能,该区域损害可引起复杂物体识别障碍、面容失认、记忆障碍及情感人格异常[17].以上发现部分与脑萎缩引起CI的事实相反,推测DM引起酮症酸中毒诱发脑炎症反应,并促进Na-K-Cl共转运,其中,炎症因子如IL-6、TNF-等可以促进神经小胶质细胞反应性增生,相关研究发现酮症酸中毒可引起海马星形胶质细胞反应性增生,而促进Na-K-Cl共转运可引起脑水肿,二者共同引起相关脑区体积或密度增高[18, 19].且对西洋参与石菖蒲的研究发现,西洋参中的人参皂苷及石菖蒲中的挥发油成分可对抗氧化应激与炎症反应而对神经元产生保护作用[20, 21].因而,推测X-S药液通过该作用而减轻神经胶质细胞反应性增生引起上述脑区体积或密度降低,从而发挥改善CI的作用.
在数据分析过程中,我们发现由于大鼠脑部体积较小,ROI分析中有些区域没有测量结果.而VBM的方法是以像素为单位,能够探测脑区局部的细微结构改变,更加精准.因此,本文通过VBM方法比较各组大鼠灰质与白质的体积和密度的像素差异脑区.本实验室前期发现,与学习记忆相关区域,如海马等区域,DACD和DNCD大鼠存在“双向性改变”[22].本次研究发现,X-S组大鼠较DACD组大鼠出现灰质和白质的体积或密度增高的区域包括:记忆相关脑区:CA3、CA1、fi;体感相关脑区:S1BF;听觉相关脑区:AuD;嗅觉相关脑区:Ect;多功能脑区:PtPD.其中,CA1、CA3为海马发挥神经信号转导重要部位,海马接受来自Ect的信号,经DG-CA3-CA1再次回至Ect构成三突触回路,该回路是保证学习记忆正常进行的重要基础.在此回路中,促进了CA1及CA3 LTP的形成,而CA1及CA3 LTP的形成与空间学习记忆相关[23, 24].CA1、CA3均处于三突触回路中,CA1 LTP的形成又有赖于CA3的高频放电[25].DACD组大鼠CA1灰质体积,CA1、CA3灰质密度均较空白组显著降低,表明DM大鼠CI的发生伴随着CA1与CA3的萎缩.通过对DM大鼠进行的药物干预,发现X-S药液可提高DACD组大鼠CA1、CA3灰质体积及CA1灰质密度.Ect位于海马旁回内,形成情景记忆需依靠其信号传导,而Ect的损伤可使海马接受信号受阻,干扰情景记忆的巩固[26].同时,DACD组大鼠伴随着Ect灰质密度的降低,而X-S药液可提高DACD组大鼠Ect的灰质密度.因而,推测X-S药液可通过神经保护作用提高DM大鼠CA1、CA3灰质体积或密度,并增强突触可塑性,增强三突触回路进而改善T1DM大鼠的学习记忆能力.另外,X-S药液还可提高DACD组大鼠的灰质密度、AuD的白质体积及密度、PtPD的白质体积、S1BF的白质密度.其中,fi参与隔-海马通路中胆碱能神经纤维投射,影响海马兴奋性进而影响学习记忆能力[27];AuD参与听觉信号的传导,促进听觉记忆的形成[28];PtPD参与工作记忆的存储与重复[29];S1BF的功能在啮齿动物中包括探索性识别或主动触摸时胡须运动的识别、协调,以及联想学习[30].此外,X-S组大鼠的CPu、DG、PnV、DpMe、MGV、RtTg、ic、Cb较DACD组大鼠灰质白质的体积或密度降低,表明X-S药液对DACD大鼠脑区存在双向性调节.
为了进一步验证X-S药物的干预作用,基于MRI分析结果,我们选取了与学习记忆相关的海马进行HE染色.结果发现,DACD组大鼠较空白组大鼠的海马CA1、CA3区核固缩及排列紊乱明显,DNCD组大鼠较DACD大鼠海马CA1、CA3区核固缩及排列紊乱现象较轻.X-S组大鼠海马CA1、CA3区的固缩及排列紊乱等现象较DACD组大鼠明显改善.该发现与MRI结果发现的DACD组大鼠海马CA1、CA3区出现明显萎缩,以及X-S药液对DACD组大鼠海马CA1、CA3区萎缩的改善相一致.
本研究仍存在不足,主要包括(1)未进行DM大鼠CI发病过程MRI动态观察,无法确定脑区变化是否与病程长短相关;(2)未结合神经电生理学对本研究差异脑区验证及全脑进行电位变化的研究.
4 结论综上所述,本文首先建立了DM大鼠模型,以X-S药液对该模型进行干预,于模型建立80天后进行Morris水迷宫实验筛选DACD大鼠,运用MRI扫描各组大鼠脑部结构,利用自动化的ROI和VBM方法对大鼠大脑灰质和白质进行体积和密度的分析,同时研究X-S药液对DM大鼠全脑结构的影响,为脑部结构与功能之间的联系提供依据.实验发现,DM会引起大鼠脑部结构的变化,即模型建立120天,DM大鼠出现全脑大范围区域的体积和密度改变.X-S药液对DACD大鼠的学习记忆相关脑区海马CA1区和CA3区存在双向调节,从而发挥学习记忆能力的改善作用.
| [1] | CHO N H, SHAW J E, KARURANGA S, et al. IDF diabetes atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Res Clin Pract, 2018, 138: 271-281. |
| [2] | MIJNHOUT G S, SCHELTENS P, DIAMANT M, et al. Diabetic encephalopathy:A concept in need of a definition[J]. Diabetologia, 2006, 49(6): 1447-1448. |
| [3] | SIMA A A. Encephalopathies:the emerging diabetic complications[J]. Acta Diabetol, 2010, 47(4): 279-293. |
| [4] | 中华医学会糖尿病学分会. 中国2型糖尿病防治指南[M]. 北京: 北京大学医学出版社, 2014. |
| [5] | OHARA T. Epidemiology of diabetes and risk of dementia[J]. Brain Nerve, 2016, 68(7): 719-727. |
| [6] | 赵瑛, 谢海龙, 王冬雪, 等.一种防治糖尿病认知障碍的药物组合物及其制备方法: 中国, 201611190858.4[P]. 2017-05-31. |
| [7] |
HUANG W, CAO Z Y. STZ-induced progressive brain atrophy studied by magnetic resonance imaging and histochemical staining[J].
Chinese J Magn Reson, 2015, 32(3): 439-449.
黄微, 曹子玉. STZ诱导大鼠1型糖尿病进行性脑萎缩的磁共振成像及组织化学研究[J]. 波谱学杂志, 2015, 32(3): 439-449. |
| [8] | 刘月婷.糖尿病致认知损害大鼠脑脊液代谢标志物的筛选[D].哈尔滨: 哈尔滨商业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10240-1016163603.htm |
| [9] | 毕田田.糖尿病致认知障碍大鼠脑脊液差异代谢物的动态变化[D].哈尔滨: 哈尔滨商业大学, 2019. |
| [10] | 高伟莹.糖尿病认知损害大鼠海马组织蛋白质组学的研究[D].哈尔滨: 哈尔滨商业大学, 2020. |
| [11] | LI C, YANG Q F, ZHOU L N, et al. Atrophy of entorhinal cortex in evaluation of cognitive performance in patients with diabetes mellitus[J]. Chin J Med Imaging Technol, 2018, 34(1): 25-29. |
| [12] | 苏力担卡扎·仇曼, 何铁英, 林海, 等. 链脲佐菌素建立1型糖尿病大鼠模型的最优剂量研究[J]. 中国普外基础与临床杂志, 2016, 23(1): 84-85. |
| [13] | BEDNARIK P, MOHEET A A, GROHN H, et al. Type 1 diabetes and impaired awareness of hypoglycemia are associated with reduced brain gray matter volumes[J]. Front Neurosci, 2017, 11: 529. |
| [14] | 谢海龙.基于代谢组学的西洋参-石菖蒲对糖尿病认知损害大鼠干预作用研究[D].哈尔滨: 哈尔滨商业大学, 2019. |
| [15] | WEINSTEIN G, MAILLARD P, HIMALI J J, et al. Glucose indices are associated with cognitive and structural brain measures in young adults[J]. Neurology, 2015, 84(23): 2329-2337. |
| [16] | 赵瑛, 刘琳, 刘月婷, 等.一种基于水迷宫的动物学习记忆的个体化评价方法[P]. CN 106070014 B, 2020-06-11. |
| [17] | PRESSLER M, NOPOULOS P, HO B C, et al. Insular cortex abnormalities in schizophrenia:Relationship to symptoms and typical neuroleptic exposure[J]. Biol Psychiatry, 2005, 57(4): 394-398. |
| [18] | GLASER N, LITTLE C, LO W, et al. Treatment with the KCa3.1 inhibitor TRAM-34 during diabetic ketoacidosis reduces inflammatory changes in the brain[J]. Pediatr Diabetes, 2017, 18(5): 356-366. |
| [19] | LO W, O'DONNELL M, TANCREDI D, et al. Diabetic ketoacidosis in juvenile rats is associated with reactive gliosis and activation of microglia in the hippocampus[J]. Pediatr Diabetes, 2016, 17(2): 127-139. |
| [20] | MIAO H H, ZHANG Y, DING G N, et al. Ginsenoside Rb1 Attenuates isoflurane/surgery-induced cognitive dysfunction via inhibiting neuroinflammation and oxidative stress[J]. Biomed Environ Sci, 2017, 30(5): 53-62. |
| [21] | WEN W, WANG Y. Effect of effective components of acorus tatarinowii schott and polygala on SOD and MDA in neurons hippocampus induced by Aβ25-35 in vitro[J]. Journal of Emergency in Traditional Chinese Medicine, 2012, 21(8): 1256-1258. |
| [22] | ZHOU Y, LI X L, XIE H L, et al. Voxel-based morphology analysis of STZ-induced type 1 diabetes mellitus rats with and without cognitive impairment[J]. Neurosci Lett, 2018, 684: 210-217. |
| [23] | LU Y M, JIA Z, JANUS C, et al. Mice lacking metabotropic glutamate receptor 5 show impaired learning and reduced CA1 long-term potentiation (LTP) but normal CA3 LTP[J]. J Neurosci, 1997, 17(13): 5196-5205. |
| [24] | ISHIHARA K, MITSUNO K, ISHIKAWA M, et al. Behavioral LTP during learning in rat hippocampal CA3[J]. Behav Brain Res, 1997, 83(1/2): 235-238. |
| [25] | STEPAN J, DINE J, EDER M. Functional optical probing of the hippocampal trisynaptic circuit in vitro:network dynamics, filter properties, and polysynaptic induction of CA1 LTP[J]. Front Neurosci, 2015, 9: 160-168. |
| [26] | DI PAOLA M, MACALUSO E, CARLESIMO G A, et al. Episodic memory impairment in patients with Alzheimer's disease is correlated with entorhinal cortex atrophy[J]. J Neurol, 2007, 254(6): 774-781. |
| [27] | NILSSON O G, SHAPIRO M L, GAGE F H, et al. Spatial learning and memory following fimbria-fornix transection and grafting of fetal septal neurons to the hippocampus[J]. Exp Brain Res, 1987, 67(1): 195-215. |
| [28] | 梁力.听觉皮层时域信号处理特征[D].广州: 第一军医大学, 2000. |
| [29] | SMITH E E, JONIDES J. Neuroimaging analyses of human working memory[J]. Proc Natl Acad Sci, 1998, 95(20): 12061-12068. |
| [30] | STÜTTGEN M C, SCHWARZ C. Barrel cortex:What is it good for?[J]. Neuroscience, 2017, 368: 3-16. |
 2020, Vol. 37
2020, Vol. 37 
