2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Science, Beijing 100049, China
随着无线电话、电脑等便携式设备以及电动汽车等新型能源汽车的推广,锂离子电池得到了越来越广泛的应用.同时,钠离子电池也因具备价廉和原材料丰富等优点,成为应用前景更加光明的新型能源.然而锂/钠离子电池的广泛应用,也对其循环寿命、电池容量和使用安全性等提出了更加严格的要求[1].
碳负极材料是锂/钠离子电池的传统负极材料,低廉的价格和独特的结构特性使其从发现至今仍然是许多电池厂商和电池材料研究者首选的材料之一.但是锂/钠电池碳负极材料存在充电时间过长、库伦效率低等问题.在锂/钠离子电池充放电循环过程中,锂/钠离子的嵌入和脱出导致碳负极材料的结构发生变化,从而可能影响材料的储能性能.研究材料充放电过程前后的结构变化及其与电池性能的联系,有利于深入了解碳负极材料锂/钠离子的脱嵌机理,为改善电极材料的性能提供指导.
固体核磁共振(NMR)技术是一种表征固体材料内部结构的重要手段,具备精确度高、原位无损、定量分析等优点,可通过谱图中化学位移的变化研究目标原子核的化学环境及原子核间的相互作用,得到电池材料的局部结构信息,并进一步探测材料结构的变化情况.
在利用固体NMR技术表征锂/钠离子电池碳负极材料在充放电过程中的结构变化时,通常选用6Li、7Li和23Na作为观察核.虽然在抗磁性材料中,6Li和7Li的化学位移分布较窄,导致很难分辨不同化学环境的信号,但是碳负极材料良好的导电性使其共振频率产生了较大的偏移,即Knight位移[2-4](Knight位移是指在外加磁场下,导电物体或金属的共振频率受到导电电子自旋产生的磁场影响而发生移动,其偏移量由电子在核上的波函数密度和Pauli磁化系数决定[5]).因此我们能够通过6Li NMR和7Li NMR谱图来分析锂离子电池体系中碳负极材料的局部结构,分辨脱出和嵌入锂/钠状态,并得到碳原子与锂/钠的配位情况.Conard和Estrade[6]在1977年首次发表了关于石墨负极上嵌锂所形成LiC6的固体NMR研究,由7Li NMR谱图发现嵌入石墨中的7Li位于δLi 40左右.6Li(I=1)的旋磁比及天然丰度均小于7Li(I=3/2),但具有比7Li更小的电四极矩和四极耦合常数,因此6Li虽然具有较低的NMR灵敏度,但容易获得更高分辨率的固体NMR谱,有利于信号归属.
高速魔角旋转(MAS)能够消除原子核的各向异性相互作用(如化学位移、四极、偶极相互作用),提高固体NMR谱图的分辨率,是固体NMR实验常用的方法之一.但在锂/钠离子电池碳负极材料的NMR测试中,有些锂/钠在碳原子上形成的中间态结构并不稳定,非原位NMR的测试结果可能不能说明其正确结构,因此有些研究者也利用原位NMR技术实时观测锂/钠在碳负极材料的结构变化.但由于原位NMR测试只能静态进行,这就使得NMR谱线变宽,影响了其分辨率.因此将原位与非原位固体NMR技术相结合,可获得更加精准详细的信息.
张忠如等[7, 8]介绍了早期碳负极的固体NMR研究,本文主要结合近些年的文献来综述固体NMR技术在锂/钠离子电池碳负极材料中应用以及研究进展.
1 天然石墨最早研究的碳负极材料是石墨.7Li NMR谱图显示,天然石墨嵌锂完全后在δLi 0和δLi 45附近出现谱峰,这两个信号分别归属于石墨表面固体电解质膜(SEI膜)上的7Li和嵌入石墨层中的7Li[5, 9-15].之后,Letellier等[16, 17]使用能够实时检测反应物变化的原位固体NMR技术对锂在石墨负极的脱嵌过程进行了详细精确的研究,还原了石墨负极第一圈循环的嵌锂过程(图 1),发现嵌入石墨层中的7Li随着放电的进行,化学位移发生了偏移,至放电完全时,7Li NMR信号位于δLi 42.5,对应其放电最终产物LiC6.Leifer等[18]在研究溶剂分子对石墨负极的影响时,利用在电解液中加入二甘醇二甲醚,以及7Li、13C和23Na NMR谱图的变化,证明了锂离子和钠离子与溶剂分子共嵌进入石墨层中,而且溶剂分子与锂离子耦合作用更强,锂离子迁移率低,解释了二甘醇二甲醚在钠离子电池中拥有更出色的电化学性能的原因.
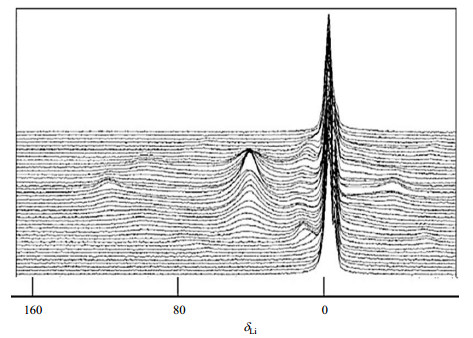
|
图 1 石墨负极第一圈恒电流循环时的原位7Li NMR谱图(依据文献[16]) Fig. 1 In situ 7Li NMR spectra of graphite during the first galvanostatic cycle (Reproduced from Ref. [16]) |
由于天然石墨负极材料库伦效率较低、容量密度有限,科学家通过对天然石墨负极材料进行改性来提升其电化学性能,并通过NMR对材料性能进行分析.Yoshio等[19]利用给天然石墨包裹软碳层的方式制备碳负极材料,通过固体NMR实验发现7Li在石墨内部层与表面软碳层的峰强比值与软碳的包覆量呈线性相关,利用该线性关系能够制备电化学性能更加出色的石墨材料.Langer等[20]通过密封的铌注射液中的元素合成出与天然石墨具有相似结构的杂石墨LBC,其理论可容纳的锂含量是天然石墨的三倍,但无论作为正极还是负极材料,电化学性能均较为低劣;固体7Li NMR和6Li NMR实验显示Li+进入BC层变得不稳定;变温7Li NMR实验表明,在500 K下,锂离子的迁移速率也较低,证实该材料的脱嵌锂的能力较差.Xing等[21]在研究石墨负极储能机理时发现扭曲的石墨结构具有更高的储锂能力和容量.球磨70 h后,该材料的7Li NMR谱比未研磨的样品出现更多的旋转边带,并且没有采集到锂插入石墨层的信号,这说明锂处于一个无序且各向异性的环境中,其储锂方式并不是插层机制(图 2);NMR及X射线衍射(XRD)实验证明,研磨后石墨的储能机理是一种电容机制,与石墨的无序性和多孔性有直接关系.这种新的储能机制的发现,会为石墨材料的改性提供新思路.对于石墨与硅复合材料的研究,Jung等[22]通过测试7Li MAS NMR谱图发现(图 3,SCN为石墨与硅复合材料),充电时LiCx与LiSix的峰相对强度比值小于放电时峰的相对强度比值;而随着x的增加,LiCx与LiSix的峰位置偏移量分别增加和减少,这就说明充电状态下的石墨比放电时少,而硅与石墨相反,证明了锂离子更容易从石墨层中脱出,更容易与硅纳米颗粒生成LiSix.

|
图 2 未经球磨[(a)和(b)],以及在氩气中球磨70 h后[(c)和(d)]石墨的固体7Li NMR谱图(依据文献[21]) Fig. 2 Solid-state 7Li NMR spectra of CG without ball-milling [(a) and (b)] and with ball-milling for 70 h in argon [(c) and (d)] (Reproduced from Ref. [21]) |

|
图 3 (a) 石墨与硅复合材料(SCN)示意图;(b)放电和(c)充电过程的7Li MAS NMR谱图对比(依据文献[22]) Fig. 3 Schematic image of SCN (a), and its 7Li MAS NMR spectra in discharging (b) and charging (c) processes (Reproduced from Ref. [22]) |
随着近几年石墨烯材料的发展,一些科学家也将NMR技术用于石墨烯负极材料的表征.Pramudita等[23]将使用有序石墨烯材料和无序石墨烯材料作为负极的钠离子电池进行了对比,发现两种石墨烯材料在循环反应前后23Na NMR信号的位置发生了不同程度的改变,这种差异证明这两种材料形成了不同的SEI膜.研究发现,无序石墨烯材料形成了更刚性的SEI膜;但是在充放电过程中,钠离子在有序石墨烯材料中具有更高的迁移率;SEI膜的刚性取决于石墨烯材料结构的特性并且决定了石墨烯电极表面钠离子的运输性能.Harris等[24]利用7Li NMR研究了石墨烯电极的电化学变化,电极充放电过程的7Li NMR谱图反映了锂在石墨烯纳米颗粒中形成晶相,而不是无序插入片层之中,并且电极中的细小电势差异会产生不同的相.2D EXSY谱图结果表明,在放电至0.4 V及0.01 V时,随着脉冲序列中混合时间(τmix)从0.1 s增大到1 s,不同合金相或者SEI膜间有着较高的迁移率,但在每个合金相中没有明显的交换峰,这说明整个样品的锂化并不是同时进行的.通过NMR能够表征碳负极材料的结构以及迁移率,从而能够判断石墨烯材料中锂/钠的运动形式和运输性能.
2 硬碳硬碳作为一种无定形碳,因具有较高的嵌锂能力而成为碳负极材料的另一种选择.对于硬碳的嵌锂过程,一般认为锂嵌在硬碳的片层间、硬碳片层边缘以及硬碳材料间隙等位置[25, 26],但目前并没有一个统一的结论.Nakagawa等[27]认为Li+在硬碳电极中的环境以及碳电极的晶体结构决定了其嵌锂的峰出现在δLi 72.Tatsumi等[28]对已放电的硬碳负极材料进行NMR测试,发现从0.1 V降至0 V间,最大的7Li峰处于δLi 110.Greenbaum[29]对硬碳电极从1.1 V到0 V的放电状态进行分析发现嵌锂过程出现三种峰:插入在无序硬碳片层形成Li-C共价键位于δLi 50,在碳材料中形成非晶态含氢位点位于δLi 17,以及在SEI膜表面位于δLi 0.Mori等[30, 31]通过7Li NMR发现在硬碳材料中锂的嵌入存在两种位置(图 4):一种是锂嵌入硬碳层内部,其峰宽较窄,称作C位;另一种则是锂处于碳层表面,其峰宽较宽,称作S位.实验证明相对于S位,位于C位的锂具有更强的脱嵌能力.Jung等[32, 33]也认为在Li在硬碳材料中存在两种位点:一种是插入碳层中能够随着充电过程脱出的可逆位点,随着反应进程出现或者消失;另一种则是留在SEI膜表面的不可逆位点,任何状态下都存在NMR峰.嵌锂过程中7Li NMR信号的位置与碳材料的复杂结构有着重大关系,目前对于NMR测试结果的解释尚不统一.

|
图 4 (a) 锂在无序碳中脱嵌过程的示意图;(b)充电完全状态下的7Li MAS NMR谱(依据文献[30]) Fig. 4 (a) Schematic of lithium doping/undoping process in disordered carbon; (b) 7Li MAS NMR spectra under a fully charged condition (Reproduced from Ref. [30]) |
采用变温NMR方法研究硬碳材料脱嵌机理,可获取许多有用信息.Gautier[34]在采集放电至-20 mV硬碳样品的7Li NMR谱时,发现室温条件下位于δLi 66的NMR谱峰随着温度降低至233 K过程中,逐渐分裂成两个峰:一个是插入石墨层中形成Li-C共价键的位于δLi 18的谱峰,该峰在温度降至273 K时出现,不随温度进一步降低而位移;另一种则是低温条件下在纳米空腔中形成锂团簇的“伪金属锂”,其峰随着温度降低而最终位移于δLi 220.在低温下,离子运动缓慢,减少了中间相态的干扰,因此能够清楚观测嵌入到不同位置的峰.此后,Guerin等[35, 36]对其进行了更深入的研究,他将温度降低至183 K时发现在室温条件下位于δLi 60左右的峰分解成三种不同信号,分别对应形成Li-C共价键、插入石墨层间以及形成锂团簇的锂.Tatsumi等[37, 38]推测低温条件下,大于δLi 100的信号为嵌锂过程中在硬碳纳米空腔中形成的锂团簇,因为其具有金属性,所以存在Knight位移.因此通过变温NMR测试,在低温下能够明确硬碳材料中锂的嵌入位置,解释嵌锂过程.
在探究锂在碳材料中的动力学方面,Saito[39]首次采用自旋回波的方法测出了锂在碳的中间相的扩散系数,该系数与界面传输效应无关,并且其大小随着无序碳中嵌锂量的增加而增加.实验证实锂先进入无序碳中,并随着充电的进行在有序碳中占主导地位,锂在有序碳中的扩散速率远高于无序碳,达到3×10-7 cm2·s-1.在对硬碳材料使用原位固体NMR技术进行分析时,Letellier等[40]通过制作硬碳负极的Bellcore型超薄塑料电池(图 5),还原了在负极材料上的脱嵌锂的过程(图 6),通过NMR峰的移动以及对弛豫时间的检测,观察到磁滞现象以及中间过程的结构状态变化.Gerald等[41]将扣式电池充放电到不同阶段后暂停并进行NMR测试,观测到充放电不同状态下,NMR峰的变化以及Knight位移的变化.这种“准原位”的测试方式,为此后电极材料NMR测试提供了借鉴依据.近几年,Shellikeri等[42]通过制作塑料电池并进行原位NMR测试,证明了锂离子在电池中的循环机理,突出了每个电极在充放电中的贡献,揭示了锂离子在正负极之间的交换通过硬碳的锂化和活性炭的双电子层的形成来进行.制作塑料电池,虽然电化学性能受到影响,但无法改变电池充放电机理,无疑为NMR测试提供了许多方便.
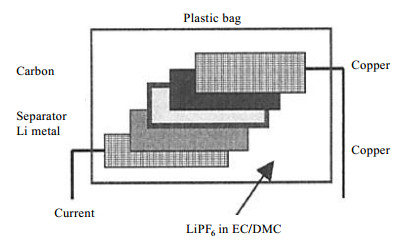
|
图 5 锂/碳超薄塑料电池示意图(依据文献[40]) Fig. 5 Ultraplate plastic lithium/carbon cell sketch (Reproduced from Ref. [40]) |

|
图 6 塑料锂/碳电池循环过程的原位7Li NMR谱图.底部为初始谱图(依据文献[40]) Fig. 6 In situ 7Li NMR spectra recorded during cycling of the plastic lithium/carbon cell. The initial spectrum is at the bottom (Reproduced from Ref. [40]) |
在钠离子电池硬碳负极材料的NMR研究中,Gotoh等[43]探究了硬碳材料中嵌入无序石墨层中可逆钠的位点以及残留在纳米孔中不可逆钠的位点,变温NMR实验(使用饱和NaCl溶液定标于δNa 0)显示,低温条件下的23Na NMR谱中特征峰并没有产生分裂(图 7),这与锂的特性不同,说明了位于硬碳不同位点的钠离子交换缓慢,即使在硬碳封闭的纳米孔中组装也不会生成钠团簇.Morita等[44]结合固体NMR与密度泛函理论(DFT)计算也说明在硬碳中钠团簇难以生成,并且揭示了电池储能容量与硬碳缺陷位点的关系.Grey等[45]结合原位固体23Na NMR与对分布函数分析法测得钠离子在嵌入硬碳过程中最大化学位移位于δNa 760,弛豫恢复实验显示钠嵌入硬碳后仍会与电解液发生反应,导致电极的自放电和氧化.本课题组与武汉大学曹余良课题组合作[46],利用XRD和NMR实验研究钠在硬碳材料中充放电机理.23Na NMR(图 8)实验证实在放电过程中,会出现两个NMR峰,分别对应电极表面上电解液的钠盐(δNa -10)和嵌入不同碳层和微孔中的钠(δNa 7);但当电池过放电时,在δNa 1 130处出现了金属钠的信号,原位XRD和电子顺磁共振(EPR)实验验证金属钠或类金属钠只在过放电时才会出现.
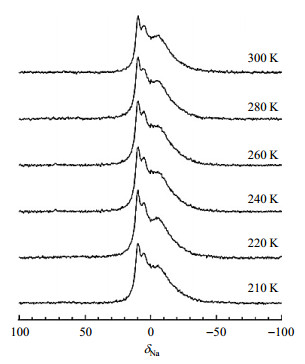
|
图 7 充电量为252 mAh/g的样品在210~300 K之间的23Na MAS NMR谱图(依据文献[43]) Fig. 7 23Na MAS NMR spectra of sample (252 mAh/g charged) at 210~300 K (Reproduced from Ref. [43]) |
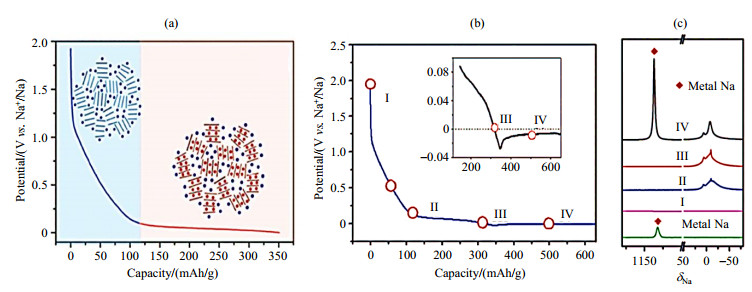
|
图 8 (a) 钠离子电池在硬碳中的机理示意图;(b)充放电曲线;(c) 23Na MAS NMR谱图(依据文献[46]) Fig. 8 (a) Schematic of the mechanisms for Na-ion storage in hard carbon; (b) The discharge-charge curve; (c) 23Na MAS NMR spectra (Reproduced from Ref. [46]) |
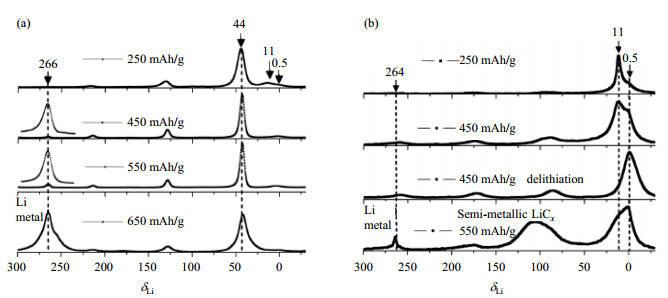
近几年,科学家们将石墨与硬碳两大碳负极材料通过NMR技术进行对比研究,探究嵌锂在不同碳负极材料中的形成机制.Fujimoto等[47]通过采集7Li NMR谱图发现,对硬碳电极进行110%过放电并没有产生锂沉积,而对石墨电极进行105%过放电时却出现了锂沉积现象.锂沉积会形成锂枝晶,可能会刺穿电池隔膜造成短路,从而引发安全问题,Fujimoto证明了硬碳负极材料具有更高的安全性.Gotohy等[48]和Arai等[49]也通过原位7Li NMR谱图发现过充产生的弛豫效应会降低锂金属在负极表面的沉积,锂金属信号降低与碳负极中锂信号增加成反比,这是由于沉积的锂被吸附进碳层中.硬碳的缓冲结构导致其比石墨拥有更大的弛豫效应,因此也证明了硬碳的安全性能.Su[50]利用NMR(使用LiCl溶液进行定标)(图 9)和XRD实验表明了石墨和硬碳在过充情况下锂枝晶的生长情况:充电之初,硬碳在δLi 264处并没有峰型,说明其表面并没生成锂枝晶;充电至550 mAh/g时,在δLi 105处在出现了半金属锂的信号.NMR与扫描电子显微镜(SEM)的测试结果证实硬碳的纳米孔为硬碳内部的锂成核和初始生长提供了空间,使锂与电解质之间的瞬时副反应最小,从而减少了活性锂的损耗,提高了可逆容量.
|
图 9 不同充电量的负极材料的7Li MAS NMR谱图.(a)石墨;(b)硬碳(依据文献[50]) Fig. 9 7Li MAS NMR spectra of anode materials with different specific capacity. (a) Graphite; (b) Hard carbon (Reproduced from Ref. [50]) |
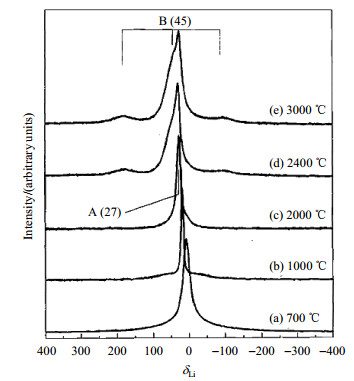
碳微球因合成容易,成本低,在电极填充密度、倍率性能以及安全性上都具有优良表现而成为碳负极材料之一.固体NMR是科学家在研究碳微球负极材料的充放电机理时常用的技术.Tatsumi等[51]对碳微球进行研究发现,当热解温度大于2 000 ℃时,碳微球与石墨具有相同结构,可以通过石墨的原理来解释碳微球中锂的脱嵌机制.嵌锂完全的碳微珠上出现两个峰,分别位于δLi 45和δLi 27(图 10,以1 mol/L LiCl溶液定标),分别对应于高温热解下石墨有序AB堆叠层和无序堆叠层,对应的完全嵌锂态分别为LiC6和Li0.2C6.Zhou等[52]通过23Na NMR研究发现在碳微球石墨层与纳米孔洞中同时发生嵌钠反应,这是由于两种结构间较低的反应位垒有利于钠的运动和填充.Alcantara等[53]利用水热法合成碳微球,对碳微球的嵌锂/嵌钠行为进行NMR和EPR研究发现,碳微球中锂/钠的脱嵌机理相似,随着电压的变化,锂嵌入无序碳结构中形成顺磁中心,从而造成了电极可逆容量的下降.另外,Goometilleke等[54]在研究单壁和多壁碳纳米管嵌钠过程时,通过23Na NMR发现,两种碳纳米管分别具有不同的可逆钠循环位点,尽管两种材料相似的钠含量相近,但是多壁碳纳米管的嵌钠量只是单壁的一半,化学位移峰半高宽表明单纳米管嵌钠的环境更加有序.
|
图 10 700~3 000 ℃热处理温度下,碳微球在完全嵌锂到0 V状态下的7Li MAS NMR谱图(依据文献[51]) Fig. 10 7Li MAS NMR spectra of the MCMBs fully lithiated to 0 V with the heat-treated temperatures at 700~3 000 ℃ (Reproduced from Ref. [51]) |
随着对锂/钠离子电池碳负极材料电化学机理研究的深入,多孔碳材料也成为科学家们研究的对象之一.Hayes等[55]使用7Li MAS NMR分析多孔碳中锂在有序石墨结构中脱嵌和在非晶型基体中形成锂团簇时(图 11)发现,随着时间增长,锂团簇会降低,C峰强度逐渐减弱且向低频移动,B峰强度逐渐增强,其周围边带峰的强度也逐渐增强,这种锂化机制与硬碳材料类似.利用多孔碳的结构特点,能够研发更大容量的电极.Kwon等[56]制作了三维石墨烯微孔碳电极,其储锂量是石墨的7.9倍.分析脱嵌锂过程中7Li NMR峰强度,测定了微孔碳电量的可逆锂容量占59%,与石墨电极不同的是其7Li NMR峰在充放电过程中并没有产生较大位移,13C NMR实验证明了三维石墨烯微孔碳电极存在大量缺陷,这些缺陷在放电时产生负电荷,因此大量锂离子与碳结构因库仑力吸附在一起,并且由于碳材料孔径较窄,很难被电解液溶解,从而具有较大的储锂量.

|
图 11 电极的一系列时间相关性的7Li MAS NMR谱图(依据文献[55]) Fig. 11 A series of time-dependent 7Li MAS NMR spectra for electrodes (Reproduced from Ref. [55]) |
综上所述,通过对锂/钠离子电池碳负极材料的固体NMR研究,得到了碳负极材料在锂/钠脱嵌过程中的结构变化,以及锂/钠离子的迁移率、可逆量、反应动力学等信息,为理解以及掌握碳负极材料充放电机理提供了重要依据.固体NMR技术因其精确无损的特性正逐渐成为锂/钠离子电池反应过程研究的重要手段.在过去的三十多年里,通过高速旋转和变温NMR实验探究了碳负极样品的结构特性以及锂/钠嵌入位点;通过弛豫时间、二维谱、自旋回波等技术研究了碳负极反应过程和锂在不同区域间交换情况;通过原位固体NMR技术实现了真正意义上的充放电反应进程实时监测.将这些固体NMR技术结合在一起,丰富了锂/钠离子电池碳负极材料的充放电过程的测试手段,还原了不同种类碳负极材料所发生的脱嵌反应进程,通过NMR谱与其它结构表征方法结合来解释各种碳负极材料在电化学上的性能差异,对于碳负极材料的改性与发展起到了至关重要的作用.
| [1] | 杨勇. 固态电化学[M]. 北京: 化学工业出版社, 2017: 266-302. |
| [2] | CARLIER D, TRIER M, GREY C P, et al. Understanding the NMR shifts in paramagnetic transition metal oxides using density functional theory calculations[J]. Phys Rev B, 2003, 67(17): 174103. DOI: 10.1103/PhysRevB.67.174103. |
| [3] | GREY C P, DUPR N. NMR studies of cathode materials for lithium-ion rechargeable batteries[J]. Chem Rev, 2004, 104(10): 4493-4512. DOI: 10.1021/cr020734p. |
| [4] | KIM J, MIDDLEMISS D S, CHERNOVA N A, et al. Linking local environments and hyperfine shifts:A combined experimental and theoretical 31P and 7Li solid-state NMR study of paramagnetic Fe(Ⅲ) phosphates[J]. J Am Chem Soc, 2010, 132(47): 16825-16840. DOI: 10.1021/ja102678r. |
| [5] | KNIGHT W D. Nuclear magnetic resonance shift in metals[J]. Phys Rev, 1949, 76(8): 1259-1260. |
| [6] | CONARD J, ESTRADE H. Resonance magnétique nucléaire du lithium interstitiel dans le Graphite[J]. Materials Science and Engineering, 1977, 31: 173-176. DOI: 10.1016/0025-5416(77)90032-5. |
| [7] |
ZHANG Z R, YANG Y, LIU H S. Progress in solid-state NMR studies of electrode materials for lithium ion batteries[J].
Progress in Chemistry, 2003, 15(1): 18-24.
张忠如, 杨勇, 刘汉三. 锂离子电池电极材料固体核磁共振研究进展[J]. 化学进展, 2003, 15(1): 18-24. |
| [8] |
ZHONG G M, HOU X, CHEN S S, et al. Solid-state NMR study of electrode/electrolyte materials for lithium-ion batteries[J].
Chinese Science Bulletin, 2013, 58(32): 3287-3300.
钟贵明, 侯旭, 陈守顺, 等. 锂离子电池电极/电解质材料的固体核磁共振研究进展[J]. 科学通报, 2013, 58(32): 3287-3300. |
| [9] | HAYES S, VAN WULLEN L, ECKERT H, et al. Solid-state NMR strategies for the structural investigation of carbon-based anode materials[J]. Chem Mater, 1997, 9(4): 901-911. DOI: 10.1021/cm960389i. |
| [10] | MATSUMURA Y, WANG S, NAKAGAWA Y, et al. An electron-spin resonance study of lithium charged carbon electrodes[J]. Synthetic Met, 1997, 85(1): 1411-1412. |
| [11] | IMANISHI N, KUMAI K, KOKUGAN H, et al. 7Li-NMR study of carbon fiber and graphite anodes for lithium ion batteries[J]. Solid State Ionics, 1998, 107(1): 135-144. |
| [12] | SMART M, RATNAKUMAR B, SURAMPUDI S, et al. Irreversible capacities of graphite in low-temperature electrolytes for lithium-ion batteries[J]. J Electrochem Soc, 1999, 146(11): 3963-3969. DOI: 10.1149/1.1392577. |
| [13] | ZAGHIB K, TATSUMI K, SAWADA Y, et al. 7Li-NMR of well-graphitized vapor-grown carbon fibers and natural graphite negative electrodes of rechargeable lithium-ion batteries[J]. J Electrochem Soc, 1999, 146(8): 2784-2793. DOI: 10.1149/1.1392009. |
| [14] | KIM Y O, PARK S M. Intercalation mechanism of lithium ions into graphite layers studied by nuclear magnetic resonance and impedance experiments[J]. J Electrochem Soc, 2001, 148(3): A194-A199. DOI: 10.1149/1.1345870. |
| [15] | WANG Y, YUFIT V, GUO X, et al. 7Li nuclear magnetic resonance study of lithium insertion in pristine and partially oxidized graphite[J]. J Power Sources, 2001, 94(2): 230-237. DOI: 10.1016/S0378-7753(00)00591-7. |
| [16] | LETELLIER M, CHEVALLIER F, B GUIN F. In situ 7Li NMR during lithium electrochemical insertion into graphite and a carbon/carbon composite[J]. J Phys Chem Solids, 2006, 67(5): 1228-1232. |
| [17] | LETELLIER M, CHEVALLIER F, MORCRETTE M. In situ 7Li nuclear magnetic resonance observation of the electrochemical intercalation of lithium in graphite; 1st cycle[J]. Carbon, 2007, 45(5): 1025-1034. DOI: 10.1016/j.carbon.2006.12.018. |
| [18] | LEIFER N, GREENSTEIN M F, MOR A, et al. NMR-detected dynamics of sodium co-intercalation with diglyme solvent molecules in graphite anodes linked to prolonged cycling[J]. J Phys Chem C, 2018, 122(37): 21172-21184. DOI: 10.1021/acs.jpcc.8b06089. |
| [19] | YOSHIO M, WANG H, FUKUDA K, et al. Effect of carbon coating on electrochemical performance of treated natural graphite as lithium-ion battery anode material[J]. J Electrochem Soc, 2000, 147(4): 1245-1250. DOI: 10.1149/1.1393344. |
| [20] | LANGER T, DUPKE S, DIPPEL C, et al. LiBC-synthesis, electrochemical and solid-state NMR investigations[J]. Z Naturforsch B, 2012, 67(11): 1212-1220. DOI: 10.5560/znb.2012-0223. |
| [21] | XING T, RAMIREDDY T, LI L H, et al. Lithium storage in disordered graphitic materials:a semi-quantitative study of the relationship between structure disordering and capacity[J]. Phys Chem Chem Phys, 2015, 17(7): 5084-5089. DOI: 10.1039/C4CP05589F. |
| [22] | JUNG H, KIM K S, PARK S E, et al. The structural and electrochemical study on the blended anode with graphite and silicon carbon nano composite in Li ion battery[J]. Electrochim Acta, 2017, 245: 791-795. DOI: 10.1016/j.electacta.2017.05.187. |
| [23] | PRAMUDITA J C, RAWAL A, CHOUCAIR M, et al. Mechanisms of sodium insertion/extraction on the surface of defective graphenes[J]. ACS Appl Mater Inter, 2017, 9(1): 431-438. DOI: 10.1021/acsami.6b13104. |
| [24] | HARRIS K J, REEVE Z E M, WANG D N, et al. Electrochemical changes in lithium-battery electrodes studied using 7Li NMR and enhanced 13C NMR of graphene and graphitic carbons[J]. Chem Mater, 2015, 27(9): 3299-3305. DOI: 10.1021/acs.chemmater.5b00323. |
| [25] |
WU Y P, FANG S B, JIANG Y Y. Reversible high storage mechanism of lithium in carbon materials[J].
Chemistry, 1998, 4: 15-19.
吴宇平, 方世璧, 江英彦. 锂在炭材料中的可逆高储存机理[J]. 化学通报, 1998, 4: 15-19. |
| [26] |
XIANG H Q, FANG S B, JIANG Y Y. Insertion mechanism of lithium in low temperature pyrolyticcarbon materials[J].
Chinese Science Bulletin, 1999, 44(3): 235-242.
相红旗, 方世璧, 江英彦. 锂在低温热解碳材料中的插入机理[J]. 科学通报, 1999, 44(3): 235-242. |
| [27] | NAKAGAVVA Y, WANG S, MATSUMURA Y, et al. 7Li-NMR study of lithium charged in carbon electrode[J]. Synthetic Met, 1997, 85(1): 1363-1364. |
| [28] | TATSUMI K, KAWAMURA T, HIGUCHI S, et al. Anode characteristics of non-graphitizable carbon fibers for rechargeable lithium-ion batteries[J]. J Power Sources, 1997, 68(2): 263-266. DOI: 10.1016/S0378-7753(96)02560-8. |
| [29] | DAI Y F, WANG Y, GREENBAUM S G, et al. Lithium-7 nuclear magnetic resonance investigation of lithium insertion in hard carbon[J]. J Electrochem Soc, 1998, 145(4): 1179-1183. DOI: 10.1149/1.1838435. |
| [30] | MORI Y, IRIYAMA T, HASHIMOTO T, et al. Lithium doping/undoping in disordered coke carbons[J]. J Power Sources, 1995, 56(2): 205-208. DOI: 10.1016/0378-7753(95)80036-G. |
| [31] | YAMAZAKI S, HASHIMOTO T, IRIYAMA T, et al. Study of the states of Li doped in carbons as an anode of LiB by 7Li NMR spectroscopy[J]. J Mol Struct, 1998, 441(2): 165-171. |
| [32] | JUNG Y, SUH M C, LEE H, et al. Electrochemical insertion of lithium into polyacrylonitrile-based disordered carbons[J]. J Electrochem Soc, 1997, 144(12): 4279-4284. DOI: 10.1149/1.1838178. |
| [33] | JUNG Y, SUH M C, SHIM S C, et al. Lithium insertion into disordered carbons prepared from organic polymers[J]. J Electrochem Soc, 1998, 145(9): 3123-3129. DOI: 10.1149/1.1838774. |
| [34] | GAUTIER S, LEROUX F, FRACKOWIAK E, et al. Influence of the pyrolysis conditions on the nature of lithium inserted in hard carbons[J]. J Phys Chem A, 2001, 105(24): 5794-5800. DOI: 10.1021/jp000892p. |
| [35] | GUERIN K, FEVRIER-BOUVIER A, FLANDROIS S, et al. A 7Li NMR study of a hard carbon as a function of temperature and lithiation state[J]. Mol Cryst Liq Cryst, 2000, 340(1): 467-472. DOI: 10.1080/10587250008025510. |
| [36] | GUERIN K, MENETRIER M, FEVRIER-BOUVIER A, et al. A 7Li NMR study of a hard carbon for lithium-ion rechargeable batteries[J]. Solid State Ionics, 2000, 127(3/4): 187-198. |
| [37] | TATSUMI K, CONARD J, NAKAHARA M, et al. 7Li NMR studies on a lithiated non-graphitizable carbon fibre at low temperatures[J]. Chem Commun, 1997, 7: 687-688. |
| [38] | TATSUMI K, CONARD J, NAKAHARA M, et al. Low temperature 7Li-NMR investigations on lithium inserted into carbon anodes for rechargeable lithium-ion cells[J]. J Power Sources, 1999, 81-82: 397-400. DOI: 10.1016/S0378-7753(99)00114-7. |
| [39] | SAITO Y, KATAOKA H, NAKAI K, et al. Determination of diffusion rate and accommodation state of Li in mesophase carbon for anode materials by NMR spectroscopy[J]. J Phys Chem B, 2004, 108(13): 4008-4012. DOI: 10.1021/jp0365561. |
| [40] | LETELLIER M, CHEVALLIER F, CLINARD C, et al. The first in situ 7Li nuclear magnetic resonance study of lithium insertion in hard-carbon anode materials for Li-ion batteries[J]. J Chem Phys, 2003, 118(13): 6038-6045. DOI: 10.1063/1.1556092. |
| [41] | GERALD R E, SANCHEZ J, JOHNSON C S, et al. In situ nuclear magnetic resonance investigations of lithium ions in carbon electrode materials using a novel detector[J]. Journal of Physics:Condensed Matter, 2001, 13(36): 8269-8285. DOI: 10.1088/0953-8984/13/36/304. |
| [42] | SHELLIKERI A, HUNG I, GAN Z H, et al. In situ NMR tracks real-time Li ion movement in hybrid supercapacitor-battery device[J]. J Phys Chem C, 2016, 120(12): 6314-6323. DOI: 10.1021/acs.jpcc.5b11912. |
| [43] | GOTOH K, ISHIKAWA T, SHIMADZU S, et al. NMR study for electrochemically inserted Na in hard carbon electrode of sodium ion battery[J]. J Power Sources, 2013, 225: 137-140. DOI: 10.1016/j.jpowsour.2012.10.025. |
| [44] | MORITA R, GOTOH K, FUKUNISHI M, et al. Combination of solid state NMR and DFT calculation to elucidate the state of sodium in hard carbon electrodes[J]. J Mater Chem A, 2016, 4(34): 13183-13193. DOI: 10.1039/C6TA04273B. |
| [45] | STRATFORD J M, ALLAN P K, PECHER O, et al. Mechanistic insights into sodium storage in hard carbon anodes using local structure probes[J]. Chem Commun, 2016, 52(84): 12430-12433. DOI: 10.1039/C6CC06990H. |
| [46] | QIU S, XIAO L F, SUSHKO M L, et al. Manipulating adsorption-insertion mechanisms in nanostructured carbon materials for high-efficiency sodium ion storage[J]. Adv Energy Mater, 2017, 7(17): 1700403. DOI: 10.1002/aenm.201700403. |
| [47] | FUJIMOTO H, MABUCHI A, TOKUMITSU K, et al. 7Li nuclear magnetic resonance studies of hard carbon and graphite/hard carbon hybrid anode for Li ion battery[J]. J Power Sources, 2011, 196(3): 1365-1370. DOI: 10.1016/j.jpowsour.2010.09.026. |
| [48] | GOTOH K, IZUKA M, ARAI J, et al. In situ 7Li nuclear magnetic resonance study of the relaxation effect in practical lithium ion batteries[J]. Carbon, 2014, 79: 380-387. DOI: 10.1016/j.carbon.2014.07.080. |
| [49] | ARAI J, OKADA Y, SUGIYAMA T, et al. In situ solid state 7Li NMR observations of lithium metal deposition during overcharge in lithium ion batteries[J]. J Electrochem Soc, 2015, 162(6): A952-A958. DOI: 10.1149/2.0411506jes. |
| [50] | SU X, DOGAN F, ILAVSKY J, et al. Mechanisms for lithium nucleation and dendrite growth in selected carbon allotropes[J]. Chem Mater, 2017, 29(15): 6205-6213. DOI: 10.1021/acs.chemmater.7b00072. |
| [51] | TATSUMI K, AKAI T, IMAMURA T, et al. 7Li-nuclear magnetic resonance observation of lithium insertion into mesocarbon microbeads[J]. J Electrochem Soc, 1996, 143(6): 1923-1930. DOI: 10.1149/1.1836926. |
| [52] | ZHOU D H, PEER M, YANG Z Z, et al. Long cycle life microporous spherical carbon anodes for sodium-ion batteries derived from furfuryl alcohol[J]. J Mater Chem A, 2016, 4(17): 6271-6275. DOI: 10.1039/C6TA00242K. |
| [53] | ALCNTARA R, ORTIZ G F, LAVELA P, et al. EPR, NMR, and electrochemical studies of surface-modified carbon microbeads[J]. Chem Mater, 2006, 18(9): 2293-2301. DOI: 10.1021/cm060060p. |
| [54] | GOONETILLEKE D, PRAMUDITA J C, CHOUCAIR M, et al. Sodium insertion/extraction from single-walled and multi-walled carbon nanotubes:The differences and similarities[J]. J Power Sources, 2016, 314: 102-108. DOI: 10.1016/j.jpowsour.2016.03.014. |
| [55] | HAYES S E, GUIDOTTI R A, EVEN W R, et al. 7Li solid-state nuclear magnetic resonance as a probe of lithium species in microporous carbon anodes[J]. J Phys Chem A, 2003, 107(19): 3866-3876. DOI: 10.1021/jp021772f. |
| [56] | KWON Y, KIM K, PARK H, et al. Anomalously high lithium storage in three-dimensional graphene-like ordered microporous carbon electrodes[J]. J Phys Chem C, 2018, 122(9): 4955-4962. DOI: 10.1021/acs.jpcc.8b00081. |
 2020, Vol. 37
2020, Vol. 37 
