发展有效的制氢技术对确立氢作为未来主要能源的地位至关重要.甲醇由于具有易于转化、储存和处理,以及价格低廉等优点,而成为目前最有前景的储氢能源分子之一.因此基于甲醇重整反应的制氢工艺得到了越来越多研究者的关注.另外,研究甲醇重整反应也有助于了解清洁燃料转化、环境治理、有机物降解[1-5].目前研究较多的甲醇制氢工艺是水蒸气重整法[6, 7],但也有研究者提出甲醇液相转化是设计制氢新工艺的一个有效方案.与常用的甲醇蒸汽重整反应相比,甲醇液相重整反应的优点包括反应装置更加紧凑、简单,因此对液相甲醇重整反应的机理研究十分重要[8, 9].目前,很多甲醇液相重整反应的研究是在相对较高的压力(约10 MPa)和温度(500 K以上)下进行的[8],近来部分研究发现利用光催化来进行甲醇液相重整反应是一种更为节能简单的方法,加入甲醇作为牺牲剂的光催化产氢反应已被广泛关注.有研究发现,牺牲剂甲醇的加入可以极大地提高光催化产氢反应的效率,然而较低的光子利用效率和较高的光生电子空穴复合速率仍在很大程度上限制了光催化性能,与其相关的催化反应机理也尚不明确,进而限制了光催化产氢和甲醇光催化重整反应的发展和应用.
在光催化甲醇重整反应中,会生成一系列气态和液态产物,但是其中的一些产物由于存在时间很短或者不稳定,很难用普通技术进行分离、捕捉和研究[10].近年来研究者使用了一些新的技术来研究甲醇重整过程,比如程序升温脱附法(TPD)、时间分辨双光子光电子能谱(2PPE)、扫描隧道显微镜(STM)、红外光谱(IR)和密度泛函理论(DFT)计算[11-20]等.通过使用这些新的研究手段可以直接或者间接地观测到催化剂表面的活性结构或者反应物的吸附结构及种类,从原子分子层面得到反应物以及生成物的结构和催化剂的表面形态,从而能够从某些方面将催化剂和反应物联系起来.但值得注意的是,其中一些技术或仅能分析反应产物,或须在超真空环境或者具有较低反应分子浓度的固气界面观测反应,以研究相应的反应机理[21-24].这类探测技术灵敏高,但并不适合有大量溶剂存在的复杂固液反应体系的观测.然而,研究真实固液反应条件下的甲醇重整机理才具有更加重要的意义.原位核磁共振(Operando NMR)技术能与高灵敏度的探测技术形成互补,对存在大量溶剂的复杂固液反应过程进行实时检测,获得真实复杂反应环境下的甲醇重整机理.
反应环境会显著影响催化反应的反应效率.它不仅可能引起催化剂表面结构的变化,而且会造成产物产率和反应选择性的变化.例如Takahashi课题组[25]认为温度和压强会影响催化剂表面铜的负载形态,影响反应选择性;而Moghaddas课题组[26]对铜基催化剂进行了研究,发现反应温度、反应流速和压强对产物的产率和选择性产生了较大的影响,增加温度或者压强会提高甲醇重整反应中CO的反应选择性生成,而流速则对反应没有明显影响;负载型VIII族金属催化剂在低温甲醇重整时表现出较高的活性,而不同反应环境下甲醇的副反应(甲醇分解所产生的CO会引起催化剂失活,不利于反应进行)发生程度不同,最终甲醇重整反应的效率也不同[27].由此可见,反应环境对甲醇光催化重整反应效率起到重要作用.然而,据我们所知,在真实固液反应环境下系统性地研究反应环境条件对甲醇光催化重整反应过程影响的研究还比较缺乏.
本文使用原位NMR技术系统研究了反应环境(气氛、压强、气体量等)对甲醇光催化重整反应产物的影响.我们首先分析了以锐钛矿型TiO2作为催化剂的甲醇光催化重整产物;然后探究了气氛、环境压强和通入气体量对甲醇光催化重整反应的产物的影响,以及气体在催化剂表面的吸附方式;最后基于上述结果,对锐钛矿型TiO2颗粒表面甲醇光催化重整反应的机理进行了深入讨论.
1 实验部分 1.1 实验药品锐钛矿型TiO2、含有0.05 wt. %四甲基硅烷(TMS)的氘水(99.9 atom % D,)、甲醇(≥99.9%)均购买于Sigma-Aldrich Co..
1.2 仪器与参数粉末X射线衍射(XRD)实验在Rigaku Ultima IV型衍射仪上完成.测试时按10°/min的速度从5°扫描至50°.粉末样品通过研磨方式制备,所有XRD实验均在室温下进行.
高分辨透射电子显微成像(TEM)实验在JEM 2100 VP场发射电镜上进行,加速电压为200.0 kV.
本文所用的原位液体NMR检测和光催化反应装置如图 1所示.将一个内径为5 mm的螺旋口NMR样品管(最高可承受压强为0.5 MPa)改造成微型反应器,在微型反应器中加入1 mg锐钛矿型TiO2催化剂粉末,并用微量进样器加入500 μL D2O和20 μL甲醇后,超声5 min,并上下摇晃使其混合均匀.下文中所有样品都按此配制比例进行制备.利用打气装置通过特制的样品管帽向反应器内通入实验所需气体(出口流量为10 m3/h,打气时间为5 s,按照均匀流速估算,一次通入反应器内的气量约为0.58 mol),从而对固液气混合体进行原位核磁共振研究.光催化反应所用光源为300 W氙灯(全波段光照),光束直接照射微型反应器中的反应体系表面.1H和13C NMR实验在配备安捷伦HXY三通道静态探头的700 MHz Varian NMR谱仪上完成,磁场强度为16.4 T,1H核工作频率为700.13 MHz,线圈是5 mm,实验温度为273 K.1H和13C NMR的谱宽(SW)分别为20 ppm和253 ppm,脉冲宽度分别为4 μs(45°)和7.3 μs(45°),循环等待时间分别为5 s和2 s,采样次数均为32.1H和13C NMR谱图均以TMS为内标,对产物谱峰进行积分和定量分析.

|
图 1 原位液体NMR检测和光催化反应装置示意图 Fig. 1 Schematic diagram of operando liquid NMR detection and photocatalytic reaction unit |
通过图 1所示的装置,我们可以在不分离产物的情况下对甲醇光催化重整反应过程进行在线观测[28],并且探究反应环境(例如通入不同气体,控制气体压强等)对甲醇光催化重整反应的影响.
2.1 使用锐钛矿型TiO2催化剂时甲醇光催化重整反应产物分析由XRD谱图[图 2(a)]可以判断本文使用的TiO2催化剂的晶型为锐钛矿晶型.由TEM图像[图 2(b)]可知,它的尺寸在纳米尺度,约为20 nm.

|
图 2 本文使用的锐钛矿型TiO2催化剂的(a) XRD谱图和(b) TEM电镜照片 Fig. 2 (a) XRD pattern and (b) TEM image of anatase-TiO2 used in this research |
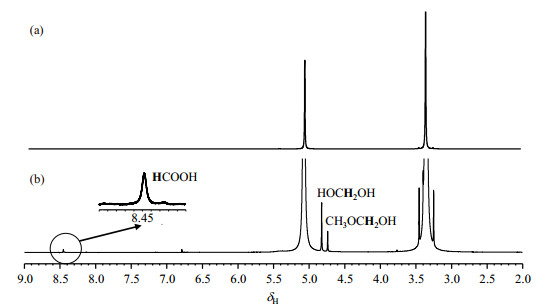
我们首先对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应产物进行了初步研究.为了了解在没有通入气体条件下体系的催化反应过程,这里的样品中并没有打入气体.图 3为光照前后光催化体系的1H NMR谱图.图 3(a)显示,在未经过光照时,上述催化体系中只存在CH3OH和HDO的信号;而对该催化体系光照4 h后[如图 3(b)所示],生成了三种主要液态产物,分别位于δH 8.45、4.83和4.74,分别代表三组质子:δH 8.45的单峰信号归属为HCOOH;而在δH 4.83和4.74处的单峰信号分别归属为HOCH2OH和CH3OCH2OH[29].
|
图 3 使用锐钛矿型TiO2催化剂时甲醇光催化重整反应体系(a)光照前和(b)光照4 h后的1H NMR谱图 Fig. 3 1H NMR spectra of the photocatalytic methanol reforming reaction system (a) before irradiation, and (b) after 4 h irradiation using anatase-TiO2 catalyst |
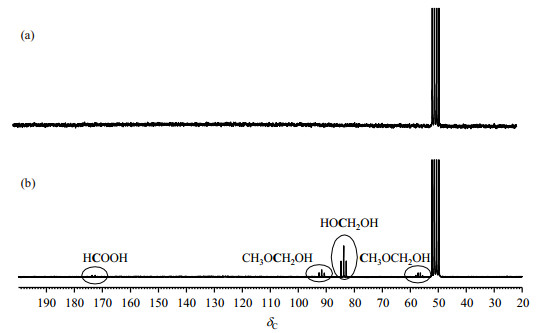
我们对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应体系的含碳产物也进行了检测.但由于产物生成量较低,为提高13C NMR谱图的分辨率,我们使用13CH3OH代替CH3OH进行实验,结果(图 4)也显示生成了对应HCOOH、HOCH2OH和CH3OCH2OH的液态产物信号,但在本文实验条件下,没有观测到甲醇重整反应的气态产物CO或CO2的信号.这可能是因为我们所使用的催化剂对于液态产物的选择性较高,而对气体产物选择性较低.后文对反应过程的分析均基于HCOOH、HOCH2OH和CH3OCH2OH来进行.
|
图 4 使用锐钛矿型TiO2催化剂时甲醇光催化重整反应体系(a)光照前和(b)光照4 h后的13C NMR谱图 Fig. 4 13C NMR spectra of the photocatalytic methanol reforming reaction system (a) before irradiation, and (b) after 4 h irradiation using anatase-TiO2 catalyst |
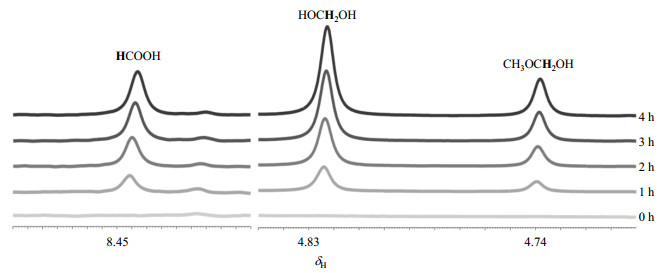
为进一步证实甲醇重整反应确实是由锐钛矿型TiO2上的光吸收驱动催化的,我们采集了上述光催化反应体系随光照时间变化的定量1H NMR谱图(图 5).从图 5我们可以看出,HCOOH、HOCH2OH和CH3OCH2OH三种主要产物的信号随着光照时间的增加而增强,由此可见,甲醇重整反应的三种产物是由光吸收驱动的.
|
图 5 使用锐钛矿型TiO2时,甲醇光催化重整反应体系随光照时间变化的1H NMR谱图(左图放大8倍,右图放大2倍) Fig. 5 1H NMR spectra of the photocatalytic methanol reforming reaction system variation with the irradiation time using anatase-TiO2 catalyst (the left partial spectra were enlarged by 8 times, and the right partial spectra were enlarged by 2 times) |
我们进一步研究了对反应环境对锐钛矿型TiO2催化剂时甲醇光催化重整反应产物的影响,包括反应环境气氛、反应压强以及气体量等方面.
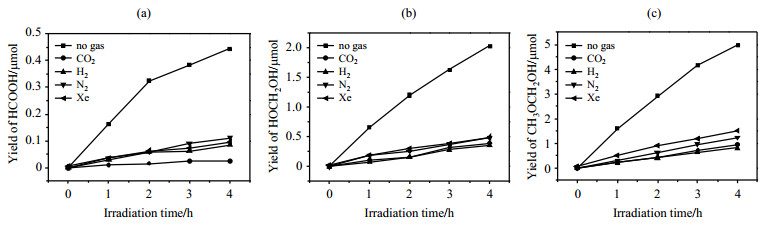
我们通过向改造过的样品管中通入不同气体(包括CO2、H2、N2和Xe四种气体)以研究反应气氛对光催化甲醇重整反应的影响[29],在保持气体压强为0.3 MPa的情况下向样品管中通入3次气体,然后进行光照.图 6为通入不同气体前后甲醇光催化重整反应的3种液体产物产量随光照时间的变化,从图 6可以看出,反应气氛的变化,即气体的通入显著抑制了3种液体产物的产量,其都下降至不加入气体时的1/5左右.有文献[30, 31]报道:锐钛矿晶型TiO2表面由于晶型结构存在一类Ti5c位点,这类位点被认为是光催化反应发生的位点;此外,除了甲醇会吸附在锐钛矿型TiO2表面反应活性位点Ti5c上外,一些气体也会吸附在这些活性位点上.通入的气体与体系中存在的甲醇形成了竞争吸附关系,气体占据了TiO2表面部分反应活性位点,进而抑制了甲醇光催化重整反应产物的产生.从图 6还可以发现,不同气氛对产物的抑制程度不同.对于HOCH2OH和CH3OCH2OH这两种产物,抑制程度的大小顺序为Xe < N2 < CO2 < H2.这种抑制程度的区别与气体性质有一定关联:通入的气体惰性越大,产物被抑制的程度越小[28].因此,对于气体通入会抑制甲醇光催化重整反应产物的产量这一现象,我们推测可能是由于气体进入到反应体系中并在锐钛矿型TiO2催化剂表面发生吸附,从而使得催化剂表面被气体占据或者部分覆盖,进而抑制了甲醇分子在催化剂表面进行反应.而对于产物HCOOH,CO2的通入对其抑制程度最大.为了排除体系pH值变化对实验结果的影响,我们对实验前后体系的pH进行了测量.通过测量发现打气前后和光照前后,体系pH并没有发生变化,从而排除了体系pH变化影响甲醇光催化重整反应产物的可能性.有研究[32]表明,CO2是甲醇重整反应的最终产物,在Pt-Ru/TiO2催化体系的反应中通过HCOOH脱氢反应生成.本研究中,CO2对产物HCOOH抑制程度最大,我们推测是由于CO2的加入导致反应逆向进行,从而抑制了HCOOH产量.
|
图 6 通入不同气体时,使用锐钛矿型TiO2催化剂的甲醇光催化重整反应的3种产物的产量随光照时间的变化. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH Fig. 6 Changes of yields of the three photocatalytic methanol reforming products with irradiation time using anatase-TiO2 catalyst under different gas environments. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH |
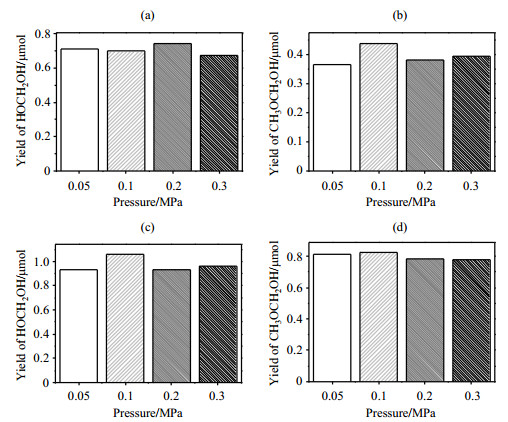
我们进一步利用向微型反应器内通入不同压强的气体探究了反应压强对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应产物的影响,每个样品通入气体的次数为3次.结合前文,并考虑到空气中CO2和N2相比其他气体存在较多,我们选择了CO2和N2进行实验.在打气操作中,我们分别控制打入的气体压强为0.05、0.1、0.2和0.3 MPa.由于HCOOH产量会受到CO2气体性质的影响,因此这里只就反应压强对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应的两种产物HOCH2OH和CH3OCH2OH的影响进行讨论.由图 7可以看出,通入不同压强的CO2和N2后,HOCH2OH和CH3OCH2OH两种产物的最终产量均呈微小波动状态,但没有显著差异.因此,我们可以得出反应压强对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应产物的产量影响较小.
|
图 7 通入不同压强的CO2和N2,光照4 h后,使用锐钛矿型TiO2催化剂时甲醇光催化重整反应的2种产物的产量. (a)和(b)通入不同压强的CO2;(c)和(d)通入不同压强的N2 Fig. 7 Yields of the two photocatalytic methanol reforming products after 4 h irradiation using anatase-TiO2 catalyst under different gas environments with different pressures. (a) and (b): Under CO2; (c) and (d): Under N2 |
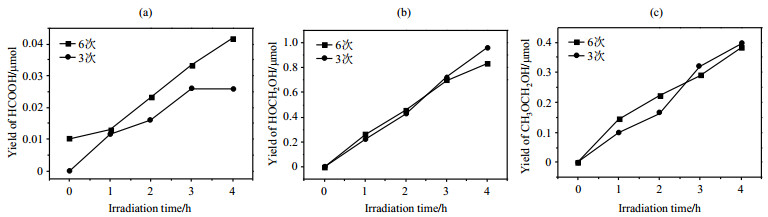
前文已经证明进入溶液的气体分子能够不同程度的占据TiO2催化剂表面,并且吸附在活性位点上.由此我们推测通入的气体量可能也会对使用锐钛矿型TiO2催化剂的甲醇光催化重整反应造成影响,因此我们通过控制打气次数的不同(3次和6次)来控制进入到反应环境中的气体量,以探究反应气体量对使用锐钛矿型TiO2催化剂时甲醇光催化重整反应的影响.为了避免通入的气体与体系内其他分子进行反应,我们选择氮气作为通入气体,气体压强为0.3 MPa,通入3次.通过对NMR谱图中的信号进行积分,我们可以获得不同条件下各产物产量随光照时间变化的趋势(图 8).由图 8可知,3次和6次通气量对于甲醇重整产物HOCH2OH和CH3OCH2OH的产量并没有太大影响,由此我们推测在本文实验条件下,气体是饱和吸附的.另外,我们想指出的是:图 8(a)中6次通气后HCOOH产量要略微高于3次.不过,由于NMR谱图中HCOOH信号非常低,上述现象也有可能是由于实验误差所造成.HCOOH的生成涉及复杂的多步反应,限于篇幅本文不对HCOOH作过多讨论.
|
图 8 通入不同量的气体时,使用锐钛矿型TiO2催化剂的甲醇光催化重整反应的3种产物的产量随光照时间的变化. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH Fig. 8 Changes of yields of the three photocatalytic methanol reforming products with irradiation time using anatase-TiO2 catalyst under gas with different concentration. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH |
我们进一步对气体在锐钛矿型TiO2催化剂表面的吸附方式(化学吸附或物理吸附)进行了探究.第一组实验未通入N2,也未进行超声处理,进行光照;第二组实验通入N2后进行光照,但未进行超声处理;第三组加入N2并进行超声处理后,再光照.如图 9所示,经过超声处理的催化体系的三种产物的产量都大于未超声处理催化体系.由此我们推断,超声处理可以使得与锐钛矿型TiO2催化剂表面发生物理吸附的气体解吸附,而增加甲醇分子在催化剂表面的吸附位点,使得更多的甲醇可以在未被气体占据的锐钛矿型TiO2的表面反应.然而,超声处理并不能完全抵消这种抑制作用,这说明气体在催化剂表面除了物理吸附,还存在化学吸附.因此,在甲醇光催化重整过程中,气体和甲醇在TiO2催化剂表面的吸附呈竞争关系,说明了反应环境对于甲醇重整反应起非常重要的作用.

|
图 9 气体吸附方式探究实验中,使用锐钛矿型TiO2催化剂的甲醇光催化重整反应的3种产物的产量随光照时间的变化. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH Fig. 9 Changes of yields of the three photocatalytic methanol reforming products with irradiation time using anatase-TiO2 catalyst in the exploration experiments of gas absorption method. (a) HCOOH; (b) HOCH2OH; (c) CH3OCH2OH |
由上述结果,我们初步推测了环境气氛影响甲醇光催化重整反应过程的机理.如图 10所示,没有加入气体前,甲醇分子会吸附在锐钛矿型TiO2催化剂表面发生光催化反应,并生成HCOOH、HOCH2OH和CH3OCH2OH三种主要产物;而在向反应体系中加入气体后,由于气体会在催化剂表面同时发生物理与化学吸附,进而占据掉大部分甲醇分子的吸附位点,最终造成甲醇光催化重整产物的生成被抑制.

|
图 10 气体对甲醇光催化重整反应的影响机理 Fig. 10 The influence mechanism of gas on photocatalytic methanol reforming reaction |
本文通过原位NMR技术对使用锐钛矿型TiO2时甲醇光催化重整反应产物进行了研究.探讨了反应气氛、压强和通入气体量对于甲醇重整反应产物的影响.结果发现在本文实验条件下,使用锐钛矿型TiO2时甲醇光催化重整反应的产物仅有三种,分别是CH3OCH2OH、HOCH2OH和HCOOH;反应气氛会抑制甲醇光催化重整反应产物的生成,且抑制程度与气氛气体种类有关,说明气体的通入会与甲醇分子发生竞争吸附,进而抑制甲醇重整产物;超声处理实验结果表明,通入气体在TiO2颗粒表面同时存在化学与物理吸附过程;环境压强和通入气体量对甲醇光催化重整反应的产物无明显影响.
| [1] | CHIN Y H, DAGLE R, HU J, et al. Steam reforming of methanol over highly active Pd-ZnO catalyst[J]. Catal Today, 2002, 77(1): 79-88. |
| [2] | RAFAEL E RODRÍGUEZ-LUGO, MÓNICA TRINCADO, VOGT M, et al. A homogeneous transition metal complex for clean hydrogen production from methanol-water mixtures[J]. Nat Chem, 2013, 5(4): 342-347. DOI: 10.1038/nchem.1595. |
| [3] | SHEN M, HENDERSON M A. Identification of the active species in photochemical hole scavenging reactions of methanol on TiO2[J]. J Phys Chem Lett, 2011, 2(21): 2707-2710. DOI: 10.1021/jz201242k. |
| [4] | CHIARELLO G L, FERRI D, SELLI E. In situ attenuated total reflection infrared spectroscopy study of the photocatalytic steam reforming of methanol on Pt/TiO2[J]. Appl Surf Sci, 2018, 450: 146-154. DOI: 10.1016/j.apsusc.2018.04.167. |
| [5] | SHEN Y B, ZHAN Y L, LI S P, et al. Methanol-water aqueous phase reforming by the assistant of dehydrogenases at near-room temperature[J]. Chemsuschem, 2018, 11(5): 864-871. DOI: 10.1002/cssc.201702359. |
| [6] | LWIN Y, DAUD W R W, MOHAMAD A B, et al. Hydrogen production from steam-methanol reforming:thermodynamic analysis[J]. Int J Hydrogen Energ, 2000, 25(1): 47-53. DOI: 10.1016/S0360-3199(99)00013-0. |
| [7] | RAMESHAN C, WEILACH C, STADLMAYR W, et al. Steam reforming of methanol on PdZn near-surface alloys on Pd(111) and Pd foil studied by in-situ XPS, LEIS and PM-IRAS[J]. J Catal, 2010, 276(1): 101-113. |
| [8] | MIYAO T, YAMAUCHI M, NAITO S. Liquid phase methanol reforming with water over silica supported Pt-Ru catalysts[J]. Catal Today, 2003, 87(1-4): 227-235. DOI: 10.1016/j.cattod.2003.10.003. |
| [9] | MIYAO T, WATANABE Y, TERAMOTO M, et al. Catalytic activity of various supported Ir-Re catalysts for liquid phase methanol reforming with water[J]. Catal Commun, 2005, 6(2): 113-117. DOI: 10.1016/j.catcom.2004.11.007. |
| [10] | WANG X L, LIU W, YU Y Y, et al. Operando NMR spectroscopic analysis of proton transfer in heterogeneous photocatalytic reactions[J]. Nat Commun, 2016, 7: 11918. DOI: 10.1038/ncomms11918. |
| [11] | LIU J, LIU Y, LIU N Y, et al. ChemInform abstract:Metal-free efficient photocatalyst for stable visible water splitting via a two-electron pathway[J]. ChemInform, 2015, 46(23): 970-974. |
| [12] | HEYDUK A F, NOCERA D G. Hydrogen produced from hydrohalic acid solutions by a two-electron mixed-valence photocatalyst[J]. Science, 2001, 293(5535): 1639-1641. DOI: 10.1126/science.1062965. |
| [13] | CHEN T, FENG Z C, WU G P, et al. Mechanistic studies of photocatalytic reaction of methanol for hydrogen production on Pt/TiO2 by in situ Fourier transform IR and time-resolved IR spectroscopy[J]. J Phys Chem C, 2007, 111(22): 8005-8014. DOI: 10.1021/jp071022b. |
| [14] | ZHANG Z R, BONDARCHUK O, WHITE J M, et al. Imaging adsorbate O-H bond cleavage:Methanol on TiO2 (110)[J]. J Am Chem Soc, 2006, 128(13): 4198-4199. DOI: 10.1021/ja058466a. |
| [15] | SCHEIBER P, RISS A, SCHMID M, et al. Observation and destruction of an elusive adsorbate with STM:O2/TiO2 (110)[J]. Phys Rev Lett, 2010, 105(21): 5332-5337. |
| [16] | CHEN X B, SHEN S H, GUO L J, et al. Semiconductor-based photocatalytic hydrogen generation[J]. Chem Rev., 2010, 110(11): 6503-6570. DOI: 10.1021/cr1001645. |
| [17] | SETVIN M, SHI X, HULVA J, et al. Methanol on anatase TiO2(101):Mechanistic insights into photocatalysis[J]. ACS Catal, 2017, 7(10): 7081-7091. DOI: 10.1021/acscatal.7b02003. |
| [18] | LIU W J, WANG J G, GUO X J, et al. Dissociation of methanol on hydroxylated TiO2-B (100) surface:Insights from first principle DFT calculation[J]. Catal Today, 2011, 165(1): 32-40. DOI: 10.1016/j.cattod.2011.01.016. |
| [19] | MAJRIK K, ÁRPÁD TURCSÁNYI, PÁSZTI Z, et al. Graphite oxide-TiO2 nanocomposite type photocatalyst for methanol photocatalytic reforming reaction[J]. Top Catal, 2018, 61(12, 13): 1323-1334. |
| [20] | WANG S S, GU X K, SU H Y, et al. First-principles and microkinetic simulation studies of the structure sensitivity of Cu catalyst for methanol steam reforming[J]. J Phys Chem C, 2018, 122(20): 10811-10819. DOI: 10.1021/acs.jpcc.8b00085. |
| [21] | YANG W S, GENG Z H, GUO Q, et al. Effect of multilayer methanol and water in methanol photochemistry on TiO2[J]. J Phys Chem C, 2017, 121(32): 17244-17250. DOI: 10.1021/acs.jpcc.7b04224. |
| [22] | XU C B, YANG W S, REN Z F, et al. Strong photon energy dependence of the photocatalytic dissociation rate of methanol on TiO2(110)[J]. J Am Chem Soc, 2013, 135(50): 19039-19045. DOI: 10.1021/ja4114598. |
| [23] | ZHOU C Y, REN Z F, TAN S J, et al. Site-specific photocatalytic splitting of methanol on TiO2(110)[J]. Chem Sci, 2010, 1(5): 575-580. DOI: 10.1039/c0sc00316f. |
| [24] | YUAN Q, WU Z F, JIN Y K, et al. Photocatalytic cross-coupling of methanol and formaldehyde on a rutile TiO2(110) surface[J]. J Am Chem Soc, 2013, 135(13): 5212-5219. DOI: 10.1021/ja400978r. |
| [25] | TAKEZAWA N, KOBAYASHI H, HIROSE A, et al. Steam reforming of methanol on copper-silica catalysts; effect of copper loading and calcination temperature on the reaction[J]. Appl Catal, 1982, 4(2): 127-134. DOI: 10.1016/0166-9834(82)80243-1. |
| [26] | AMIRI T Y, MOGHADDAS J. Reaction parameters influence on the catalytic performance of copper-silica aerogel in the methanol steam reforming[J]. J Fuel Chem Tech, 2016, 44(1): 84-90. |
| [27] | AGRELL J, BIRGERSSON H, BOUTONNET M. Steam reforming of methanol over a Cu/ZnO/Al2O3 catalyst:a kinetic analysis and strategies for suppression of CO formation[J]. J Power Sources, 2002, 106(1-2): 249-257. DOI: 10.1016/S0378-7753(01)01027-8. |
| [28] |
LIU W Q, SONG Y H, WANG X L, et al. In situ NMR study of photocatalytic methanol reforming mechanism[J].
Chinese J Magn Reson, 2019, 36(3): 298-308.
刘文卿, 宋艳红, 王雪璐, 等. 光催化甲醇重整机理的原位核磁共振研究[J]. 波谱学杂志, 2019, 36(3): 298-308. |
| [29] |
SONG Y H, LIU W Q, YAO Y F. Optimization of NMR experimental conditions for parahydrogen-induced polarization[J].
Chinese J Magn Reson, 2015, 32(3): 470-480.
宋艳红, 刘文卿, 姚叶锋. 仲氢诱导极化增强的核磁共振实验条件优化[J]. 波谱学杂志, 2015, 32(3): 470-480. |
| [30] | WANBAYOR R, RUANGPORNVISUTI V. Adsorption of CO, H2, N2O, NH3 and CH4 on the anatase TiO2 (001) and (101) surfaces and their competitive adsorption predicted by periodic DFT calculations[J]. Mater Chem Phys, 2010, 124(1): 720-725. DOI: 10.1016/j.matchemphys.2010.07.043. |
| [31] | XU C B, YANG W S, GUO Q, et al. Molecular hydrogen formation from photocatalysis of methanol on anatase-TiO2(101)[J]. J Am Chem Soc, 2014, 136(2): 602-605. DOI: 10.1021/ja411020t. |
| [32] | MIYAO T, YAMAUCHI M, NARITA H, et al. Remarkable support effect for liquid phase methanol reforming with water over supported Pt-Ru catalysts[J]. Appl Catal A-Gen, 2006, 299: 285-291. DOI: 10.1016/j.apcata.2005.10.043. |
 2020, Vol. 37
2020, Vol. 37 
