甲醇重整的研究在环境修复、光催化重整、燃料电池等方面具有显著意义[1-3].由于甲醇具有比水氧化能力更强、氧化过程更快以及不可逆的特征,因此常作为电子牺牲剂而应用于光解水产氢中.在这一应用中,甲醇能够和光生空穴快速反应,降低光生电子-空穴的复合几率,最终大幅度提高氢气产生速率[4, 5].因此,甲醇光催化重整反应一直是相关领域的研究热点.
二氧化钛(TiO2)是甲醇光催化反应中具有代表性的催化剂之一.因具有无毒、催化效率高、稳定性好等优点,TiO2在光催化以及能源领域受到很大关注.TiO2有3种典型晶型,分别是:金红石型(rutile)、锐钛矿型(anatase)与板钛矿型(brookite).其中,金红石型TiO2因具有热稳定性高、覆盖性强等特点在工业上被大量生产,并广泛用于航空航天、涂料造纸等领域.大多有关甲醇重整反应机理研究的文献也使用了金红石型TiO2 (110)[6-8].相比之下,对锐钛矿型TiO2 (101)的探究较少.然而,锐钛矿型TiO2 (101)较金红石型TiO2 (110)有更高的表面反应活性,并且对于直径小于11 nm的纳米颗粒而言,锐钛矿型TiO2具有更好的稳定性[9-15].近十年来,使用锐钛矿型TiO2探究甲醇催化重整反应机理的研究越来越多,并取得了不错的研究进展[16-19].例如,Herman等[20]采用程序升温脱附(TPD)与X射线光电子能谱分析(XPS)方法对锐钛矿型TiO2 (101)表面氧空位缺陷进行了研究,发现锐钛矿型TiO2 (101)表面难以形成氧空位缺陷,这是导致甲醇在锐钛矿型TiO2 (101)上的分解情况与金红石型TiO2 (110)不同的主要原因.Wang等[21]采用和频振动光谱(SFG)技术对于吸附在锐钛矿型TiO2表面的甲醇分子进行了研究,发现甲醇分子的吸收主要位于非缺陷位点,而甲氧基(CH3O·)的化学吸收则发生在缺陷位点.Lang等[22]随后通过第一原理理论计算(first-principles calculations)方法进一步探究了锐钛矿型TiO2上的缺陷位点对甲醇分子分解的影响,证明了甲醇分子在锐钛矿型TiO2 (101)上有缺陷的表面更容易发生分解,并且甲醇的分解需要直接或者间接通过表面下的氧空位进行.另外,目前大部分研究甲醇催化重整体系的方法仅适合在高真空和大量水溶液[23]条件下进行,而对其在真实固-液反应环境中的探究还比较缺乏.但研究真实的固-液反应环境中甲醇催化重整体系是十分必要的.大量研究表明,贵金属有更低的费米能级,使得载流电子更易转移到贵金属表面.因此,在锐钛矿型TiO2中引入贵金属作为光生电子的接收器,可降低光生电子-空穴的复合率,进而提高催化剂的光催化活性[24].目前关于甲醇在贵金属/锐钛矿型TiO2共催化剂固液体系中的原位系统研究尚未见报道.
本文以不同贵金属担载的锐钛矿型TiO2共催化剂为研究对象,采用原位核磁共振(NMR)的方法研究不同的贵金属/TiO2共催化剂对甲醇光催化重整产物的影响.在此基础上,进一步探究了光照波长对甲醇光催化重整产物以及产氢的影响.基于实验结果,对贵金属/TiO2共催化剂对甲醇光催化重整产物的影响和作用进行了讨论.
1 实验部分 1.1 试剂与合成方法锐钛矿型TiO2(纯度为99.9%)、氘水[D2O,纯度为99.9%,包含0.3 v/v 2, 2, 3, 3-d4-3-(三甲基硅基)丙酸钠(TSP)]和甲醇(CH3OH,纯度为99.9%)均购于Sigma-Aldrich公司.这些药品都直接用于反应,不做进一步提纯.
M(1.0 wt. %)/ TiO2(M=Pt、Pd、Au、Ir或Ru)制备过程如下:将100 g纯锐钛矿型TiO2粉末置于50 mL的瓷坩埚中,加入适量的H2PtCl6/K2PdCl4/HAuCl4·3H2O/H2Cl6Ir·xH2O/ RuCl3·3H2O溶液.超声分散均匀后,在80 ℃下边搅拌边烘干,随后将瓷坩埚放入马弗炉中以10 ℃/min速率升温至300 ℃并保存2 h,反应结束后,冷却至室温.样品检测前需在20% H2/Ar中,200 ℃下还原0.5 h.
1.2 仪器与实验透射电子显微镜(TEM)实验在JEM 2100 VP场发射电镜上进行.加速电压为200.0 kV.
扫描电子显微镜(SEM)仪器型号为Hitachi S-4800.加速电压为5.0 kV.
X射线粉末衍射(XRD)实验所用仪器型号为Rigaku Ultima Ⅳ,Cu-Kα靶.测试电压为35 kV,电流为25 mA,X射线波长为0.154 18 nm,扫描范围为10˚~90˚,扫描速度为10˚/min.
紫外-可见吸收光谱(UV-Vis)采用紫外-可见分光光度计(UV-2700,Shimadzu)采集,检测波长范围为200~800 nm.
用于光催化反应的原位1H NMR实验谱仪为Varian 700 MHz,使用探头为安捷伦HXY三通道静态探头.光催化反应光源为北京泊菲莱公司生产的300 W氙灯:400 nm波长光照实验中光源使用400 nm滤光片;全波段光照实验中,不使用滤光片.1H NMR实验相关参数如下:质子共振频率为700.13 MHz,温度为276 K,谱宽(SW)为20 ppm,脉冲宽度为4 μs(45˚),采样时间为3 s,循环等待时间为5 s,采样次数为32.所有实验以TSP定标(δH 0.00).13C NMR实验在Bruker AV800 MHz NMR谱仪上进行.谱宽(SW)为238 ppm,采样时间为0.8 s,采样次数为256次.
光解水产氢性能检测设备由制氢设备与气相色谱组成.制氢设备中光源为300 W氙灯,电流为15 A,总循环水温为15 ℃.气相色谱相关参数如下:柱温为40 ℃,进样温度为50 ℃,检测温度为100 ℃,载气为Ar气,气压为0.3 MPa.
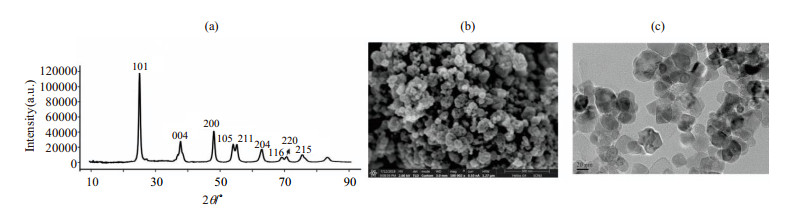
2 结果与讨论 2.1 纯锐钛矿型TiO2的结构形貌表征纯锐钛矿型TiO2的XRD谱图见图 1(a).从图上可以清晰的看出(101)、(004)、(200)、(105)、(211)、(204)、(116)、(220)和(215)特征反射.催化剂材料的形貌、尺寸及分散等特征可以通过SEM [图 1(b)]和TEM [图 1(c)]表征得出.由图 1(b)和1(c)可以看出,纯锐钛矿型TiO2催化剂尺寸大小均匀,在20 nm左右.
|
图 1 纯锐钛矿型TiO2的(a) XRD谱图、(b) SEM图片及(c) TEM图片 Fig. 1 (a) XRD pattern, (b) SEM image and (c) TEM image of anatase TiO2 |
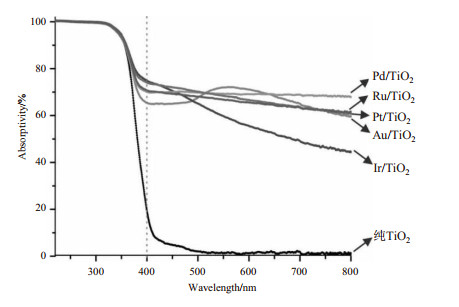
图 2为不同共催化剂的UV-Vis光谱.从图中可以看出,当波长大于420 nm以后,纯锐钛矿型TiO2吸光率很低,而担载贵金属(Au、Ir、Pd、Pt和Ru)的共催化剂可以大大增加催化剂的可见光吸收(420~800 nm).在400 nm光照下,不同贵金属担载的共催化剂吸光率也有一定的差别,这可能是由各种贵金属不同的吸收和催化属性所导致的.从图中可以看出,在400 nm时,担载贵金属的共催化剂中,Au/TiO2吸光率最小,而Ir/TiO2吸光率最大,其他担载贵金属的共催化剂在两者之间.
|
图 2 不同共催化剂的紫外-可见光吸收光谱 Fig. 2 UV-Vis absorptive spectra of different co-catalysts |
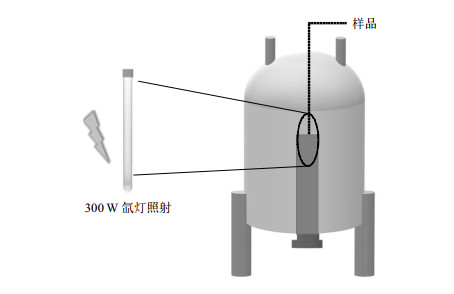
本实验所使用的原位NMR实验装置图如图 3所示.将包含催化剂粉末和溶液的悬浮液直接加入到设计好的NMR样品管中,并放入NMR谱仪腔体中进行原位检测.值得注意的是,使用该方法可以在不分离产物的前提下对整个光催化体系进行原位观察[18, 25].
|
图 3 原位NMR监测甲醇光催化反应示意图 Fig. 3 Schematic diagram of photocatalytic methanol reforming detected by in operando NMR |
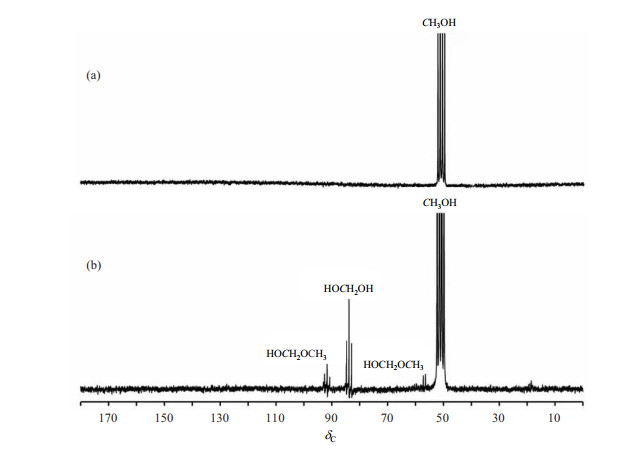
首先,我们以Pt/TiO2共催化剂为代表,用原位NMR方法研究了甲醇光催化反应的主要重整产物.将1 mg的Pt/TiO2粉末放入NMR样品管中,并向其中加入500 μL D2O(含0.3 v/v TSP)和20 μL CH3OH,超声10 min,待催化剂在液体中分散均匀后,置于400 nm光照下,并对该体系光照前后的产物进行研究.图 4显示了该体系光照前后的1H NMR信号.如图 4(a)所示,光照前,1H NMR谱图中出现了两个明显的单峰信号,位于δH 3.35和5.09处,分别对应甲醇(CH3OH)和氘水中残余质子.光照1 h后,谱图中出现4个明显的单峰信号,位移从小到大依次为δH 4.74、4.82、8.13和8.45,分别对应为半缩醛(HOCH2OCH3)、甲二醇(HOCH2OH)、甲酸甲酯(HCOOCH3)和甲酸(HCOOH)[25, 26].

|
图 4 (a) 光照前和(b) 400 nm光照1 h后,Pt/TiO2共催化体系的1H NMR谱图 Fig. 4 1H NMR spectra of the reaction system with Pt/TiO2 co-catalyst (a) before irradiation, and (b) after 1 h irradiation at 400 nm |
在甲醇重整过程中,常见的除了液态产物,也有可能生成比如一氧化碳(CO)或二氧二碳(CO2)等气相产物.因此,我们同样以Pt/TiO2共催化剂为代表,用原位NMR方法研究了甲醇光催化过程中的主要含碳气相重整产物.为了提高13C NMR的分辨率,我们使用了13C标记的甲醇.图 5显示了该体系光照前后的13C NMR信号.气相产物在溶液中溶解度较小,因此我们在采集13C NMR谱之前,适当延长光照时间至4 h.如图 5(a)所示,光照前,13C NMR谱图中出现了明显四重峰的信号,对应于甲醇中的甲基(13CH3-).光照4 h后,谱图中出现3个明显的多重峰信号,位移从小到大分别对应为半缩醛中的甲基(13CH3-)、甲二醇中的亚甲基(-13CH2-)、半缩醛中的亚甲基(-13CH2-).除此之外,并没有发现CO2或CO的信号.由此可见,在400 nm下光照4 h较难观察到甲醇光催化重整中的含碳气相产物.
|
图 5 (a) 光照前和(b) 400 nm光照4 h后,Pt/TiO2催化体系的13C NMR谱图 Fig. 5 13C NMR spectra of the reaction system with Pt/TiO2 co-catalyst (a) before irradiation, and (b) after 4 h irradiation at 400 nm |
我们进一步研究了5种共催化剂(包括Pt/TiO2、Pd/TiO2、Au/TiO2、Ru/TiO2和Ir/TiO2)对甲醇光催化重整产物的影响.为了减少数据的误差,我们对400 nm光照1 h时甲醇重整产物的产量进行对比.如图 6所示,我们可以发现,5种类型的贵金属共催化剂体系中,4种主要甲醇催化重整产物的产量大小关系都存在相似的规律:HOCH2OH > HOCH2OCH3 > HCOOCH3 > HCOOH.但是,不同类型的贵金属共催化剂对重整产物的产量有不同的影响:对于重整产物HOCH2OH而言,Pd/TiO2催化体系中产量最大,而Ir/TiO2催化体系中产量最少,前者产量约为后者的1.8倍;对于重整产物HOCH2OCH3,Pd/TiO2催化体系中产量最大,Ru/TiO2催化体系中产量最小,前者产量约为后者的1.5倍;对于重整产物HCOOCH3,Pd/TiO2催化体系中产量最大,Ru/TiO2和Au/TiO2催化体系中产量最小,前者产量约为后者的1.4倍;对于产物HCOOH,Pt/TiO2催化体系产量最大,Ru/TiO2催化体系产量最小,前者产量约为后者的2.3倍.我们可以得出结论,共催化剂种类不影响4种产物产量的大小顺序,但是对于产量影响明显.
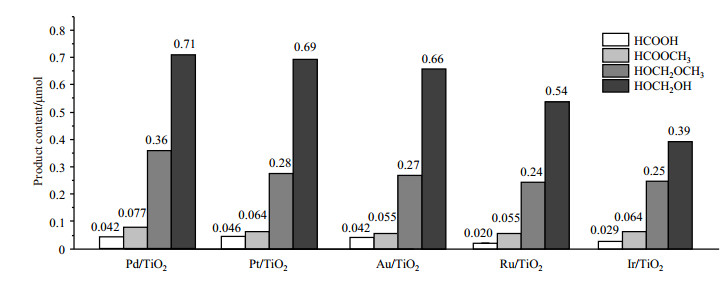
|
图 6 400 nm光照1h时,5种共催化剂体系中甲醇重整产物产量图 Fig. 6 Quantitative yield of photocatalytic methanol reforming products with 5 co-catalysts after 1 h irradiation at 400 nm |
我们进一步研究了在不同的共催化剂体系中,4种产物随着光照时间变化的动力学特征.如图 7所示,不同的共催化体系中,4种催化重整产物随光照时间增加呈线性增长的趋势,具有相同的动力学特征.
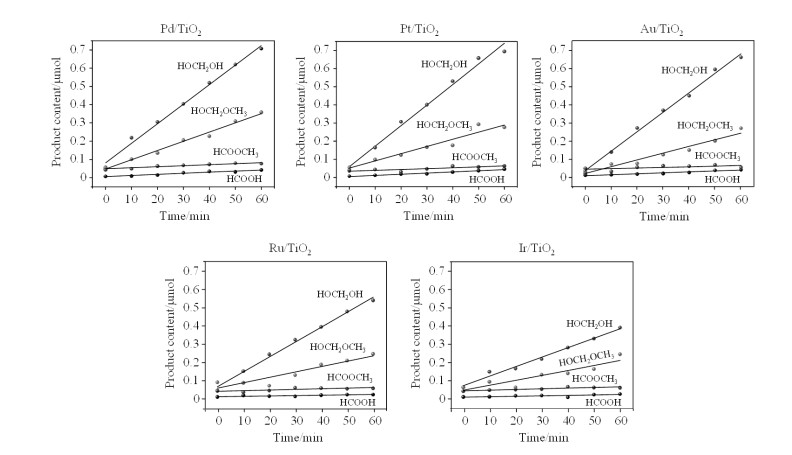
|
图 7 400 nm光照时,使用Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2和Ir/TiO2共催化剂得到的4种甲醇光催化重整产物产量随光照时间的变化 Fig. 7 Quantitative yield of the 4 photocatalytic methanol reforming products as a function of irradiation time at 400 nm with Pd/TiO2, Pt/TiO2, Au/TiO2, Ru/TiO2 and Ir/TiO2 |
随后,我们进一步计算了不同共催化剂体系在400 nm光照1 h的4种光催化重整产物的生成速率(表 1和图 8).
| 表 1 400 nm光照1 h内,5种共催化剂体系中4种甲醇光催化重整产物的生成速率(μmol/min) Table 1 Forming rates (μmol/min) of the 4 photocatalytic methanol reforming products with 5 co-catalysts in 1 h irradiation at 400 nm |
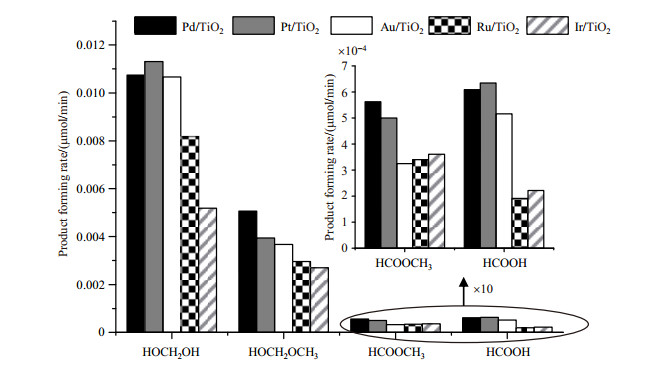
|
图 8 400 nm光照1 h时,5种共催化剂体系中4种甲醇光催化重整产物的生成速率 Fig. 8 Forming rates of the 4 photocatalytic methanol reforming products with 5 co-catalysts in 1 h irradiation at 400 nm |
从表 1和图 8可以看出,在不同的共催化剂体系中,HOCH2OH的生成速率明显高于HOCH2OCH3,并远高于HCOOCH3与HCOOH.而且4种甲醇光催化重整产物在不同的共催化剂体系中有着不同的生成速率.
由此,我们可以得出结论,担载不同贵金属的TiO2共催化剂对甲醇光催化重整产物的产量和生成速率大小有着不同程度的影响,但不会改变重整产物产量的大小顺序以及催化产物的动力学特征.
2.5 光照波长对甲醇光催化重整产物的影响本文继续研究了400 nm和全波段光照对使用这5种贵金属担载的TiO2催化剂(Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2、Ir/TiO2)得到的甲醇光催化产物的影响.如图 9所示,在Pd/TiO2催化体系中,全波段光照的3种主要甲醇光催化重整产物(HOCH2OH、HOCH2OCH3、HCOOH)产量明显高于400 nm光照,前者分别是后者的9.7、12.0、5.2倍;而对于重整产物HCOOCH3,全波段光照的产量低于400 nm光照,前者是后者的0.4倍.由此可见,在Pd/TiO2体系中,全波段对于甲醇光催化重整产物有不同程度地促进或抑制影响,其中全波段对HOCH2OCH3促进最为明显,而对HCOOCH3表现为抑制.在Pt/TiO2体系中,全波段光照的4种主要甲醇光催化重整产物产量明显高于400 nm光照,前者的HOCH2OH、HOCH2OCH3、HCOOH和HCOOCH3产量分别约是后者的10.1、9.9、5.9和2.2倍.由此可见,在Pt/TiO2体系中,全波段对这4种产物都有不同程度地促进.其中,波长对HOCH2OH的影响最大,而对HCOOCH3影响相对较小.在Au/TiO2催化体系中,全波段照射的HOCH2OH、HOCH2OCH3、HCOOH与HCOOCH3产量约为400 nm光照的5.3、5.6、4.3与1.6倍,全波段对HOCH2OCH3影响最大,对HCOOCH3影响较小.在Ru/TiO2催化体系中,全波段照射的HOCH2OH、HOCH2OCH3、HCOOH与HCOOCH3产量约为400 nm光照的4.2、4.5、6.0与1.5倍,波长对HCOOH的影响最大,而对HCOOCH3影响相对较小.在Ir/TiO2催化体系中,全波段照射的HOCH2OH、HOCH2OCH3、HCOOH与HCOOCH3产量约为400 nm光照的9.5、10.3、4.1与0.3倍,全波段对HOCH2OCH3促进最为明显,而对HCOOCH3表现为抑制.由此可以看出,不同的波长照射对于甲醇光催化重整产物的有着不同程度的促进或抑制影响.
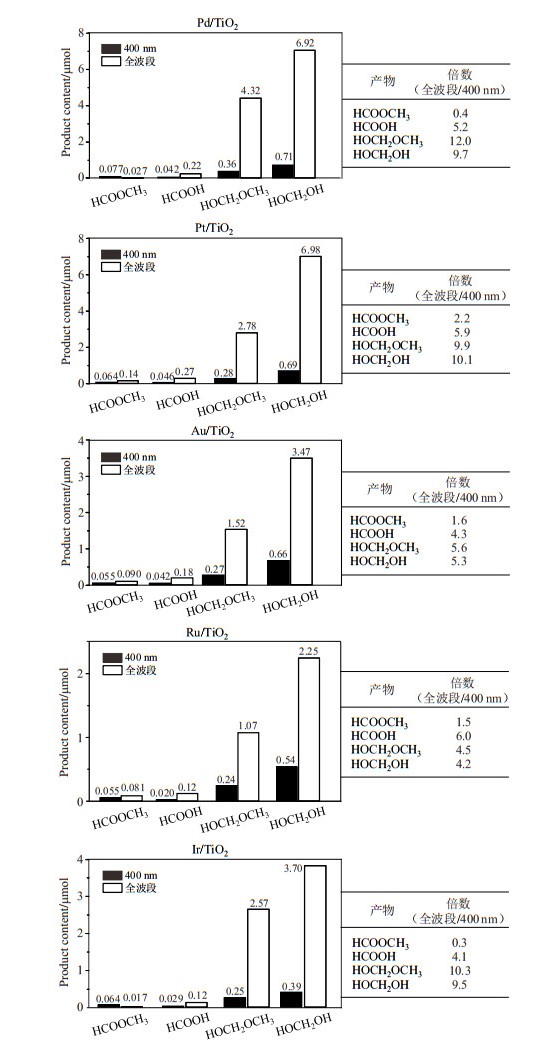
|
图 9 全波段与400 nm光照1 h后,Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2和Ir/TiO2催化体系中4种甲醇光催化重整产物的产量 Fig. 9 Yield of the 4 photocatalytic methanol reforming products after 1 h irradiation at 400 nm and full wave with Pd/TO2, Pt/TO2, Au/TiO2, Ru/TiO2, Ir/TiO2 |
而且,我们计算出在全波段光照1 h时,Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2、Ir/TiO2催化体系中4种主要的光催化产物生成总量分别为11.5、10.2、5.3、3.5、6.4 μmol,我们若以这4种主要的光催化产物的生成总量作为该催化体系中甲醇催化重整氧化能力,通过比较这5种共催化体系中甲醇光催化主要产物的生成总量,就可得知氧化能力的强弱.通过计算,我们可以得知Pd/TiO2与Pt/TiO2共催化体系甲醇重整能力较强,明显高于Au/TiO2、Ru/TiO2和Ir/TiO2.我们注意到,在400 nm光照下,Au/TiO2催化剂与Pd/TiO2、Pt/TiO2有着相似的氧化能力,但是在全波段下,Au/TiO2催化剂的氧化能力远低于Pd/TiO2、Pt/TiO2,我们推测这与Au/TiO2在不同波长下的催化能力大小有一定关系.从已报道[27]的理论计算结果可知,对于甲醇解离能力,Au弱于Pd和Pt.所以在全波段下,Au/TiO2催化剂对甲醇的氧化能力会低于Pd/TiO2和Pt/TiO2.而在400 nm下,据我们所知,Au纳米颗粒在光照下同时可以激发表面等离子体共振(SPR)效应,在等离子基元振荡弛豫过程中会产生热电子并参与到反应当中[28].所以,虽然在UV-Vis光谱中,Au/TiO2在400 nm下所表现出的吸收率稍低于其他贵金属担载的TiO2催化剂.但是Au本身所特有的SPR效应促使Au/TiO2在400 nm表现出与Pd/TiO2和Pt/TiO2相似的甲醇氧化能力.
综上所述,我们可以得出结论,不同波长对于甲醇光催化重整产物有不同程度地促进或抑制影响,在全波段下,不同共催化体系中重整产物的产量有明显的区别,而且它们甲醇催化重整氧化能力不同,Pd/TiO2与Pt/TiO2体系中催化重整氧化能力较强,明显高于Au/TiO2、Ru/TiO2、Ir/TiO2体系.
2.6 甲醇光催化重整产物与产氢的关系已有研究表明光催化过程中光照射反应体系会生成光生电子和空穴,当电子和空穴到达催化剂表面后,它们会与吸附在表面的有机分子发生氧化或还原反应.在本文的体系中,甲醇是作为牺牲剂,也就是电子供应分子,会与产生并迁移到催化剂表面的空穴反应生成甲醇催化重整产物.同时,担载在催化剂表面的贵金属可以作为光生电子的接收器降低光生电子-空穴的复合率,提高产氢效率.因此,我们猜测甲醇与贵金属之间可能存在协同作用,共同提高光催化效率.为了验证这一猜想,我们在全波段光照1h内,对贵金属担载的TiO2催化剂(Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2、Ir/TiO2)的产氢速率进行了探究.
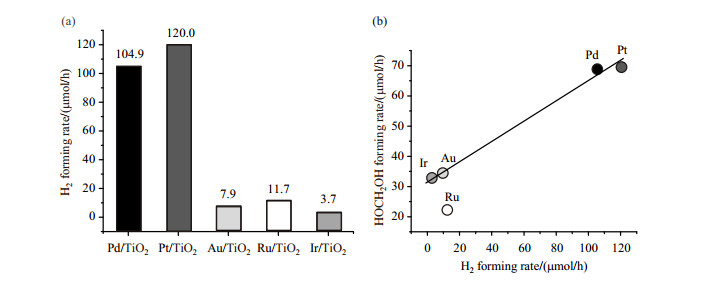
如图 10(a)所示,Pd/TiO2、Pt/TiO2、Au/TiO2、Ru/TiO2、Ir/TiO2催化剂的产氢速率分别为104.9、120.0、7.9、11.7与3.7 μmol/h,其中Pd/TiO2与Pt/TiO2催化剂的产氢效率较高,明显高于Au/TiO2、Ru/TiO2和Ir/TiO2体系,此结果与他们体系中甲醇催化重整产物的产量大致趋势一致(如图 9所示).为了进一步探究这些共催化剂体系在光催化过程中电子氧化和空穴还原速率和能力是否存在一定的协同性,我们对这5种共催化剂的产氢速率(还原反应)与HOCH2OH生成速率(氧化反应)关系进行了比较.由于产氢反应中催化剂使用量约为光催化重整反应的10倍,我们在比较两者速率关系时,统一了两者速率的标准.如图 10(b)所示,Pd/TiO2、Pt/TiO2、Au/TiO2和Ir/TiO2催化体系的HOCH2OH生成速率与光催化产氢速率随体系改变的变化趋势大致一致,说明这4种共催化剂体系的光催化还原能力与氧化能力具有一定的协调性.而在Ru/TiO2催化体系中,光催化氧化能力略弱于氢气还原能力.由此可以得出结论,共催化剂的种类对光催化反应速率及氧化还原能力起到了重要的作用,且会影响氧化能力和还原能力之间的协同性.
|
图 10 全波段光照1 h内,5种共催化剂体系的(a)产氢速率图和(b) HOCH2OH生成速率与光催化产氢速率的关系 Fig. 10 (a) Hydrogen forming rates and (b) its relationship with HOCH2OH forming rates with 5 co-catalysis in 1 h irradiation at full wave |
本文采用原位NMR的方法探究了在真实固-液环境中不同共贵金属担载的锐钛矿型TiO2催化剂以及光照波长对甲醇光催化重整产物的影响,并进一步探究了共催化剂类型对光解产氢速率的影响:
(1)本文使用的贵金属/TiO2催化剂的甲醇水溶液体系中,甲醇光催化重整产物主要为HOCH2OCH3、HOCH2OH、HCOOCH3和HCOOH.这4种甲醇催化重整产物产量随光照时间呈线性增长趋势.
(2)担载在TiO2催化剂表面的贵金属种类对甲醇光催化重整产物的产量和产率有着不同程度的影响,但是对重整产物产量的大小顺序和催化产物的动力学特征影响不大.其中,Pt/TiO2与Pd/TiO2共催化体系中,重整产物的产量与生成速率表现优异.光照波长对甲醇光催化重整产物的产量也影响较大.
(3)在贵金属担载的锐钛矿型TiO2体系中,共催化剂的种类对光催化反应速率及氧化还原能力起到了重要的作用,且会影响氧化能力和还原能力之间的协同性.
| [1] | MUGGLI D S, ODLAND M J, SCHMIDT L R. Effect of trichloroethylene on the photocatalytic oxidation of methanol on TiO2[J]. J Catal, 2001, 203(1): 51-63. DOI: 10.1006/jcat.2001.3311. |
| [2] | PALMISANO G, AUGUGLIARO V, PAGLIARO M, et al. Photocatalysis:A promising route for 21st century organic chemistry[J]. Chem Commun, 2007, 38(33): 3425-3437. |
| [3] | WASMUS S, KUVER A. Methanol oxidation and direct methanol fuel cells:A selective review[J]. J Electroanal Chem, 1999, 461(1/2): 14-31. |
| [4] | KIM S, CHOI W. Dual photocatalytic pathways of trichloroacetate degradation on TiO2:Effects of nanosized platinum deposits on kinetics and mechanism[J]. J Phys Chem B, 2002, 106(51): 13311-13317. DOI: 10.1021/jp0262261. |
| [5] | MORAND R, LOPEZ C, Koudelkahep M, et al. Photoelectrochemical behavior in low-conductivity media of nanostructured TiO2 films deposited on interdigitated microelectrode arrays[J]. J Phys Chem, 2002, b106(29): 7218-7224. |
| [6] | XU C B, YANG W S, GUO Q, et al. Photoinduced decomposition of formaldehyde on a TiO2(110) surface, assisted by bridge-bonded oxygen atoms[J]. J Phys Chem Lett, 2013, 4(16): 2668-2673. DOI: 10.1021/jz401349q. |
| [7] | WANG T J, HAO Q Q, WANG Z Q, et al. Deuterium kinetic isotope effect in the photocatalyzed dissociation of methanol on TiO2(110)[J]. J Phys Chem C, 2018, 122(46): 26512-26518. DOI: 10.1021/acs.jpcc.8b09077. |
| [8] | XU C B, WANG R M, XO F, et al. Enhanced hydrogen production from methanol photolysis on a formate-modified rutile-TiO2(110) surface[J]. J Phys Chem C, 2018, 122(25): 13774-13781. DOI: 10.1021/acs.jpcc.8b00724. |
| [9] | SETVIN M, SHI X, HULVA J, et al. Methanol on anatase TiO2(101):Mechanistic insights into photocatalysis[J]. ACS Catal, 2017, 7(10): 7081-7091. DOI: 10.1021/acscatal.7b02003. |
| [10] | TILOCCA A, SELLONI A. Methanol adsorption and reactivity on clean and hydroxylated anatase (101) surfaces[J]. J Phys Chem B, 2004, 108(50): 19314-19319. DOI: 10.1021/jp046440k. |
| [11] | XU C B, YANG W S, GUO Q, et al. Molecular hydrogen formation from photocatalysis of methanol on anatase-TiO2(101)[J]. J Am Chem Soc, 2014, 136(2): 602-605. DOI: 10.1021/ja411020t. |
| [12] | BENNETT D A, CARGNELLO M, GORDON T R, et al. Thermal and photochemical reactions of methanol on nanocrystalline anatase TiO2 thin films[J]. Phys Chem Chem Phys, 2015, 17(26): 17190-17201. DOI: 10.1039/C5CP02307F. |
| [13] | SETVIN M, ASCHAUER U, SCHEIBER P, et al. Reaction of O2 with subsurface oxygen vacancies on TiO2 anatase (101)[J]. Science, 2013, 341(6149): 988-991. DOI: 10.1126/science.1239879. |
| [14] | HE Y B, DULUB O, CHENG H Z, et al. Evidence for the predominance of subsurface defects on reduced anatase TiO2(101)[J]. Phys Rev Lett, 2009, 102(10): 106105. DOI: 10.1103/PhysRevLett.102.106105. |
| [15] | WANG C Y, GROENZIN H, SHULTZ M J. Surface characterization of nanoscale TiO2 film by sum frequency generation using methanol as a molecular probe[J]. J Phys Chem B, 2004, 108(1): 265-272. DOI: 10.1021/jp0356463. |
| [16] | HENDERSON M A, OTERO-TAPIA S, CASTRO M E, et al. The chemistry of methanol on the TiO2(110) surface:the influence of vacancies and coadsorbed species[J]. Faraday Discuss, 1999, 114(2): 399-405. |
| [17] | BATES S, GILLAN M, KRESSE G. Adsorption of methanol on TiO2(110):A first-principles investigation[J]. J Phys Chem B, 1998, 102(11): 2017-2026. DOI: 10.1021/jp9804998. |
| [18] |
LIU W Q, SONG Y H, WANG X L, et al. The mechanism study of photocatalytic methanol reforming by operando nuclear magnetic resonance spectroscopy[J].
Chinese J Magn Reson, 2019, 36(3): 298-308.
刘文卿, 宋艳红, 王雪璐, 等. 光催化甲醇重整机理的原位核磁共振研究[J]. 波谱学杂志, 2019, 36(3): 298-308. |
| [19] | MURAKAMI N, MAHANEY O O P, TORIMOTO T, et al. Photoacoustic spectroscopic analysis of photoinduced change in absorption of titanium(Ⅳ) oxide photocatalyst powders:A novel f..easible technique for measurement of defect density[J]. Chem Phys Lett, 2006, 426(1-3): 204-208. DOI: 10.1016/j.cplett.2006.06.001. |
| [20] | HERMAN G S, DOHNÁLEK Z, RUZYCKI N, et al. Experimental investigation of the interaction of water and methanol with anatase-TiO2(101)[J]. Hist Eur Ideas, 2003, 21(107): s169-176. |
| [21] | WANG C Y, GROENZIN H, SHULTZ M J. Comparative study of acetic acid, methanol, and water adsorbed on anatase TiO2 probed by sum frequency generation Spectroscopy[J]. J Am Chem Soc, 2005, 127(27): 9736-9744. DOI: 10.1021/ja051996m. |
| [22] | LANG X F, LIANG Y H, SUN L L, et al. Interplay between methanol and anatase TiO2(101) surface:The effect of subsurface oxygen vacancy[J]. J Phys Chem C, 2017, 121(11): 6072-6080. DOI: 10.1021/acs.jpcc.6b11356. |
| [23] | TAO F F, CROZIER P A. Atomic-scale observations of catalyst structures under reaction conditions and during catalysis[J]. Chem Rev, 2016, 47(19): 3487-3539. |
| [24] | XING J, CHEN J F, LI Y H, et al. Stable isolated metal atoms as active sites for photocatalytic hydrogen evolution[J]. Eur J Chem, 2014, 20(8): 2088-2088. DOI: 10.1002/chem.201304764. |
| [25] | WANG X L, LIU W, YU Y Y, et al. Operando NMR spectroscopic analysis of proton transfer in heterogeneous photocatalytic reactions[J]. Nat Commun, 2016, 7: 11918. DOI: 10.1038/ncomms11918. |
| [26] |
SONG Y H, LIU W Q, YAO Y F. Gaining Higher NMR signal enhancement with parahydrogen-induced polarization[J].
Chinese J Magn Reson, 2015, 32(3): 470-480.
宋艳红, 刘文卿, 姚叶锋. 仲氢诱导极化增强的核磁共振实验条件优化[J]. 波谱学杂志, 2015, 32(3): 470-480. |
| [27] | MELVIN A A, ILLATH K, DAS T, et al. M-Au/TiO2(M=Ag, Pd, and Pt) nanophotocatalyst for overall solar water splitting:role of interfaces[J]. Nanoscale, 2015, 7: 13477-13488. DOI: 10.1039/C5NR03735B. |
| [28] | YIN Z, WANG Y, SONG C Q, et al. Hybrid Au-Ag nanostructures for enhanced plasmon-driven catalytic selective hydrogenation through visible light irradiation and surface-enhanced Raman scattering[J]. J Am Chem Soc, 2018, 140(3): 864-867. DOI: 10.1021/jacs.7b11293. |
 2019, Vol. 36
2019, Vol. 36 
