2. 中国科学院大学, 北京 100049;
3. 复旦大学 生命科学学院, 上海 200433;
4. Division of Cancer, Department of Surgery and Cancer, Imperial College London, London W120NN;
5. Singapore Phenome Center, Lee Kong Chian School of Medicine, School of Biological Sciences, Nanyang Technological University, Singapore 639798;
6. 基因诊断中心, 华中科技大学同济医学院附属同济医院, 湖北 武汉 430030
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Life Sciences, Fudan University, Shanghai 200433, China;
4. Division of Cancer, Department of Surgery and Cancer, Imperial College London, London W120NN, UK;
5. Singapore Phenome Center, Lee Kong Chian School of Medicine, School of Biological Sciences, Nanyang Technological University, Singapore 639798, Singapore;
6. Genetic Diagnosis Center, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
绒毛膜癌(choriocarcinoma,简称绒癌)是一种发生于育龄妇女的恶性滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN),常继发于葡萄胎、自然流产和足月妊娠之后,在亚洲育龄妇女中较为常见,其比例可达到1例/200次妊娠[1].目前,绒癌主要使用甲氨蝶呤(methotrexate,MTX)、5-氟尿嘧啶(5-fluorouracil,5-FU)、更生霉素(dactinomycin,KSM)和依托泊苷(Vp-16)等单药或多药联合治疗,其治愈率可高达90%[2],是人类目前能治愈的实体瘤之一.然而据估计,在低风险病人中,10%~20%的无转移性病人、30%~50%的转移病人会产生单药耐药[3],需联合用药缓解;高风险病人中,有20%~30%的病人对多个化疗药物无响应[4-6].耐药已成为绒癌治疗失败的主要原因之一.
绒癌耐药分原药耐药和多药耐药(multidrug resistance,MDR).前者可更换药物治疗,而MDR则难以治疗.MDR产生的机制十分复杂,其一涉及多药耐药基因(multi-drug resistance 1,MDR1)及其产物P-糖蛋白(P-glycoprotein,P-gp)和多药耐药蛋白(multi-drug resistance related protein,MRP)等.其中,MDR1参与5-FU和Vp-16间歇诱导的绒癌耐药产生过程[7].而绒癌耐药细胞转染肿瘤坏死因子-α(hTNF-α)或人白细胞介素2(hIL-2)的基因后,均可通过调节MDR1的表达逆转其耐药性[8, 9].目前对MRP与耐药的关系尚存争议.如,同样是用MTX诱导JEG3细胞耐药,Wu等[10]发现氯离子胞内通道蛋白1(CLIC1)可正向调节MRP1介导JEG3细胞对MTX耐药,但崔竹梅等[7]却证明绒癌耐药与MRP不相关.此外,绒癌耐药还与细胞凋亡自噬及活性氧簇(reactive oxygen species,ROS)密切相关[11].ROS可调控JNK/p62通路,使耐药细胞从凋亡模式切换为自噬而保护细胞[12].Zhao等[13]发现耐药细胞中醛酮还原酶1C3(AKR1C3)过表达,减少了ROS的积累,进而导致JEG3细胞对MTX的耐药.
上述耐药机理的研究多聚焦于蛋白和转录水平,但鲜有代谢物水平的研究.事实上,绒癌治疗的药物多为抗代谢药,通常与体内蛋白发生特异性结合或作为核苷酸类似物参与DNA合成而影响或拮抗机体的代谢功能.如MTX可竞争性抑制二氢叶酸还原酶(dihydrofolate reductase,DHFR),扰乱四氢叶酸的合成,抑制核苷酸合成中一碳基团转移,最终导致DNA的生物合成受阻.此外,肿瘤细胞常因伴随基因及酶突变而导致其代谢异常[3, 14],如沃伯格效应[15]是肿瘤的糖代谢由正常的氧化磷酸化转变为有氧糖酵解.因此,无论是DNA合成受阻还是糖代谢异常,均牵涉到体内的诸多生化反应,必然会导致代谢物水平的改变.Li等[16]已发现肺癌耐药细胞中的还原型谷胱甘肽(glutathione,GSH)水平明显低于敏感细胞,而通过再平衡GSH含量可逆转细胞的耐药性,进一步提示从代谢物水平探索绒癌耐药机制或许可以提供崭新的视角.基于此,本研究借助基于核磁共振(nuclear magnetic resonance,NMR)的代谢组学技术,比较分析了绒癌耐药细胞株(JEG3R)与敏感细胞株(JEG3)及其培养基在代谢水平上的差异.
1 实验部分 1.1 药品与化学试剂DMEM培养基(Gibco)购买于赛默飞世尔科技有限公司,胎牛血清(四季青)购自浙江天杭生物科技股份有限公司.MTX水合物(methotrexate hydrate,98%)和重水(D2O,99%氘代)购于Sigma-Aldrich公司,2, 2, 3, 3-d(4)-3-(三甲基硅基)丙酸钠[2, 2, 3, 3, -d(4)-3-(trimethylsilyl)propionic acid sodium salt, TSP]购于Cambridge Isotope Laboratories公司.分析纯级试剂甲醇、三水磷酸氢二钾(K2HPO4·3H2O)和二水磷酸二氢钠(NaH2PO4·2H2O)购自国药集团化学试剂有限公司.超纯水(电导率大于18.2 MΩ·cm)取自德国Elix Advantage超纯水仪.
1.2 细胞培养和样本收集细胞培养:JEG3和JEG3R(由逐渐提高JEG3培养基中MTX的浓度诱导得到)母代细胞经消化后分为12等分,传代至直径为150 mm的培养皿中,加入20 mL DMEM培养基(含10%胎牛血清)进行培养,培养条件为:温度37 ℃,CO2浓度10%.为维持JEG3R的耐药性,每培养两周用20 μmol/L MTX处理3天.为排除MTX的影响,JEG3R细胞停用MTX一周后,且两组的细胞汇合度达到90%时才收集样品.
培养基样本收集:取4 mL培养基经0.45 μm滤器过滤至15 mL无菌离心管,保存于﹣80 ℃冰箱中.
细胞样本收集:弃去多余培养基后,加入4 mL磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)润洗;去除PBS,再加入4 mL胰酶(0.25%),消化5 min.待细胞开始变圆脱落,加入4 mL含血清培养基终止消化,轻轻吹下细胞并转移至15 mL离心管.另加4 mL培养基润洗培养皿并转移至同一离心管.所得细胞液4 ℃离心(800×g)5 min弃上清,再加入3 mL PBS漂洗3次,收集细胞并称重.
1.3 代谢物提取及NMR样品制备培养基NMR样品:4 mL培养基中加入8 mL冷甲醇溶液(v甲醇: v水=2:1)混匀,冰浴30 min以沉淀蛋白.经4 ℃离心(1 600×g)10 min后,取6 mL上清.上清经离心浓缩除去甲醇后冷冻干燥.向冷冻干燥粉末中加入1 mL双蒸水混匀,取480 μL至1.5 mL离心管,再加入120 μL磷酸盐缓冲液A(浓度为0.4 mol/L,K2HPO4与NaH2PO4之比为4:1,100% D2O,0.02% TSP).混匀后,4 ℃离心(15 930×g)10 min,取550 μL上清至直径为5 mm的NMR样品管待测.
细胞NMR样品:向收集的细胞样本中加入1 mL预冷甲醇水溶液(v甲醇:v水=2:1),液氮冻融三次后,冰浴超声破碎15 min(超声1 min-停1 min,循环8次).4℃离心(3 200×g)10 min,收集上清.重复上述提取过程两次,将三次收集的上清合并.离心浓缩去除甲醇后进行冷冻干燥.冻干粉末中加入600 μL磷酸盐缓冲液B(浓度为0.1 mol/L,K2HPO4与NaH2PO4之比为4:1,100% D2O,0.001% TSP),混匀后4 ℃离心(15 930×g)10 min,取550 μL上清至直径为5 mm的NMR样品管待测.
1.4 NMR数据采集培养基和细胞样品的1H NMR谱图在配备超低温探头的Bruker AVIII 600 MHz NMR谱仪上采集.实验温度为298 K,采用noesygppr1d(RD-90˚-t1-90˚-tm-90˚-ACQ)脉冲序列.等待时间(RD)设为2 s,混合时间(tm)设为80 ms,t1设为4 μs.细胞样本的90˚脉宽(p1)、采样点数(TD)、采样时间(AQ)和扫描次数(NS)分别设为10 μs、32 k、1.36 s和128;但培养基分别设为12 μs、64 k、2.72 s和64.
为确定代谢物的结构信息,对典型样品采集了一系列二维NMR谱,包括1H-1H COSY、1H-1H TOCSY、1H-13C HSQC、1H-13C HMBC和J-Res.实验温度均为298 K.其中COSY和TOCSY的F2(1H)和F1(1H)维谱宽设定为6 313.13 Hz,采样点数t2×t1=2 048×160,每个t1增量累加扫描64次.HSQC的F2(1H)维和F1(13C)维谱宽分别为6 313.13 Hz和26 410.10 Hz,采样点数均为t2×t1=2 048×138,每个t1增量累加扫描220次.HMBC的F2(1H)维和F1(13C)维谱宽分别为6 313.13 Hz和33 201.93 Hz,采样点数均为t2×t1=2 048×110,每个t1增量累加扫描400次.J-Res的F2维(1H)谱宽设定为6 313.13 Hz,采样点数为t2×t1 =4 096×80,每个t1增量累加扫描48次.
1.5 数据分析将采集所得自由感应衰减(free induction decay,FID)信号乘以线宽因子0.5,经过傅里叶变换、相位和基线校正,用TSP定标(δ 0.00).利用MestReNova 9.0软件(Mestrelab Research,西班牙)对谱图进行积分,积分区间为δ 0.6~9.5(去除δ 4.68~4.98残余水峰和δ 3.34~3.38甲醇信号),积分间隔为1.2 Hz.对积分数据进行归一化处理:细胞数据采取重量归一化,而培养基则采用总面积归一化.处理后的积分数据导入SIMCA-P+ 13.0软件(Umetrics,瑞典),经自适变换(unit variance scale,UV)后进行多变量分析.利用主成分分析(principal component analysis,PCA)检测异常点,偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)进行模型验证,正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)识别差异代谢物.最后使用自编Matlab程序绘制Pearson相关系数负载图(coefficient plots),以直观展示在敏感细胞和耐药细胞间差异显著的代谢物.
2 结果与讨论 2.1 细胞及培养基提取物的NMR信号归属绒癌细胞及其培养基提取物的1H NMR谱见图 1.代谢物归属根据二维谱提供的氢-氢相关和碳-氢相关信息,并参考已有文献[17-19],借助STOCSY技术[20]和HMDB[21]等数据库确认.本文共归属出49种代谢物、主要包括糖类、氨基酸类、核苷酸类、有机酸、胆碱代谢物以及山梨糖醇、还原型谷胱甘肽和三甲胺等物质.

|
图 1 绒癌细胞(JEG3, JEG3R)及其培养基(JEG3 M, JEG3R M)提取物的1H NMR谱图(600 MHz).图中虚线区域纵向放大10倍.注:1. 3-甲基-2-氧基戊酸;2. 2-氧代异戊酸;3. 2-氧代亮氨酸;4.乙酸;5.丙氨酸;6.胆碱;7.肌酸;8.甲酸;9.延胡索酸;10.山梨糖醇;11.葡萄糖;12.谷氨酸;13.谷氨酰胺;14.丙三醇;15.甘氨酸;16.组氨酸;17.异亮氨酸;18.乳酸;19.乳糖;20.亮氨酸;21.赖氨酸;22.甲醇;23.甲硫氨酸;24.肌醇;25.烟酰胺腺嘌呤二核苷酸;26.烟酰胺;27.泛酸;28.苯丙氨酸;29.磷酸胆碱;30.焦谷氨酸;31.丙酮酸;32.琥珀酸;33.蔗糖;34.牛磺酸;35.苏氨酸;36.三甲胺;37.色氨酸;38.酪氨酸;39.尿苷二磷酸-N-乙酰葡糖胺;40.缬氨酸;41.天冬氨酸;42.还原型谷胱甘肽;43.单磷酸腺苷;44.二磷酸腺苷;45.鸟苷三磷酸;46.二磷酸尿苷葡糖;47.脯氨酸;48.丝氨酸;49.尿苷一磷酸 Fig. 1 1H NMR spectra derived from choriocarcinoma cells (JEG3 and JEG3R) and medium extracts (M means Medium). The spectra in the dashed box are vertically expanded for 10 times. Key: 1. 2-Oxoisoleucine (2-O-Ile); 2. 2-Oxoisovalerate (2-O-Val); 3. 2-Oxoleucine (2-O-Leu); 4. Acetate (Ace); 5. Alanine (Ala); 6. Choline (Cho); 7. Creatine (Cre); 8. Formate (For); 9. Fumarate (Fum); 10. Glucitol; 11. Glucose (Glc); 12. Glutamate (Glu); 13. Glutamine (Gln); 14. Glycerol; 15. Glycine (Gly); 16. Histisine (His); 17. Isoleucine (Ile); 18. Lactate (Lac); 19. Lactose; 20. Leucine (Leu); 21. Lysine (Lys); 22. Methanol; 23. Methionine (Met); 24. myo-Inositol (myo-Ino); 25. Nicotinamide adenine dinucleotide (NAD+); 26. Nicotinamide; 27. Pantothenate; 28. Phenylalanine (Phe); 29. Phosphocholine (PCho); 30. Pyroglutamate; 31. Pyruvate (Pyr); 32. Succinate; 33. Sucrose; 34. Taurine (Taur); 35. Threonine (Thr); 36. Trimethylamine; 37. Tryptophan (Trp); 38. Tyrosine (Tyr); 39. Uridine 5'-diphospho-N-Acetylglucosamine (UDP-GlcNAc); 40. Valine (Val); 41. Asparartate (Asp); 42. Reduced glutathione (GSH); 43. Adenosine monophosphate (AMP); 44. Adenosine diphosphate (ADP); 45. Guanosine triphosphate (GTP); 46. UDP-Glucose (UDP-Glc); 47. Proline (Pro); 48. Serine (Ser); 49. Uridine monophosphate(UMP) |
值得注意的是,细胞中发现的山梨糖醇,在肿瘤细胞中并不常见.山梨糖醇的鉴定经由一系列二维谱初步确定其结构(图 2为HSQC谱图),而后采用往样品中滴加标准品(peak picking)的方法进行进一步的验证.代谢物的详细归属见论文网络版表S1.
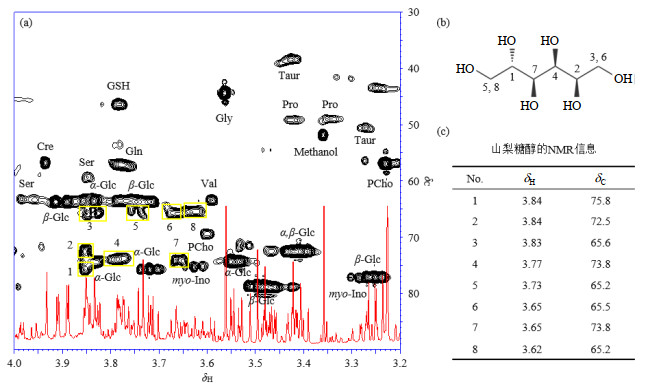
|
图 2 山梨糖醇结构确认. (a)细胞提取物2D HSQC谱图,黄色方框标出了山梨糖醇的信号;(b)山梨糖醇结构式;(c)山梨糖醇的1H和13C NMR信息 Fig. 2 The signal identification for glucitol. (a) Glucitol signals were highlighted with yellow box in 2D HSQC spectrum from cell extract; (b) Chemical structure formula of glucitol; (c) 1H and 13C NMR information of glucitol |
细胞和细胞培养基水相提取物的NMR谱图积分数据经PCA分析后得分图如图 3(a)和3(b)所示,无论是细胞提取物[图 3(a)]还是培养基[图 3(b)]提取物,JEG3和JEG3R间分离趋势均很明显,且未发现异常点.然后分别对细胞和培养基提取物的数据建立OPLS-DA模型,并采用交叉验证和CV-ANOVA分析验证模型可靠性,结果显示两组OPLS-DA分析均提示模型是成立的.通过对OPLS-DA的loading值进行回溯变换[22],将发生显著变化的代谢物展示在相关系数负载图[图 3(c)]中.同时通过计算模型中Pearson相关系数,挑选出相关系数大于0.576的代谢物,此即对模型的分离具有重要贡献的差异代谢物(表 1).在细胞提取物中,相比于JEG3敏感细胞,JEG3R耐药细胞中山梨糖醇和胆碱含量更高,而缬氨酸、亮氨酸、异亮氨酸、丙氨酸、谷氨酸、甘氨酸、酪氨酸、组氨酸、苯丙氨酸、磷酸胆碱、二磷酸尿苷葡萄糖、鸟苷三磷酸、腺苷一磷酸、尿苷一磷酸和延胡索酸含量较低.在培养基提取物中,与JEG3敏感细胞的培养基相比,JEG3R耐药细胞的培养基含有较高水平的缬氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸、乳酸、乙酸、延胡索酸和甲酸,以及较低水平的甘油、丙酮酸、丙氨酸、3-甲基-2-氧基戊酸、2-氧代亮氨酸和2-氧基异戊酸.

|
图 3 多变量分析结果图.(a)细胞提取物的PCA得分图;(b)培养基提取物的PCA得分图;(c) JEG3和JEG3R比较的OPLS-DA得分图(左)和相关系数负载图(右).显著变化的代谢物及其相关系数见表 1.OPLS-DA模型验证参数见其得分图上方 Fig. 3 Plot for multivariate data analysis. Scatter plots for PCA of (a) cell extracts and (b) medium extracts; (c) Plot for OPLS-DA analysis: scores plot (left) and coefficient loadings plots (right) derived from OPLS-DA models constructed by 1H NMR spectra of cell and medium extracts. Changed metabolites and their coefficients are shown in Table 1. Detailed parameters of validations of OPLS-DA model are presented on the top of scores plot |
| 表 1 发生显著变化的代谢物及其相关系数 Table 1 Significantly changed metabolites with their corresponding coefficient values |
在多变量分析结果的基础上,我们将细胞提取物所有的差异代谢物进行了代谢物富集分析[23](MetaboAnalyst 4.0,网站https://www.metaboanalyst.ca/)(图 4).JEG3和JEG3R两组间差异最显著的糖代谢,主要包括半乳糖代谢、果糖和甘露糖代谢及甘油磷脂代谢通路.其次是氨基酸代谢(酪氨酸、苯丙氨酸及甘氨酸等)、三羧酸循环障碍等代谢通路的改变.

|
图 4 细胞提取代谢物富集分析结果 Fig. 4 Metabolite set enrichment analysis of cell extracts |
半乳糖代谢以及果糖和甘露糖代谢为代谢物富集分析(图 4)受影响最大的两个通路,均涉及到山梨糖醇代谢,而山梨糖醇也是JEG3R相比于JEG3发生显著变化的代谢物[图 3(c)],推测其与JEG3R耐药密切相关.山梨糖醇在敏感和耐药细胞中均有检测到,而DMEM培养基组分中却没有,说明山梨糖醇为细胞代谢的产物.此外,因为山梨糖醇不易透过细胞膜,所以只在胞内积累,因此培养基中也未检测到.有研究报道山梨糖醇与糖尿病慢性并发症相关[24, 25],是多元醇旁路激活的产物.该通路的关键限速酶醛糖还原酶(aldose reductase,AR)可将葡萄糖转化为山梨糖醇.在血糖正常时,AR不激活,而高血糖状况下,己糖激酶被饱和,AR才被激活产生山梨糖醇.然而下游代谢酶山梨糖醇脱氢酶(sorbitol dehydrogenase,SDH)的活力并不会成比例增加,这就导致山梨糖醇在胞内的积累.在本研究中由于培养基中的葡萄糖并无差异,说明JEG3R与JEG3对糖的吸收无差别.结合JEG3R增殖速率明显慢于JEG3,因此JEG3R未将葡萄糖用于增殖,而可能增强AR活性从而造成山梨糖醇积累.于是我们猜想,JEG3R细胞内山梨糖醇的积累过程与慢性糖尿病并发症类似[24]:JEG3R在经MTX诱导的过程中,可能对代谢进行了重编程,通过激活多元醇旁路将胞内葡萄糖消耗掉,减少了葡萄糖的增殖需求,减缓JEG3R增殖速率来对抗MTX的作用,保护细胞免受MTX化疗影响,从而使其耐药.当然也不能排除JEG3R在经MTX诱导过程中,其葡萄糖代谢中其他酶发生了改变,导致葡萄糖代谢障碍.另有研究证实甘露糖可以增强肿瘤细胞化疗效果,具体机制与磷酸甘露糖异构酶(phosphomannose isomerase,PMI)活性相关[26],AR是否存在类似的效果,其相关性尚待验证.
2.3.2 三羧酸循环障碍的丙氨酸代偿机制鉴于JEG3R葡萄糖代谢障碍,一定存在相应的补偿机制.众所周知,肿瘤细胞通过沃伯格效应,将葡萄糖氧化为丙酮酸.丙酮酸部分进入三羧酸循环,产生少量能量以及大量的可用于合成生物大分子的代谢中间体,其余的丙酮酸则转化为乳酸[15].JEG3R培养基中乳酸含量明显上调,其来自于细胞的分泌,因此可推断JEG3R的沃伯格效应相比于JEG3反而是增强的.另外丙酮酸为培养基组分,在JEG3R培养基中显著下调,说明其被JEG3R细胞吸收量增多,这与乳酸升高一致.最后,培养基中的丙氨酸下调,表明JEG3R丙氨酸吸收增多,但细胞中含量反而降低,说明丙氨酸胞内代谢增强.在一项胰腺癌研究中,非必需氨基酸丙氨酸可通过转变为丙酮酸增强三羧酸途径,从而减少肿瘤细胞对葡萄糖以及其他能量物质的依赖[27].因此丙氨酸可能作为JEG3R的补充营养物质和能量来源.
2.3.3 与JEG3R增殖相关的其他代谢差异除上述代谢改变外,代谢富集分析还提示多条通路改变.如,氨基酸代谢、嘌呤和嘧啶代谢、氨酰tRNA合成、磷脂合成等代谢,且所涉及的代谢物在JEG3R细胞中多下调,可归因于JEG3R和JEG3增殖速率的差异.JEG3R与JEG3增殖速率差异较大,以JEG3细胞的基础代谢更旺盛,通过细胞培养时观察可得其倍增时间比约为3:1.其原因可能在于氨基酸是合成蛋白的物质基础,而JEG3R细胞的氨基酸消耗减少(Ala,Ile,Leu,Val,Phe,Tyr,Glu,Gly,His),并在培养基中(Val,Leu,Ile,Tyr,Phe,Glu,Met)含量升高,说明JEG3R对氨基酸的需求弱于JEG3.另外可能因为JEG3R中细胞膜相关物质的合成减弱[28, 29],如JEG3R中胆碱增多,磷酸胆碱及甘油含量降低.胆碱可以通过胆碱激酶转化为磷酸胆碱,再转化为卵磷脂参与细胞膜的形成.最后,JEG3R细胞中AMP、GTP、UMP等核苷酸类物质的含量低于JEG3细胞,可能与DNA合成,蛋白质合成密切相关,间接反应了JEG3R细胞增殖速率的减慢.总结,绝大多数下调的代谢物提示JEG3R基础代谢减缓,细胞内生物合成减弱,导致增殖速率下降.
3 结论本文采用基于NMR的代谢组学方法,比较分析了绒癌耐药株JEG3R与敏感株JEG3细胞及其培养基的代谢物组成差异.结果发现,JEG3R细胞中多元醇通路激活,醛糖还原酶活性增高,导致糖代谢异常,造成山梨糖醇积累,而这很可能与绒癌耐药相关.耐药JEG3R的沃伯格效应增强,尽管糖异常代谢,但糖吸收无差别,细胞可能通过丙氨酸回补三羧酸循环而维持增殖.由于JEG3R和JEG3细胞增殖速率的差异,导致氨基酸、核苷酸、磷酸胆碱等的同向改变.虽然本研究发现了绒癌耐药与其代谢物水平的关联,尤其是山梨糖醇积累的现象,但尚需验证.后续可采用13C标记的葡萄糖或丙氨酸示踪,同时测试相关酶的活性验证本文结论.总而言之,本研究初步认为绒癌细胞的耐药性与山梨糖醇通路相关,而且导致了耐药细胞的丙氨酸回补途径,为后续从分子生物学水平探究绒癌对MTX耐药的机制提供了新视角.
| [1] | 赵静, 向阳. 绒癌耐药机制的研究现状[J]. 中国癌症防治杂志, 2014, 6(2): 105-108. DOI: 10.3969/j.issn.1674-5671.2014.02.02. |
| [2] | HOEKSTRA A V, LURAIN J R, RADEMAKER A W, et al. Gestational trophoblastic neoplasia-treatment outcomes[J]. Obstet Gynecol, 2008, 112(2): 251-258. DOI: 10.1097/AOG.0b013e31817f58ae. |
| [3] | SANTABALLA A, GARCIA Y, HERRERO A, et al. SEOM clinical guidelines in gestational trophoblastic disease (2017)[J]. Clin Transl Oncol, 2018, 20(1): 38-46. DOI: 10.1007/s12094-017-1793-0. |
| [4] | LURAIN J R, NEJAD B. Secondary chemotherapy for high-risk gestational trophoblastic neoplasia[J]. Gynecol Oncol, 2005, 97(2): 618-623. DOI: 10.1016/j.ygyno.2005.02.004. |
| [5] | LURAIN J R, SINGH D K, SCHINK J C. Primary treatment of metastatic high-risk gestational trophoblastic neoplasia with EMA-CO chemotherapy[J]. J Reprod Med, 2006, 51(10): 767-772. |
| [6] | ABRAO R A, DE ANDRADE J M, TIEZZI D G, et al. Treatment for low-risk gestational trophoblastic disease:comparison of single-agent methotrexate, dactinomycin and combination regimens[J]. Gynecol Oncol, 2008, 108(1): 149-153. DOI: 10.1016/j.ygyno.2007.09.006. |
| [7] |
CUI Z M, XIANG Y, YANG X Y, et al. The establishment of the drug resistant cell lines and the study on the mechanism of acquired drug resistance in choriocarcinoma[J].
Prog Obstet Gynecol, 2001, 10(5): 333-336.
崔竹梅, 向阳, 杨秀玉, 等. 绒癌耐药细胞系的建立及获得性耐药机制的研究[J]. 现代妇产科进展, 2001, 10(5): 333-336. DOI: 10.3969/j.issn.1004-7379.2001.05.004. |
| [8] |
CUI Z M, XIANG Y, YANG X Y, et al. Establishment of the drug resistant cell line of choriocarcinoma and the reversal of drug resistance by transfection of human interleukin 2 gene[J].
Chin J Obstet Gynecol, 2001, 36(9): 549-553.
崔竹梅, 向阳, 杨秀玉, 等. 绒毛膜癌耐药细胞系的建立及人白细胞介素2基因转染后对其多药耐药性的逆转作用[J]. 中华妇产科杂志, 2001, 36(9): 549-553. DOI: 10.3760/j.issn:0529-567X.2001.09.011. |
| [9] |
FENG F Z, XIANG Y, ZHANG W G, et al. In vitro reversal of multidrug resistance by transduction of human tumor necrosis factor-αinto drug resistant cell line of choriocarcinoma[J].
Tumor, 2003, 23(4): 283-286.
冯凤芝, 向阳, 张卫光, 等. 人肿瘤坏死因子-α基因转导绒癌耐药细胞系体外耐药逆转的研究[J]. 肿瘤, 2003, 23(4): 283-286. |
| [10] | WU J H, WANG D S. CLIC1 induces drug resistance in human choriocarcinoma through positive regulation of MRP1[J]. Oncol Res, 2017, 25(6): 863-871. DOI: 10.3727/096504016X14772315906527. |
| [11] | SMITH A G, MACLEOD K F. Autophagy, cancer stem cells and drug resistance[J]. J Pathol, 2019, 247(5): 708-718. DOI: 10.1002/path.5222. |
| [12] | SHEN Y, YANG J J, ZHAO J, et al. The switch from ER stress-induced apoptosis to autophagy via ROS-mediated JNK/p62 signals:A survival mechanism in methotrexate-resistant choriocarcinoma cells[J]. Exp Cell Res, 2015, 334(2): 207-218. DOI: 10.1016/j.yexcr.2015.04.010. |
| [13] | ZHAO J, XIANG Y, XIAO C J, et al. AKR1C3 overexpression mediates methotrexate resistance in choriocarcinoma cells[J]. Int J Med Sci, 2014, 11(11): 1089-1097. DOI: 10.7150/ijms.9239. |
| [14] | HANAHAN D, WEINBERG R A. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646-674. DOI: 10.1016/j.cell.2011.02.013. |
| [15] | HEIDEN M G V, CANTLEY L C, THOMPSON C B. Understanding the warburg effect:the metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029-1033. DOI: 10.1126/science.1160809. |
| [16] | LI H D, STOKES W, CHATER E, et al. Decreased glutathione biosynthesis contributes to EGFR T790M-driven erlotinib resistance in non-small cell lung cancer[J]. Cell Discov, 2016, 2: 16031. |
| [17] |
HU Y L, HAO F H, WANG Y L. NMR-based metabonomic analyses on spleen tissues of 4T1 tumor-bearing mice subjected to chemotherapies with different drug delivery strategies[J].
Chinese J Magn Reson, 2018, 35(1): 8-21.
胡依黎, 豪富华, 王玉兰. 基于NMR的4T1荷瘤小鼠脾脏受不同给药方式影响的代谢组学研究[J]. 波谱学杂志, 2018, 35(1): 8-21. |
| [18] |
SONG Y P, LI N, XUE H S, et al. Metabonomics analysis of brown adipose and white adipose tissues[J].
Chinese J Magn Reson, 2016, 33(2): 208-223.
宋懿朋, 李宁, 薛海斯, 等. 棕色脂肪组织和白色脂肪组织的代谢组学研究[J]. 波谱学杂志, 2016, 33(2): 208-223. |
| [19] | LIU Z G, WANG L M, ZHANG L M, et al. Metabolic characteristics of 16HBE and A549 cells exposed to different surface modified gold nanorods[J]. Adv Healthc Mater, 2016, 5(18): 2363-2375. DOI: 10.1002/adhm.201600164. |
| [20] | CLOAREC O, DUMAS M E, CRAIG A, et al. Statistical total correlation spectroscopy:an exploratory approach for latent biomarker identification from metabolic 1H NMR data sets[J]. Anal Chem, 2005, 77(5): 1282-1289. DOI: 10.1021/ac048630x. |
| [21] | WISHART D S, FEUNANG Y D, MARCU A, et al. HMDB 4.0:the human metabolome database for 2018[J]. Nucleic Acids Res, 2018, 46(D1): D608-D617. DOI: 10.1093/nar/gkx1089. |
| [22] | CLOAREC O, DUMAS M E, TRYGG J, et al. Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in 1H NMR spectroscopic metabonomic studies[J]. Anal Chem, 2005, 77(2): 517-526. DOI: 10.1021/ac048803i. |
| [23] | XIA J G, WISHART D S. Web-based inference of biological patterns, functions and pathways from metabolomic data using MetaboAnalyst[J]. Nat Protoc, 2011, 6(6): 743-760. DOI: 10.1038/nprot.2011.319. |
| [24] | GIACCO F, BROWNLEE M. Oxidative stress and diabetic complications[J]. Circ Res, 2010, 107(9): 1058-1070. DOI: 10.1161/CIRCRESAHA.110.223545. |
| [25] | QIU F, ZHANG Y Q. Metabolic effects of mulberry branch bark powder on diabetic mice based on GC-MS metabolomics approach[J]. Nutr Metab, 2019, 16: 10. DOI: 10.1186/s12986-019-0335-x. |
| [26] | GONZALEZ P S, O'PREY J, CARDACI S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, , 563: 719-723. DOI: 10.1038/s41586-018-0729-3. |
| [27] | SOUSA C M, BIANCUR D E, WANG X, et al. Pancreatic stellate cells support tumour metabolism through autophagic alanine secretion[J]. Nature, 2016, 536(7617): 479-483. DOI: 10.1038/nature19084. |
| [28] | ABOAGYE E O, BHUJWALLA Z M. Malignant transformation alters membrane choline phospholipid metabolism of human mammary epithelial cells[J]. Cancer Res, 1999, 59(1): 80-84. |
| [29] | FAGONE P, JACKOWSKI S. Phosphatidylcholine and the CDP-choline cycle[J]. BBA-Mol Cell Biol L, 2013, 1831(3): 523-532. DOI: 10.1016/j.bbalip.2012.09.009. |
 2019, Vol. 36
2019, Vol. 36 
