2. 集美大学 信息工程学院, 福建 厦门 361021;
3. 厦门大学 电子科学与技术学院, 福建 厦门 361005
2. Information Engineering College, Jimei University, Xiamen 361021, China;
3. College of Electronic Science and Technology, Xiamen University, Xiamen 361005, China
食品安全是近年来公众关心的热点.传统的食品成分检测方法包括感官检测法、生物检测法、色谱法、萃取法等[1].然而这些检测方式或操作复杂、或获得的食品组成信息有限,不能满足便携式食品检测装置的要求.尽管核磁共振(Nuclear Magnetic Resonance,NMR)技术具备不破坏样品、不需对样品做预处理、操作简单等优点,而且可以通过NMR谱图判别样品成分组成及其含量,是一种较为理想的食品检测方法,但是目前国内外仅有少量将其用于食品检测领域的报道.例如李玮等[2]利用基于NMR的代谢组学技术分辨天然奶油和人造奶油,所得的结果与传统的气相色谱法一致.Hohmann小组[3]利用传统1H NMR和同位素比质谱、中红外光谱相结合的技术识别有机番茄和常规种植番茄的差异,结果显示利用NMR技术能够检测到用于区分两种蕃茄的生物标记物.究其原因主要是因为要获得分辨率更高的NMR谱图,传统的NMR波谱技术应用到食品检测领域时通常需要对样品进行萃取,将其制备为溶液再进行检测.例如Choi小组[4]利用萃取法分辨出不同成熟阶段黑树莓果实中氨基酸、糖类和有机酸等物质含量的波动情况.这是由于液体NMR检测时,分子运动十分迅速,分子间各向异性得以消除,磁场呈现均匀状态[3];而半固体的果肉内分子运动受到束缚,并且果肉的分布会破坏磁场的均匀度,干扰NMR检测,使得NMR图谱出现频谱变宽、谱峰重叠、分辨率降低等问题,导致从中获得的有效信息量变少.也有报道利用魔角旋转(Magic Angle Spinning,MAS)方法改善NMR谱图的分辨率.MAS通过对样品进行高速旋转降低分子间的相互作用、获得分辨率更高的NMR谱图.旋转轴与磁场夹角归为54.44˚,称为魔角[5-7].例如Iglesias小组[8]利用MAS分辨出三个不同成熟阶段的蕃茄果肉、果皮和种子中成分的变化.Sobolev小组[9]利用MAS技术研究了水果在生长过程中代谢物的变化[10-12].这两种方法都可以显著提高NMR光谱的分辨率.但是都有一定的局限性:萃取法会破坏样品的完整性,萃取过程中用到的化学药剂对环境有一定的污染,并且操作复杂耗时;MAS需要专用的旋转设备和探头,需要持续的维护费用,使NMR的便携化受到限制,而且高速旋转同时会对一些脆弱样品的物理结构产生破坏[13].
为寻找更具有发展前景的的水果无损检测方法,本文对基于分子间多量子相干(intermolecular Multiple-Quantum Coherence,iMQC)的NMR方法[14-17]在水果检测中的应用效果进行了探讨.Warren小组在80%水和20%重水组成的高极化溶液溶液中,利用CRAZED序列,在脉冲梯度场的作用下检测到iMQC信号[17, 18].iMQC信号的作用范围在微米数量级,样品在这个数量级上可以看作是均匀的,因此iMQC信号对不均匀场具有一定的免疫特性.利用脉冲梯度场可以选择不同的相干信号.本文将两个脉冲梯度场比例设置为1:2,即选择分子间双量子相干(intermolecular Double-Quantum Coherence,iDQC).这种方法可以较好的抑制水峰的干扰,在不均匀场下获得分辨率较高的NMR谱图.本文选用甲基丙烯酸丁酯、蕃茄、西瓜作为样品,验证iMQC方法能否在不均匀场下直接获得水果的高分辨NMR谱,旨在探索更加方便快捷的便携式水果检测方式.
1 实验部分 1.1 仪器与试剂蕃茄和西瓜采购于厦门市集美区洪润福超市,甲基丙烯酸丁酯与二甲亚砜(DMSO)采购于青岛腾龙微波科技有限公司.使用Varian 500 MHz液体NMR谱仪(Varian NMR System)和5 mm NMR样品管.
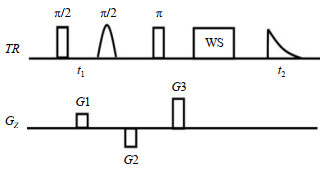
1.2 NMR实验本文使用的基于iDQC的IDEAL-Ⅱ序列[19]如图 1所示.第一个射频(Radio Frequency,RF)脉冲为90˚硬脉冲,用于产生各个阶的量子相干,第二个RF脉冲为激发溶剂频率的选择性高斯脉冲.第三个RF脉冲为180˚硬脉冲,负责相位的重聚.由于在第一个和第三个RF脉冲后分别加入了G1、G3两个梯度场,且它们的比例为1:2,因此可以选择iDQC信号,也可同时滤除单量子相干(intermolecular Single-Quantum Coherence,iSQC)和iMQC信号.G2的作用为散相.为消除不需要的信号,我们设计了四位的相位循环.三个脉冲的相位依次是(x, y, x, y)、(x, x, ﹣x, ﹣x)和(x, x, x, x),第三个脉冲相位固定在x方向.WS为溶剂压制模块,用于压制溶剂峰[20-22];t1=1.2 ms,为间接维演化最长时间;t2=3.0 ms,为采样时间.
针对三种样品各分别进行了三次实验:第一个实验为在不均匀场下采用单脉冲序列采集1D 1H NMR谱图;第二个实验在均匀场下采集1D 1H NMR谱图,采用带PRESAT溶剂压制模块的单脉冲序列;第三个实验为不均匀场下采用IDEAL-Ⅱ序列,采集2D NMR谱图,其中F1维代表不均匀场的宽度,F2维代表化学位移,通过在横轴累计投影可以得到1D 1H NMR谱图.
在进行第三个实验时,不同样品所使用的实验参数有所不同.以甲基丙烯酸丁酯为样品(溶剂为DMSO)时,F2维和F1维的谱宽分别为5 000 Hz和80 Hz,F2维采样点数=50,回波时间= 300.8 ms,实验总时间为471 s.以番茄为样品时,取新鲜未经处理的蕃茄(200 μg)直接塞入NMR样品管中,没有添加锁场和定标物质,F2维和F1维的谱宽分别为5 000 Hz和90 Hz,F2维采样点数=20,回波时间=121.6 ms,实验总时间为759 s.以西瓜为样品时,选取了西瓜果肉中带有籽的部分(200 μg)直接塞入NMR样品管中,没有添加锁场和定标物质,F2维和F1维谱宽分别为5 000 Hz和120 Hz,F2维采样点数=32,回波时间=198.4 ms,实验总时间为925 s.
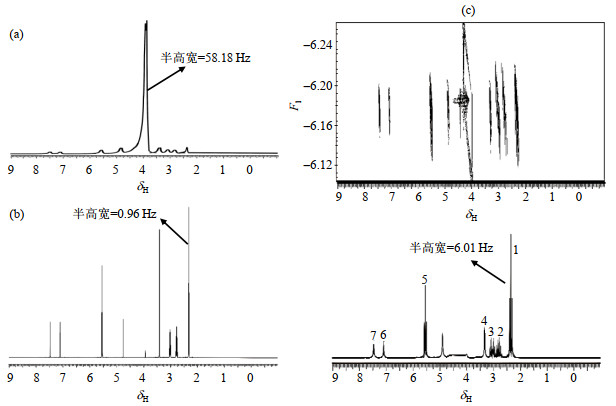
2 结果与讨论为模拟采集水果样品NMR谱图时的不均匀环境,我们首先以甲基丙烯酸丁酯为样品,通过调偏仪器中X、Y和Z方向的磁场,制造不均匀磁场,采集的不均匀磁场下甲基丙烯酸丁酯的NMR谱图如图 2(a)所示.使用带有PRESAT溶剂压制模块脉冲序列,仔细匀场后,采集得到的均匀磁场下甲基丙烯酸丁酯的NMR谱图如图 2(b)所示.本文选用半高宽衡量NMR谱图的分辨率:线宽越小,谱图分辨率更高;反之,则越低.比较图 2(a)和图 2(b)可以发现:不均匀场下,甲基丙烯酸丁酯大部分NMR谱峰几乎消失,谱图中最大的信号(δH 4.8)来源于溶剂.在与图 2(a)相同的不均匀场下,应用IDEAL-Ⅱ序列,采集得到的NMR谱图如图 2(c)所示.与图 2(a)相比,图 2(c)溶剂峰基本被抑制.可以清晰分辨谱峰的化学位移和J偶合裂分情况;最大信号(δH 2.3)的半高宽为6.01 Hz,远远小于图 2(a)最大信号的半高宽(58.18 Hz).
|
图 2 甲基丙烯酸丁酯的1H NMR谱.(a)不均匀场下,使用单脉冲序列采集的1D 1H NMR谱;(b)均匀场下,使用带有PRESAT溶剂压制模块的单脉冲序列采集的1D 1H NMR谱;(c)与图(a)相同的不均场下,应用具有溶剂压制模块的IDEAL-Ⅱ序列采集得到的2D NMR谱和在横轴累计投影得到的1D 1H NMR谱.谱图均以水峰定标(δH 4.8) Fig. 2 1H NMR spectra of butyl methacrylate: (a) 1D 1H NMR spectrum under inhomogeneous field; (b) 1D 1H NMR spectrum under uniform field using a pulse sequence with PRESAT pressure module; (c) 2D NMR spectrum obtained by IDEAL-Ⅱ sequence and 1D 1H NMR spectrum obtained by cumulative projection on transverse axis under the same inhomogeneous field as Fig. (a). The spectra were calibrated by water peak (δH 4.8) |
为了验证实验结果的准确性,我们利用Chemical Draw 7.0(Cambridge Soft)软件,通过搜索化学式进行谱库检索,将图 2(c)与谱库中的谱图和图 2(b)分别进行了对比,结果一致,根据化学位移的规律,我们对图 2(c)中的谱峰进行了基团归属(表 1).
| 表 1 甲基丙烯酸丁酯1H NMR谱峰的归属 Table 1 1H NMR assignments of butyl methacrylate |
图 2和表 1证明使用iDQC序列,能够在不均匀场下获得正确的、高分辨率的NMR谱图.为了将iDQC技术推广运用到水果NMR检测中,我们选取了蕃茄和西瓜两种具有代表性的水果进行NMR实验.
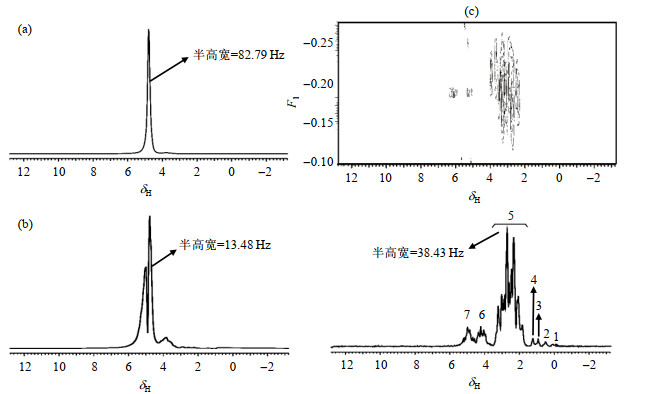
图 3(a)是利用一个RF脉冲激发采集得到的蕃茄的1H NMR谱图.蕃茄组织的不均匀性以及磁场的不均匀性导致从图 3(a)只可分辨出强的水峰信号,该水峰半高宽为82.79 Hz.使用带有PRESAT溶剂压制模块的脉冲序列,在均匀场下采集得到的番茄的1H NMR谱图如图 3(b)所示:水峰被压制后,出现了裂分,但其它信号仍然不够明显.应用带有溶剂压制模块的IDEAL-Ⅱ序列,在与图 3(a)相同的不均匀场下采集得到的番茄的NMR谱图如图 3(c)所示:谱图中最高峰的半高宽降至38.43 Hz;可以较为清楚的观察到谱图的多重裂分情况,谱图分辨率大大提升.我们根据文献[10]对图 3(c)所得的1H NMR谱图进行了归属(表 2).
|
图 3 番茄的1H NMR谱图:(a)不均匀场下1D 1H NMR谱;(b)均匀场下,使用带有PRESAT溶剂压制模块的单脉冲序列采集得到的1D 1H NMR谱;(c)与图(a)相同的不均场下,应用带有溶剂压制模块的IDEAL-Ⅱ序列采集得到的2D NMR谱和在横轴累计投影得到的1D 1H NMR谱.谱图均以水峰定标(δH 4.8) Fig. 3 1H NMR spectra of tomatoes. (a) 1D 1H NMR spectrum under inhomogeneous field; (b) 1D 1H NMR spectrum under uniform field using pulse sequence with PRESAT pressure module; (c) 2D NMR spectrum obtained by IDEAL-Ⅱ sequence and 1D 1H NMR spectrum obtained by cumulative projection on transverse axis under the same inhomogeneous field as Fig. (a). The spectra were calibrated by water peak (δH 4.8) |
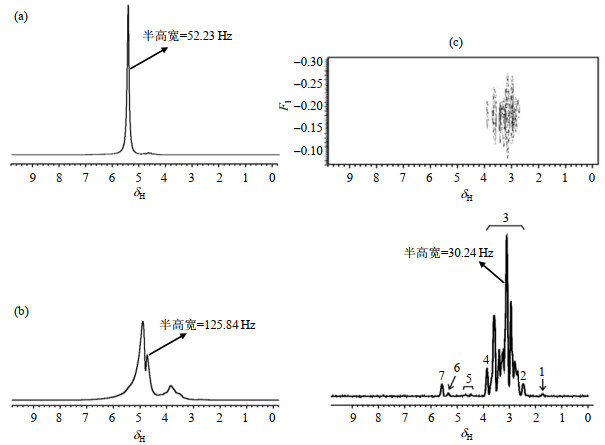
相对于番茄组织,西瓜组织中的籽进一步增加了磁场的不均匀性.不均匀场下,其1H NMR谱[图 4(a)]仅显示一个半高宽为52.23 Hz的最高峰,分辨率很低.对比图 4(b),我们发现加入了PRESAT压水序列后,在均匀场下采集得到的1H NMR谱图最高峰的半高宽反而增大到125.84 Hz.使用iDQC序列,在与图 4(a)相同的不均匀场下采集的西瓜的NMR谱图如图 4(c)所示:最高峰(δH 3.6)的半高宽下降至30.24 Hz;可较为清楚的分辨其裂分情况.对于图 4(c)的归属(表 3)显示谷氨酸盐信号主要位于δ 2.0~3.4(m)和δ 0.5(s).
|
图 4 西瓜的1H NMR谱. (a)不均匀场下1D 1H NMR谱;(b)均匀场下,使用带有PRESAT溶剂压制模块的单脉冲序列采集得到的1D 1H NMR谱;(c)与图(a)相同的不均场下,应用IDEAL-Ⅱ序列采集得到的2D NMR谱和在横轴累计投影得到的1D 1H NMR谱.谱图均以水峰定标(δH 4.8) Fig. 4 1H NMR spectra of watermelon. (a) 1D 1H NMR spectrum under inhomogeneous field; (b) 1D 1H NMR spectrum under uniform field using pulse sequence with PRESAT pressure module; (c) 2D NMR spectrum obtained by IDEAL-Ⅱ sequence and 1D 1H NMR spectrum obtained by cumulative projection on transverse axis under the same inhomogeneous field as Fig. (a). The spectra were calibrated by water peak (δH 4.8) |
上述三个实验结果均显示iDQC技术对较为复杂的场强环境具有较强的适应性,是一种有效的不均匀场下NMR测量方法.
对于甲基丙烯酸丁酯,使用溶剂压制模块在均匀场下获得的50%线宽较为理想,以其作为基准制造不均匀场,用于模拟水果采样时的不均匀环境,结果显示得到甲基丙烯酸丁酯和蕃茄的NMR谱图中最高峰的50%线宽急剧增加,而西瓜在由果肉和籽引起的不均匀场下,其50% NMR线宽较均匀场反而降低,说明磁场均匀度对检测结果的准确性影响很大.当使用基于iDQC的序列后,在同样的不均匀场下,蕃茄和西瓜的NMR谱图中最高峰的半高宽几乎是没使用iDQC方法的1/2,甚至更窄,说明iDQC可以有效解决水果原位NMR检测时固有的不均匀场对NMR谱图分辨率的影响,这为NMR在水果检测中的应用提供了一条途径.一般来说,水果组织中的水分和代谢物与自身的成熟度有着一定的关系[24, 25],通过基于基于iDQC方法的NMR技术是一种潜在的无损检测水果组织中多种成分和成熟度的方法.
但该种技术还存在以下问题:(1)2D NMR实验所需时间大多超过5 min,3D NMR实验时间则达到数小时,因此如何缩短采样时间是利用NMR技术检测水果组织时亟待解决的问题,可以进一步优化iDQC序列,而更有效的途径是结合空间编码方法[15, 26];(2)在实验中,我们发现iDQC信号信噪比较低,大约为iSQC信号的1/10,提高便携式谱仪中小型磁体的磁场强度和均匀度,研发高灵敏度探头和与其配套的控制台和软件系统[27],开发提高谱图分辨率的脉冲序列,都将提高未来利用便携化NMR设备检测水果组织的可行性.
3 结论食品领域的磁共振检测技术应用尚不成熟,为了提高未来便携化水果NMR检测设备应用的可行性,本文采用基于iDQC技术的IDEAL-Ⅱ序列对甲基丙烯酸丁酯、蕃茄和西瓜三种样品进行了NMR实验,结果证明基于iDQC技术在不均匀场下获得水果的高分辨NMR谱图是可行的,该序列在无损检测的基础上提高了水果NMR谱图的分辨率,对于水果NMR检测设备的优化提供了理论基础.
| [1] |
WANG X H, SUN P, ZHANG X, et al. Application of magnetic resonance technique to quality and safety evaluation of food[J].
Chinese J Magn Reson, 2017, 34(2): 245-256.
王小花, 孙鹏, 张许, 等. 磁共振技术在食品质量与安全研究中的应用[J]. 波谱学杂志, 2017, 34(2): 245-256. |
| [2] |
LI W, JIA J Y, LI L, et al. Differentiating butter (cream) from margarine (non-dairy whip topping) based on metabolomics by NMR spectrometry[J].
Food Science, 2017, 38(12): 278-285.
李玮, 贾婧怡, 李龙, 等. 核磁共振代谢组学技术鉴别天然奶油与人造奶油[J]. 食品科学, 2017, 38(12): 278-285. DOI: 10.7506/spkx1002-6630-201712043. |
| [3] | HOHMANN M, MONAKHOVA Y, ERICH S, et al. Differentiation of organically and conventionally grown tomatoes by chemometric analysis of combined data from 1H NMR- and MIR-spectroscopy and stable isotope analysis[J]. J Agric Food Chem, 2015, 63(43): 9666-9675. DOI: 10.1021/acs.jafc.5b03853. |
| [4] | KIM H S, PARK S J, HYUN S H, et al. Biochemical monitoring of black raspberry (Rubus coreanus Miquel) fruits according to maturation stage by 1H NMR using multiple solvent systems[J]. Food Res Int, 2011, 44(7): 1977-1987. DOI: 10.1016/j.foodres.2011.01.023. |
| [5] |
CHEN Z, CAI S H, HUANG Y Q, et al. Intermolecular multiple-quantum coherences and their applications in NMR[J].
Journal of Xiamen University (Natural Science), 2011, 50(2): 193-202.
陈忠, 蔡淑惠, 黄玉清, 等. 核磁共振中分子间多量子相干及其应用[J]. 厦门大学学报(自然科学版), 2011, 50(2): 193-202. |
| [6] | VALENTINI M, RITOTA M, CAFIERO C, et al. The HR MAS-NMR tool in food stuff characterization[J]. Magn Reson Chem, 2011, 49(s1): 121-125. |
| [7] | ANDRÉ M, PIOTTO M, CALDARELLI S, et al. Ultrafast high-resolution magic-angle-spinning NMR spectroscopy[J]. Analyst, 2015, 140(12): 3942-3946. DOI: 10.1039/C5AN00653H. |
| [8] | PÉREZ E M S, IGLESIAS M J, ORTIZ F L, et al. Study of the suitability of HR MAS NMR for metabolic profiling of tomatoes:Application to tissue differentiation and fruit ripening[J]. Food Chem, 2010, 122(3): 877-887. DOI: 10.1016/j.foodchem.2010.03.003. |
| [9] | SOBOLEV A P, MANNINA L, PROIETTI N, et al. Untargeted NMR-based methodology in the study of fruit metabolites[J]. Molecules, 2015, 20(3): 4088-4108. DOI: 10.3390/molecules20034088. |
| [10] | VERMATHEN M, MARZORATI M, VERMATHEN P. Exploring high-resolution magic angle spinning (HR-MAS) NMR spectroscopy for metabonomic analysis of apples[J]. Chimia (Aarau), 2012, 66(10): 747-751. DOI: 10.2533/chimia.2012.747. |
| [11] | VERMATHEN M, MARZORATI M, BAUMGARTNER D, et al. Investigation of different apple cultivars by high resolution magic angle spinning NMR. A feasibility study[J]. J Agric Food Chem, 2011, 59(24): 12784-12793. DOI: 10.1021/jf203733u. |
| [12] | MANNINA L, SOBOLEV A P, CAPITANI D. Applications of NMR metabolomics to the study of food stuffs:Truffle, kiwifruit, lettuce, and sea bass[J]. Electrophoresis, 2012, 33(15): 2290-2313. DOI: 10.1002/elps.201100668. |
| [13] | CAI H H, CHEN Y S, CUI X H, et al. High-resolution 1H NMR spectroscopy of fish muscle, eggs and small whole fish via Hadamard-encoded intermolecular multiple-quantum coherence[J]. PLoS One, 2014, 9(1): e86422. DOI: 10.1371/journal.pone.0086422. |
| [14] | 蔡宏浩.核磁共振新技术在食品科学研究中的应用[D].厦门: 厦门大学, 2015: 20-35. http://d.g.wanfangdata.com.cn/Thesis_Y2951583.aspx |
| [15] | 林玉兰.不均匀磁场下超快速高分辨核磁共振波谱新技术[D].厦门: 厦门大学, 2011: 32-38. http://d.wanfangdata.com.cn/Thesis/Y2012002 |
| [16] | 王楚楚.不均匀场下快速获取高分辨二维核磁共振谱的研究[D].厦门: 厦门大学, 2015: 1-19. http://d.wanfangdata.com.cn/Thesis/Y2926433 |
| [17] | WARREN W S, RICHTER W, ANDREOTTI A H, et al. Generation of impossible cross-peaks between bulk water and biomolecules in solution NMR[J]. Science, 1993, 262(5142): 2005-2009. DOI: 10.1126/science.8266096. |
| [18] | BRANCA R T. MRI using intermolecular multiple-quantum coherencesin vivo NMR imaging[D]. Methods Mol Biol, 2011, 771: 241-52. http://link.springer.com/10.1007/978-1-61779-219-9_13 |
| [19] | CHEN Z, CHEN Z W, ZHONG J H. High-resolution NMR spectra in inhomogeneous fields via IDEAL (intermolecular dipolar-interaction enhanced all lines) method[J]. J Am Chem Soc, 2004, 126(2): 446-447. DOI: 10.1021/ja036491f. |
| [20] | 陈松.异核分子间多量子相干核磁共振新技术及其应用[D].厦门: 厦门大学, 2008: 22-26. http://d.wanfangdata.com.cn/Thesis/Y1445375 |
| [21] | 陈志伟.分子间多量子相干在液体NMR高分辨率谱中的应用和大脑嗅觉功能磁共振成像研究[D].厦门: 厦门大学, 2007: 8-15. http://dspace.xmu.edu.cn/handle/2288/55127 |
| [22] | 林玉兰, 蔡淑惠, 张志勇, 等.单扫描获取不均匀场下高分辨分子间单量子相干谱[C]//中国物理学会.第十七届全国波谱学学术会议论文集.厦门: 第十七届全国波谱学学术会议. 2012. |
| [23] | JAYAPRAKASHA G K, PATIL B S. A metabolomics approach to identify and quantify the phytochemicals in watermelons by quantitative 1H NMR[J]. Talanta, 2016, 153: 268-277. DOI: 10.1016/j.talanta.2016.02.060. |
| [24] | CAPITANI D, MANNINA L, PROIETTI N, et al. Monitoring of metabolic profiling and water status of Hayward kiwifruits by nuclear magnetic resonance[J]. Talanta, 2010, 82(5): 1826-1838. DOI: 10.1016/j.talanta.2010.07.080. |
| [25] | GIL A M, DUARTE I F, DELGADILLO I, et al. Study of the compositional changes of mango during ripening by use of nuclear magnetic resonance spectroscopy[J]. J Agri Food Chem, 2000, 48(5): 1524-1536. DOI: 10.1021/jf9911287. |
| [26] | 吴灿.空间编码超快速二维相关磁共振谱方法研究[D].厦门: 厦门大学, 2011: 26-28. http://mobileir.xmu.edu.cn:8080/dspace/handle/2288/54709 |
| [27] |
LIU M, QIU W Q, SUN H J, et al. Progress in the portable NMR spectrometer[J].
Chinese J Magn Reson, 2014, 31(4): 504-514.
刘敏, 邱雯绮, 孙惠军, 等. 便携式核磁共振谱仪的研究进展[J]. 波谱学杂志, 2014, 31(4): 504-514. |
 2019, Vol. 36
2019, Vol. 36