磁共振成像(Magnetic Resonance Imaging,MRI)技术[1]是利用磁场内原子核的共振现象进行成像的一种技术,它可以实现脑部的高分辨率无创成像,为分析人脑功能和结构提供影像基础.它对人体无电离辐射、无创伤,安全可靠,且易于获得人体组织中不同断面的图像,而且图像的分辨率较高.科学家通过磁共振图像(比如T1加权像、T2加权像)构建人脑图谱,将其作为模板对比不同人脑,以此来了解人脑的功能信息和解剖信息,以及定位人脑的区域,并描绘其功能.目前,脑图谱已经被应用于各种脑疾病的诊断,如自闭症[2]、精神分裂症[3]、癫痫[4]等.然而目前尚没有比较统一的标准人脑图谱.
脑图谱构建过程中常用的关键技术包括脑图像配准、脑图谱分区、脑图谱标记等.脑图像配准是一种预处理技术,可以用来确定两幅或多幅医学图像的空间对应关系.脑图谱分区是图谱标记前的关键步骤,它的发展经历了从人工划分、半自动划分到全自动划分的过程.脑图谱标记的目标就是定义脑区的边界,分割人脑各组成,当前常用的分割方法有:基于图谱的分割法[5]、分割传播法[6]、多图谱标记法[7]等.脑图谱的标记中,通常使用标准化的三维(3D)坐标来分析和定量描述人脑解剖结构及组成部分,坐标用于提供脑图谱中各位置的精确定位,使其能够直接访问解剖标签,为区域大脑结构的定性描述提供了一致的评判方法.标记完成的人脑图谱运用一些统计学方法计算脑的组成差异,并应用于疾病的定量分析.
本文针对基于磁共振图像的人脑图谱构建方法进行概述,首先介绍了人脑图谱构建的发展进程,阐述脑图谱构建中需解决的技术问题及其局限性;然后描述了构建人脑图谱的基本方法;最后论述了应用人脑图谱进行疾病精确定量分析的统计学方法,包括基于体素的形态学测量[8](Voxel-Based Morphometry,VBM)分析法和基于纤维束示踪的空间统计[9](Tract-Based Spatial Statistics,TBSS)分析法,并较深入地比较了两种方法的差异和近期研究进展.通过分析目前研究现状,本文总结了脑图谱构建研究中的主要方法及不足,并就该领域未来的研究进展进行了展望.
1 基于MRI的人脑图谱长久以来,研究人员一直尝试借助不同的方法来了解人脑的结构和功能,其中脑图谱是最具代表性的方法之一.随着研究的不断深入,人脑图谱从最初的带有个体解剖信息的二维脑图谱逐渐发展为包含群体解剖及功能的三维、四维多模态脑图谱.在既往研究中,基于MRI的人脑图谱构建的一般步骤如下:1)选取目标图像,通常选择磁共振T1加权像;2)将MRI数据进行预处理,包括空间标准化、配准、平滑等;3)使用体积填充、分层、解剖的标记方法,将每个体素指定为x、y、z坐标;4)参考专家标记的样本图像来分割目标图像,并应用标签融合实现最终分割;5)将每层切片不同的结构标记成不同颜色,构建最终的MRI脑图谱,流程如图 1所示.下文提及的常用MRI人脑图谱的下载地址列表见表 1.

|
图 1 MRI人脑图谱构建流程图
Fig. 1 Flow chart of constructing MRI human brain map
|
| 表 1 常用MRI人脑图谱的下载地址 Table 1 The list of download links of common MRI human brain maps |
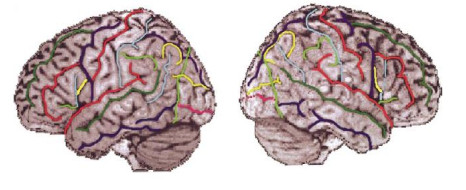
最早涉及脑图谱标记研究的是布罗德曼.1909年,德国科学家布罗德曼初次绘制了人类大脑皮层图谱[10].该图谱是基于细胞构造结构绘制的,布罗德曼通过将人类与不同的哺乳动物大脑进行比较,将大脑皮层分为“区域”特征.该图谱将人类大脑皮层划分成11个立体脑区[图 2(a)中以不同背景表示],在大脑外皮层上划分为43个区域,布罗德曼用1~52之间的数字对其进行标记,但是由于某些区域无法识别出人类大脑皮层,因此在图谱中没有显示12~16和48~51区域[11].在其后将近一百年的时间里,大量神经学家选择使用布罗德曼脑图谱来定位在活人脑中获得的神经影像数据.1925年,Von Economo与Koskinas在布罗德曼脑图谱后提出了更为细化的脑分区图,如图 2(b)所示[12].该分类系统用第一个字母显示大脑皮层区域的前脑叶,第二个字母(或一对字母)表示主要的细胞构造类型,第三个或者更多字母用于表示区域或子区域.
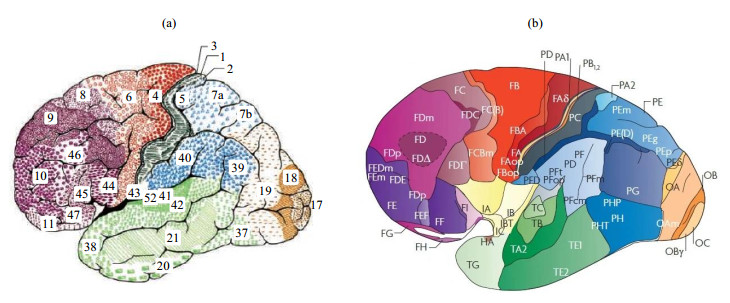
|
图 2 (a) 布罗德曼脑图谱和(b)改进后的细化的布罗德曼脑图谱[12] Fig. 2 The (a) original Broadmann brain map, and (b) the improved and refined Broadmann brain map[12] |
尽管布罗德曼脑图谱是现今研究脑皮质结构和功能的参考图谱,但是它存在两个固有的问题:一个是缺乏关于细胞构造区域的主体间变异性的数据,数据模式较为单一,另一个是缺乏观察者的独立性、可重复性和客观性.而改进后的脑分区图所划分的脑区数量大约是布罗德曼分区图的两倍,但是由于它只是提供了类似的整体分区方案,对大脑皮质区域的具体位置、大小和范围还没有明确的定义,因此布罗德曼及其细化分区的脑图谱均不能应用于普通人脑的疾病研究中.
1.2 Talairach脑图谱为了弥补布罗德曼脑图谱用于研究的缺陷,1988年,Talairach和Tournoux两人[13]通过将坐标系中的原点设定为前联合,水平向设定为前联合与后联合的连线方向,并在假定脑对称仅包含一个脑半球的前提下,对一名60岁法国妇女尸体脑切片的主要解剖结构进行了划分,最终提出了Talairach立体人脑图谱(TT图谱),如图 3所示.相较于之前的图谱,该图谱定义了三维坐标系(Talairach坐标系),实现了对图谱中每个脑部区域的三维化.在此基础上,研究人员借助该脑图谱开发了Talairach Daemon系统[14],它能够通过用户提供的三维坐标自动确定该坐标所在的对应的人脑结构.
Talairach脑图谱的提出意义重大,它为不同人的脑图像之间的对比提供了一个标准空间,也被认为是对布罗德曼脑图谱的补充,但是该图谱仍旧存在着缺陷[15]:首先它基于单个个体的大脑结构,无法体现其代表性;其次该图谱的空间分辨率低,不能进行任意角度观测,且当前开发的软件大多使用蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)的MNI305作为配准模板,这可能导致额外的误差;另外,这一图谱没有考虑到脑半球的不对称性;最后,该图谱的布罗德曼区域划分存在错误,所以该图谱并不适用于普通人群的脑疾病研究.
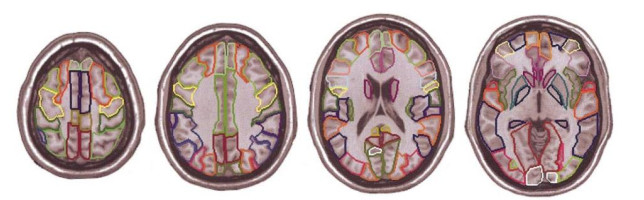
1.3 概率脑图谱尽管Talairach脑图谱可以进行空间位置和生理结构的对应,但该图谱未提供在给定位置时不同区域相对概率的信息,因此科学家会倾向于使用德国尤利希研究中心创建的基于细胞构造的概率人脑图谱.生成概率细胞结构脑图谱(Probabilistic Cytoarchitectonic Maps)的流程为:先观察不同尸体脑的区域边缘,对确定脑结构的个体大脑进行三维重构,然后将其标准变化到MNI单个被试模板并将其叠加,从而确定大脑任意位置属于不同结构的概率性.图 4所示为概率脑图谱的左半球侧视图、后视图和右半球侧视图.在此基础上,Eickoff[16]将概率图谱整合到了SPM(Statistical Parametric Mapping)解剖工具箱中,用户可以在这个软件环境中比较细胞结构和功能,提供概率性细胞构造图的常规标准化应用,作为功能激活的解剖学参考.这个工具箱的功能包括:1)显示和统计描述立体空间中每个细胞构造区域的概率图;2)将各个图谱组合成总图谱,以定义每个区域的非重叠感兴趣的体积;3)功能性聚类和局部最大值的解剖位置描述;4)通过评估它们对不同实验条件的响应来表征解剖区域的功能.
与经典的细胞构造图相比,概率脑图谱提供了关于MNI参考空间中皮层区域的位置和可变性的立体定位信息,且相较于基于单个个体大脑的图谱,该图谱可直接与功能成像数据进行比较,给出不同受试者个体大脑结构的概率性,是真正基于细胞构造分析的图谱,它克服了许多Talairach脑图谱在方法上的缺点及可能的错误来源.但是,由于研究中结构和功能磁共振成像(functional MRI,fMRI)数据的数量有限,因此概率脑图谱没有直接的标准化方法来描述SPM软件包[17]中通过统计分析所揭示的重要聚类的解剖位置,今后的研究应该将概率脑图谱集成到一个标准的软件包中,从而得到更多的研究数据.
1.4 自动解剖标记脑图谱自动解剖标记(Anatomical Automatic Labeling,AAL)脑图谱是由MNI [18]基于MNI单个被试的T1加权结构影像模板绘制的数字化人脑结构图谱,其主要使用正电子发射型计算机断层扫描(Positron Emission computed Tomography,PET)或fMRI研究检测到的自动解剖标记的激活信息.具体的构建过程如下:首先寻找脑沟所处的位置(图 5),然后在此基础上手动勾画解剖区域(图 6),最后进行三维重构,进而完成大脑结构的分割及标记.基于这一分区方法,功能性研究的自动解剖标记的程序:1)标记一个由坐标系定义的极值点;2)针对以一组坐标点为中心的球形相交的解剖上的兴趣区域(Anatomical Volumes of Interest,AVOI),计算属于每个AVOI的像素百分比;3)在一个聚类区域激活的情况下,计算属于每个AVOI的像素百分比;最后利用SPM软件包可以自动完成各个分割体的解剖学标记.
相较于Talairach脑图谱,AAL脑图谱对大脑激活区域的宏观标记进行了改进,且该图谱可以抑制某一组坐标与其解剖标签之间关系的混淆.然而,由于它是基于MNI单个受试者大脑的解剖学分割,且不提供绝对的解剖学定位,考虑到个体间存在的变异性,该图谱在群体研究中可能会存在一些脑区的定位错误,而且其定位也仅能通过参考个体解剖结构来确定,或通过参考解剖学概率图来近似,具有其局限性.
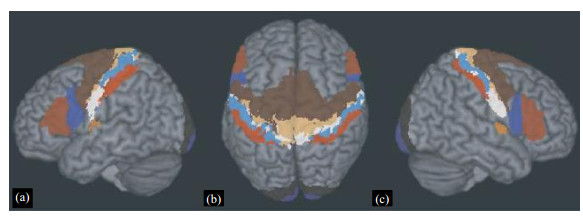
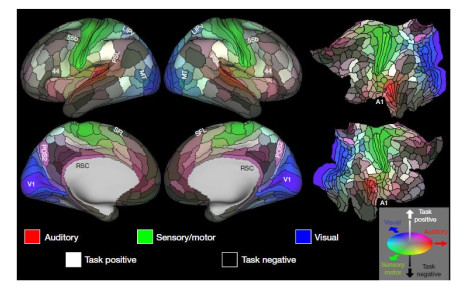
1.5 最新人脑图谱2016年7月20日,Glasser等[19]使用多组MRI数据,结合机器学习方法提出了目前最为全面的人脑图谱,如图 7所示.该图谱基于物理差异(如皮层厚度)、功能差异(如哪些区域对语言刺激作出反应)和大脑区域连接上的差异,将左脑半球和右脑半球均划分为了180个区域,其中有97个大脑皮层区域首次被描述.在此过程中,机器学习方法起到了至关重要的作用,它能够准确识别大脑皮质的变化,从而对不同脑区的进行自动分区.研究显示,使用该方法得到的自动分区准确率为96.6%,说明Glasser等绘制的图谱是基本正确的,该图谱是迄今为止得到的较为精确的脑图谱.
最新人脑图谱利用机器学习系统,揭示了大脑结构的划分及其连接模式,在了解大脑处理信息机制的同时,为新型的信息处理系统的设计提供了方向.但是,该图谱在某些方面仍旧存在其局限性,首先是由于大脑区域大小存在个体差异而导致的图谱结果不准确;其次,该图谱无法细化到单个神经元的活动,并且无法体现大脑的生理结构.尽管如此,该图谱的提出首次将脑图谱与人工智能进行了结合,为大脑疾病的研究及其治疗提供了新的方向和参考.
1.6 中国人脑图谱由于大脑结构和形状的差异,西方人群和其他种族的脑图谱不能用于中国人群,因此有中国研究者在基于脑结构模板和脑网络组研究的前提下,结合国外的研究现状,创建了属于中国人群的大脑图谱,该图谱包含了中国人丰富的大脑信息,为中国人群脑部疾病的临床诊断提供了重大帮助.
山东大学刘树伟教授团队[20]构建了中国数字化标准人脑图谱Chinese_56,该图谱有助于详细准确地研究中国人群的大脑解剖部位和激活区域.但是,由于这个脑图谱是基于有限的样本大小构建的,因此不具备充分的代表性.为进一步得到更准确的脑图谱,首都医科大学李坤成教授团队与香港中文大学王德峰和石林教授团队合作[21],首次基于多中心大规模数据开发了中国人脑图谱Chinese2020,该图谱定义了新的中国大脑标准空间、坐标和脑区标签,研究数据涵盖了不同年龄段和性别的中国人群,相较于AAL脑图谱,它在受试者的海马分割上显示出更高的准确性.中国科学院自动化所脑网络组研究中心蒋田仔教授团队[22]创建了较为完整的脑网络组图谱.此外,由华东师范大学的门卫伟博士[23]构建的一套适用于中国人脑科学研究的大样本中国人脑模板、组织概率图、解剖标准模板和皮层下神经核模板能够满足脑科学对临床研究的需要,为今后绘制更为精确的脑图谱奠定基础.本人所在课题组[24]通过改进配准方法,构建了基于MRI的中国人脑模板[25],该模板能精确显示大脑各部位的结构,后期我们计划创建基于扩散张量成像(Diffusion Tensor Imaging,DTI)的中国人脑模板[26].
2 人脑图谱构建的关键方法近年来,由于研究者对人脑图谱构建的关键方法的不断改进,使得它能够系统而全面地描述人脑各结构区域,并利用具体的三维坐标来进行定性描述[14].人脑图谱的构建通常运用到的技术方法一般有脑图像配准、脑图谱分区等.
2.1 人脑图像配准医学图像配准[27]是指对于一幅医学图像寻求一种(或一系列)空间变换,使得它与另一幅医学图像的对应点达到空间上的一致,它在几何上对齐两个图像,即参考图像和感测图像.在人脑图谱的研究中,由于大脑结构较为复杂,因此对不同个体的大脑图像进行配准更加困难,为此,我们需要构造一个精确的人脑图谱,利用人脑图谱所包含的先验知识对患者或者其他人群的人脑图像进行自动识别,以便于后续进行分区操作.
目前人脑图像配准的方法主要分为两类:一类是使用统一标准进行比较:比如将两个患者的PET或者MRI图像[28]都映射到同一参考空间进行比较,目前最为常用的是MNI标准空间.概率脑图谱的配准方法就是将三维重构后的人脑图像标准化到T1加权的MNI模板上,MNI模板是单个主体模板和152个个体大脑创建的组模板;AAL脑图谱则是基于MNI单个受试者大脑的解剖学结构绘制的.第二类是刚体变换方法,它指的是图像间任意两点的距离不变.最典型的例子是,我们可以把大脑看成是刚体,可以对不同方向的人脑图像的进行配准[29].
2.2 人脑图谱分区人脑图谱的分区最早是由布罗德曼基于细胞构造结构提出的.近三十年来,MRI技术的出现可以对人脑进行无创地高分辨率成像,并可以在获得大量人脑影像后对脑图像的功能区和脑部结构进行划分,得到精确的人脑图谱.
人脑图谱分区技术的发展实际上是一个从人工分区、半自动化分区到全自动化分区的过程.人工分区是指让临床医生直接在原始人脑图像上勾画出边界或者感兴趣区域(Region Of Interest,ROI).比如概率脑图谱是手动选择大脑皮层的区域边缘;AAL脑图谱是手动勾画出大脑沟回,再根据勾画位置按照先验知识逐层勾画脑区的各个边界,最后将勾画好的二维平面上的解剖区域在三维空间进行连接,以完成大脑解剖区域的分割.半自动分区技术是将计算机强大的数据处理优势与医学专家的知识和经验有机地进行结合,通过人机交互的方式完成脑区的划分.全自动分区则完全是由计算机自动完成,不借助人工的干预方式.2016年刊登的人类当前最全面的脑图谱中,采用了半自动与全自动方法的结合,对于最初的分区,采用了一种独立于观察者的半自动神经解剖学方法[30, 31],用于为非侵入性神经影像学结构分区;然后再使用全自动方法,训练机器学习分类器,根据多模态区域描绘和识别个体受试者的皮层区域,从而允许在新的受试者和研究中复制分区.
从人脑图谱分区的准确度来说,采用人工分区的精确度最高,被称为金标准,但该方法的缺陷是需要耗费大量的时间及人力资源,其分割结果的准确性完全取决于临床医生本人的经验和操作技术,且很难进行重复相同的区域划分操作;与人工分区相比,半自动方法的分区速度明显提高,但仍然在某种程度上依赖于临床医生的主观经验和实际操作.因此,近些年来,研究高效、实用的全自动分区方法一直是科学家追求的目标,未来它将代替传统的人工分区技术和仍具有局限性的半自动分区技术,成为新的研究人脑图谱的重点.
3 基于人脑图谱的定量分析统计学方法精确的定量分析对于脑科学研究和临床疾病诊断都非常重要.研究者借助脑图谱,基于一些统计分析方法可以得出健康组和疾病组在脑组成的差异,进而将结果应用于临床疾病的治疗中.常见的定量分析统计学方法,包括VBM分析法和TBSS的分析法.
3.1 VBM分析法2000年,Ashburner和Friston[32]首次提出了VBM分析法,该技术能够对人脑进行定量分析,从而得出患者脑区的异常部位和差异信息.
VBM方法的一般操作步骤如下:1)MRI数据采集,一般选用磁共振T1加权像;2)空间标准化,把被试者磁共振脑图像标准化到一个相同的空间中;3)分割,对人脑磁共振图像进行分割,得到脑灰质(Gray Matter)、脑白质(White Matter)和脑脊液(Cerebro-Spinal Fluid)三种组织成分,另外剩下的背景成分,可采用混合模型聚类算法进行实现[31];4)平滑,使被试者之间的比较在合理的空间标度范围内进行,实验中一般采用8 mm半高全宽的高斯卷积核进行操作;5)统计建模和假设检验,对每个体素进行统计分析,获得一幅统计参数映射图,根据实验目的指定合适的对比度,在显著水平下进行假设检验,结果显示与所研究的问题显著相关的脑组织成分的差异.常用的统计模型有:双样本t检验、方差分析、回归分析等[33],流程图如图 8所示.
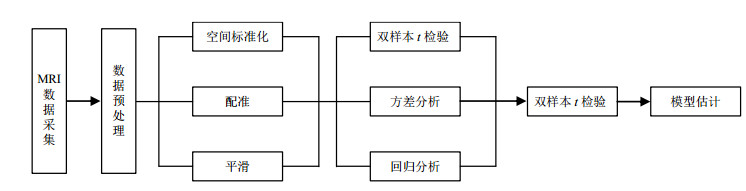
|
图 8 VBM方法流程图
Fig. 8 Flow chart of VBM analysis
|
实验中使用SPM软件包进行处理,它是为检验人脑中特定的脑区效应而构建的空间延展的统计方法,通过对人脑MRI数据中的每一个体素分别进行计算,得出包含体素参数值的图像,最后输出参数图像,是对大脑异常部位进行判断和分析的常用工具.
VBM方法具有自动化、无偏倚、重复性及客观性均较高的优点,可逐个体素进行分析,易于发现细微的结构差异,相对于基于ROI分析,它省去了选择ROI的步骤,且不局限于特定脑区的分析,可以同时反映全脑范围内的密度差异和体积上的差异[34].基于精确的脑图谱,VBM定量分析法可以应用于多种神经系统疾病的研究,以揭示这些病变引起的大脑内在结构的改变,包括隐源性婴儿痉挛症[35]、阿尔兹海默症[36](Alzheimer’s Disease,AD)等,都显示出了良好的应用前景.
3.2 fMRI的VBM分析fMRI[37]是一种脑功能成像技术,它无创伤面,能够利用磁共振造影来测量神经元活动所引发的大脑局部血液的动力改变,其研究方法主要包括任务态和静息态两种.其中,静息态低频振幅(Amplitude of Low Frequency Fluctuation,ALFF)是静息态磁共振中常用的研究方法,它是基于全脑体素的统计学分析,能够直接反映脑区局部神经元的信号强弱,可结合VBM方法来分析脑部结构的异常.
首先进行VBM的预处理,包括MRI数据采集、空间标准化、分割、平滑、双样本t检验等操作,将检验后灰质体积存在差异的脑部区域指定为ROI,然后进行ALFF分析.VBM方法预处理的步骤为:1)fMRI数据采集,去除前10个时间点;2)时间和头动校正;3)空间标准化;4)空间平滑,一般采用6 mm半高全宽的高斯核进行操作;5)去除线性漂移;6)滤波减少低频漂移和高频噪声.
fMRI的VBM分析法通过结构和功能两个方面对脑部进行分析:先利用VBM方法提取灰质异常部位作为ROI,再通过ALFF方法计算低频振幅的均值得到全脑各体素静息状态下的神经元活跃情况,然后针对ROI进行数值计算和双样本t检验统计分析,最终得出脑部异常区域.实验中常使用一种用来进行静息态fMRI数据分析的软件——REST进行处理,该软件包含了丰富的图像分析和指标处理功能,是对大脑异常部位进行判断和分析的常用工具.
3.3 TBSS分析法TBSS分析法是一种基于纤维束示踪的配准方法,其采用“骨架化”的处理思路,直接实现不同被试的纤维来对齐,克服了采用勾画ROI和基于体素分析(Voxel-Based Analysis,VBA)两种方法的局限性,可以为预估患者脑部病变程度提供有利参考,它经常被应用于临床疾病的诊断中.
DTI[38]是一种能检测到脑白质纤维束的检查方法,故选用DTI数据进行TBSS分析,一般处理步骤如下:1)DTI数据采集;2)数据预处理,将被试者DTI原始DICOM(Digital Imaging and Communications in Medicine)数据转换成NIFTI(Neuroimaging Informatics Technology Initiative);3)采用涡流校正(Eddy Current Correction)方法进行各向异性分数(Fractional Anisotropy,FA)数据的头动和涡流伪影矫正;4)采用DTIFIT软件进行张量计算;5)将被试者的FA数据非线性对齐到标准空间;6)计算所有被试者FA的均值,制作骨架;7)骨架化处理,即将所有被试者FA标准到骨架上;8)设计统计分析矩阵;9)对两组数据进行双样本t检验.
实验中运用FSL(Functional MRI Software Library)工具包[39]进行分析,它是由牛津大学脑功能磁共振实验室在2000年开发的一个软件库,可以处理多种人脑图像.FSL在纤维示踪方面采用概率性示踪方法,能够更准确地进行纤维示踪分析,有利于DTI人脑图像的研究.虽然利用FSL对DTI数据进行处理可以解决配准、单一纤维走向以及参数设置等问题,但是在进行纤维重建过程中仍然存在一些问题,例如活体纤维示踪结果没有金标准、示踪建模时间较长、对纤维的上行与下行走向无法判断[40],这些仍需要研究者进一步的改进.但总的来说,FSL在病理研究和认知科学方面还是起到了极大的促进作用.
TBSS方法的优势在于可以精确地对齐不同被试者的白质纤维束,并进行配准,对脑部异常部位的诊断更加精确,使得产生假阳性结果的可能性明显下降[41].与此同时,TBSS最大的特点是适用于全脑分析,通过估计组平均骨架的方法,在纤维细化后使得数据配准误差得到大幅度的降低,有利于进行后续的全脑统计分析,从而提高数据分析的可靠性.它和脑模板的结合可以对全脑进行标签化分区,对病变位置进行确认,建立全面的大脑连接网络,为大脑结构连接的可视化提供可行方案.
4 讨论脑图谱是脑科学研究的基础,它为大脑病变的研究及临床诊断提供了帮助,但是,目前构建的脑图谱依旧存在着一些不足.
首先,是脑区划分上的不足.先前许多脑图谱的分区与脑功能分区对应较为困难,而且对部分亚区边界划分也存在错误,因而目前的脑区划分标准尚未统一.以经典的布罗德曼脑图谱为例,它的分区只能反映脑回冠的部分信息,却不能反映脑区间边缘内部沟的具体信息,与此同时,有的分区存在错误,如BA29、BA30、BA31脑区等.因此,需要对大脑区域重新进行精确分区.
其次,脑图谱构建中还没有建立东方人标准的人脑模板.目前,MNI152标准模板已经作为标准的解剖参考.但是,既往构建的脑图谱都是基于西方人脑的信息,尽管目前已经有一些单位构建了基于中国人群的脑模板和脑图谱,但仍存在着不足,所以在脑科学研究和应用中,研究者只能将中国人的脑图像配准到西方人的标准脑图谱上进行实验.由此可见,建立一个东方人的标准脑图谱对于临床诊断和深入研究都是十分重要的.
另外,脑影像数据可以应用更高场强的磁共振设备获得.目前构建脑图谱所使用的MRI设备磁场强度已由先前的1.5 T提升至3 T,未来更有望向7 T发展.当前,7 T高场强MRI分子影像技术普遍应用于动物(如大鼠)的脑部病变研究中[42],它可以提高大鼠脑图像的空间分辨率、对比度和信噪比,便于获得高分辨率的结构信息,也能更清晰的反映其大脑边界范围,针对动物的研究为后续人类的大脑分区及标记提供了帮助,也使结合脑图谱进行早期脑部疾病部位的诊断成为可能.
最后,获得科学、准确的定量分析结果也是未来所要攻克的难关.VBM方法和TBSS方法尽管可以根据已标记好的脑图谱定量分析患者脑部的异常区域,但仍具有其局限性[43]:VBM方法中使用的SPM软件无法进行算法标准化,可能会出现假阳性结果;图像空间配准确率不高;在平滑处理时其中心的选择具有明显的主观性.TBSS方法对脑白质纤维束FA值改变较为敏感[44];同时,因为FA骨架提取算法具有局限性,使得骨架在纤维束交叉的部位会比较容易出现中断[7, 45];另外,TBSS方法无法消除头动的影响[6].
针对上述脑图谱存在的不足,考虑到中西方人脑的个体差异性,而目前被广泛应用的脑图谱都是基于西方人脑信息构建的,本人及所在课题组在构建脑图谱前首先建立了基于特定的中国人群的MRI脑模板,该模板能够精确地呈现部分中国人脑部的结构信息,为大脑的评估和临床诊断提供参考.此外,本课题组[25]还提出了基于多项式展开模型的脑图像配准算法,能够让脑图像在空间上达到精确地一致性,为构建完整的人脑图谱提供了较大的技术支持.下一步,本课题组将着力于利用高磁场强度的脑影像数据进行大脑分区工作,将大脑的各解剖结构进行划分,确定各组织边界,并进行后续的图谱标记.未来我们将加快图谱分区的速度和准确性,并探讨在脑图像配准及脑图谱定量分析中可能存在的其它问题,不断改进现有的实验算法.
5 总结本文从人脑图谱的发展过程、构建脑图谱的技术方法以及应用统计学方法对人脑图谱进行定量分析三部分展开叙述.第一部分着重罗列了目前研究者常用的五类人脑图谱:布罗德曼脑图谱、Talairach立体脑图谱、概率脑图谱、AAL脑图谱,以及最新脑图谱,详细介绍了它们的创建过程、应用现状及存在的不足,接着列举了目前一些单位所构建的适用于中国人群的大脑图谱;第二部分阐述了构建人脑图谱的基本技术方法,需要先通过配准将人脑图像标准化到同一个参考空间,再通过分区将脑区进行划分,为后续人脑图谱的精确标记提供技术支持;第三部分是对精确标记后的人脑图谱应用统计学方法进行定量分析,VBM方法和TBSS方法可以从一定程度上对患者的脑区异常区域进行检测和分析,以便后续临床的应用和诊断.
近年来,MRI技术的出现可以对人脑进行无创成像,借助人脑图谱,可以得出人脑结构的变化.本文就脑图谱目前的发展现状及存在的不足,以及本人所在课题组的研究进展进行了初步阐述及探讨,从而为建立一个科学、精确的人脑图谱做些铺垫.
| [1] |
CHEN H Y, ZHAO S L, LI X N, et al. B1 mapping on low-field permanent magnet MRI scanner[J].
Chinese J Magn Reson, 2018, 35(4): 498-504.
陈海燕, 赵世龙, 李晓南, 等. 低场永磁体磁共振射频场映像[J]. 波谱学杂志, 2018, 35(4): 498-504. |
| [2] | DAWSON J E, MATSON J L, CHERRY K E. An analysis of maladaptive behaviors in persons with autism, PDD-NOS, and mental retardation[J]. Res Dev Disabil, 1998, 19(5): 439-448. DOI: 10.1016/S0891-4222(98)00016-X. |
| [3] | SZESZKO P R, ARDEKANI B A, ASHTARI M, et al. White matter abnormalities in first-episode schizophrenia or schizoaffective disorder:a diffusion tensor imaging study[J]. Am J Psychiatry, 2005, 162(3): 602-605. DOI: 10.1176/appi.ajp.162.3.602. |
| [4] | PENFIELD W, JASPER H. Epilepsy and the functional anatomy of the human brain[J]. South Med J, 1954, 47(7): 704. |
| [5] | CABEZAS M, OLIVER A, LLADÓ X, et al. A review of atlas-based segmentation for magnetic resonance brain images[J]. Comput Methods Programs Biomed, 2011, 104(3): e158-e177. DOI: 10.1016/j.cmpb.2011.07.015. |
| [6] | MA D, CARDOSO M J, MODAT M, et al. Automatic structural parcellation of mouse brain MRI using multi-atlas label fusion[J]. PLoS One, 2014, 9(1): e86576. DOI: 10.1371/journal.pone.0086576. |
| [7] | WANG H, SUH J W, DAS S R, et al. Multi-Atlas segmentation with joint label fusion[J]. IEEE Trans Pattern Anal Mach Intell, 2013, 35(3): 611-623. DOI: 10.1109/TPAMI.2012.143. |
| [8] |
ZHANG J, ZHANG C Z, ZHANG Y T. Advance clinical application of voxel-based morphometery[J].
International Journal of Medical Radiology, 2010, 33(4): 314-317.
张敬, 张成周, 张云亭. 基于体素的形态学测量技术临床应用进展[J]. 国际医学放射学杂志, 2010, 33(4): 314-317. DOI: 10.3784/j.issn.1674-1897.2010.04.Z0402. |
| [9] | SMITH S M, JENKINSON M, JOHANSEN-BERG H, et al. Tract-based spatial statistics:voxelwise analysis of multi-subject diffusion data[J]. Neuroimage, 2006, 31(4): 1487-1505. DOI: 10.1016/j.neuroimage.2006.02.024. |
| [10] | GAREY L J. Brodmann's localisation in the cerebral cortex[M]. US: Springer, 2000. |
| [11] | BRODMANN K. Vergleichende lokalisationslehre der grosshirnrinde in ihren prinzipien dargestellt auf grund des zellenbaues[M]. German: Barth, 1909. |
| [12] | ZILLES K, AMUNTS K. Centenary of Brodmann's map-conception and fate[J]. Nat Rev Neurosci, 2010, 11(2): 139-145. DOI: 10.1038/nrn2776. |
| [13] | TALAIRACH J J, TOURNOUX P. Co-planar stereotaxic atlas of the human brain[M]. New York: Georg Thieme Verlag, 1988. |
| [14] | LANCASTER J L, WOLDORFF M G, PARSONS L M, et al. Automated Talairach atlas labels for functional brain mapping[J]. Hum Brain Mapp, 2015, 10(3): 120-131. |
| [15] | DEVLIN J T, POLDRACK R A. In praise of tedious anatomy[J]. Neuroimage, 2007, 37(4): 1033-1041. DOI: 10.1016/j.neuroimage.2006.09.055. |
| [16] | EICKHOFF S B, STEPHAN K E, MOHLBERG H, et al. A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data[J]. Neuroimage, 2005, 25(4): 1325-1335. DOI: 10.1016/j.neuroimage.2004.12.034. |
| [17] | ASHBURNER J, FRISTON K J. Nonlinear spatial normalization using basis functions[J]. Hum Brain Mapp, 2015, 7(4): 254-266. |
| [18] | TZOURIO-MAZOYER N, LANDEAU B, PAPATHANASSIOU D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J]. Neuroimage, 2002, 15(1): 273-289. DOI: 10.1006/nimg.2001.0978. |
| [19] | GLASSER M F, COALSON T S, ROBINSON E C, et al. A multi-modal parcellation of human cerebral cortex[J]. Nature, 2016, 536(7615): 171-178. DOI: 10.1038/nature18933. |
| [20] | TANG Y, HOJATKASHANI C, DINOV I D, et al. The construction of a Chinese MRI brain atlas:A morphometric comparison study between Chinese and Caucasian cohorts[J]. Neuroimage, 2010, 51(1): 33-41. DOI: 10.1016/j.neuroimage.2010.01.111. |
| [21] | LIANG P, SHI L, CHEN N, et al. Construction of brain atlases based on a multi-center MRI dataset of 2020 Chinese adults[J]. Sci Rep, 2015, 5: 18216. |
| [22] | FAN L Z, LI H, ZHUO J J, et al. The human brainnetome atlas:A new brain atlas based on connectional architecture[J]. Cereb Cortex, 2016: 3508-3626. |
| [23] | 门卫伟.中西方人脑形态学研究与大样本中国人脑模板构建[D].上海: 华东师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10269-1014150537.htm |
| [24] |
WANG Y J, LIU Y. A groupwise registration method based on topology center of images[J].
Chinese J Magn Reson, 2018, 35(4): 457-464.
王远军, 刘玉. 基于图像集拓扑中心的群体配准方法[J]. 波谱学杂志, 2018, 35(4): 457-464. |
| [25] |
LI J, JIANG F, WEI L, et al. Magnetic resonance image-based Chinese brain template construction[J].
Chinese Journal of Medical Physics, 2017, 34(6): 614-618.
李均, 蒋帆, 魏乐, 等. 基于磁共振图像构建中国人脑模板[J]. 中国医学物理学杂志, 2017, 34(6): 614-618. DOI: 10.3969/j.issn.1005-202X.2017.06.015. |
| [26] |
JIANG F, WANG Y J. Construction of human brain templates with diffusion tensor imaging data:A review[J].
Chinese J Magn Reson, 2018, 35(4): 520-530.
蒋帆, 王远军. 扩散张量成像的人脑模板构建[J]. 波谱学杂志, 2018, 35(4): 520-530. |
| [27] | ALPERT N M, BRADSHAW J F, KENNEDY D, et al. The principal axes transformation——a method for image registration[J]. J Nucl Med, 1990, 31(10): 1717-1722. |
| [28] |
SUN T, HAN S Q, WANG J W. Image theory, predominance and clinical applications of PET/CT[J].
Chinese Journal of Medical Physics, 2010, 5(1): 1581-1582.
孙涛, 韩善清, 汪家旺. PET/CT成像原理、优势及临床应用[J]. 中国医学物理学杂志, 2010, 5(1): 1581-1582. DOI: 10.3969/j.issn.1005-202X.2010.01.003. |
| [29] |
CHEN G Y, XU S N, LI Z H, et al. Contour-based multisensor image registration with rigid transformation[J].
Systems Engineering and Electronics, 2007, 29(7): 1169-1173.
陈桂友, 徐胜男, 李振华, 等. 刚体变换下基于轮廓的多传感器图像配准算法[J]. 系统工程与电子技术, 2007, 29(7): 1169-1173. DOI: 10.3321/j.issn:1001-506X.2007.07.035. |
| [30] | CASPERS S, EICKHOFF S B, ZILLES K, et al. Microstructural grey matter parcellation and its relevance for connectome analyses[J]. NeuroImage, 2013, 80: 18-26. DOI: 10.1016/j.neuroimage.2013.04.003. |
| [31] | SCHLEICHER A, AMUNTS K, GEYER S, et al. Observer-independent method for microstructural parcellation of cerebral cortex:A quantitative approach to cytoarchitectonics[J]. Neuroimage, 1999, 9(1): 165-177. DOI: 10.1006/nimg.1998.0385. |
| [32] | ASHBURNER J, FRISTON K J. Voxel-based morphometry-the methods[J]. Neuroimage, 2000, 11(6): 805-821. DOI: 10.1006/nimg.2000.0582. |
| [33] | HOLMES A P, FRISTON K J, WORSLEY K J, et al. Statistical parametric maps in functional imaging:A general linear approach[J]. Hum Brain Mapp, 1994, 2(4): 189-210. DOI: 10.1002/hbm.460020402. |
| [34] | 吴小伟.颞叶癫痫患者脑灰质与白质的基于体素的形态测量学研究[D].福建: 厦门大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10384-1014227545.htm |
| [35] | CHUGANI H T, SHIELDS W D, SHEWMON D A, et al. Infantile spasms:Ⅰ. PET identifies focal cortical dysgenesis in cryptogenic cases for surgical treatment[J]. Ann Neurol, 2010, 27(4): 406-413. |
| [36] | MCKHANN G, DRACHMAN D, FOLSTEIN M, et al. Clinical diagnosis of alzheimer's disease:report of the Nincds-Adrda work group under the auspices of department of health and human services task force on alzheimer's disease[J]. Neurology, 1984, 34(7): 939-944. DOI: 10.1212/WNL.34.7.939. |
| [37] |
TAN Z, CHEN W B, PANG Y H, et al. Applications of resting⁃state functional MRI in low-frequency fluctuation combined with voxel-based morphometry in schizophrenia[J].
Journal of Practical Medicine, 2017, 33(14): 2380-2385.
谭志, 陈武标, 庞燕华, 等. 低频振幅fMRI联合基于体素的形态学分析在精神分裂症中的应用[J]. 实用医学杂志, 2017, 33(14): 2380-2385. DOI: 10.3969/j.issn.1006-5725.2017.14.034. |
| [38] | MAKRIS N, WORTH A J, SORENSEN A G, et al. Morphometry of in vivo human white matter association pathways with diffusion-weighted magnetic resonance imaging[J]. Ann Neurol, 1997, 42(6): 951-962. DOI: 10.1002/ana.410420617. |
| [39] |
XIA Y H, GUO S Q, PEI K Y, et al. A diffusion tensor imaging study of brain white matter and cognitive function in first-episode of childhood and adolescence-onset schizophrenia[J].
Chinese Journal of Psychiatry, 2017, 50(6): 432-438.
夏艳红, 郭素芹, 裴科阳, 等. 首次发病儿童青少年精神分裂症患者脑白质弥散张量成像特点与认知功能的研究[J]. 中华精神科杂志, 2017, 50(6): 432-438. DOI: 10.3760/cma.j.issn.1006-7884.2017.06.008. |
| [40] | BOHANNA I, GEORGIOU-KARISTIANIS N, EGAN G F. Connectivity-based segmentation of the striatum in Huntington's disease:Vulnerability of motor pathways[J]. Neurobiol Dis, 2011, 42(3): 475-481. DOI: 10.1016/j.nbd.2011.02.010. |
| [41] |
DING B, LING H W, WANG T, et al. Investigation of white matter by tract-based spatial statistics in patients with Alzheimer's disease[J].
Diagnostics Theory and Practice, 2013, 3: 269-273.
丁蓓, 凌华威, 王涛, 等. 采用基于纤维束示踪的空间统计分析方法观察阿尔茨海默病患者的脑白质改变[J]. 诊断学理论与实践, 2013, 3: 269-273. |
| [42] |
ZHANG J H, GU J W, QI F B, et al. A research of secondary injury of rat intracerebral hematoma by using 7 tesla upfield magnetic resonance imaging[J].
Chinese Journal of Neuromedicine, 2012, 11(6): 586-589.
张俊海, 顾建文, 郜发宝, 等. 大鼠脑内血肿继发性损伤7 T核磁共振影像学研究[J]. 中华神经医学杂志, 2012, 11(6): 586-589. DOI: 10.3760/cma.j.issn.1671-8925.2012.06.011. |
| [43] | SHU N, LI J, LI K, et al. Abnormal diffusion of cerebral white matter in early blindness[J]. Hum Brain Mapp, 2010, 30(1): 220-227. |
| [44] | FOCKE N K, YOGARAJAH M, BONELLI S B, et al. Voxel-based diffusion tensor imaging in patients with mesial temporal lobe epilepsy and hippocampal sclerosis[J]. Neuroimage, 2008, 40(2): 728-737. DOI: 10.1016/j.neuroimage.2007.12.031. |
| [45] | TUCH D S, SALAT D H, WISCO J J, et al. Choice reaction time performance correlates with diffusion anisotropy in white matter pathways supporting visuospatial attention[J]. P Natl Acad Sci U S A, 2005, 102(34): 12212-12217. DOI: 10.1073/pnas.0407259102. |
 2020, Vol. 37
2020, Vol. 37