2. 中国药科大学 药物研究院, 江苏 南京 210009
2. Pharmaceutical Research Institute, China Pharmaceutical University, Nanjing 210009, China
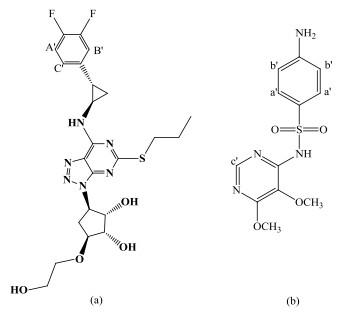
替格瑞洛[ticagrelor图 1(a)],化学名为(1S, 2S, 3R, 5S)-3-[7-[(1R, 2S)-2-(3, 4-二氟苯基)环丙氨基]-5-(硫丙基)-3H-[1,2,3]三唑[4, 5-d]嘧啶-3-基]-5-(2-羟基乙氧基)环戊烷-1, 2-二醇,是由英国阿斯利康公司研制开发的一种新的治疗急性冠状动脉综合征的药物[1],其通过防止血液中血小板形成结块来预防血栓,进而减少心血管事件的发生.2011年7月20日,美国食品及药物管理局(Food and Drug Administration,FDA)正式批准替格瑞洛上市.目前,《中国药典》2015年版及最新版的《美国药典》、《欧洲药典》、《日本药局方》均未收载替格瑞洛的质量标准.作为创新药,目前报道较多的是替格瑞洛的药理作用及疗效[2-7],其检测方法也有少量报道,如高效液相色谱法(High Performance Liquid Chromatography,HPLC)及液相色谱-串联质谱(Liquid Chromatography-Tandem Mass Spectroscopy,LC/MS/MS)[8].虽然光谱法准确可靠,但需特定的对照品才能完成定量测定[9, 10].目前,还未见使用核磁共振(Nuclear Magnetic Resonance,NMR)技术对其含量进行测定的报道.
|
图 1 (a) 替格瑞洛和(b)磺胺多辛的化学结构(字母标记处的质子信号为所选定量峰) Fig. 1 Chemical structures of (a) ticagrelor and (b) sulfadoxin (marked signals were selected for quantitative analysis) |
定量核磁共振法(Quantitative NMR,QNMR)基于各化学环境中质子吸收峰的面积与质子数呈正比,不需特定的对照品、快速准确、特异性强,特别适合无对照品的新药的含量测定.核磁共振氢谱(1H NMR)因具有较高的检测灵敏度,广泛应用于医药[11]、化学[12]及化工[13]等领域,已被收载于《中国药典》2015版.本文以磺胺多辛,化学名为4-(对氨基苯磺酰氨基)-5, 6-二甲氧基嘧啶[图 1(b)]为内标,根据作者所在课题组的经验[14]建立了基于1H NMR测定替格瑞洛原料药绝对含量的方法,研究了溶剂、内标物及NMR实验参数对测量结果的影响,为该物质的含量测定提供了一种新思路.
1 实验部分 1.1 仪器与试剂Bruker Avance 300型超导NMR谱仪,配备QNP探头;分析用电子天平(Mettler Toledo,AB265-S,感量0.01 mg);真空干燥箱(上海精宏实验设备有限公司).替格瑞洛待测样品(扬子江药业集团有限公司提供);磺胺多辛内标(批号40918,质量分数为98.0%,中国食品药品检定研究院提供);氘代甲醇(CD3OD,99.8%氘代,Sigma-Aldrich公司).
1.2 样品制备分别精密称取一定量的磺胺多辛及替格瑞洛待测样品,置于同一离心管,加入0.5 mL的CD3OD,振荡溶解、涡旋混匀,转移至5 mm NMR样品管中。
1.3 NMR实验和谱图处理通过分析溶剂、NMR实验参数,包括延迟时间(d1)、采样次数(ns)、脉冲翻转角(θ),及图谱处理技术对实验结果的影响(后文将给出具体的实验参数及其对实验结果的影响分析),本文最终确定的NMR检测方案为以CD3OD为溶剂,以磺胺多辛为内标,测试条件如下:谱宽为3 511.5 Hz(谱仪对应的质子共振频率为300.1 MHz时)、中心频率为1 470.6 Hz(谱仪对应的质子共振频率为300.1 MHz时)、θ=30˚、时间域数据点为32 k,测定温度为308 K,延迟时间为10 s,ns为16.每份样品平行测定5次,取平均值.采用线宽因子为0.3 Hz的窗函数对原始的自由感应衰减(Free Induction Decay,FID)信号进行傅里叶变换得到频域谱,然后对谱图进行手动相位和基线校正,以及化学位移定标处理.
1.4 替格瑞洛含量的测定采用(1)式计算待测样品替格瑞洛样品的含量:
| ${P_x} = \frac{{{I_x}}}{{{I_{{\rm{IS}}}}}} \cdot \frac{{{N_{{\rm{IS}}}}}}{{{N_x}}} \cdot \frac{{{M_x}}}{{{M_{{\rm{IS}}}}}} \cdot \frac{{{m_{{\rm{IS}}}}}}{{{m_x}}} \cdot {P_{{\rm{IS}}}}$ | (1) |
Ix为替格瑞洛待测样品定量峰的积分面积,IIS为磺胺多辛内标定量峰的积分面积;Nx和NIS分别为替格瑞洛待测样品和磺胺多辛内标定量峰包含的质子数(Nx = 3,NIS = 5);Mx和MIS分别为替格瑞洛和磺胺多辛的相对分子质量(Mx = 522.57,MIS = 310.33);mx和mIS分别为替格瑞洛待测样品和磺胺多辛内标的称样量;Px和PIS分别为替格瑞洛和磺胺多辛内标的质量分数(PIS = 98.0%).
2 结果与讨论 2.1 实验条件的确定 2.1.1 溶剂的选择合适的溶剂除了对样品和内标均有良好的溶解性外,其残留的信号峰应不干扰所分析样品的信号峰.替格瑞洛在氯仿、二甲亚砜及甲醇中溶解较好,在水中微溶.但经过试验,我们发现当溶剂为氯仿和二甲亚砜时,替格瑞洛某些质子的NMR信号呈现为两组峰,影响定量的准确性;而当溶剂为CD3OD时,上述现象会随着探头温度的升高而消失.而且内标磺胺多辛在甲醇中也较易溶解.因此本文最终确定溶剂为CD3OD、测试温度为308 K.
2.1.2 NMR实验参数的选择 2.1.2.1 d1的选择在QNMR实验中,d1必须设定的足够长(≥5T1)[15],才能使原子核完全弛豫,进而确保被积分的信号强度与原子核数目呈正比.为考量d1对实验结果的影响,针对同一待测样品,我们分别将d1设置为2 s、5 s、10 s、20 s和40 s.结果表明,当d1≥10 s后,待测样品及内标的定量峰的积分面积不再变化.为同时满足d1≥5T1,且节省采样时间,本文选择d1为10 s.
2.1.2.2 ns的选择ns的大小直接影响NMR信号的信噪比(Signal to Noise Ratio,S/N):ns越大,信噪比越高,定量越准确;反之,则会影响定量的准确性.对于QNMR,一般要求S/N ≥ 250[16].但ns越大,采样时间也越长.为考量ns对实验结果的影响,针对同一待测样品,我们分别将ns设定为2、4、8、16、32和64.结果表明,当ns≥16时,待测样品及内标NMR定量峰的信噪比已满足定量分析的要求,为节省采样时间,本文选择ns为16.
2.1.2.3 θ的选择为考量θ对实验结果的影响,针对同一待测样品,我们对θ设置为10˚~90˚范围,间隔为10˚,对样品与内标定量峰的积分面积之比进行了分析。结果显示,当θ ≥ 20˚时,样品与内标定量峰的积分面积之比已无明显变化,定量峰信噪比满足定量要求.当θ = 30˚时,实验条件稳定,所需延迟时间较少,故选择θ = 30˚作为实验的脉冲角度.
2.1.3 图谱处理技术NMR图谱的正确处理可以提高定量结果的准确度和精密度.采集到样品的自由感应衰减(Free Induction Decay,FID)信号后,需首先利用傅里叶变换将时域谱变换为频域谱。较大的线宽因子可以提高信号的信噪比,但是也会使得临近信号分辨率下降[15].综合考虑,本文采用线宽因子为0.3 Hz的窗函数对原始的FID信号进行傅里叶变换得到频域谱.然后,对NMR图谱的后处理包括相位和基线校正、化学位移定标,以及定量峰积分.相位和基线校正的质量会显著影响积分面积,进而影响定量的准确性.在QNMR实验中,最理想的相位校正方式是经验丰富的操作者进行手动相位校正.基线校正有多种方法,包括多项式函数法、sine函数法、指数函数法、三次样条差值法、分段校正法等.其中多项式函数法易于操作、直观简单,应用较多;而且手动校正的效果明显优于自动校正.正确进行相位和基线校正、准确进行化学位移定标之后,即可对所选的定量峰进行积分.一般而言,为使积分面积的准确度达到99%,积分范围应为峰宽的32倍[17].本文严格按照图谱处理技术的要求对NMR图谱进行处理,以得到准确的结果.
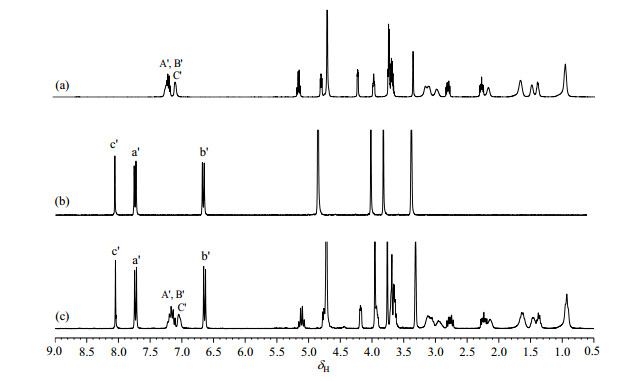
2.1.4 内标及定量峰的选择理想的内标应满足以下条件:内标的定量峰与待测样品的定量峰分离良好,易溶于测试溶剂,不与待测样品相互作用,分子量与待测样品接近,等等.替格瑞洛的1H NMR谱图(图 2)显示其在高场区δH 0.5~5.5和低场区δH 6.8~7.7信号较为密集,因此,可选择在低场区(δH 5.5~6.8和δH 7.7~8.5)出现信号的物质作为内标.综合考虑NMR图谱特征、所用溶剂,参照文献[18]以及本课题组的实践经验:磺胺多辛在δH 5.5~6.8和δH 7.7~8.5区域峰型简单、与样品信号无重叠;性质稳定;分子量较大,与替格瑞洛分子量之比约为1:2;作为内标物称样量与样品称样量近似,可减少称样量误差;溶解性良好.因此,本文选择磺胺多辛作为内标物.而盐酸吉西他滨在甲醇中溶解性较差,不宜作为内标.
|
图 2 (a) 替格瑞洛、(b)磺胺多辛,以及(c)两者混合物的1H NMR谱 Fig. 2 1H NMR spectra of ticagrelor (a), sulfadoxin (b), and their mixed solutions (c) |
待测样品及内标的定量峰均应选择不受其他信号干扰的孤立峰.若化合物中多个信号均符合上述条件,最好采用其积分面积之和,以减小误差.处于不同化学环境的质子的NMR弛豫时间不同,在QNMR实验中,待测样品和内标最好选择处于相似化学环境的质子作为定量峰.由图 2可知,替格瑞洛位于δH 7.14和δH 7.04的信号尽管裂分为多重峰,但是仍相对独立,而且与磺胺多辛位于δH 8.04、δH 7.73和δH 6.54的信号均无重合,因此本文选定δH 7.14(2H, m)和δH 7.04(1H, s)为替格瑞洛待测样品的定量峰,δH 8.04(1H, s)、δH 7.73(2H, d)和δH 6.54(2H, d)为磺胺多辛内标的定量峰.为验证选用替格瑞洛中多重质子峰做定量的影响,我们进一步做了19F NMR定量实验,其测定结果为替格瑞洛含量是99.3%。在95%的置信水平时,结果与1H NMR结果相比较没有显著性差异.
2.2 替格瑞洛待测样品的含量测定通过上述分析,本文最终确定的NMR实验条件如1.3节所述.替格瑞洛待测样品1H NMR谱中位于δH 7.14(2H, m)和δH 7.04(1H, s)的信号作为其定量峰,磺胺多辛内标1H NMR谱中位于δH 8.04(1H, s)、δH 7.73(2H, d)和δH 6.54(2H, d)的信号作为其定量峰.并按照(1)式计算待测样品中替格瑞洛的含量:Ix为替格瑞洛待测样品的1H NMR谱中位于δH 7.14和δH 7.04的信号的积分面积之和,IIS为磺胺多辛内标1H NMR谱中位于δH 8.04、δH 7.73和δH 6.54的信号的积分面积之和;Nx和NIS分别为替格瑞洛待测样品和磺胺多辛内标定量峰包含的质子数(Nx = 3,NIS = 5).
测定供试品的结果如表 1所示,以磺胺多辛为内标,含量均值为99.4%,相对标准偏差(Relative Standard Deviation,RSD)为0.20%.
| 表 1 替格瑞洛含量测定结果 Table 1 Quantitative test of ticagrelor |
目前,国际上尚未发布关于NMR定量分析方法建立与验证的相关技术规范,参照人用药品注册技术要求国际协调会(International Conference on Harmonization,ICH)[19]的指导原则和相关文献[20],我们对该方法的线性范围、精密度、稳定性和耐用性进行了验证.
2.2.1 线性范围的测定保持内标质量不变,使替格瑞洛待测样品与磺胺多辛内标物质的量之比在0.8:1~1.2:1范围内变化,精密称取内标和替格瑞洛样品适量于离心管中.按照1.2节所述配制5份系列溶液,依据1.3节所述进行NMR实验和谱图处理,以替格瑞洛待测样品与磺胺多辛内标的物质的量比X为横坐标,其单位质子数的积分面积(定量峰积分面积之和除以所用定量质子数)Y为纵坐标,进行线性回归,得回归方程为:Y=1.053X - 0.081(r = 0.996,n=5),表明在替格瑞洛待测样品与磺胺多辛内标物质的量之比在0.8:1~1.2:1范围内,线性关系良好(具体结果见表 2).
| 表 2 线性范围测定 Table 2 Linearity range determination |
精密称取磺胺多辛内标和替格瑞洛待测样品适量于离心管中,平行制备6份样品,按照1.3节所述于不同天进行1H NMR实验和谱图处理,每份样品平行测定5次,按照(1)式计算替格瑞洛含量,考察该方法的日内精密度及日间精密度.结果表明,第一天和第二天测得替格瑞洛含量分别为99.1%、99.4%,RSD分别为0.08%、0.10%(n=6);不同天测得样品中替格瑞洛含量平均值为99.2%,RSD为0.17%(n=6),表明该方法的日内及日间精密度均良好,具体结果见表 3.
| 表 3 日内及日间精密度的测定 Table 3 Intra-day and inter-day precisions of the quantitative test |
取同一待测样品溶液分别在一天内的第0、6、12和24 h进行NMR实验,结果显示待测样品中替格瑞洛与磺胺多辛内标的峰面积之比的RSD为0.09%(n=4).表明待测样品的CD3OD溶液室温放置24 h稳定.
2.2.4 耐用性实验耐用性系指当测试条件有微小变动时,测定结果不受影响的承受程度.本文主要考察采样次数、温度及内标的量变化对该实验结果的影响,按1.2节所述配制样品,在采样次数为12、16、20,测试温度为308 K、313 K,内标称样量变化范围小于1 mg实验条件下分别采集1H NMR谱图.结果表明,在采样次数为12~20范围内变化时,采样次数对测定结果的影响较小,待测样品中替格瑞洛含量测定值的RSD为0.20%;测试温度在308~313 K的范围变化时,待测样品中替格瑞洛含量测定值的RSD为0.16%;当内标称样量在(5.9±1) mg范围内变化时,待测样品中替格瑞洛含量测定值的RSD为0.19%:表明该方法耐用性较好.
3 结论各国药典尚未收载新药替格瑞洛含量测定的质量标准,而且相关文献报道也较少,故对其研究具有重要意义.本文基于1H NMR技术,以磺胺多辛为内标、CD3OD为溶剂,直接称量法配制待测样品溶液,在理想的实验条件下,选择1H NMR谱中位于δH 7.14和δH 7.04的信号为替格瑞洛定量峰,位于δH 8.04、δH 7.73和δH 6.54的信号为磺胺多辛内标的定量峰,测得待测样品中替格瑞洛含量为99.4%(RSD = 0.20%).虽然在本文所采用的原料药及内标质量较大(均为毫克级),但是提高NMR谱仪磁场强度或者采用超低温探头等方法均可以大大降低所需的样品量.本文所建立的方法操作简便、快速准确、不破坏样品,为替格瑞洛研发过程中的含量测定提供了一种新的手段,也为其质量控制研究提供了实验依据.
| [1] |
LIANG D W, DONG J H. Ticagrelor[J].
Chin J Med Chem, 2011, 21(6): 509-510.
梁大伟, 董金华. 替格瑞洛[J]. 中国药物化学杂志, 2011, 21(6): 509-510. |
| [2] | JAMES S, AKERBLOM A, CANNON C P, et al. Comparison of ticagrelor, the first reversible oral P2Y 12 receptor antagonist, with clopidogrel in patients with acute coronary syndromes:rationale, design, and baseline characteristics of the PLATelet inhibition and patient outcomes (PLATO) trial[J]. Am Heart J, 2009, 157(4): 599-605. DOI: 10.1016/j.ahj.2009.01.003. |
| [3] |
YANG X W, ZHANG J Y, YI F, et al. Effect of ticagrelor on patients undergoing percutaneous coronary intervention with acute coronary syndrome[J].
Chin J Clinicians, 2013, 7(19): 8696-8670.
杨晓伟, 张君毅, 易甫, 等. 替格瑞洛对急性冠状动脉综合征择期介入治疗患者近中期疗效观察[J]. 中华临床医师杂志, 2013, 7(19): 8696-8670. |
| [4] |
MA Y Y, WANG Y X, XU B G, et al. Short term clinical efficacy and safety of ticagrelor in patients received percutaneous coronary intervention[J].
Chin J Intervent Cardiol, 2014(6): 380-383.
马颖艳, 王艳霞, 徐白鸽, 等. 替格瑞洛用于经皮冠状动脉介入治疗术后患者抗血小板治疗短期内的有效性和安全性研究[J]. 中国介入心脏病学杂志, 2014(6): 380-383. DOI: 10.3969/j.issn.1004-8812.2014.06.010. |
| [5] | GURBEL P A, BLIDEN K P, BUTLER K, et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease[J]. Circulation, 2009, 120(25): 2577-2585. DOI: 10.1161/CIRCULATIONAHA.109.912550. |
| [6] |
ZHU Y H, JIA G L, ZHOU M, et al. Clinical effects of ticagrelor in 41 Chinese acute coronary syndrome patients[J].
Chin J Intervent Cardiol, 2013, 21(6): 374-375.
朱永宏, 贾国良, 周妙, 等. 替格瑞洛治疗41例急性冠状动脉综合征患者的临床疗效[J]. 中国介入心脏病学杂志, 2013, 21(6): 374-375. |
| [7] | TENG R, OLIVER S, HAYES M A, et al. Absorption, distribution, metabolism, and excretion of ticagrelor in healthy subjects[J]. Drug Metab Dispos, 2010, 38(9): 1514-1521. DOI: 10.1124/dmd.110.032250. |
| [8] | SILLEN H, COOK M, DAVIS P. Determination of ticagrelor and two metabolites in plasma samples by liquid chromatography and mass spectrometry[J]. J Chromatogr B, 2010, 878(25): 2299-2306. DOI: 10.1016/j.jchromb.2010.06.018. |
| [9] |
HUANG P, GAO L, SIMA L, et al. The method improvement of determination of tetracycline tablets by HPLC[J].
Northwest Pharml J, 2014, 29(3): 255-257.
黄萍, 高林, 司马磊, 等. 高效液相色谱法测定四环素片含量的方法改进[J]. 西北药学杂志, 2014, 29(3): 255-257. DOI: 10.3969/j.issn.1004-2407.2014.03.014. |
| [10] |
HU M, HU C Q, LIU W Y. Determination of drug reference substance content by 1H-nuclear magnetic resonance spectroscopy[J].
Chinese J Anal Chem, 2004, 32(4): 451-455.
胡敏, 胡昌勤, 刘文英. 核磁共振波谱法测定药物基准物质的绝对含量[J]. 分析化学, 2004, 32(4): 451-455. DOI: 10.3321/j.issn:0253-3820.2004.04.008. |
| [11] |
GUO S Q, LIU M K, YU S, et al. A quantitative NMR method to analyze vitamin B1, vitamin B2, nicotinamide and calcium pantothenate contents in compound vitamin B tablets[J].
Chinese J Magn Reson, 2016, 33(3): 442-451.
郭强胜, 刘明珂, 禹珊, 等. 定量核磁共振法同时测定复合维生素B片中B1、B2、烟酰胺和泛酸钙[J]. 波谱学杂志, 2016, 33(3): 442-451. |
| [12] |
ZHANG M, ZHAI G Q, LI G Y, et al. An auto-processing algorithm for liver fat quantification[J].
Chinese J Magn Reson, 2018, 35(4): 427-439.
张苗, 翟国强, 李改英, 等. 定量肝脏脂肪的波谱自动后处理算法[J]. 波谱学杂志, 2018, 35(4): 427-439. |
| [13] | FLORES I S, GODINHO M S, DE OLIVEIRA A E, et al. Discrimination of biodiesel blends with 1H NMR spectroscopy and principal component analyses[J]. Fuel, 2012, 99: 40-44. DOI: 10.1016/j.fuel.2012.04.025. |
| [14] |
ZHANG F F, JIANG M H, SUN L L, et al. Quantitative determination of sitafloxacin hydrate by proton nuclear magnetic resonance (1H NMR)[J].
Northwest Pharml J, 2015, 30(2): 137-141.
张芬芬, 蒋孟虹, 孙林林, 等. 核磁共振氢谱法(1H NMR)测定西他沙星标准物质的含量[J]. 西北药学杂志, 2015, 30(2): 137-141. DOI: 10.3969/j.issn.1004-2407.2015.02.010. |
| [15] | HOLZGRABE U. Quantitative NMR spectroscopy in pharmaceutical applications[J]. J Prog Nucl Magn Reson Spectrosc, 2010, 57(2): 229-240. DOI: 10.1016/j.pnmrs.2010.05.001. |
| [16] | HOLZGRABE U, DEUBNER R, SCHOLLMAYER C, et al. Quantitative NMR spectroscopy-applications in drug analysis[J]. J Pharm Biomed Anal, 2005, 38(5): 806-812. DOI: 10.1016/j.jpba.2005.01.050. |
| [17] | RABENSTEIN D L, KEIRE D A, POPOV A I, et al. Practical spectroscopy[M]. New York: Marcel Dekker Inc., 1991: 323-369. |
| [18] | BEKIROGLU S, MYRBERG O, ÖSTMAN K, et al. Validation of a quantitative NMR method for suspected counterfeit products exemplified on determination of benzethonium chloride in grapefruit seed extracts[J]. J Pharm Biomed Anal, 2008, 47(4/5): 958-961. |
| [19] | ICH EXPERT WORKING GROUP. Validation of analytical procedures: Text and methodology Q2(R1)[M]//ICH Harmonized Tripartite Guidelines. 2005: 1-13. |
| [20] | GADAPE H H, PARIKH K S. Quantitative determination and validation of metformin hydrochloride in pharmaceutical using quantitative nuclear magnetic resonance spectroscopy[J]. J Chem, 2011, 8(2): 767-781. |
 2020, Vol. 37
2020, Vol. 37 
