2. 中国科学院苏州生物医学工程技术研究所, 医学影像室, 江苏 苏州 215163
2. Medical Imaging Department, Suzhou Institute of Biomedical Engineering and Technology, Chinese Academy of Sciences, Suzhou 215163, China
正常组织的生理代谢有赖于细胞内外的酸碱平衡.某些疾病,如脑卒中、肾衰竭、肿瘤等,会导致或伴随细胞内外的酸碱平衡发生紊乱.快速准确地检测组织的酸碱变化,对于疾病的早期诊断以及治疗评估具有重要的科学意义和临床价值.pH微电极[1]、光学荧光成像[2]、正电子发射型计算机断层成像(Positron Emission Computed Tomography,PET)[3]等手段可以用来检测组织中pH变化,但是这些方法存在侵入性[4]、组织穿透深度有限、电离辐射损伤等问题,使其广泛应用受到很大制约.磁共振成像(Magnetic Resonance Imaging, MRI)具备无创性,随着MRI技术的不断发展,可以有效克服上述检测手段的不足,测定生物组织的pH.由于31P核化学位移对pH变化比较敏感,31P磁共振波谱(Magnetic Resonance Spectroscopy,MRS)技术[5]很早就被用来测定组织细胞内外的pH,但是波谱技术在实际应用时也面临着一些问题,例如空间分辨率有限、难以获得整个组织的pH空间分布.
利用质子交换速率与微环境pH之间的联系,化学交换饱和转移(Chemical Exchange Saturation Transfer,CEST)成像技术[6, 7]为克服上述技术手段的不足提供了新的途径.CEST成像是在磁化转移(Magnetic Transfer,MT)和化学交换理论基础上发展起来的一种新型的磁共振分子影像技术.其基本原理是对可交换质子施加预饱和脉冲,使其达到饱和状态,并与周围水质子发生化学交换作用,将饱和信号转移到水质子上.通过测定水分子在施加饱和脉冲前后的信号变化,可以间接获取特定分子的含量以及组织pH等重要的生物学信息[8].CEST应用于pH成像[9]主要分为外源性pH成像[10]和内源性pH成像[11]两种.应用于pH成像的外源性分子包括应用于临床的碘类对比剂和其他一些具有CEST信号的pH敏感型小分子;内源性pH成像则主要利用生物组织中大分子(如蛋白质、多肽等)中所含的酰胺质子和氨基质子.
本文详细总结了2000年以来CEST MRI技术在pH成像方面的进展,归纳了几类可以用于pH成像的外源性和内源性分子,重点分析了几种不同的pH成像方法及其原理,讨论了基于CEST机制的pH成像在脑中风、肿瘤以及肾脏疾病等方面的应用情况.
1 CEST成像原理CEST成像技术最早由Ward和Balaban[12]提出.一些生物大分子(包括蛋白质、多肽等)、脂质体、小分子等含有可交换质子,利用射频脉冲使它们达到饱和状态,通过化学交换作用将饱和效应传递给周围的水质子,从而引起水质子信号的降低,以此来获得生物体内这些分子的相关信息.CEST的原理如图 1所示.举例说明,若溶液中的溶剂为水,设定水质子的共振频率为δ0,而溶质质子相对于水质子的共振频率为
|
图 1 CEST成像技术的原理 Figure 1 Principle of CEST imaging |
以射频脉冲频率为横坐标,水质子相对于未施加脉冲时的磁共振信号强度(Ms/M0)为纵坐标作出的图谱被称为Z谱或CEST谱[13],通过不对称分析(④)计算出的CEST信号,称为MTRasym谱[7].通过MTRasym值的大小和共振频率的位置,可以获得有关溶质浓度和成分的信息.当CEST技术应用于活体组织时,溶质和溶剂就分别对应生物体内的大分子和游离水分子.能产生CEST效应的前提条件是溶质质子与水质子间的共振频率之差要大于其质子交换的速率(
| $ PTR = \frac{{{k_{SW}} \cdot \alpha \cdot {X_{CA}}}}{{{R_{1W}} + {k_{SW}} \cdot {X_{CA}}}}[1 - {{\rm{e}}^{ - ({R_{{\rm{1}}W}} + {k_{SW}} \cdot {X_{CA}}){t_{sat}}}}] $ | (1) |
(1) 式中,α为溶质质子的饱和效率,XCA为溶质质子与水质子的摩尔百分比,R1W为水质子的纵向驰豫速率,
对比剂在CEST成像中起到至关重要的作用.与传统弛豫机制的MRI对比剂不同,CEST对比剂可以选择性打开或关闭产生的对比度,这给体内MRI提供了很大的灵活性.CEST对比剂包括外源性和内源性两大类.外源性CEST对比剂主要包括金属螯合物和应用于临床的碘类对比剂等;内源性CEST对比剂主要包括组织中含有酰胺质子和氨基质子的蛋白质和多肽分子,含有羟基质子的葡萄糖、糖原、肌醇等分子,以及其他体内代谢物小分子,例如谷氨酸、肌酸等[14].人体内有些分子虽然具有CEST效应,但是其体内浓度不足以被检测到.当这种对人体无害的小分子被用做对比剂注射到体内进行pH成像时,这种小分子对比剂也归为外源性CEST对比剂.
2.1 外源性CEST对比剂 2.1.1 抗磁性CEST对比剂2000年,Ward和Balaban等人[15]探究了一系列具有pH敏感性的化学分子,包括5, 6-二氢尿嘧啶、5-羟色氨酸和亚乙基硫脲等,这些分子中都含有两个不同化学位移的酰胺基或者氨基基团.2004年,Aime等人[16]发现了临床上用作CT对比剂的碘帕醇,也具有明显的CEST信号.碘帕醇分子有两类酰胺基和多个羟基,均具有CEST信号,并且有pH敏感性.但是由于羟基质子的共振频率与水质子太近,所以碘帕醇分子中羟基的CEST效应受关注较少;而两类酰胺基团由于与苯环连接方式不同,化学位移相差较大,分别为δ4.2和δ5.5.Longo等人[17]首次利用碘帕醇外源性对比剂获取了小鼠肾脏的pH分布图.随后其他类型的碘对比剂也开始被考虑应用于pH成像,例如碘佛醇[18]、碘普罗胺[19]、碘比醇[20]等.虽然碘比醇分子中只含一个共振频率的酰胺质子,但Longo等人巧妙利用交换质子对不同饱和强度射频脉冲的CEST响应也不同的效应,实现了仅仅使用单一共振频率的交换质子进行肾脏pH成像.2006年,McMahon等人[21]在开发用于测定质子间化学交换速率成像方法的过程中,发现多聚赖氨酸的交换速率与其所处环境的pH有关,这说明多聚赖氨酸具有良好的pH敏感性.最近,Yang等人[22]筛选一系列化学分子用于pH成像时,发现咪唑类及其衍生物具有良好的pH敏感性,将咪唑类衍生物尾静脉注射到小鼠体内,也实现了对小鼠肾脏的pH成像.值得一提的是,咪唑类衍生物的pH敏感交换质子,其化学位移相对于水质子达到δ7.8,是目前文献报道的抗磁性分子用于pH成像的最大化学位移之差.表 1整理了文献中用于pH成像的抗磁性分子的相关信息,包括有pH敏感的化学分子、交换质子相对于水质子的化学位移、pH响应范围等.
| 表 1 用于pH成像的外源抗磁性对比剂 Table 1 Exogenous diamagnetic contrast agents used for pH imaging |
除上述抗磁性CEST对比剂外,用于pH成像的外源性CEST对比剂还包括以金属螯合物为主体的顺磁性对比剂.影响CEST信号强度和敏感性的一个重要因素就是对比剂和水质子的交换速率
2001年,Aime等人[25]提出镧系元素(Eu、Dy、Ho、Er、Tm、Yb)和大环DOTAM-Gly络合物有pH敏感性,可用作pH成像的CEST对比剂.这种聚合物的共振基团是亚氨基(-NH),不同元素构成的聚合物有不同的共振频率.Yb元素的络合物Yb-DOTAM-Gly共振频率在偏离水质子δ-16处,其pH的检测范围为5.5~8.1.此后,越来越多的镧系元素的螯合物被研究者合成,并被证实具有CEST效应和pH敏感性.表 2总结了这些金属络合物和一些聚合物对比剂的共振频率、pH检测范围和实验参数等信息:
| 表 2 用于pH成像的外源顺磁性金属螯合物 Table 2 Exogenous paramagnetic metal chelate used for pH imaging |
外源性CEST对比剂具有敏感性高、背景信号低、特异性好等优势,在有效控制毒性和剂量的前提下更有利于获得准确的pH图像.但是由于自身的安全性和毒性问题,外源性CEST对比剂进行临床转化的难度无疑比内源性分子大很多.例如金属螯合物存在体内重金属离子沉积的问题.虽然碘类对比剂已经在临床检查中进行使用,但是也存在着副反应多和碘过量沉积的问题.基于外源性分子在肾脏和肿瘤组织的特殊富集特性,目前外源性CEST对比剂主要应用于这些组织和器官的pH成像.但是对于血脑屏障完整的脑组织和脊髓等,外源性对比剂的有效输送成为制约其广泛应用的瓶颈.
蛋白质和肽链氨基酸等内源性分子也是CEST技术的成像信号来源,是人体内重要的内源性CEST对比剂[31].蛋白质和肽链氨基酸中含有酰胺基团和氨基,它们相对于水质子的化学位移分别为δ3.50和δ2.75,这两种基团的CEST信号也对pH敏感,因此可以作为pH成像的内源性对比剂[32].而人体组织中有大量游离的蛋白质和肽链氨基酸分子,适合运用内源性的pH成像技术.Sun等人[33]就通过量化内源性对比剂的交换率和环境pH之间的关系,获取了体模的pH分布图.McVicar等人[34]将比率法应用于内源性酰胺基和氨基获取了缺血性脑组织的pH分布图.
虽然δ3.50处酰胺质子的CEST信号可以在3 T MRI扫描仪上被观测到,但δ2.75处氨基质子的CEST信号难以检测,而且δ2.75处的信号易被水质子的直接饱和(Directed Saturation,DS)信号所影响.因此,内源性CEST对比剂在临床上进行pH成像仍具有挑战性.
3 基于CEST技术的pH成像方法及应用研究者最初利用酰胺质子进行pH成像时,采用的方法是对交换质子施加单一强度的饱和脉冲,通过不对称分析来获取CEST信号与pH的关系.但是这种方法获得的仅仅是pH加权的图像,容易受到体系中交换质子的浓度、纵向弛豫时间(T1)、温度等多种因素的干扰[35].为此,后来研究人员陆续开发出其他的pH成像方法,主要包括:(1)外源性比率法及其改进方法;(2)内源性胺和酰胺浓度-独立检测(Amine and Amide Concentration-independent Detection,AACID)法;(3)内源性基于质子交换速率
2000年,Ward和Balaban[36]提出如果一个分子中有两个不同偏置频率的交换基团,利用不同基团处的CEST信号相比的方法,去除物质浓度和T1等对CEST信号强度的影响,原理如下:
当对含有具备CEST效应的分子的溶液或组织利用持续稳定的饱和脉冲照射时,水质子的信号可以表达为:
| $ {M_S}/{M_0} \approx [1/(1 + {k_{ex}} \cdot {f_{CA}} \cdot {T_{1W}})] $ | (2) |
(2) 式中,
| $ ({M_0} - M_S^{site1})/M_S^{site1} = k_{ex}^{site1} \cdot f_{CA}^{site1} \cdot {T_{1W}} $ | (3) |
| $ ({M_0} - M_S^{site2})/M_S^{site2} = k_{ex}^{site2} \cdot f_{CA}^{site2} \cdot {T_{1W}} $ | (4) |
所以(3)式和(4)式之比为:
| $ M_S^{site{\rm{2}}} \cdot ({M_0} - M_S^{site1})/[M_S^{site1} \cdot ({M_0} - M_S^{site2})] = k_{ex}^{site1} \cdot f_{CA}^{site1}/(k_{ex}^{site2} \cdot f_{CA}^{site2}) $ | (5) |
当
| $ M_S^{site{\rm{2}}} \cdot ({M_0} - M_S^{site1})/[M_S^{site1} \cdot ({M_0} - M_S^{site2})] = k_{ex}^{site1}/k_{ex}^{site2} $ | (6) |
而
经过静脉注射或皮下注射后,碘对比剂主要分布在细胞外液中,并且经肾小球滤过作用排出体外.因此可选用碘帕醇、碘普罗胺等对比剂,通过不同频率的比率法,研究肾脏疾病[17]中肾脏的pH变化.Aime等人[17]就利用这种方法将碘帕醇分子用于正常肾脏组织的pH成像,接着又将这一技术应用于急性肾损伤(Acute Kidney Injury,AKI)的动物模型中.由于AKI疾病进程短,损伤组织的pH变化会更大.Aime等人[37]在AKI动物模型中的实验结果证实了这一变化,整个肾脏pH平均值相对正常老鼠改变了0.5左右.
由于肿瘤细胞糖代谢紊乱,会生成大量乳酸,造成肿瘤组织的pH下降.同时肿瘤组织还有非常丰富的血管,外源性对比剂会大量富集在此,因此也有研究者将碘帕醇、碘普罗胺等对比剂用于肿瘤[19, 38]微环境的pH成像.通过不同频率的比率法,Moon等人[39]就利用碘帕醇和碘普罗胺作为外源性对比剂,进行肿瘤细胞微环境的pH成像.他们的结果显示,恶性肿瘤的细胞外微环境的pH值在6.5~6.9之间,较正常组织偏低一些.此外,还有选用美国食品药品监督管理局(Food and Drug Administration, FDA)核准的碘帕醇对比剂,通过不同频率的比率法进行临床肿瘤pH成像研究的相关报道[40].这也说明外源性对比剂对肿瘤进行pH成像的方法,将来有望在临床上推广使用[41].
3.2 不同饱和强度的比率法Ward和Balaban提出的不同共振频率的外源性对比剂比率法限制了外源性对比剂的种类,为了去除这种限制,Longo和Sun等人[20]提出了一种改进的比率法,即基于不同饱和强度的比率法.这种方法不需要一种对比剂有两个CEST信号,而只需要改变射频脉冲的强度,并求得不同饱和射频脉冲强度下的CEST信号的比率(RF Power Mismatch, RPM)即可:
| $ RPM = M_S^{RF{\rm{2}}} \cdot ({M_0} - M_S^{RF1})/[M_S^{RF1} \cdot ({M_0} - M_S^{RF2})] $ | (7) |
(7) 式与(6)式相似,但是前者是两个不同射频脉冲强度下CEST信号处理后的比值.该方法简化了对比剂的选取,使CEST技术在pH成像方面有了更广泛的应用.
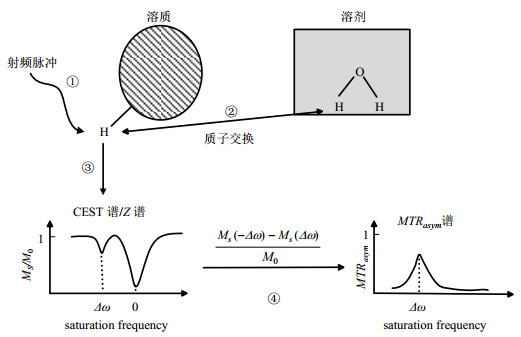
选用碘佛醇对比剂作为研究对象,我们分别在体模和大鼠肾脏上对这种不同饱和强度比率pH成像方法进行一定的尝试,实验结果如图 2和图 3所示,以上实验均在7 T布鲁克小动物MRI扫描仪上进行.图 2(a)显示的是不同pH条件下碘佛醇体模的Z谱图,碘佛醇体模的溶液浓度为30 mmol/L.Z谱采集范围为偏离水质子共振频率δ-8~8,间隔频率δ0.25.采用2 s连续波进行预饱和,然后用弛豫增强快速采集序列(Rapid Acquisition Relaxation Enhancement, RARE)进行信号读出,总共采集时间40 min.此外还通过饱和时间0.5 s,强度0.5 μT的连续波进行WASSR(Water Saturation Shift Referencing)采集来校正B0场不均匀性,采集范围为偏离水质子共振频率δ-2~2范围内,间隔频率为δ0.1.图 2(b)是射频脉冲强度在2 μT和6 μT下不同pH值的碘佛醇的CEST信号强度,结果显示碘佛醇的CEST信号是随着pH的增大先增大后减小,其CEST信号最强时的pH在7.5附近.图 2(c)是将两个射频脉冲强度下的CEST信号经(7)式处理后取对数,并建立其与pH的线性关系.结果显示碘佛醇的可有效测量pH的范围为pH 6.5~8.5.图 2(d)是利用2(c)得到的线性关系曲线检测未知体模的pH,结果显示根据线性关系测得的pH与滴定法测得的pH误差在±0.1之间.

|
图 2 利用碘佛醇和不同饱和强度比率法进行的体外体模pH测定实验. (a)不同pH时的Z谱;(b)两个强度射频脉冲照射下CEST信号强度与pH的关系;(c)不同强度射频脉冲照射下CEST信号比率值与pH的关系;(d)利用(c)图得到的线性关系检测未知体模的pH Figure 2 pH measurement for phantom using ioversol and ratiometric procedure at radio-frequency pulses of different powers. (a) Zspectra at different pH values; (b) CEST signal intensity changed with pH values irradiated using radio-frequency pulses with two powers; (c) Relationship between CEST ratio obtained from Fig. (b) and pH values; (d) Unknown pH values measurement using the linear relationship in Fig. (c) in vitro |
体内肾脏pH成像时,将碘佛醇用生理盐水配制成30 mmol/L溶液,以5 mL/kg体重的剂量给大鼠尾静脉注射送药.先用注射泵以18 mL/h快速注射一半剂量,然后以2 mL/h慢速持续给药.图 3(a)与3(b)是给药后分别在2 μT和6 μT饱和射频脉冲照射下大鼠肾脏的CEST图像,图 3(c)是采用不同饱和强度比率法获得的大鼠肾脏pH分布图.碘佛醇分子中只含有一个具有CEST效应的基团,因此只有在不同饱和强度的比率法被提出后才被用来进行pH成像.我们的体外实验结果显示这种方法得到的pH线性响应范围在6.5~8.5.体内我们测得的大鼠肾皮质、髓质、肾盂的pH均值分别为6.7、6.4、6.8,其中肾盂的pH值与文献[20]报道数值(6.5左右)之间有一定的偏差.可能原因是肾盂真实的pH值较小,超过该方法检测的线性pH范围.因此进行体内pH成像时,线性响应范围是选择对比剂和pH成像方法所需要考虑的一个重要因素.
|
图 3 利用碘佛醇和不同饱和强度的比率法进行的大鼠肾脏pH成像实验.(a) 2 μT饱和射频脉冲照射下大鼠肾脏的CEST图像;(b) 6 μT饱和射频脉冲照射下大鼠肾脏的CEST图像;(c)大鼠肾脏的pH分布图 Figure 3 pH imaging for rat's kidney using ioversol and ratiometric procedure at radio-frequency pulses of different powers. (a) CEST map of rat's kidney under irradiation with radio-frequency pulse of 2 μT; (b) CEST map of rat's kidney under irradiation with radio frequency pulse of 6 μT; (c) pH map of rat's kidney |
改进的不同饱和强度的比率法虽然可以去除对比剂必须含两种具有CEST效应的基团的限制,方便了对比剂的选取.但有些特定情况下,在已确定对比剂有两种具有CEST效应的基团(如临床上的碘类对比剂——碘帕醇)时,还需进一步提高CEST信号对pH的敏感性.Wu等人[42]提出了基于不同共振频率和不同饱和强度射频脉冲的CEST信号的比率法(Ratiometric Measurement by ratioing ST effects,
| $ {R_{{\rm{ST}}}} = ({M_0} - M_S^{site1, {\rm{ }}RF1})/({M_0} - M_S^{site2, {\rm{ }}RF2}) $ | (8) |
(8) 式中,
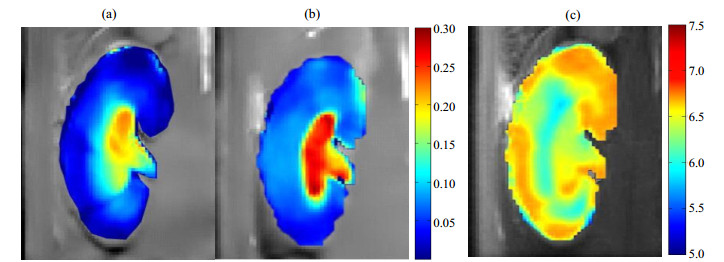
Wu等人[42]在4.7 T MRI扫描仪上利用碘帕醇作为对比剂进行了体模和肾脏pH成像实验,结果如图 4和图 5所示.图 4(a)~(c)分别是使用传统基于不同频率比率法测得的比率值图和pH图,以及pH真实值与测量值之间的相关性.图 4(d)~(f)分别是使用基于不同共振频率及不同饱和强度下的比率法测得的比率值图和pH图,以及pH真实值与测量值之间的相关性.结果显示相比传统的比率法,改进的比率法有更宽的pH响应范围(从5.5~7.0提高为5.5~7.5),准确度也明显提高.

|
图 4 利用碘帕醇作为对比剂进行的体模实验[42]. (a)~(c)分别为利用传统比率法测得的比率值图、pH图,以及pH真实值与测量值之间的相关性;(d)~(f)分别为利用基于不同共振频率及不同饱和强度射频脉冲的比率法测得的比率值图、pH图,以及pH真实值与测量值之间的相关性. RMSE表示均方根误差 Figure 4 Phantom experiments using iopamidol and ratiometric procedure[42]. (a)~(c) Ratiometric images, pH map and correlation between titrated pH and measured pH using traditional ratiometric procedure; (d)~(f) Ratiometric images, pH map and correlation between titrated pH and measured pH using improved ratiometric procedure based on different resonant frequencies and radio-frequency pulses of different power. RMSE: root mean square error |
|
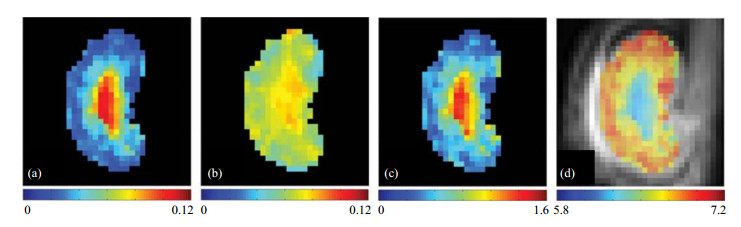
图 5 利用碘帕醇作为对比剂,以及基于不同共振频率和不同饱和射频脉冲强度的比率法进行的大鼠肾脏pH成像实验[42]. (a) δ5.5处用2 μT饱和射频脉冲照射下的大鼠肾脏的CEST图;(b) δ4.3处用1 μT饱和射频脉冲照射下的大鼠肾脏的CEST图;(c)大鼠肾脏的CEST信号比率图谱;(d)大鼠肾脏的pH分布图 Figure 5 pH imaging for rat's kidney using iopamidol and improved ratiometric procedure based on different resonant frequencies and radio-frequency pulses of different power[42]. (a) CEST map of rat's kidney irradiated with radio-frequency of 2 μT at δ5.5; (b) CEST map of rat's kidney irradiated with radio frequency of 1 μT at δ4.3; (c) Ratiometric image of rat's kidney; (d) pH map of rat's kidney |
图 5为Wu等人[42]利用改进的比率法进行的正常大鼠肾脏pH成像实验,通过尾静脉注射碘帕醇溶液,得到正常大鼠肾脏皮质、髓质和肾盂的pH值分别为(6.4±0.2)、(6.2±0.2)和(5.8±0.2).
3.4 内源性AACID法AACID法就是将比率法应用到内源性氨基质子(δ2.75)和酰胺质子(δ3.50)上来获取组织的pH图.McVicar等人[34]首先报导了利用内源性氨基基团和酰胺基团修正的CEST信号比,去除组织内交换质子浓度、T1值、核Overhauser效应(Nuclear Overhauser Effect,NOE)和温度等因素的干扰.这种方法与上文所述的基于不同共振频率的比率法原理相同,但对比剂不一样,基于不同共振频率的比率法使用的是外源性对比剂,而AACID法使用的是内源性对比剂.其计算公式为:
| $ AACID = \frac{{{M_Z}(\delta 3.50) \times [{M_Z}(\delta 6.0) - {M_Z}(\delta 2.75)]}}{{{M_Z}(\delta 2.75) \times [{M_Z}(\delta 6.0) - {M_Z}(\delta 3.50)]}} $ | (9) |
(9) 式中,AACID是胺和酰胺浓度-独立检测值,
McVicar [34]首先利用体模实验验证AACID法准确性,实验结果如图 6所示.图 6(a)~(c)分别为牛血清白蛋白在不同pH环境中氨基和酰胺基的CEST信号,图 6(d)为通过(9)式得到的AACID与pH的关系,其pH测量范围为6.0~8.0,完全适用于脑组织pH成像.图 6(e)和6(f)说明了AACID法不受温度和浓度的影响.
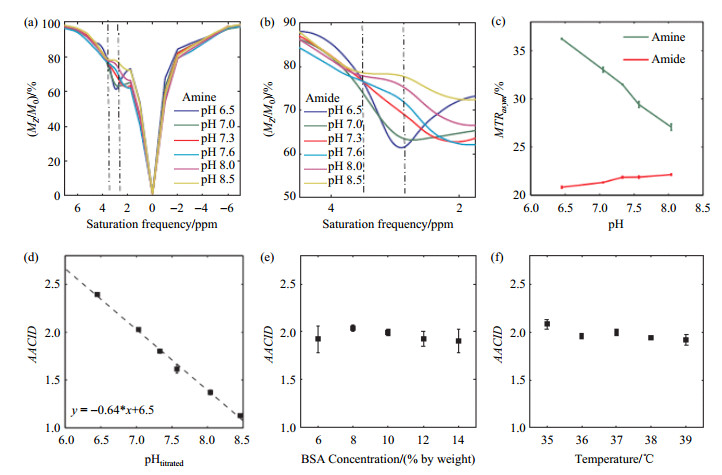
|
图 6 利用体模实验验证AACID法的准确性[34]. (a)~(c)分别为牛血清白蛋白在不同pH环境中氨基和酰胺基的CEST信号;(d)通过(9)式得到的AACID 与pH值的关系;(e)和(f)说明了AACID法不受温度和浓度的影响. Figure 6 Verified the accuracy of AACID method by phantom experiment[34]. (a)~(c) CEST signal of amine and amide of BSA in different pH environments; (d) Correlation between AACID and titrated pH; (e)~(f) AACID procedure is independent of temperature and concentration |
接着他们进一步将AACID法应用于缺血性脑中风疾病的研究中.如图 7所示,中风后脑组织由于血氧供给不足,pH值下降至6.5左右,而正常脑组织的pH范围在7.0~7.4.这一结果显示出内源性ACCID法监测脑中风组织pH变化是完全可行的.此后还有研究者将AACID法应用在脑肿瘤pH成像中[43].由于AACID法利用到δ2.75处氨基质子的CEST信号,氨基质子的交换速率很快,在3 T MRI扫描仪的应用,容易受到酰胺质子和水质子直接饱和信号的干扰.
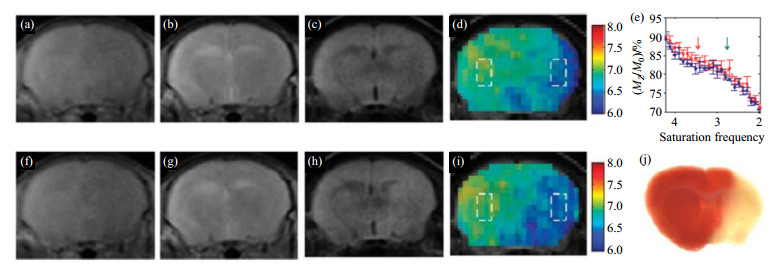
|
图 7 脑贫血实验[34]. (a)~(e)分别为缺血2 h后的T1加权图、T2加权图、弥散加权图、pH图和Z谱,其中(d)左右两个方框所示的感兴趣区域分别为正常脑组织和缺血性脑组织,其Z谱在(e)是分别用蓝色和红色表示;(f)~(i)分别分别为缺血5 h后的T1加权图、T2加权图、弥散加权图、pH图;(j) 2, 3, 5-三苯基四唑氯化物染色,pH降低的脑区显示出低氧化代谢 Figure 7 Cerebral ischemia experiments[34]. (a)~(e) T 1-weighted image, T2-weighted image, diffusion-weighted image, pH map and Z-spectra of cerebral ischemia after 2 hours, The right and left boxes in Fig. (d) show the regions of interest (ROIs) of ischemic and contralateral, and their Z-spectra in Fig. (e) were red and blue, respectively; (f)~(i)T1-weighted image, T2-weighted image, diffusion-weighted image, pH map of cerebral ischemia after 5 hours; (j) Histology 2, 3, 5-triphenyltetrazolium chloride (TTC) stained, showed that regions of decreased pH corresponded to regions of low oxidative metabolism |
Zhou等人[32]利用大鼠脑组织内蛋白质分子的酰胺基团和氨基来量化获取脑部的pH成像.Sun等人[33, 44]将这种方法进行改进,通过酰胺质子交换(Amide Proton Transfer,APT)的速率
| $ {k_{SW}} = {k_0} \cdot {10^{{\rm{pH}} - p{K_W}}} $ | (10) |
(10) 式中,水电离常数
| $ CESTR = \frac{{{f_s} \cdot {k_{SW}}}}{{{R_{1W}} + {f_s} \cdot {k_{SW}}}} \cdot \alpha \cdot (1 - \sigma ) $ | (11) |
其中
| $ MT{R_{asym}} = \Delta MT{R'_{asym}} + APTR = \Delta MT{R'_{asym}} + \frac{{{f_s} \cdot {k_{SW}}}}{{{R_{1W}} + {f_s} \cdot {k_{SW}}}} \cdot \alpha \cdot (1 - \sigma ) $ | (12) |
APTR表示人体内CESTR,变形得:
| $ {k_{SW}} = \frac{{{R_{1W}}}}{{{f_s} \cdot \left[ {\frac{{\alpha \cdot (1 - \sigma )}}{{MT{R_{asym}} - \Delta MT{{R'}_{asym}}}} - 1} \right]}} $ | (13) |
由(10)式和(13)式可得:
| $ {\rm{pH}} = 6.4 + {\rm{lg}}\left\{ {\frac{{{R_{1W}}}}{{{f_s} \cdot \left[ {\frac{{\alpha \cdot (1 - \sigma )}}{{MT{R_{asym}} - \Delta MT{{R'}_{asym}}}} - 1} \right]}}{\rm{ }}/5.57} \right\} $ | (14) |
根据(14)式便可以得到组织的pH分布图.
基于CEST机制的内源性pH成像方法除了上文所述AACID法和利用交换速率
基于CEST的pH成像技术在肾脏疾病、脑中风、恶性肿瘤等疾病应用方面显示出很好的应用前景,但它面临较多的问题和较大的挑战.一方面是如何在保证有足够大pH响应范围的前提下,提高CEST成像的pH敏感性,更加灵敏地检测出组织微弱的酸碱变化;另一方面是怎样将基于CEST的pH成像真正应用于临床研究.
为提高CEST成像的pH敏感性,质子间交换速率随着pH变化越显著越好.然而慢交换条件
除了选取合适的对比剂外,方法的改进也能改善pH成像的灵敏度或线性响应范围.比率法在利用CEST技术进行pH成像时,一直扮演着非常重要的角色,从最初外源性不同共振频率的两类交换质子,到只需要一种共振频率的交换质子,再到利用组织内不同共振频率的内源性对比剂.比率法的出现让CEST技术在pH成像研究方面取得了较大进展.无论是外源性还是内源性的比率法,或者是基于交换速率量化的方法,都是在提高CEST信号对pH变化的响应,即提高敏感性.但是比率法的应用很大程度上取决于CEST信号提取的准确性.通过不对称分析或类似方法获得的CEST信号,容易受到体内MT效应[48]、NOE效应[49, 50]的干扰,影响得到的比率值.同时,比率法需要pH值的标定.也就是说可能需要一个额外的体外实验确定CEST信号与pH之间的关系后,才能得到组织的pH分布图,这大大增加了pH成像的时间.通过方法的改进来提高CEST信号的敏感性和pH检测的精确性或许是未来利用CEST技术进行pH成像的重点研究方向之一.
目前已经开展的临床pH成像应用主要是通过内源性酰胺质子信号实现的[51],其定量的准确性以及敏感性仍有待提高.临床MRI下进行pH成像主要受制于磁场强度的限制,一方面会使得各种类型的交换质子在频谱上更加接近,各种CEST信号的分离更加困难;另一方面会使得满足慢交换条件的化学交换速率范围相对于高场MRI缩小.虽然使用化学位移较大的外源性对比剂可以克服上述临床MRI设备的限制,但是它们真正进入临床应用,还需要面临外源性对比剂的毒性评估、高交换速率带来的射频特定吸收率(Specific Absorption Rate,SAR)高等一系列问题.
综上所述,基于CEST机制的无创pH成像技术是近年MRI领域的研究热点,尽管面临诸多挑战,但有大量的研究证明其可以成为真正意义上无创的、利用内源性对比剂的成像技术,获取人体器官或组织pH分布图,对肾脏、脑部疾病和肿瘤的鉴定与愈后监控有着重要的指导意义.
| [1] | ASHBY B S. pH studies in human malignant tumours[J]. The Lancet, 1966, 288(7458): 312-315. DOI: 10.1016/S0140-6736(66)92598-0. |
| [2] | LI C, XIA J S, WEI X B, et al. pH-activated near-infrared fluorescence nanoprobe imaging tumors by sensing the acidic microenvironment[J]. Adv Funct Mater, 2010, 20(14): 2222-2230. DOI: 10.1002/adfm.v20:14. |
| [3] | VĀVERE A L, BIDDLECOMBE G B, SPEES W M, et al. A novel technology for the imaging of acidic prostate tumors by positron emission tomography[J]. Cancer Res, 2009, 69(10): 4510-4516. DOI: 10.1158/0008-5472.CAN-08-3781. |
| [4] | WIKE-HOOLEY J L, VAN DEN BERG A P, VAN DER ZEE J, et al. Human tumour pH and its variation[J]. Eur J Cancer Clin Oncol, 1985, 21(7): 785-791. DOI: 10.1016/0277-5379(85)90216-0. |
| [5] | YOO B, PAGEL M D. An overview of responsive MRI contrast agents for molecular imaging[J]. Front Biosci, 2008, 13: 1733-1752. DOI: 10.2741/2796. |
| [6] | LIU G S, SONG X L, CHAN K W Y, et al. Nuts and bolts of chemical exchange saturation transfer MRI[J]. NMR Biomed, 2013, 26(7): 810-828. DOI: 10.1002/nbm.2899. |
| [7] | VAN ZIJL P C, YADAV N N. Chemical exchange saturation transfer (CEST):what is in a name and what isn't?[J]. Magn Reson Med, 2011, 65(4): 927-948. DOI: 10.1002/mrm.22761. |
| [8] |
YANG Y G, CHEN Z, CAI C B, et al. Factors affecting chemical exchange saturation transfer imaging on 1.5 T Clinical MRI scanners[J].
Chinese J Magn Reson, 2017, 34(3): 275-282.
杨永贵, 陈忠, 蔡聪波, 等. 1.5 T磁共振化学交换饱和转移成像的影响因素分析[J]. 波谱学杂志, 2017, 34(3): 275-282. |
| [9] | CHEN L Q, PAGEL M D. Evaluating pH in the extracellular tumor microenvironment using CEST MRI and other imaging methods[J]. Adv Radiol, 2015: 206405. |
| [10] | HANCU I, DIXON W T, WOODS M, et al. CEST and PARACEST MR contrast agents[J]. Acta Radiol, 2010, 51(8): 910-923. DOI: 10.3109/02841851.2010.502126. |
| [11] | LINDEMAN L R, RANDTKE E A, HIGH R A, et al. A comparison of exogenous and endogenous CEST MRI methods for evaluating in vivo pH[J]. Magn Reson Med, 2018, 79(5): 2766-2772. DOI: 10.1002/mrm.26924. |
| [12] | WARD K M, ALETRAS A H, BALABAN R S. A new class of contrast agents for MRI based on proton chemical exchange dependent saturation transfer (CEST)[J]. J Magn Reson, 2000, 143(1): 79-87. DOI: 10.1006/jmre.1999.1956. |
| [13] | GRAD J, BRYANT R G. Nuclear magnetic cross-relaxation spectroscopy[J]. J Magn Reson, 1990, 90(1): 1-8. |
| [14] | HINGORANI D V, BERNSTEIN A S, PAGEL M D. A review of responsive MRI contrast agents:2005-2014[J]. Contrast Media Mol Imaging, 2015, 10(4): 245-265. DOI: 10.1002/cmmi.v10.4. |
| [15] | WARD K M, ALETRAS A H, BALABAN R S. A new class of contrast agents for MRI based on proton chemical exchange dependent saturation transfer (CEST)[J]. J Magn Reson, 2000, 143(1): 79-87. DOI: 10.1006/jmre.1999.1956. |
| [16] | AIME S, CALABI L, BIONDI L, et al. Iopamidol:Exploring the potential use of a well-established x-ray contrast agent for MRI[J]. Magn Reson Med, 2005, 53(4): 830-834. DOI: 10.1002/(ISSN)1522-2594. |
| [17] | LONGO D L, DASTR W, DIGILIO G, et al. Iopamidol as a responsive MRI-chemical exchange saturation transfer contrast agent for pH mapping of kidneys:In vivo studies in mice at 7 T[J]. Magn Resona Med, 2011, 65(1): 202-211. DOI: 10.1002/mrm.22608. |
| [18] | CHEN M M, CHEN C Y, SHEN Z W, et al. Extracellular pH is a biomarker enabling detection of breast cancer and liver cancer using CEST MRI[J]. Oncotarget, 2017, 8(28): 45759. |
| [19] | CHEN L Q, HOWISON C M, JEFFERY J J, et al. Evaluations of extracellular pH within in vivo tumors using acidoCEST MRI[J]. Magn Reson Med, 2014, 72(5): 1408-1417. DOI: 10.1002/mrm.v72.5. |
| [20] | LONGO D L, SUN P Z, CONSOLINO L, et al. A general MRI-CEST ratiometric approach for pH imaging:demonstration of in vivo pH mapping with iobitridol[J]. J Am Chem Soc, 2014, 136(41): 14333-14336. DOI: 10.1021/ja5059313. |
| [21] | MCMAHON M T, GILAD A A, ZHOU J Y, et al. Quantifying exchange rates in chemical exchange saturation transfer agents using the saturation time and saturation power dependencies of the magnetization transfer effect on the magnetic resonance imaging signal (QUEST and QUESP):pH calibration for poly-L-lysine and a starburst dendrimer[J]. Magn Reson Med, 2006, 55(4): 836-847. DOI: 10.1002/(ISSN)1522-2594. |
| [22] | YANG X, SONG X L, RAY BANERJEE S, et al. Developing imidazoles as CEST MRI pH sensors[J]. Contrast Media Mol Imaging, 2016, 11(4): 304-312. DOI: 10.1002/cmmi.v11.4. |
| [23] | MELKUS G, GRABAU M, KARAMPINOS D C, et al. Ex vivo porcine model to measure pH dependence of gagCEST in the inter-vertebral disc[J]. Magn Resona Med, 2014, 71(5): 1743. DOI: 10.1002/mrm.v71.5. |
| [24] | ZHANG S R, ZHOU K J, HUANG G, et al. A novel class of polymeric pH-responsive MRI CEST agents[J]. Chem Commun, 2013, 49(57): 6418-6420. DOI: 10.1039/c3cc42452a. |
| [25] | AIME S, BARGE A, DELLI CASTELLI D, et al. Paramagnetic lanthanide (Ⅲ) complexes as pH-sensitive chemical exchange saturation transfer (CEST) contrast agents for MRI applications[J]. Magn Reson Med, 2002, 47(4): 639-648. DOI: 10.1002/(ISSN)1522-2594. |
| [26] | SHETH V R, LIU G S, LI Y G, et al. Improved pH measurements with a single PARACEST MRI contrast agent[J]. Contrast Media Mol Imaging, 2012, 7(1): 26-34. DOI: 10.1002/cmmi.460. |
| [27] | LIU G S, LI Y G, SHETH V R, et al. Imaging in vivo extracellular pH with a single paramagnetic chemical exchange saturation transfer magnetic resonance imaging contrast agent[J]. Mol Imaging, 2012, 11(1): 47-57. |
| [28] | DELLI CASTELLI D, FERRAUTO G, CUTRIN J C, et al. In vivo maps of extracellular pH in murine melanoma by CEST-MRI[J]. Magn Reson Med, 2014, 71(1): 326-332. DOI: 10.1002/mrm.24664. |
| [29] | RANCAN G, DELLI CASTELLI D, AIME S. MRI CEST at 1T with large µeff Ln3+ complexes Tm3+-HPDO3A:An efficient MRI pH reporter[J]. Magn Reson Med, 2016, 75(1): 329-336. DOI: 10.1002/mrm.25589. |
| [30] | KRCHOV T, G LISOV A, JIR K D, et al. Ln (Ⅲ)-complexes of a DOTA analogue with an ethylenediamine pendant arm as pH-responsive PARACEST contrast agents[J]. Dalton Trans, 2016, 45(8): 3486-3496. DOI: 10.1039/C5DT04443J. |
| [31] | ZHOU J Y, LAL B, WILSON D A, et al. Amide proton transfer (APT) contrast for imaging of brain tumors[J]. Magn Reson Med, 2003, 50(6): 1120-1126. DOI: 10.1002/(ISSN)1522-2594. |
| [32] | ZHOU J Y, PAYEN J F, WILSON D A, et al. Using the amide proton signals of intracellular proteins and peptides to detect pH effects in MRI[J]. Nat Med, 2003, 9(8): 1085-1090. DOI: 10.1038/nm907. |
| [33] | SUN P Z, SORENSEN A G. Imaging pH using the chemical exchange saturation transfer (CEST) MRI:correction of concomitant RF irradiation effects to quantify CEST MRI for chemical exchange rate and pH[J]. Magn Reson Med, 2008, 60(2): 390-397. DOI: 10.1002/mrm.v60:2. |
| [34] | MCVICAR N, LI A X, GONCALVES D F, et al. Quantitative tissue pH measurement during cerebral ischemia using amine and amide concentration-independent detection (AACID) with MRI[J]. J Cereb Blood Flow Metab, 2014, 34(4): 690-698. DOI: 10.1038/jcbfm.2014.12. |
| [35] | SUN P Z, ZHOU J Y, SUN W Y, et al. Detection of the ischemic penumbra using pH-weighted MRI[J]. J Cerebral Blood Flow Metab, 2007, 27(6): 1129-1136. DOI: 10.1038/sj.jcbfm.9600424. |
| [36] | WARD K M, BALABAN R S. Determination of pH using water protons and chemical exchange dependent saturation transfer (CEST)[J]. Magn Reson Med, 2000, 44(5): 799-802. DOI: 10.1002/(ISSN)1522-2594. |
| [37] | LONGO D L, BUSATO A, LANZARDO S, et al. Imaging the pH evolution of an acute kidney injury model by means of iopamidol, a MRI-CEST pH-responsive contrast agent[J]. Magn Reson Med, 2013, 70(3): 859-864. DOI: 10.1002/mrm.24513. |
| [38] | CHEN L Q, RANDTKE E A, JONES K M, et al. Evaluations of tumor acidosis within in vivo tumor models using parametric maps generated with acidoCEST MRI[J]. Mol Imaging Biol, 2015, 17(4): 488-496. DOI: 10.1007/s11307-014-0816-2. |
| [39] | MOON B F, JONES K M, CHEN L Q, et al. A comparison of iopromide and iopamidol, two acidoCEST MRI contrast media that measure tumor extracellular pH[J]. Contrast media & molecular imaging, 2015, 10(6): 446-455. |
| [40] | M LLER-LUTZ A, KHALIL N, SCHMITT B, et al. Pilot study of Iopamidol-based quantitative pH imaging on a clinical 3T MR scanner[J]. MAGMA, 2014, 27(6): 477-485. DOI: 10.1007/s10334-014-0433-8. |
| [41] | JONES K M, RANDTKE E A, YOSHIMARU E S, et al. Clinical translation of tumor acidosis measurements with AcidoCEST MRI[J]. Mol Imaging Biol, 2017, 19(4): 617-625. DOI: 10.1007/s11307-016-1029-7. |
| [42] | WU Y, ZHOU I Y, IGARASHI T, et al. A generalized ratiometric chemical exchange saturation transfer (CEST) MRI approach for mapping renal pH using iopamidol[J]. Magn Reson Med, 2018, 79(3): 1553-1558. DOI: 10.1002/mrm.26817. |
| [43] | ALBATANY M, LI A, MEAKIN S, et al. Dichloroacetate induced intracellular acidification in glioblastoma:in vivo detection using AACID-CEST MRI at 9.4 Tesla[J]. J Neurooncol, 2018, 136(2): 255-262. DOI: 10.1007/s11060-017-2664-9. |
| [44] | SUN P Z, WANG E, CHEUNG J S. Imaging acute ischemic tissue acidosis with pH-sensitive endogenous amide proton transfer (APT) MRI-correction of tissue relaxation and concomitant RF irradiation effects toward mapping quantitative cerebral tissue pH[J]. Neuroimage, 2012, 60(1): 1-6. DOI: 10.1016/j.neuroimage.2011.11.091. |
| [45] | GOERKE S, ZAISS M, BACHERT P. Characterization of creatine guanidinium proton exchange by water-exchange (WEX) spectroscopy for absolute-pH CEST imaging in vitro[J]. NMR Biomed, 2014, 27(5): 507-518. DOI: 10.1002/nbm.3086. |
| [46] | MCMAHON M T, GILAD A A, ZHOU J Y, et al. Quantifying exchange rates in chemical exchange saturation transfer agents using the saturation time and saturation power dependencies of the magnetization transfer effect on the magnetic resonance imaging signal (QUEST and QUESP):pH calibration for poly-L-lysine and a starburst dendrimer[J]. Magn Reson Med, 2006, 55(4): 836-847. DOI: 10.1002/(ISSN)1522-2594. |
| [47] | SUN P Z, WANG Y, DAI Z Z, et al. Quantitative chemical exchange saturation transfer (qCEST) MRI-RF spillover effect-corrected omega plot for simultaneous determination of labile proton fraction ratio and exchange rate[J]. Contrast Media Mol Imaging, 2014, 9(4): 268-275. DOI: 10.1002/cmmi.1569. |
| [48] | HENKELMAN R M, STANISZ G J, GRAHAM S J. Magnetization transfer in MRI:a review[J]. NMR Biomed, 2001, 14(2): 57-64. DOI: 10.1002/(ISSN)1099-1492. |
| [49] | KALTSCHNEE L, KNOLL K, SCHMIDTS V, et al. Extraction of distance restraints from pure shift NOE experiments[J]. J Magn Reson, 2016, 271: 99-109. DOI: 10.1016/j.jmr.2016.08.007. |
| [50] |
ZHANG M, LU J H, CAI C B, et al. Effects of lipids signals on nuclear overhauser enhancement contrast imaging at 7 T[J].
Chinese J Magn Reson, 2015, 32(4): 606-617.
张苗, 卢建华, 蔡聪波, 等. 7 T下脂肪对基于NOE的磁共振对比成像的影响[J]. 波谱学杂志, 2015, 32(4): 606-617. |
| [51] | JONES C K, SCHLOSSER M J, VAN ZIJL P, et al. Amide proton transfer imaging of human brain tumors at 3T[J]. Magn Reson Med, 2006, 56(3): 585-592. DOI: 10.1002/(ISSN)1522-2594. |
 2018, Vol. 35
2018, Vol. 35 
