2. 超声医疗国家工程研究中心, 重庆 401121
2. National Engineering Research Center of Ultrasound Medicine, Chongqing 401121, China
国家癌症中心最新发布的癌症数据显示,我国每年新发现肿瘤病例超过350万,死亡病例超过200万[1].肿瘤治疗效果差、复发转移率高,肿瘤治疗副作用大、精准性差,治愈难度大[2].磁共振成像(Magnetic Resonance Imaging,MRI)某些参数对温度较为敏感,因此可用于测量温度[3].MRI引导高强度聚焦超声(High Intensity Focused Ultrasound,HIFU)治疗作为一种非侵入治疗技术,已经应用于诸多肿瘤的临床治疗,最常见的是用于子宫肌瘤的治疗[4].它是在MRI的精准解剖定位及其测温序列实时测温引导下,通过聚焦超声束能量沉积于肿瘤瘤体内,使组织局部温度升高至60 ℃以上而导致肌瘤组织产生凝固性坏死,从而达到治疗目的.因此,准确获取组织温度分布图,并依据温度分布判断焦点位置、组织是否发生凝固性坏死、周围边界组织的损伤风险,以实现HIFU辐照能量的调整成为该技术的关键.
为了更安全地引导HIFU治疗,在治疗的整个温度范围内,MRI温度敏感参数应该与温度具有很好的线性关系,以便根据温度敏感参数确定温度,从而准确呈现被辐照组织的温度分布.目前,常用的磁共振测温方法主要有质子共振频率法(Proton Resonance Frequency,PRF)和纵向弛豫时间(Longitudinal Relaxation Time,T1)法[5].诸多研究[6, 7]发现水模测温或在组织无相变温度范围内,MRI温度敏感参数和温度线性关系很好.因此传统的磁共振测温引导HIFU治疗技术沿用了MRI温度敏感参数和温度的线性关系.
PRF测温引导HIFU治疗已经用于临床[8-10],美国食品及药物管理局(Food and Drug Administration,FDA)也批准通过了PRF测温引导的子宫肌瘤治疗疗法[11, 12].但是,现阶段该技术还存在一些问题,如脂肪组织温度检测[13-15]、组织相变对其测温准确性的影响等.除此以外,PRF测温利用了温度与质子共振频率之间的线性关系进行测温,但是质子共振频率对温度的敏感性较弱,且易受场漂等其它因素影响,而且有研究发现共振频率和温度线性关系存在不可逆的现象.例如,文献[16, 17]发现凝固性坏死相变前后,质子共振频率随温度有轻微的不可逆性,特别是达到60℃以上,升温和降温曲线具有不可逆性.2013年,Diakite等人[18]将T1测温用于引导HIFU治疗,当温度超过60℃时,T1的升温和降温曲线也存在不可逆现象.Delannoy等人[19]也得到类似的研究结果.不可逆现象可能已影响了磁共振测温引导HIFU治疗的准确性.2001年,Hynynen等人[20]在磁共振测温引导下用HIFU治疗9例乳腺纤维肌瘤疾病时,由于11处病灶的3处靶区超声能量估计过高或过低,导致治疗后2例出现并发症、1例无效治疗,并且1例术中由于在最高温度60℃附近测量不准确,找不到焦点位置,导致“脱靶”.梁松年等人[21]于2012年用磁共振测温引导HIFU治疗21例子宫肌瘤时,也由于超声能量估计过高,导致引发并发症,术中12例腹痛、7例皮肤灼伤、4例腰腿麻木.
但是,磁共振测温引导HIFU治疗的研究中,研究者并没有深究不可逆现象对测温结果的影响,以及这种不可逆现象产生的原因.而本文认为这种现象是由组织相变引起的.在不断供热条件下,组织性质会发生变化,从一种相变成另一种相,在相变过程中虽然继续供热,但温度并不升高,温度是无法检测的[22].在不同的相中,组织性质不同,温度随其他参数的变化是不同的.HIFU治疗过程中,肿瘤组织涉及相变.大量磁共振测温监控热治疗研究[23-25]表明在43 ℃附近出现相变,磁共振测温不准确,根据温度敏感参数不能确定唯一的温度值,从而得不到组织准确的温度分布.本文通过实验和理论分析发现,组织在60 ℃附近也会出现相变,并且本文以基于T1加权图像信号的磁共振测温为例,探讨HIFU治疗过程组织相变对磁共振测温时的影响,进而探讨磁共振测温能否用于实时引导HIFU治疗.
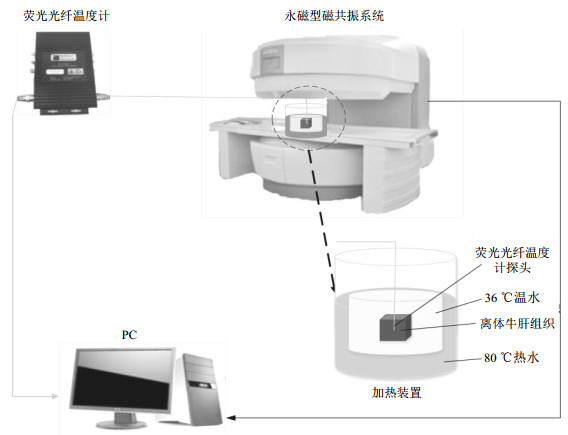
1 材料与方法 1.1 实验装置及材料系统装置如图 1所示,由磁共振系统、荧光光纤温度计、计算机控制系统组成.
|
图 1 实验系统框图 Figure 1 The block diagram of experimental system |
(1)磁共振系统
磁共振系统为0.35 T永磁开放式磁共振系统(深圳贝斯达科技有限公司),线圈为体线圈.
(2)多通道荧光光纤温度计
为了适应高磁场的工作环境,不产生电磁干扰,本文选择多通道荧光光纤温度计(苏州英迪戈精密光电科技有限公司,FOTS-DINA-1000系列)用来采集基准温度,其探头为非金属材料.这种温度计利用特殊荧光材料的温度特性进行测温,荧光材料受到某种波长光的照射时,会吸收光能发生能级跃迁,发出荧光,这种荧光的寿命受温度影响.其测温范围为0~80 ℃,测温精度为±0.4 ℃,分辨率为0.1 ℃,平均测温间隔为0.6 s.
(3)水浴加热和降温装置
加热装置由两个烧杯组成,小烧杯和大烧杯内的物质之间存在温度差,因此两烧杯之间会出现热传递,可使两烧杯的温度达到平衡,传热过程中低温度烧杯里的物质温度会升高,达到加热目的.
实验材料为离体新鲜牛肝组织,大小为30 mm×30 mm×30 mm,牛肝组织较为均匀,无明显的大血管.由于HIFU治疗的起始温度是人体的正常温度36 ℃,因此我们采用36 ℃温水水浴,将牛肝组织加热至36 ℃待用.
1.2 实验参数及方法(1)MRI扫描序列及参数
采用梯度回波(Gradient Recalled Echo,GRE)序列采集T1加权图像.GRE序列用读出梯度场的正反向切换来采集回波,脉冲间隔重复时间(Repetition Time,TR)短,回波时间(Echo Time,TE)短,小角度激发,其获取图像速度快.扫描参数如下:TR=25 ms,TE=10 ms,平均次数(Number of Averages,NSA)= 8,翻转角(Flip Angle,FA)= 30°,层数(Number of Slice)= 1,层厚(Slice Thickness)= 9 mm,层间距(Separation)= 7 mm,成像视野(Field of View,FOV)= 340×340 mm2,成像时间=28 s.
(2)图像采集
实验过程中,假设牛肝组织与水的比热容、传热速度等性质相同,用荧光光纤温度计同时实时采集牛肝组织中心区域、大烧杯和小烧杯里水的温度.小烧杯内装入水温为36 ℃的水和相同温度的牛肝组织;将小烧杯放入大烧杯,向大烧杯里注入80 ℃热水(注入热水时,不要将热水滴入小烧杯里,以防止新鲜牛肝组织局部凝固性坏死).因为小烧杯和大烧杯之间存在温度差,会发生热传递现象,直到两烧杯的温度达到相同.实验过程中用热传递使牛肝组织加热至60 ℃.假设小烧杯36 ℃水与牛肝组织体积V1一定时,大烧杯热水为80 ℃,根据
| $ (80 - 60)V2 = (60 - 36)V1 $ | (1) |
可知需要加入的80 ℃热水体积V2.
采集整个升温(36 ℃升温至60 ℃)和自然降温过程(60 ℃自然降温至36 ℃)的T1加权图像,并记录每幅图像对应的荧光光纤温度计所测牛肝组织的温度.
(3)图像处理
在荧光光纤温度计附近选取半径为2个像素的圆形感兴趣区域(Region of Interest,ROI)里的13个点的T1加权图像信号,并求其平均值.
(4)线性拟合
对图像感兴趣区域的T1加权图像信号与荧光光纤温度计所测温度进行回归分析.
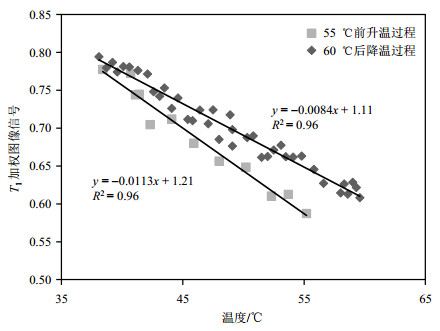
2 结果与讨论实验结果如图 2所示.正方形表示在牛肝组织凝固性坏死前的加热过程,T1加权图像信号与温度近似呈线性关系,相关系数为0.96.加热过程传热速度快,相对降温过程采集点数少.菱形表示凝固性坏死产生后降温过程,T1加权图像信号与温度也呈线性关系,相关系数也为0.96.但是组织降温过程中的T1加权图像信号与升温过程中相同温度时的T1加权图像信号已经不同.凝固性坏死前后,组织中质子T1加权图像信号与温度的关系已然不同,呈现不可逆现象.实验过程中,上升温度接近60 ℃时,视觉观察到牛肝组织逐渐由血红色变为了白色,产生明显的凝固性坏死现象.
|
图 2 升温和降温过程牛肝组织T1加权图像信号随温度的变化 Figure 2 T1-weighted image signal of bovine liver tissue varying with temperature during temperature rise and fall periods |
组织中质子的弛豫通常由两态快速交换模型[26-28]来描述,这个模型假设组织中的水有自由水和结合水两种状态.结合水占小部分,被束缚在蛋白质表面;大部分水(≥90%)为自由水.基于两态快速交换模型,组织质子的纵向弛豫率如下:
| $ {({T_1})^{ - 1}} = b{({T_{1h}})^{ - 1}} + (1 - b){({T_{1f}})^{ - 1}} $ | (2) |
(2) 式中,T1h为结合水的T1,T1f为自由水的T1,b为结合水占的比例.
T1f与温度关系[26]为:
| $ {T_{1f}} \approx T_{1f}^\infty {{\rm{e}}^{ - \frac{{{E_a}}}{{kT}}}} $ | (3) |
(3) 式中,Ea为弛豫过程活化能,k是玻尔兹曼常数,T为绝对温度.
在组织中,结合水只占小部分[25],忽略结合水的贡献,由(2)式和(3)式得组织中水质子的T1与温度的关系为:
| $ {T_1} \approx \frac{{T_{1f}^\infty {{\rm{e}}^{ - \frac{{{E_a}}}{{kT}}}}}}{{1 - b}} $ | (4) |
组织中T1与温度的关系可以近似为:
| $ {T_1} \approx T_{1f}^\infty \times \left[ { - \frac{{{E_a}}}{{k(1 - b)}} \times \frac{1}{T} + \frac{1}{{1 - b}}} \right] $ | (5) |
由(5)式看出,当组织状态不变时,结合水占的比例b、活化能Ea可以看作常数时,T1与1/T可以近似呈线性关系,因此,可根据T1准确的确定出组织的温度.
当组织升温达到相变温度,由于组织相变会导致结构变化,结合水份额b、活化能Ea会发生变化,降温过程时温度没变,但是T1变了,因此如果还是延续之前的线性关系,就会测得错误的温度.在凝固性坏死前后,T1参数与温度具有不同的关系,因此,应根据不同的T1参数与温度曲线检测温度.
当组织温度超过相变温度后,相对凝固性坏死前,结合水份额b和活化能Ea将变化为另一个量b1和Ea1,根据(5)式,在同一温度范围,将形成不同的T1与温度的关系曲线.
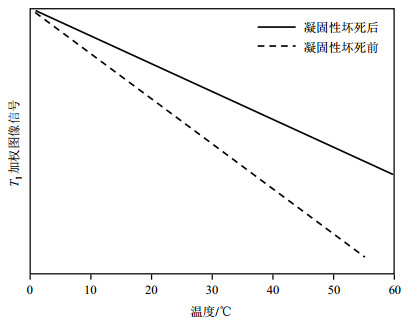
根据这一结论,假设凝固性坏死前组织结合水份额b为0.12,凝固性坏死后组织结合水份额b变为0.20,Ea由4.9 kJ/mol变为5.1 kJ/mol[26];凝固性坏死相变温度为60 ℃,组织凝固性坏死前后所处的温度范围都设为10~55℃,是远离相变温度范围.通过理论模型,将得到如图 3的T1加权图像信号与温度关系曲线.(注意:由于T1值一般采用翻转恢复序列采集,获取时间较长,不符合HIFU治疗监控实时性的要求,故本文采用与T1值相关的T1加权图像信号进行研究.)
|
图 3 凝固性坏死前后T1加权图像信号随温度变化的理论结果(b从0.12变为0.20,Ea从4.9 kJ/mol变为5.1 kJ/mol) Figure 3 Theoretical results of T1-weighted image signal varying with temperature before and after coagulation necrosis (b changes from 0.12 to 0.20, Ea changes from 4.9 kJ/mol to 5.1 kJ/mol) |
从离体牛肝组织测温实验结果来看,在牛肝凝固性坏死前,T1加权图像信号与温度近似呈线性关系,凝固性坏死产生后,T1加权图像信号与温度也呈线性关系,但凝固性坏死前后组织中T1加权图像信号与温度的线性关系式不同,呈现出不可逆现象,在60 ℃附近,组织T1加权图像信号并不能确定唯一的温度值,确实发生了相变.另外,文献[24, 25]在43 ℃附近发现了相变测温误差增大的现象,文献[23]认为43 ℃附近出现相变.HIFU治疗过程中,靶区组织温度由正常温度36 ℃经过超声热效应加热至60 ℃以上,涉及43 ℃和60 ℃附近的相变.虽然在凝固性坏死相变过程测温是困难的,但在偏离相变温度较远区,是可以通过T1加权图像信号对组织有效测温的.在HIFU治疗中,测温时,温度范围应该尽量远离相变温度,可以用在远离相变的温度范围内得到的温度分布图,预测靶区的位置和周围组织面临的潜在风险,根据远离相变的温度范围内的温度分布推测凝固性坏死时的情况,如靶区位置、坏死区域,边界是否损伤.为了预测更可靠,避免无效治疗.
磁共振测温引导HIFU治疗主要是利用得到的温度分布图,确定治疗时靶区位置和周围组织的风险,为了判断更可靠,避免无效治疗,磁共振测温引导HIFU治疗时,测量的温度范围应该尽量远离相变温度,从而确保治疗的安全性和有效性.尽管本文是基于T1加权图像信号来进行的,其他参数与之类似,但还需后续研究对其进行验证.
3 结论根据本文实验结果和理论分析,可以得知在HIFU治疗过程组织凝固性坏死前后,T1加权图像信号与温度具有不同的关系.因此,在凝固性坏死前后应根据不同的T1加权图像信号与温度的相关曲线检测温度.
| [1] | 佚名.国家癌症中心: 2017最新中国肿瘤现状和趋势[OL].[2017-12-09]. http://www.medsci.cn/article/show_article.do?id=203a122910ce |
| [2] |
CHEN W Q, SUN K X, ZHENG R S, et al. Report of cancer incidence and mortality in different areas of China, 2014[J].
China Cancer, 2018, 27(1): 1-14.
陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14. |
| [3] |
GAO T X, LV Z, DING H Y, et al. Chinese Journal of Medical Imaging, 2014, 22(7): 547-550.
高天欣, 吕宙, 丁海艳, 等.磁共振温度成像技术研究进展[J].中国医学影像学杂志, 2014, 22(7):547-550. |
| [4] | 许永华. MRI引导、监测和评估HIFU治疗子宫肌瘤研究[D].重庆: 重庆医科大学, 2014. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2690463 |
| [5] |
LU Y, ZHENG X W, ZHONG K, et al. Research progresses in development of thermo-sensitive MRI contrast agent[J].
Chinese J Magn Reson, 2017(4): 528-536.
路遥, 郑新威, 钟凯, 等. 温敏性磁共振成像造影剂的研究进展[J]. 波谱学杂志, 2017(4): 528-536. |
| [6] | GULTEKIN D H, GORE J C. Temperature dependence of nuclear magnetization and relaxation[J]. J Magn Reson, 2005, 172(1): 133-141. DOI: 10.1016/j.jmr.2004.09.007. |
| [7] |
TANG X Y, LIU Z W, PENG Y H, et al. Real-time non-invasive temperature measurement with MRI based on T1[J].
Acta Electronica Sinica, 2009, 37(12): 2770-2773.
唐晓英, 刘志文, 彭彧华, 等. 基于T1的磁共振成像实时无创测温的研究[J]. 电子学报, 2009, 37(12): 2770-2773. DOI: 10.3321/j.issn:0372-2112.2009.12.030. |
| [8] | HYNYNEN K, POMEROY O, SMITH D N, et al. MR imaging-guided focused ultrasound surgery of fibroadenomas in the breast:a feasibility study[J]. Radiology, 2001, 219(1): 176-185. DOI: 10.1148/radiology.219.1.r01ap02176. |
| [9] | FENNESSY F M, TEMPANY C M. MRI-guided focused ultrasound surgery of uterine leiomyomas[J]. Acad Radiol, 2005, 12(9): 1158-1166. DOI: 10.1016/j.acra.2005.05.018. |
| [10] | TEMPANY C M, STEWART E A, MCDANNOLD N, et al. MR imaging-guided focused ultrasound surgery of uterine leiomyomas:a feasibility study[J]. Radiology, 2003, 226(3): 897-905. DOI: 10.1148/radiol.2271020395. |
| [11] | FENNESSY F M, TEMPANY C M, MC DANNOLD N J, et al. Uterine leiomyomas:MR imaging-guided focused ultrasound surgery-results of different treatment protocols[J]. Radiology, 2007, 243(3): 885-893. DOI: 10.1148/radiol.2433060267. |
| [12] | SCHLESINGER D, BENEDICT S, DIEDERICH C, et al. MR-guided focused ultrasound surgery, present and future[J]. Med Phys, 2013, 40(8): 1-32. |
| [13] | RIEKE V, BUTTS P K. Echo combination to reduce proton resonance frequency (PRF) thermometry errors from fat[J]. J Magn Reson Imaging, 2008, 27(3): 673-677. DOI: 10.1002/(ISSN)1522-2586. |
| [14] | WINTER L, OBERACKER E, PAUL K, et al. Magnetic resonance thermometry:Methodology, pitfalls and practical solutions[J]. Int J Hyperthermia, 2016, 32(1): 63-75. DOI: 10.3109/02656736.2015.1108462. |
| [15] | GRISSOM W A, RIEKE V, HOLBROOK A B, et al. Hybrid referenceless and multibaseline subtraction MR thermometry for monitoring thermal therapies in moving organs[J]. Med Phys, 2010, 37(9): 5014-5026. DOI: 10.1118/1.3475943. |
| [16] | OLSRUD J, WIRESTAM R, BROCKSTEDT S, et al. MRI thermometry in phantoms by use of the proton resonance frequency shift method:application to interstitial laser thermotherapy[J]. Phys Med Biol, 1998, 43(9): 2597-2613. DOI: 10.1088/0031-9155/43/9/012. |
| [17] | GRAHAM S J, BRONSKILL M J, HENKELMAN R M. Time and temperature dependence of MR parameters during thermal coagulation of ex vivo rabbit muscle[J]. Magn Reson Med, 2010, 39(2): 198-203. |
| [18] | DIAKITE M, PAYNE A, TODD N, et al. Irreversible change in the T1 temperature dependence with thermal dose using the PRF-T1 technique[J]. Magn Reson Med, 2013, 69(4): 1122-1130. DOI: 10.1002/mrm.v69.4. |
| [19] | DELANNOY J, CHEN C N, TURNER R, et al. Noninvasive temperature imaging using diffusion MRI[J]. Magn Reson Med, 1991, 19(2): 333-339. DOI: 10.1002/(ISSN)1522-2594. |
| [20] | HYNYNEN K, POMEROY O, SMITH D N, et al. MR imaging-guided focused ultrasound surgery of fibroadenomas in the breast:a feasibility study[J]. Radiology, 2001, 219(1): 176-185. DOI: 10.1148/radiology.219.1.r01ap02176. |
| [21] |
LIANG S N, SU H Y, ZHAO Y, et al. Evaluation of the safety and early therapeutic effect of magnetic resonance guided focused ultrasound surgery on uterine fibroids[J].
Biomedical Engineering and Clinical Medicine, 2012, 16(3): 233-237.
梁松年, 苏洪英, 赵杨, 等. 磁共振引导下聚焦超声治疗子宫肌瘤安全性评价及近期疗效[J]. 生物医学工程与临床, 2012, 16(3): 233-237. DOI: 10.3969/j.issn.1009-7090.2012.03.007. |
| [22] | 于渌, 郝柏林. 相变和临界现象(Ⅰ)[M]. 北京: 科学出版社, 1984. |
| [23] | PARKER D L, SMITH V, SHELDON P, et al. Temperature distribution measurements in two-dimensional NMR imaging[J]. Med Phys, 1983, 10(3): 321-325. DOI: 10.1118/1.595307. |
| [24] | PELLER M, KURZE V, LOEFFLER R, et al. Hyperthermia induces T1 relaxation and blood flow changes in tumors. A MRI thermometry study in vivo[J]. Magn Reson Imaging, 2003, 21(5): 545-551. DOI: 10.1016/S0730-725X(03)00070-5. |
| [25] | PELLER M, REINL H M, WEIGEL A, et al. T1 relaxation time at 0.2 Tesla for monitoring regional hyperthermia:feasibility study in muscle and adipose tissue[J]. Magn Reson Med, 2002, 47(6): 1194-1201. DOI: 10.1002/(ISSN)1522-2594. |
| [26] | LEWA C J, MAJEWSKA Z. Temperature relationships of proton spin-lattice relaxation time T1 in biological tissues[J]. Bull Cancer, 1980, 67(5): 525-530. |
| [27] | 俎栋林, 高家红. 核磁共振成像:物理原理和方法[M]. 北京: 北京大学出版社, 2014. |
| [28] | BOTTOMLEY P A, FOSTER T H, ARGERSINGER R E, et al. A review of normal tissue hydrogen NMR relaxation times and relaxation mechanisms from l-100MHz:Dependence on tissue type, NMR frequency, temperature, species, excision and age[J]. Med Phys, 1984, 11(4): 425-448. DOI: 10.1118/1.595535. |
 2018, Vol. 35
2018, Vol. 35 
