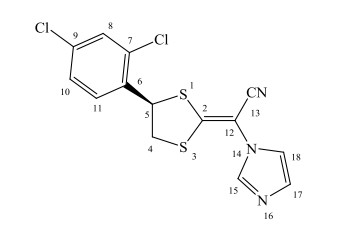
卢立康唑(luliconazole),商品名为Luzu,化学名为(-)-(E)-4(R)-4-(2, 4-二氯苯基)-1, 3-二硫戊环-2-亚取代(1H-咪唑-1-取代)乙腈(图 1),是由日本农药株式会社研发的一种新型的咪唑类外用抗真菌药物.已上市的1%卢立康唑乳膏主要用于治疗足癣、股癣和体癣[1].目前卢立康唑用于甲癣(灰指甲)的治疗,也已进入Ⅲ期临床研究.
|
图 1 卢立康唑的化学结构 Figure 1 The chemical structure of luliconazole |
目前,国内外已有卢立康唑的化学合成、晶型、药效、药动和临床研究的报道[2-7],但其完整的结构解析确证尚未见报道.本研究采用红外吸收光谱、紫外吸收光谱、核磁共振(nuclear magnetic resonance,NMR)波谱(包含1H NMR、13C NMR、DEPT135、1H-1H COSY、1H-13C HMQC和1H-13C HMBC)、质谱等谱学技术,以及差示扫描量热分析、X-射线粉末衍射和元素分析等方法,对该化合物的结构及NMR数据进行了详细解析[8-10],并确证了其结构.这些数据为该化合物的定性及纯度分析提供了科学依据,同时为其合成及生产过程的质量控制提供了重要参考信息.
1 实验部分 1.1 仪器与试剂INOVA 600型NMR谱仪(美国瓦里安有限公司);Vertex 70傅里叶红外光谱仪(德国布鲁克公司);UV 2550紫外-可见分光光度计(日本岛津制作所);6520 Accurate-Mass Q-TOF液相色谱-质谱联用仪(美国安捷伦科技有限公司).
氘代二甲基亚砜(DMSO-d6,美国剑桥同位素实验室公司);甲醇(色谱纯,德国默克公司);其他试剂均为分析纯;实验用水为超纯水(电阻率为18 MΩ·cm).
1.2 样品卢立康唑(批号:1502001)为齐鲁制药有限公司提供.利用高效液相色谱(HPLC)测定样品纯度为99.78%,符合结构鉴定所需的纯度.差示扫描量热分析显示152 ℃的吸热峰为其熔融峰温;X-射线粉末衍射显示样品为结晶态;元素分析显示样品含C:47.24%,H:2.62%,N:11.75%,符合卢立康唑分子式C14H9Cl2N3S2.
1.3 NMR实验样品溶于DMSO-d6,1D和2D NMR实验均在配备PFG Switchable Broadband探头的Varian INOVA 600型NMR谱仪上完成,采用直径为5mm的NMR样品管.以四甲基硅烷(TMS)为内标(δH 0.00,δC 0.0).1H NMR和13C NMR的工作频率分别为599.78 MHz和150.81 MHz,谱宽分别为6 400.0 Hz和37 700.3 Hz.DEPT135的工作频率为150.83 MHz,谱宽为37 700.3 Hz.2D谱包括2D梯度场1H-1H COSY、1H-13C HMQC和1H-13C HMBC谱,均采用标准脉冲程序.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为6 400.0 Hz,采样数据点阵t2×t1 = 1 024×512,累加次数为8;HMQC的F2(1H)和F1(13C)维谱宽分别为6 400.0 Hz和37 700.3 Hz,采样数据点阵t2×t1= 1 024×512,累加次数为16;HMBC的F2(1H)和F1(13C)维谱宽分别为6 400.0 Hz和37 700.3 Hz,采样数据点阵t2×t1 = 1 024×512,累加次数32.
2 结果与讨论 2.1 紫外吸收光谱分析卢立康唑甲醇溶液的紫外吸收光谱中,λmax = 296 nm处的吸收峰为取代苯环的B带跃迁吸收峰,这与卢立康唑的化学结构相符.
2.2 红外吸收光谱分析采用溴化钾压片法制备样片,进行红外光谱测试.样品的红外光谱数据分析与归属见表 1. 3 040 cm-1为苯环中=C-H的伸缩振动吸收,1 586 cm-1、1 556 cm-1为苯环骨架伸缩振动吸收,829 cm-1、817 cm-1为苯环中=C-H的弯曲振动吸收,说明存在苯环结构.2 201 cm-1为不饱和氰中C≡N的伸缩振动吸收,说明存在不饱和氰结构.由此说明,样品的红外光谱吸收特征与卢立康唑包含基团一致.
| 表 1 卢立康唑的红外吸收光谱数据 Table 1 Infrared absorption spectrum data of luliconazole |
高分辨质谱(图 2)测得该样品的准分子离子峰[M+H]+的质荷比(m/z)为353.970 6,与卢立康唑(精确分子量为352.961 5)一致.

|
图 2 卢立康唑的高分辨质谱 Figure 2 High resolution mass spectrum of luliconazole |
卢立康唑的1H NMR谱(图 3)显示有8组质子信号.综合分析1H-1H COSY谱(图 4)、1H-13C HMQC谱(图 5)和1H-13C HMBC谱(图 6)显示,δH 4.14(1H, dd, J=12.6/5.4 Hz)和δH 4.05(1H, dd, J=12.6/5.4 Hz)分别归属为H-4a和H-4b.在HMQC谱中,δC 43.9同时与H-4a和H-4b相关,被归属为C-4.在COSY谱中,δH 5.81(1H, dd, J=5.4/4.8 Hz)与H-4a和H-4b相关,因此被归属为H-5.在HMQC谱中,δC 55.1与H-5相关,被归属为C-5.在HMBC谱中,H-5与C-4、δC 130.2、δC 133.9、δC 134.5和δC 167.2远程相关;DEPT135谱和13C NMR谱(图 7)显示δC 130.2为叔碳,δC 133.9、δC 134.5和δC 167.2为季碳,因此δC 130.2为C-11.在HMQC谱中,δH 7.78(1H, d, J=8.4 Hz)与C-11相关,被归属为H-11.在COSY谱中,δH 7.53(1H, dd, J=8.4/2.4 Hz)与H-11相关,因此被归属为H-10.在HMQC谱中,δC 128.3与H-10相关,被归属为C-10.在HMBC谱中,H-10与C-11、δC 129.8、δC 133.9和δC 134.2远程相关;DEPT135谱和13C NMR谱显示δC 129.8和C-11为叔碳,δC 133.9和δC 134.2为季碳,因此δC 129.8为C-8.在HMQC谱中,δH 7.75(1H, d, J=2.4)与C-8相关,被归属为H-8.在HMBC谱中,季碳δC 133.9与H-4a、H-4b、H-5、H-10、H-8和H-11远程相关,归属为C-6;季碳δC 134.5与H-5、H-8和H-11远程相关,归属为C-7.在HMBC谱中,δC 134.2与H-10、H-8和H-11远程相关;DEPT谱中显示δC 134.2为季碳,因此δC 134.2为C-9.

|
图 3 卢立康唑的1H NMR谱 Figure 3 1H NMR spectra of luliconazole |
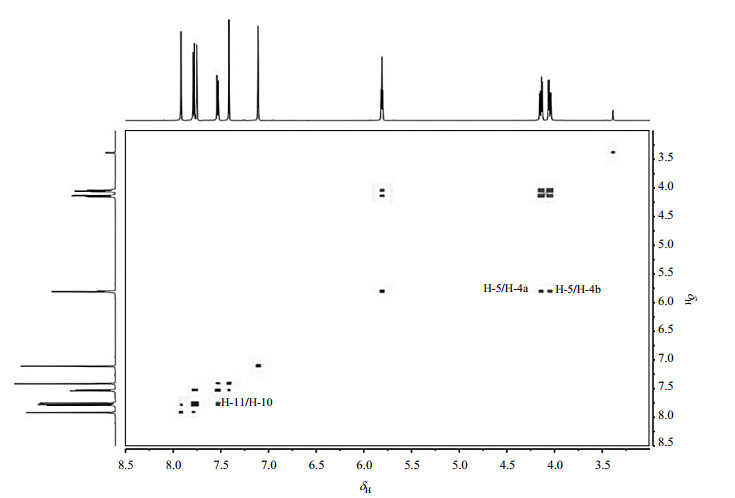
|
图 4 卢立康唑的1H-1H COSY谱 Figure 4 1H-1H COSY spectrum of luliconazole |
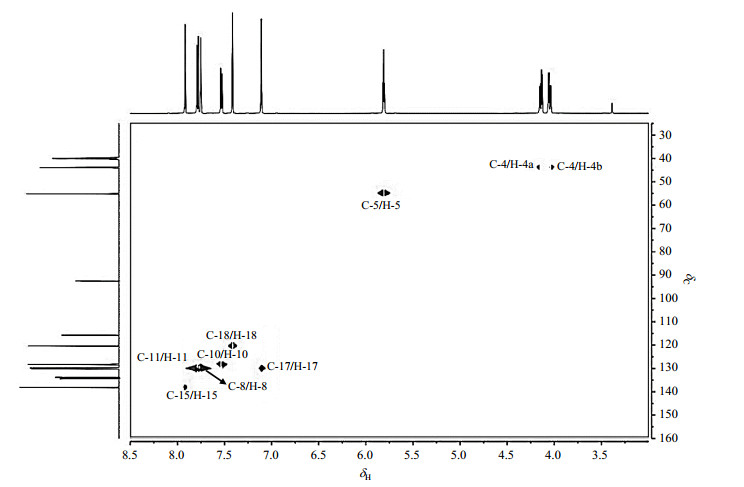
|
图 5 卢立康唑的1H-13C HMQC谱 Figure 5 1H-13C HMQC spectrum of luliconazole |

|
图 6 卢立康唑的1H-13C HMBC谱. (a)全谱;(b)为(a)中方框所示部分放大图 Figure 6 1H-13C HMBC spectra of luliconazole. (a) Full spectrum; (b) Local amplified spectra in the box of (a) |

|
图 7 卢立康唑的DEPT135和13C NMR谱 Figure 7 DEPT135 and 13C NMR spectra of luliconazole |
化合物的13C NMR谱(图 7)显示14个信号峰,结合DEPT谱(图 7),显示化合物结构中存在6个季碳、7个叔碳和1个仲碳.其中,上文已归属了C-4、C-5、C-6、C-7、C-8、C-9、C-10和C-11.在HMBC谱中,季碳δC 167.2与H-4a、H-4b和H-5远程相关,归属为C-2.根据DEPT谱得知,剩余两个季碳δC 92.6和δC 115.8没有归属;在HMBC谱中,δC 92.6与δH 7.42(1H, t, J=1.2 Hz)远程相关,δC 115.8无相关峰;因此δC 92.6归属为C-12,δC 115.8归属为C-13.
至此,还剩余δH 7.11(1H, dd, J=1.2/1.2 Hz)、δH 7.42(1H, dd, J=1.2/1.2 Hz)和δH 7.92(1H, dd, J=1.2/1.2 Hz),以及叔碳δC 120.4、δC 130.0和δC 138.1没有归属.在HMQC谱中,δH 7.42与δC 120.4相关;δH 7.11与δC 130.0相关;δH 7.92与δC 138.1相关.
由于H-15处于两个氮原子之间,受去屏蔽效应的影响,化学位移较H-17和H-18移向低场,所以将δH 7.92(1H, dd, J=1.2/1.2 Hz)归属为H-15,因此δC 138.1归属为C-15.在HMBC谱中,δH 7.42(1H, dd, J=1.2/1.2 Hz)与C-12远程相关,我们判断δH 7.42为H-18,因此δC 120.4归属为C-18.在HMBC谱中,叔碳δC 130.0与H-18和H-15远程相关,归属为C-17,因此δH 7.11(1H, dd, J=1.2/1.2 Hz)归属为H-17.
具体的1H NMR和13C NMR数据及归属见表 2,均与卢立康唑结构一致.
| 表 2 卢立康唑的1H NMR和13C NMR数据 Table 2 1H NMR and 13C NMR data of luliconazole |
综上所述,紫外吸收光谱、红外吸收光谱、高分辨质谱,以及1D和2D NMR谱图测试结果表明,所测样品与卢立康唑分子结构式一致.该结果为该药物的合成、生产中的质量控制以及同类化合物的解析提供了参考依据.
| [1] |
FAN Y B, ZHAO L X. Luliconazole[J].
Chinese Journal of Medicinal Chemistry, 2014, 24(3): 255.
樊印波, 赵临襄. 卢立康唑[J]. 中国药物化学杂志, 2014, 24(3): 255. |
| [2] |
DI Q F, XU J. Synthesis of luliconazole[J].
Chinese Journal of Pharmaceuticals, 2016, 47(11): 1357-1359.
狄庆锋, 徐晶. 卢立康唑的合成[J]. 中国医药工业杂志, 2016, 47(11): 1357-1359. |
| [3] | 巍彦君, 王华, 于向达. 卢立康唑的晶型及制备方法. 中国: 103012385[P]. 2013-04-03. |
| [4] | JONES T M, JARRATT M T, MENDEZ-MOGUEL I, et al. A randomized, multicenter, double-blind, vehicle-controlled study evaluating the efficacy and safety ofluliconazole cream 1% once daily for 7 days in patients aged ≥ 12 years with tineacruris[J]. J Drugs Dermatol, 2014, 13(1): 32-38. |
| [5] | KOGA H, NANJOH Y, MAKIMURA K, et al. In vitro antifungal activities of luliconazole, a new topical imidazole[J]. Med Mycol, 2009, 47(6): 640-647. DOI: 10.1080/13693780802541518. |
| [6] | UCHIDA K, NISHIYAMA Y, YAMAGUCHI H. In vitro antifungal activity of luliconazole(NND-502) against Malassezia species[J]. Int J Antimicrob Agents, 2003, 21(3): 234-238. DOI: 10.1016/S0924-8579(02)00362-X. |
| [7] |
ZHANG J, CAI W Y, XIAO X, et al. Evaluation of efficacy and safety of 1% luliconazole cream in the treatment of tinea pedis[J].
Chinese Journal of Mycology, 2016, 11(1): 48-50.
张静, 蔡文莹, 肖星, 等. 1%卢立康唑乳膏治疗足癣的疗效和安全性评价[J]. 中国真菌学杂志, 2016, 11(1): 48-50. DOI: 10.3969/j.issn.1673-3827.2016.01.014. |
| [8] | 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京: 科学出版社, 2000: 200-218. |
| [9] |
YU D H, KANG W, HAO F, et al. Spectroscopic studies and structural elucidation of cabazitaxel[J].
Chinese J Magn Reson, 2017, 34(2): 191-199.
余大海, 康旺, 郝福, 等. 卡巴他赛结构确证的波谱学研究[J]. 波谱学杂志, 2017, 34(2): 191-199. |
| [10] |
FENG X H, YU S T, XIA Z J, et al. Spectral analysis of bortezomib[J].
Chinese J Magn Reson, 2017, 34(1): 43-51.
冯小虎, 于水涛, 夏正君, 等. 硼替佐米的波谱学数据解析[J]. 波谱学杂志, 2017, 34(1): 43-51. |
 2018, Vol. 35
2018, Vol. 35 
