2. 亚邦医药研究院, 江苏 常州 213145
2. Yabang Medical Institute, Changzhou 213145, China
贝西沙星(Besifloxacin)是由美国博士伦公司(Bausch & Lomb Incorporated)开发的一种新型的广谱氟喹诺酮类抗菌药,它通过干扰细菌DNA在细胞分裂时的转录、复制和分离,从而阻断革兰氏阳性菌和革兰氏阴性菌的繁殖,达到杀菌的目的[1].临床使用贝西沙星的盐酸盐,0.6%盐酸贝西沙星混悬滴眼液于2009年5月28日获得美国FDA批准,用于治疗由敏感菌引起的细菌性结膜炎.它是一种仅作用于眼科而不是全身系统的氟喹诺酮类药物,按处方缓释技术制得的0.6%的贝西沙星混悬滴眼液能有效延长其在眼睛表面的停留时间.盐酸贝西沙星具有一个手性中心,化学式为C19H21ClFN3O3×HCl,化学名为(R)-7-[3-氨基六氢-1H-氮杂卓-1-基]-8-氯-1-环丙基-6-氟-1, 4-二氢-4-氧代-3-喹啉羧酸盐酸盐,其结构式如图 1所示.
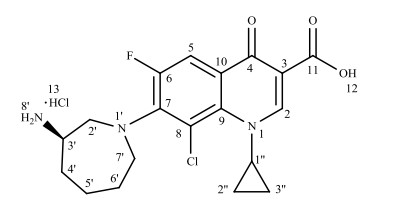
|
图 1 盐酸贝西沙星的化学结构式 Figure 1 The chemical structure of besifloxacin hydrochloride |
目前关于盐酸贝西沙星的合成、药理及临床研究方面的文献报道较多[2-8],而有关其紫外吸收光谱(UV)、红外吸收光谱(IR)、核磁共振(NMR)波谱数据的全归属,还未见文献报道.本文结合文献[9, 10]方法,对盐酸贝西沙星进行了比较全面的波谱表征,测定了盐酸贝西沙星的UV、IR、NMR(包括1H NMR、13C NMR、DEPT、HSQC、HMBC、COSY、NOESY)和质谱(MS)数据,对其所有的1H和13C NMR信号进行了归属,同时还分析讨论了其红外特征吸收峰所对应的官能团的振动形式,从而提供了较完整的盐酸贝西沙星的波谱和结构信息.
原料药化合物的波谱学数据及结构确认将为同类物的研究提供更多的波谱信息,为药品的质量研究提供较为全面的参考意义[10],本文工作对盐酸贝西沙星原料药的进一步开发应用以及合成过程[11]中有关物质的鉴定具有一定的参考意义.
1 实验部分 1.1 仪器及试剂 1.1.1 试剂DMSO-d6(氘代率为99.8%,美国CIL公司)含0.03% ν/ν用于化学位移定标的四甲基硅烷(TMS,δH 0.00,δC 0.0).其余分析纯试剂均购自上海国药集团化学试剂有限公司.所有试剂均未经进一步提纯,直接使用.
1.1.2 仪器及采样参数UV光谱采用岛津UV1601(日本岛津)测定.
IR光谱采用NICOLET Impact 410型红外光谱仪(美国Nicolet公司)测定,KBr压片.
MS谱图采集采用Agilent 6300 Trap-SL型质谱仪(美国Agilent公司),配备ESI离子源,质谱采集参数为室温、0.192~0.225 min、扫描3次、碎裂电压为130.0 V.
元素分析:碳、氢、氮元素含量的测定使用Vario EL Ⅲ元素分析仪(德国Elementar公司),采用C、H、N检测模式.
1H NMR、1H-1H COSY、NOESY、13C NMR、DEPT、1H-13C HSQC和1H-13C HMBC谱均在Bruker Avance AV-500型NMR谱仪(瑞士Bruker公司)上测定,配备5 mm QNP反向检测探头,以DMSO-d6为溶剂,TMS为内标.1H NMR的工作频率为500.13 MHz,90˚脉冲宽度为9.8 μs,谱宽为6 009.6 Hz;13C NMR的工作频率为125.77 MHz,90°脉冲宽度为8.0 μs,谱宽为30 303.0 Hz;DEPT的工作频率及谱宽与13C NMR相同;1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为6 009.6 Hz,采样数据点阵t2×t1 = 1 024×512;NOESY两维谱宽也均为6 009.6 Hz,采用标准脉冲程序;HSQC的F2维(1H)和F1维(13C)谱宽分别为6 009.6 Hz和30 303.0 Hz,采样数据点阵t2×t1 = 1 024×512;HMBC的F2维(1H)和F1维(13C)谱宽分别为6 009.6 Hz和30 303.0 Hz,JCH = 3.45 ms(JCH为一键碳氢耦合常数),采样数据点阵t2×t1=1 024×256.
1.2 样品制备实验中的盐酸贝西沙星原料由亚邦医药研究院制备并提供.具体以(R)-3-(三苯甲基胺基)六氢氮杂卓-2-酮和1-环丙基-8-氯-6, 7-二氟-1, 4-二氢-4-氧-3-喹啉羧酸乙酯为起始原料,先后通过硼酯螯合、缩合反应、脱三苯甲基保护、成盐酸盐,最后重结晶得到盐酸贝西沙星[4].样品经高效液相色谱(HPLC)测试纯度为99.89%.元素分析测定值(w/%,括号内为理论值)为C:52.96(53.03);H:5.33(5.15);N:9.50(9.77).
2 结果与讨论 2.1 UV光谱分析盐酸贝西沙星样品水溶液最大紫外吸收波长在244.6 nm,吸收度为0.516,摩尔吸光系数为21 640.84,为强吸收带,属于K带,由喹啉环与羰基等基团的共轭π→π*跃迁产生,是该物质的特征吸收峰.在293 nm处有中等强度吸收峰,说明苯环或某些杂芳环的存在.其酸性(0.1 mol/L盐酸溶液)、碱性溶液(0.1 mol/L氢氧化钠溶液)中的UV光谱与中性溶液基本一致,表明盐酸贝西沙星分子中的生色团与助色团在不同pH环境中比较稳定.紫外吸收特征符合盐酸贝西沙星结构.
2.2 IR光谱分析IR光谱中(图 2),3 448.2 cm-1(νN-H C-NH2)为伯胺宽峰的吸收带,证明结构中有伯胺基存在. 3 057.7 cm-1(νC-H Cyc)(注:Cyc表示环丙基,下同)为三元碳环的特征吸收峰,证明结构中有环丙基三元碳环存在.2 939.8、2 832.6 cm-1(vC-H CH2)为亚甲基的对称和不对称伸缩振动吸收带,证明分子结构中含有亚甲基结构.1 731.1 cm-1(νC=O CO)为羰基的特征吸收峰,证明结构中有羰基存在,同时由于羧酸内羰基和羟基的强烈缔合作用,2 562.5~3 057.7 cm-1(νO-H COOH)出现弱的羧酸羟基宽峰,证明结构中有羧酸存在.1 613.6、1 560.1、1 489.5 cm-1(νC=C Ph)(注:Ph表示苯环,下同)有强且尖的苯环骨架振动吸收带,证明分子中有苯环存在;1 449.1 cm-1(δC-H CH2)有强且尖的亚甲基弯曲振动吸收带,证明分子中有大量亚甲基存在;同时在870.3 cm-1(δC-H Ph-H)处的特征峰证明苯环中存在孤立氢原子;807.3 cm-1(δC-Cl Ph-Cl)处的特征峰证明苯环中存在与卤素相连的碳原子.
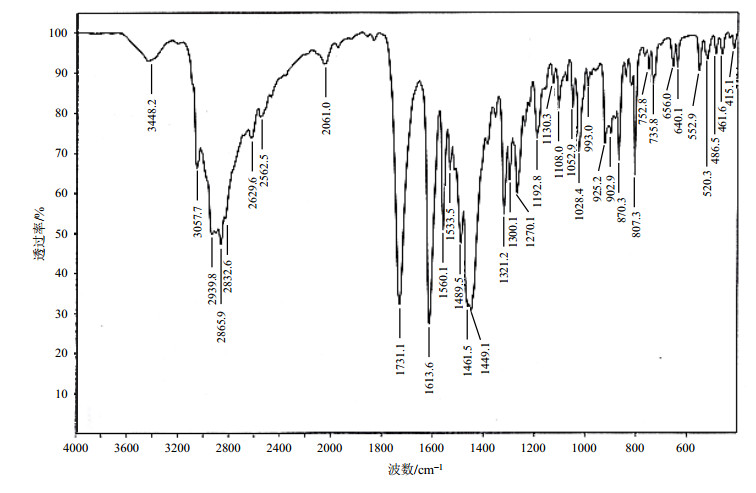
|
图 2 盐酸贝西沙星的红外吸收光谱 Figure 2 IR spectrum of besifloxacin hydrochloride |
由样品红外图谱可知:样品结构中存在取代的苯环、羧基、羰基、三元环、伯胺基以及亚甲基(表 1).其结果与盐酸贝西沙星的结构相符.
| 表 1 盐酸贝西沙星的红外吸收光谱数据及归属 Table 1 IR data and assignment of besifloxacin hydrochloride |
盐酸贝西沙星的MS谱图如图 3所示,正离子检测模式检测到质荷比(m/z)为394.149 3 [M+H]+和m/z 416.118 7 [M+Na]+的准分子离子峰.贝西沙星分子式为C19H21ClFN3O3,精确分子量为393.125 5, 因此与贝西沙星的分子量一致.
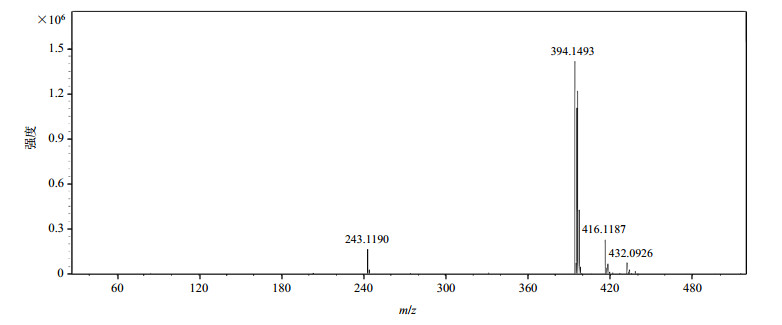
|
图 3 盐酸贝西沙星的质谱图 Figure 3 MS spectrum of besifloxacin hydrochloride |
1H NMR谱(图 4)中给出14组质子信号,结合1H-1H COSY谱图(图 5),分析如下:低场区δH 8.86(1H, s)、δH 8.02(1H, d, J = 10.65 Hz)被归属为两组芳氢质子,其中H-5受邻位碳上氟原子影响裂分成双峰,H-2由于受到邻近的环丙胺基氮原子诱导效应和弱去屏蔽效应影响,距离氮原子较近的芳氢略移向低场,因此δH 8.02归属为H-5,δH 8.86归属为H-2.
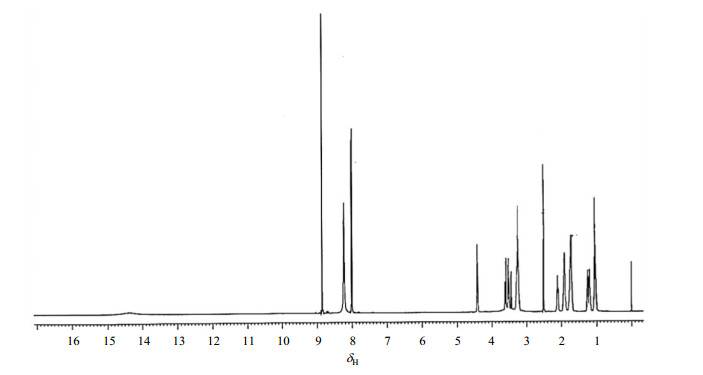
|
图 4 盐酸贝西沙星的1H NMR谱图 Figure 4 1H NMR spectrum of besifloxacin hydrochloride |

|
图 5 盐酸贝西沙星的1H-1H COSY谱图. (a)全谱;(b)~(c)为(a)中方框所示部分放大谱图 Figure 5 1H-1H COSY spectra of besifloxacin hydrochloride. (a) Full spectrum; (b)~(c) Local amplified spectra in the box of (a) |
在低场区出现的两组宽峰质子信号δH 14.43(1H,br,加D2O消失)和δH 8.23(3H,br,加D2O消失),因加入重水交换后消失,故为活泼氢.根据质子化学位移规律,羧酸基的质子受邻位羰基吸电子诱导效应和去屏蔽效应影响偏向低场,δH 14.43归属为H-12;盐酸中的H+与游离伯胺基团形成NH3+,所以δH 8.23归属为H-8′和H-13.
在1H-1H COSY谱中,δH 3.27(1H, m)与δH 8.23相关,归属为H-3′,由于受到邻近位即2′位和4′位质子的偶合作用,裂分为多重峰.在1H-1H COSY谱中,H-3′除了与H-8′相关,还与δH 3.51(1H, m)和δH 1.71(1H, m)相关,结合HSQC谱,推测应为不同碳上的两个质子H-2′α和H-4′α,其中H-2′α受邻位氨基氮原子诱导效应和去屏蔽效应影响偏向低场,因此δH 3.51(1H, m)归属为H-2′α,δH 1.71(1H, m)归属为H-4′α.受分子刚性影响,同碳质子H-2′α和H-2′β不等价,结合后文中的HSQC谱图,δH 3.59(1H, m)归属为H-2′β,δH 2.10(1H, m)归属为H-4′β.在NOESY谱(图 6)中,H-3′与H-2′β和H-4′β相关,说明H-3′与H-2′β和H-4′β在构型上处于空间距离较近的同侧位置.在1H-1H COSY谱中,δH 1.73(1H, m)和δH 1.90(1H, m)与H-3′和H-4′相关,结合HSQC,为同碳质子,受分子刚性影响,H-5′α和H-5′β不等价,因此δH 1.73归属为H-5′α,δH 1.90归属为H-5′β,受邻近位即4′位和6′位质子的耦合作用,均被裂分为多重峰.同理,δH 1.75归属为H-6′α,δH 1.91归属为H-6′β,受邻近位即5′位和7′位氢的耦合作用,均被裂分为多重峰.δH 3.23(2H, m)在COSY谱中与H-2′和H-6′相关,由于受到邻近的仲胺基氮原子诱导效应弱去屏蔽效应影响,距离氮原子较近的碳氢原子化学位移略移向低场,被归属为H-7′,为两个磁等价质子.

|
图 6 盐酸贝西沙星的NOESY谱图. (a)全谱;(b)~(c)为(a)中方框所示部分放大谱图 Figure 6 NOESY spectra of the besifloxacin hydrochloride. (a) Full spectrum; (b)~(c) Local amplified spectra in the box of (a) |
δH 4.41(1H, m)与δH 1.20(1H, m),δH 1.26(1H, m)和δH 1.06(2H, m)在COSY谱中相关,根据化学位移和耦合裂分规律,δH4.41归属为H-1",由于受到邻近的环丙胺基氮原子诱导效应的弱去屏蔽效应影响,化学位移略移向低场,受邻近位即2"位和3"位质子的耦合作用裂分为多重峰.在NOESY谱中,H-1"与H-2相关,说明H-1"与H-2在构型上处于空间距离较近的同侧位置.根据HSQC,δH1.06(2H, m)为不同碳原子上的两个质子,归属为H-2"α和H-3"α,在NOESY谱中,H-2"α和H-3"α与H-2相关,H-1"还与δH 1.26(1H, m)和δH 1.20(1H, m)相关.因为受邻近苯环上氯原子弱去屏蔽影响,H-2"β化学位移偏向低场,因此δH 1.26(1H, m)归属为H-2"β,δH 1.20(1H, m)归属为H-3"β.
2.4.2 13C NMR,DEPT,HSQC和HMBC谱图分析13C NMR和DEPT图谱(图 7)表明,该分子结构中含有7个仲碳(δC 54.9、32.2、21.5、28.2、53.7、11.1和10.6)、4个叔碳(δC 110.4、152.9、51.8和41.5)、8个季碳(δC 157.1、144.9、124.6、137.4、107.7、176.2、123.5和164.9).

|
图 7 盐酸贝西沙星的DEPT和13C NMR谱图 Figure 7 DEPT and 13C NMR spectra of besifloxacin hydrochloride |
δC 176.2为羰基碳,HMBC(图 8)谱显示其与H-5和H-2远程相关,被归属为C-4;δC 110.4(d, J= 22.64 Hz)在HSQC(图 9)谱中与H-5直接相关,被归属为C-5,受邻位氟原子影响,裂分为双峰.δC 152.9在HSQC谱中与H-2直接相关,被归属为C-2.δC 164.9为羰基碳,HMBC谱显示其只与H-2远程相关,被归属为C-11.
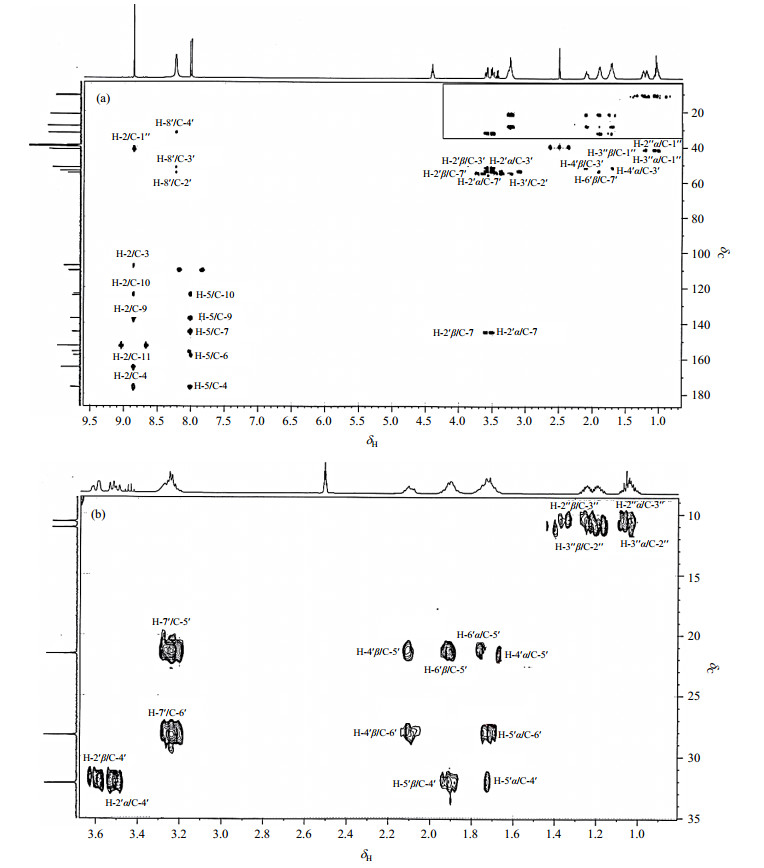
|
图 8 盐酸贝西沙星的HMBC谱图. (a)全谱; (b)为(a)中方框所示部分放大谱图 Figure 8 HMBC spectra of besifloxacin hydrochloride. (a) Full spectrum; (b) Local amplified spectra in the box of (a) |
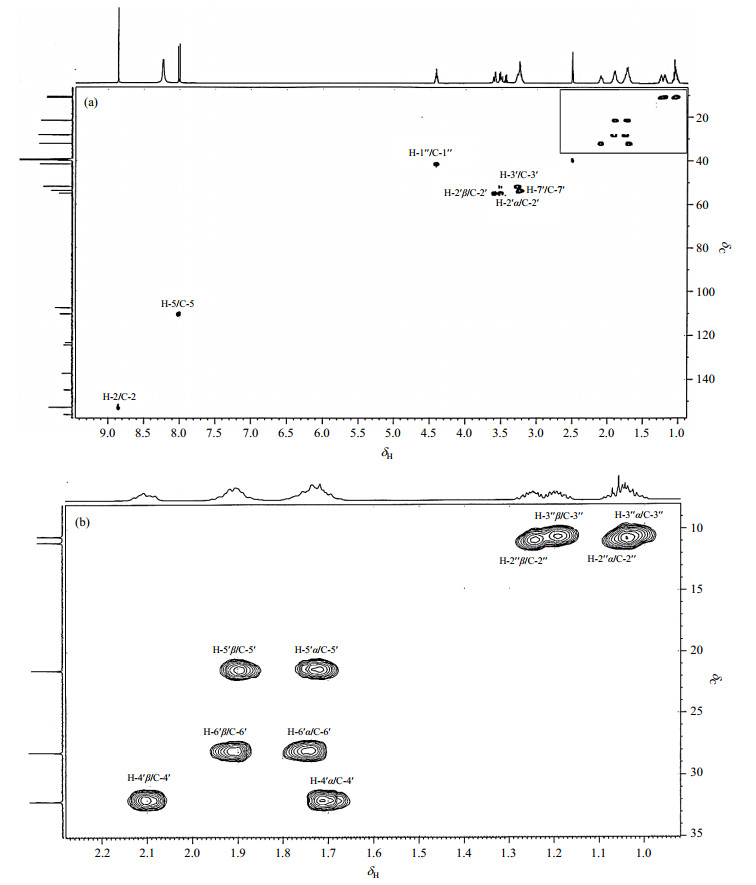
|
图 9 盐酸贝西沙星的HSQC谱图. (a)全谱;(b)为(a)中方框所示部分放大谱图 Figure 9 HSQC spectra of besifloxacin hydrochloride. (a) Full spectrum; (b) Local amplified spectra in the box of (a) |
HMBC谱显示季碳δC 107.7只与H-2远程相关,归属为C-3;季碳δC 137.4、δC 123.5与H-5和H-2远程相关,因δC 123.5与H-2相关性较弱,δC 123.5归属为C-10,δC 137.4归属为C-9.季碳δC157.1(d, J = 250.24 Hz)与H-5远程相关,季碳δC 144. 9(d, J = 15.09 Hz)与H-2′α和H-2′β远程相关,受邻近氟原子影响,均裂分为双峰,因此,δC 157.1归属为C-6;δC 144. 9归属为C-7.因此剩余的1个季碳δC 124.6为季碳归属为C-8.
HMBC谱显示叔碳δC 51.8与H-2′α、H-2′β、H-4′α和H-4′β远程相关,叔碳δC 41.5与H-2、H-2"α、H-2"β、H-3"α和H-3"β远程相关,因此,δC 51.8归属为C-3′,δC 41.5归属为C-1".仲碳δC 11.1在HSQC谱中与H-2"α和H-2"β直接相关,HMBC谱显示其与H-3"α、H-3"β远程相关,归属为C-2".仲碳δC 10.6在HSQC谱中与H-3"α和H-3"β直接相关,HMBC谱显示其与H-2"α和H-2"β远程相关,被归属为C-3".
仲碳δC 54.9在HSQC谱中与H-2′α和H-2′β直接相关,HMBC谱显示其与H-3′远程相关,被归属为C-2′.仲碳δC 53.7在HSQC谱中与H-7′直接相关,HMBC谱显示其与H-2′α、H-2′β和H-6′β远程相关,被归属为C-7′.仲碳δC 28.2在HSQC谱中与H-6′α和H-6′β直接相关,HMBC谱显示其与H-5′α、H-4′β和H-7′远程相关,被归属为C-6′.仲碳δC 21.5在HSQC谱中与H-5′α和H-5′β直接相关,HMBC谱显示其与H-4′α、H-4′β、H-6′α和H-7′远程相关,被归属为C-5′.仲碳δC 32.2在HSQC谱中与H-4′α和H-4′β直接相关,HMBC谱显示其与H-2′α、H-2′β、H-5′β和H-8′远程相关,被归属为C-4′.
具体的1H NMR和13C NMR数据归属见表 2.
| 表 2 盐酸贝西沙星1H NMR和13C NMR归属(DMSO-d6, 500 MHz) Table 2 1H NMR and 13C NMR data of besifloxacin hydrochloride (DMSO-d6, 500 MHz) |
通过UV、IR、MS、1H NMR、13C NMR、DEPT、HSQC、HMBC、COSY和NOESY谱图测定和解析,对盐酸贝西沙星的结构进行了全面地分析和验证.通MS确证了盐酸贝西沙星的分子量,UV图谱显示出特征官能团,IR光谱给出各基团的特征吸收,通过1H NMR、13C NMR、DEPT、HSQC、HMBC、COSY和NOESY谱的测定和解析,对化合物的全部1H和13C NMR信号进行了归属,从而确证了盐酸贝西沙星的结构.
| [1] | CHANG M H, FUNG H B. Besifloxacin:A topical fluoroquinolone for the treatment of bacterial conjunctivitis[J]. Clin Ther, 2010, 32(3): 454-471. DOI: 10.1016/j.clinthera.2010.03.013. |
| [2] | 哈姆斯A E. 喹诺酮羧酸、其衍生物及它们的制备方法和作为抗菌剂的用途. 中国, 101595101A[P]. 2009-12-02. |
| [3] | TOMISATO F K, YACHIYO A S, ABIKO H M, et al. Quilonone carboxylic acid derivatives: US, 005447926A[P]. 1995-09-05. |
| [4] | 陈再新, 夏正君, 蒋龙, 等. 盐酸贝西沙星的制备方法. 中国, 102659761A[P]. 2012-09-12. |
| [5] |
WANG Y J, MA Z J. Synthesis of besifloxacin hydrochloride[J].
Hebei Huagong, 2011, 34(7): 13-14.
王亚娟, 马志珺. 盐酸贝西沙星的合成[J]. 河北化工, 2011, 34(7): 13-14. DOI: 10.3969/j.issn.1003-5059.2011.07.006. |
| [6] | 王立明, 郭夏, 宋雪梅. 盐酸贝西沙星制备新方法. 中国, 103058992A[P]. 2013-04-24. http://www.wanfangdata.com.cn/details/detail.do?_type=patent&id=CN201210589641.6 |
| [7] | 田远. 一种盐酸贝西沙星的制备方法. 中国, 104592196A[P]. 2015-05-06. |
| [8] | MALHOTRA R, ACKERMAN S, GEARINGER L S. The safety of besifloxacin ophthalmic suspension 0.6% used three times daily for 7 days in the treatment of bacterial conjunctivitis[J]. Drugs R D, 2013, 13(4): 243-252. DOI: 10.1007/s40268-013-0029-1. |
| [9] |
SUN W, GAO X, GUO J, et al. An NMR study on lomustine[J].
Chinese J Magn Reson, 2016, 33(2): 353-359.
孙伟, 高翔, 郭娟, 等. 洛莫司汀的1H、13C NMR全归属[J]. 波谱学杂志, 2016, 33(2): 353-359. |
| [10] |
YU D H, KANG W, HAO F, et al. Spectroscopic studies and structural elucidation of cabazitaxel[J].
Chinese J Magn Reson, 2017, 34(2): 191-199.
余大海, 康旺, 郝福, 等. 卡巴他赛结构确证的波谱学研究[J]. 波谱学杂志, 2017, 34(2): 191-199. |
| [11] | YASASWINI P, VIJAYA L M, SAI S M, et al. Development and validation of new RP-HPLC-PDA method for the estimation of besifloxacin hydrochloride in pharmaceutical dosage forms[J]. Indo American Journal of Pharmaceutical Research, 2015, 5(11): 3406-3411. |
 2018, Vol. 35
2018, Vol. 35 
